猪流行性腹泻病毒繁殖条件的研究
王靓靓,白会新
(1.大庆市动物卫生监督所,黑龙江 大庆 163311;大庆市畜牧技术推广站,黑龙江 大庆 163311)
猪流行性腹泻病毒繁殖条件的研究
王靓靓1,白会新2*
(1.大庆市动物卫生监督所,黑龙江 大庆 163311;大庆市畜牧技术推广站,黑龙江 大庆 163311)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV) 引起的一种严重的病毒性传染病。该病可导致哺乳仔猪发生严重的腹泻、呕吐、脱水,并且致死率极高,给养猪业带来了巨大的危害。实验为了提高PEDV的繁殖滴度,对PEDV的培养条件进行优化并连续体外传代培养,分别从改变胰酶浓度、吸附时间和培养方式三个方面进行了PEDV的传代培养,最终提高了病毒的滴度(TCID50),从而降低了该病毒的致病性。
猪流行性腹泻病毒;疫苗;培养特性
PEDV是一种有包膜的单链RNA病毒,属于冠状病毒科,冠状病毒属,该病毒引起的临床症状一般表现为严重的水样腹泻,病猪在腹泻3~4 d后,会因严重脱水而死亡。PEDV经口传染仔猪,在腹泻的早期阶段,它富集在小肠内的组织内容物中。随着PEDV在许多国家的暴发,国内外很多学者始终致力于研究PEDV的培养条件[1],提高病毒的滴度[2],为PEDV的疫苗研制提供重要的物质基础。但是,由于其复杂的培养条件,病毒在细胞中繁殖滴度等问题仍是急需解决的难题之一。为了解决此问题,本实验通过改变胰酶浓度、吸附时间和培养条件等方面对PEDV HLJBX株进行培养,确立了PEDV的最佳培养条件,从而提高了病毒的滴度,为下一步疫苗开发奠定了一定的基础。
1 毒株、细胞系和引物
本实验在东北农业大学动物医学院预防与兽医学实验室进行,PEDV HLJBX株由实验室分离并保存,非洲绿猴传代肾细胞(Vero)细胞系于实验室保存, PEDV鉴定引物均由实验室设计并由博仕生物公司合成。
2 实验方法
2.1 细胞库的建立
将Vero细胞的复苏后,进行培养,待细胞库性状稳定后进行无菌检测和支原体检测。
2.2 PEDV的特异性检测
2.2.1 间接免疫荧光检测
接种病毒的Vero细胞培养48 h后弃培养液,用PBS漂洗细胞标本片3次,用4%多聚甲醛溶液固定细胞,室温20 min后用PBS漂洗3次,用甘氨酸溶液350μL/孔处理细胞,室温10 min,再用PBS漂洗3次,将残留液弃净后,加入一抗,37 ℃孵育60 min,PBS洗涤3次后,再加二抗,37 ℃避光孵育60 min,最后用中性甘油封片,于荧光显微镜下观察并拍照。
2.2.2 RT-PCR检测
取150μL的PEDV放入EP管中,管中加入RA2液500μL,充分颠倒10次,静置1 min。将PEDV裂解物全部吸入内套管中,离心1 min。取出内套管,弃掉外套管中的液体,在内套管中加入500 μL洗液,离心1 min。重复一次上面的步骤后,取出内套管弃掉外套管中的液体,再将内套管放回到外套管中,不加洗液离心1 min。将内套管移入新的EP管中,在内套管膜的中央加入洗脱液25 μL,室温静置1 min后离心1 min,获得总RNA。之后用PEDV引物将RNA反转录成cDNA,反应参数为42 ℃、1 h,72 ℃、15 min,冰上冷却。
将反转录的产物使用上游引物及下游引物进行PCR扩增。反应条件为:95 ℃预变性 5 min;95 ℃变性40 s,55 ℃退火40 s,72 ℃延伸50 s,30个循环;72 ℃终延伸10 min。
反应结束后,用1 %琼脂糖凝胶电泳检测结果。
2.2.3 PEDV滴度的测定采用96孔板进行测定。首先将细胞进行消化,分装到96孔板内,待细胞长满80 %时,弃去DMEM液,用PBS洗3次,将病毒稀释成10-1,10-2,10-3,10-4,10-5,10-6,10-7,10-8,
10-9,10-10,10个稀释度,每一稀释度接种5孔细胞,接种量为100 μL/孔,并设立一行作为细胞对照,在接毒后72 h,判定细胞病变,当病变细胞在80 %以上时,判定为病变细胞孔,进行TCID50的测定。按公式计算(Reed-Muech 氏法)。
2.2.4 PEDV滴度的提高
2.2.4.1 不同胰酶浓度对病毒滴度的影响
取生长良好的Vero单层细胞进行消化,分装到24孔板中,观察细胞,待细胞长满80%时,弃去24孔板中的培养液,用PBS清洗细胞2次,将病毒液和无血清的DMEM液混合,同时胰酶终浓度分别为1 μg/mL、2.5 μg/ mL、5 μg/ mL、10 μg/ mL、15 μg/ mL、20 μg/ mL、25 μg/mL、50 μg/ mL、60 μg/ mL和75 μg/ mL,在37 ℃培养箱内共同吸附1 h后加入不含血清的DMEM,同时设立细胞对照孔,37 ℃培养,72 h收毒,繁殖8代后,均接种在长满Vero细胞的96孔板中进行TCID50测定。
2.2.4.2 不同吸附时间对病毒滴度的影响
取生长良好的Vero单层细胞进行消化,分装到24孔板中,观察细胞,待细胞长满80 %时,弃去24孔板中的培养液,用PBS清洗细胞2次,将病毒液、最适的胰酶终浓度和无血清的DMEM液按比例混合,在37 ℃培养箱内共同吸附0.5 h、1 h、1.5 h和2 h后加入不含血清的DMEM,同时设立细胞对照孔,37 ℃培养,72 h收毒,繁殖8代后,均接种在长满Vero细胞的96孔板中进行 TCID50测定。
2.2.4.3 不同培养条件对病毒滴度的影响
取生长良好的Vero单层细胞进行消化,分装到24孔板中,观察细胞,待长满80 %时,弃去24孔板中的培养液,用PBS清洗细胞2次,将病毒液、最适的胰酶终浓度和无血清的DMEM液按比例混合,接种在Vero细胞上,在到达最适吸附时间时,一孔直接加入无血清的DMEM,一孔弃去吸附液后加入无血清的DMEM,并设立细胞对照孔,37 ℃培养,72 h收毒,繁殖8代后,均接种在长满Vero细胞的96孔板中进行 TCID50测定。
3 实验结果
3.1 Vero细胞的培养
待细胞长满单层时进行传代,接种密度是1×106/ mL,细胞状态良好。镜检可见,长满单层的细胞紧贴于细胞壁,生长致密,呈长梭形,轮廓清晰,折光性强(如图1A)。将PEDV病毒接种在Vero细胞上,在30 h时出现明显的CPE,有部分细胞肿胀变圆,折光性增强,颗粒物质增多(如图1D),细胞对照未出现异常(如图1B)。培养48 h,细胞间隙变大,有少量细胞脱落(如图1E),对照细胞生长良好,仍然未见异常(如图1C)。在72 h时,细胞脱落已达80 %以上,细胞间隙变大、皱缩、融合,细胞单层形成网眼状,收毒(如图1F)。
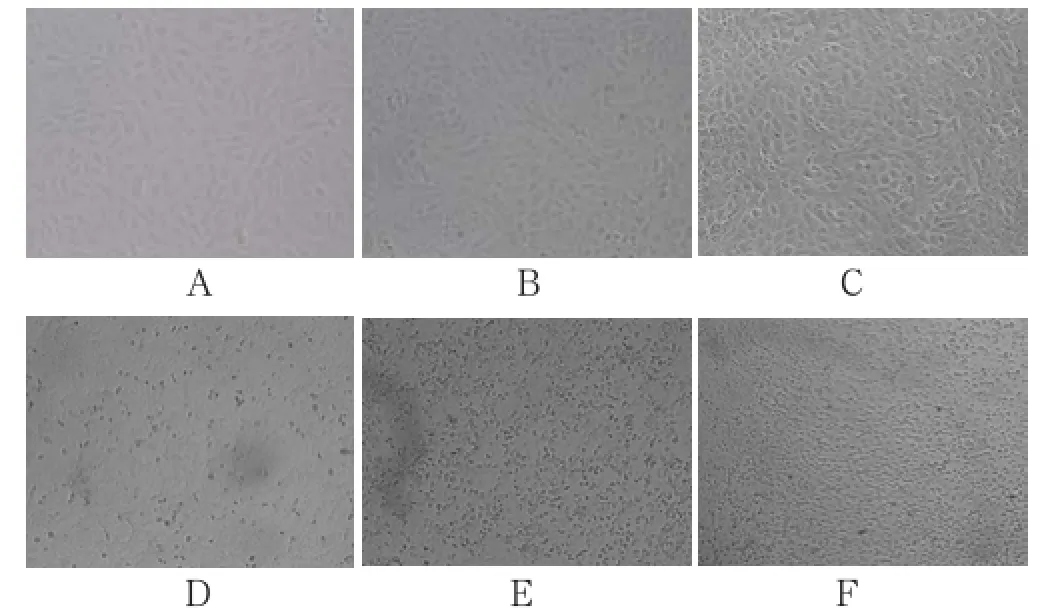
图1 在不同时间点接种PEDV的Vero细胞产生的病变(20X)
3.2 细胞的纯净检测结果
3.2.1 Vero细胞的细菌、霉菌检测结果
用硫乙醇酸盐培养基(T.G)和葡萄糖蛋白胨培养基(G.P)
对Vero细胞进行检测,未见细菌、霉菌污染。
3.2.2 Vero细胞的支原体检测结果
用支原体培养基对Vero细胞进行检测,均未见支原体污染。
3.3 PEDV的鉴定结果
3.3.1 间接免疫荧光检测结果
取Vero细胞培养物接种长满单层的Vero细胞48 h后,经 PEDVN蛋白单克隆抗体间接免疫荧光检测,在未接种PEDV的Vero细胞中,未见到任何特异性绿色荧光斑点(图 2A),而在感染PEDV的Vero细胞中观察到大量特异性绿色荧光斑点(图 2B)。表明PEDV在Vero细胞中复制增殖。
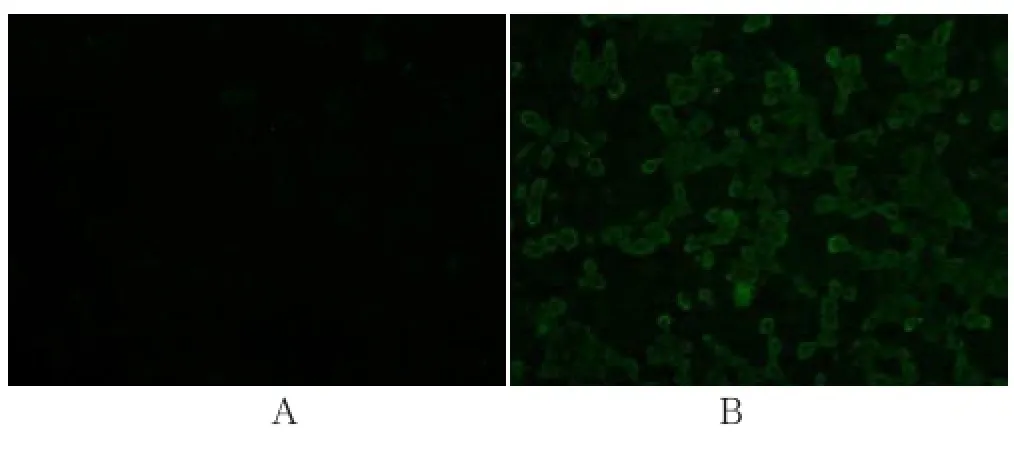
图2 间接免疫荧光检测 PEDV(20 X)
3.3.2 RT-PCR检测结果
扩增产物片段约467 bp,与预期结果相一致(见图3)。

图3 PEDV的RT-PCR结果
3.4 PEDV滴度的测定结果
采用96孔板进行测定,在接毒后72 h,判定细胞病变,当病变细胞在80 %以上时,判定为病变细胞孔,进行TCID50的测定。按公式计算(Reed-Muech 氏法)结果见表1。
其确切稀释倍数可按下列公式计算:

将由上式获得的0.73加在高于50 %死亡的稀释度的对数(3)上,因此该病毒的 TCID50应是10-3.73/0.1 mL。
3.5 PEDV滴度的提高
3.5.1 不同的胰酶浓度对滴度的影响
设立了胰酶浓度分别为1 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL、25 μg/mL、50 μg/mL、60 μg/mL和75 μg/mL这10个浓度进行PEDV的培养,当胰酶浓度在50 μg/mL及以上时,PEDV无法进行培养。达到该浓度时可以观察到细胞拉网成堆,很难观察出病变。

表1 TCID50测定结果

图4 不同的胰酶浓度对病毒滴度的影响
3.5.2 不同吸附时间对滴度的影响
在培养PEDV毒株时,分别设立在37 ℃培养箱内吸附0.5 h、1 h、1.5 h和2 h后,加入无血清的DMEM溶液,72 h收毒,测定病毒滴度。

图5 不同吸附时间对病毒滴度的影响
3.5.3 不同培养方式对滴度的影响
培养PEDV时采用2种培养方式进行培养,分别为留吸附液和弃吸附液,之后在加入维持液,72 h收毒,测定病毒滴度。

图6 不同培养方式对病毒滴度的影响
4 讨论
近年来,有关PEDV疫苗的研究已经取得了一定的进展[3],疫苗滴度的高低可以直接影响到疫苗接种的效果,因此准确测定疫苗滴度十分重要。本文通过改变胰酶终浓度、孵育时间和培养方式,来提高病毒的滴度,最终将PEDV的滴度维持在10-6.0/0.1 mL至10-7.0/0.1 mL之间。Hofinann和Wy1er实验表明,在培养PEDV时,若不加胰酶,那么PEDV感染细胞的能力会大大减弱,连续培养几代后,会使病毒在细胞上发生丢失[4]。所以PEDV的繁殖是有赖于胰酶的存在的。但是很多研究学者在培养PEDV时,对于胰酶的终浓度的选择都有一定的差别[5-6]。在本实验中,对PEDV HLJBX毒株进行培养时,设立了胰酶终浓度为1μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL、25 μg/mL、50 μg/mL、60 μg/mL和75 μg/mL这10个浓度进行PEDV的培养,结果表明当胰酶浓度在50 μg/mL及以上时,PEDV无法进行培养。达到该浓度时可以观察到细胞拉网成堆,很难观察出病变。在胰酶终浓度1~25 μg/mL之间,都适合PEDV的培养,但是在胰酶终浓度为2.5 μg/mL时,我们测得PEDV的病毒滴度高于其他组的病毒滴度。
本实验对不同吸附时间对病毒滴度的影响进行了研究,分别设立了0.5 h、1 h、1.5 h和2 h 4个时间点。结果表明,吸附时间为1.5 h,病毒的滴度最高,到2 h时病毒的滴度反而有所下降,但是下降不明显。这可能是由于吸附时间过长,导致一些状态不好的细胞贴在了培养瓶底部,因此影响了病毒的滴度。本实验还研究了不同培养方式对病毒滴度的影响,分别采用弃吸附液和留吸附液两种方式,结果发现采用弃吸附液的培养方式PEDV的病毒滴度明显比留吸附液的培养方式要高。这可能是由于在吸附液中存在一些感染能力较弱的病毒,当弃去吸附液后,感染能力较弱的病毒也随之弃去,那么感染细胞能力较强的病毒就会吸附在细胞上。如果留吸附液,对于感染能力较弱的病毒便会留在吸附液中,繁殖几代后便失去感染细胞的能力,从而影响了病毒的滴度。
[1] 周靓靓,孙心,吴蕾. 猪传染性胃肠炎和猪流行性腹泻疫苗病毒培养条件的优化[J].广东畜牧兽医科技,2014,39(6):33-35.
[2] 王琳,邢育钢,李继昌. 猪流行性腹泻病毒疫苗株在Vero细胞中繁殖条件的优化[J].当代畜禽养殖业,2014(11):3-4.
[3] 王靓靓,李训良,李鹏冲,等. 猪流行性腹泻的诊断与预防[J].世界华人消化杂志,2013,21(1):33-38.
[4] HOFMANN M,WYLER R.Propagation of the virus of PED in ce11 cu1ture[J].J C1in Microbio1,1988,26:2235-2239.
[5] 郝伟伟,邱文英,徐静,等.猪流行性腹泻病毒SZ株的分离与鉴定[J].福建畜牧兽医,2012,34(6):1-3.
[6] 毛雅元,张桂红,葛俊伟,等.猪流行性腹泻病毒地方株LJB/ 03分离及培养特性[J].病毒学报,2010,26(6):483-489.
2016-07-17)
黑龙江省高校科技创新团队基金资助项目(2011TD001)
王靓靓(1987-),女,黑龙江哈尔滨人,兽医师,兽医硕士,主要从事工作:动物卫生监督和疫病防控。E-mail:383456366@qq.com 联系电话:18345587338
白会新(1986-),男,黑龙江望奎人,畜牧师,博士,研究方向:分子营养学与免疫学。E-mail:dqxmjbhx@163.com

