结直肠癌肝转移微创射频消融术远期疗效影像评估
董 永张雯珺方 勇
结直肠癌肝转移微创射频消融术远期疗效影像评估
董 永1张雯珺2方 勇1
目的:探讨射频消融对结直肠癌肝转移患者的远期疗效影像评估。方法:本研究回顾性分析2010年6月至2015年10月在浙江大学医学院附属邵逸夫医院接受RFA治疗的CRLM患者临床及影像资料。对所有患者射频后生存期(射频OS)及无进展生存期(PFS)运用SPSS22.0统计分析软件,通过Kaplain-Meier方法描绘患者生存曲线,进行单因素分析筛选;并对单因素筛选后有统计学意义的指标采用Cox比例风险模型进行多因素分析。结果:影响射频OS结局的因素是肝脏肿瘤最大直径、肝脏病灶数目、RFA术后1个月肿瘤灭活情况。影响PFS结局的因素为肝脏肿瘤最大直径、RFA术后1个月肿瘤灭活情况。结论:结直肠癌肝转移患者通过射频消融治疗后可获得较好的远期生存,特别是针对直径≤3cm、单发的病灶来说是一种安全有效的治疗手段。
射频消融;结直肠癌;肝转移;疗效评估
方 法
1.临床资料
搜集浙江大学医学院附属邵逸夫医院2010年6月至2015年10月共87例结直肠癌肝转移患者的临床和影像学资料,全部患者均有明确的病理或者临床诊断。收集病例中男56例,女31例;年龄在21~82岁,平均为(57.8±12.1)岁;治疗肿瘤最大径(为避免各种混杂因素, 若患者行多次射频手术,本研究只取每例患者第1次射频消融的数据)为9.8~65.8mm,平均为(23.04±10.16)mm。其中单发转移灶37例,转移灶多发患者50例,累计共147个病灶。全部患者均于治疗前详细告知治疗方案并签署知情同意书。
2.仪器和方法
87例病人中,3例患者进行了直视下(开腹或腹腔镜)射频消融治疗,余84例患者均行经皮穿刺射频消融治疗。引导方式釆用B超及CT两种方式,分别为80例和4例。选用的射频系统主要有两大类:Cool-tip中空冷却单束射频针(Valleylab Tyco, Colorado,USA)和Rita射频针( AngioDynamics,Latham,NY, USA)。术前完善相关检查,根据病灶大小、位置、数目制定射频方案。当用于治疗直径小于3cm的病灶时,多使用单极射频针,穿刺入肿瘤中心,进行加热消融;当治疗的肿瘤直径大于3cm时,多使用Rita射频针,其针尖端近肿瘤边缘后,逐步将针伞状进入肿瘤,消融至少0.5cm的边界区正常肝组织;射频消融时间约12~15min,射频后针道消融,拔针[3]。本组92.0%(80/87)的患者采用全麻,余患者因为无法耐受全麻或者需要患者腹式呼吸配合选择更好的穿刺路径而选择局麻。
3.随访
随访截止时间为2016年3月1日,观察收集RFA患者术后门诊和住院信息。患者射频消融术后1个月均接受影像学评估,包括CT增强、磁共振增强(MRI)。根据增强CT或者MRI检查消融区域是否有异常强化判断肿瘤灭活、残留或者复发(图1)。定期复查一旦发现肿瘤复发,应尽早再次行射频消融治疗。电话随访获取每位患者的生存状态和死亡时间,主要观察的指标包括总生存期(overall survival,OS)、射频后生存期(射频OS)、无进展生存期(progress-free survival,PFS)。其中OS定义为患者从确诊为结直肠癌至死亡或末次随访的时间;射频OS定义为患者从接受第一次射频治疗至死亡或末次随访的时间;PFS定义为患者从接受第一次射频至第一次出现疾病进展(局部或远处)或死亡的时间(若患者存活为末次检查时间)。
4.统计学结果
应用SPSS22.0统计软件进行数据处理与分析,以Kaplan-Meier法和Log-rank检验进行单因素生存曲线分析,P<0.05被认为具有显著性差异,筛选P<0.05的因素通过Cox风险模型进行多因素回归分析。
结 果
患者中位总生存期(OS)为45.1个月,中位射频后生存期(射频OS)为28.3个月,中位无进展生存期(PFS)为13.2个月。患者性别、年龄、原发肿瘤部位、肝转移时间、是否伴有肝外转移、血清癌胚抗原(CEA)水平、肝脏肿瘤数目、最大径、RFA后1个月肿瘤灭活情况、射频次数、是否行结直肠癌手术、淋巴结数目等与患者生存期的单因素分析结果见表1。其中,肝脏病灶数目为单发的患者射频OS为30.7个月,2~3个的射频OS为24.3个月,大于3个的射频OS为15.5 个月(P=0.004);三者的PFS分别为22.3个月、7.4个月、9.3个月(P=0.047)。射频肝脏肿瘤最大直径≤3cm的患者的射频OS的为33.8个月,直径>3cm的患者的射频OS为18.9个月(P=0.001);两者的PFS分别为21.3个月、5.6个月(P=0.001)。接受结直肠癌手术患者的射频OS为29.7个月,未行结直肠癌手术患者的射频OS为15.0个月(P=0.011);两者的PFS分别为17.2个月、3.6个月(P=0.061)。首次RFA术后1个月肝脏病灶完全灭活的患者射频OS为31.2个月,首次RFA术后1个月肝脏病灶未完全灭活的患者射频OS为16.8个月(P=0.001)。肝脏转移性质为同时性(肝转移诊断时间距离原发结直肠癌诊断时间小于6个月)的患者射频OS为24.1 个月,肝脏转移性质异时性(肝转移诊断时间距离原发结直肠癌诊断超过6个月)患者射频OS为37.6个月(P= 0.036);两者的PFS分别为 13.1个月、25.5个月(P=0.089 )。接受肝脏肿瘤切除手术的患者PFS为6.8个月,未行肝脏肿瘤切除手术的PFS为21.3个月(P=0.013)。最终经COX多因素回归分析后,影响射频OS结局的因素是肝脏肿瘤最大直径、肝脏病灶数目、RFA术后1个月肿瘤灭活情况。影响PFS结局的因素为肝脏肿瘤最大直径、RFA术后1个月肿瘤灭活情况(表1、图2~6)。
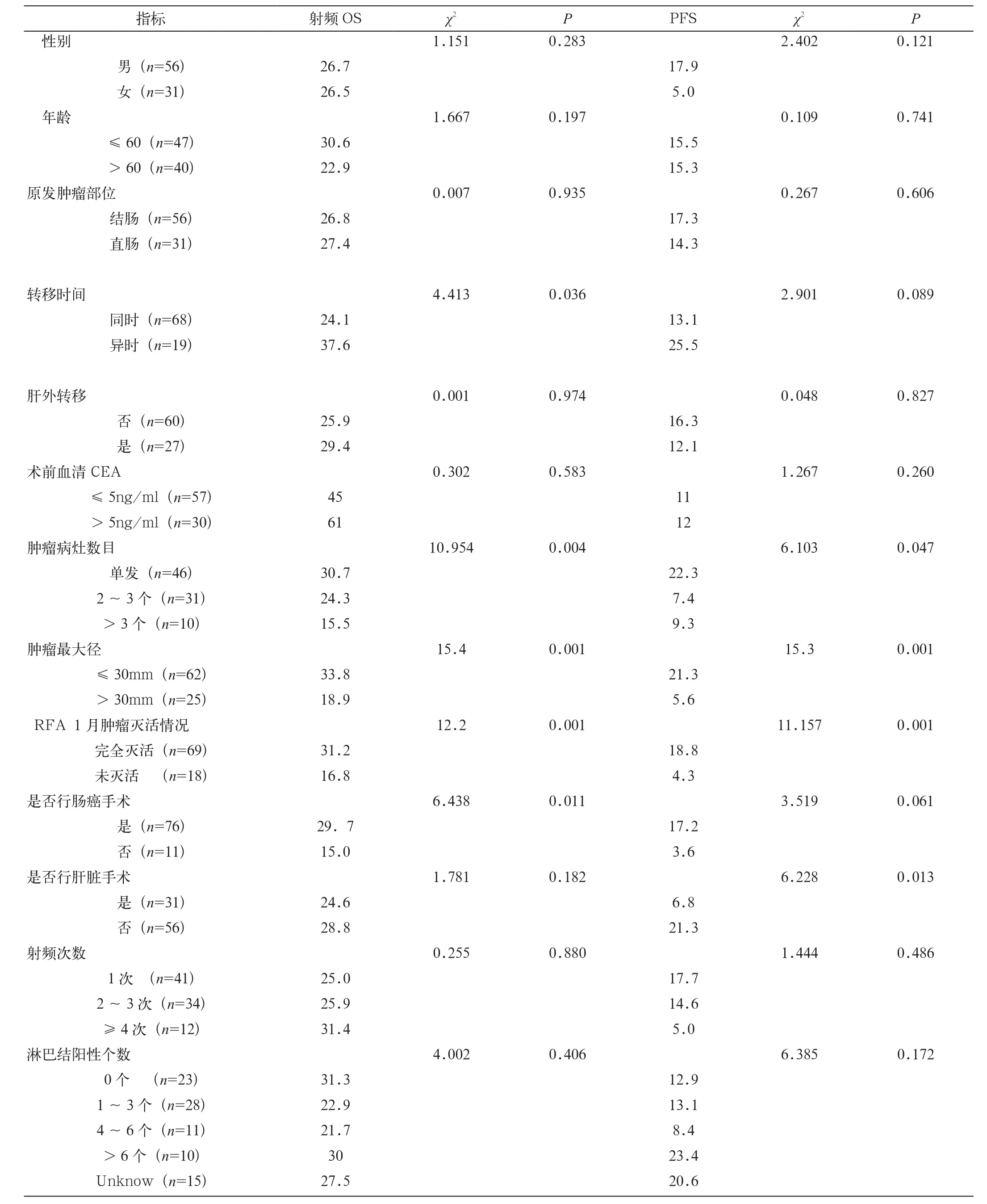
表1 患者一般资料与患者生存期的单因素分析
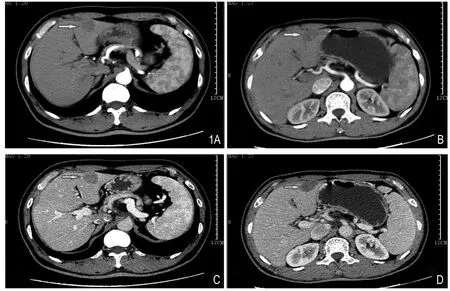
图1 A、C分别代表结直肠癌肝转移病灶射频消融术前增强CT动脉期、静脉期边缘均见强化;B、D分别代表复查结直肠癌肝转移病灶射频消融术后增强CT动脉期、静脉期边缘均未见强化,表示肿瘤完全灭活。
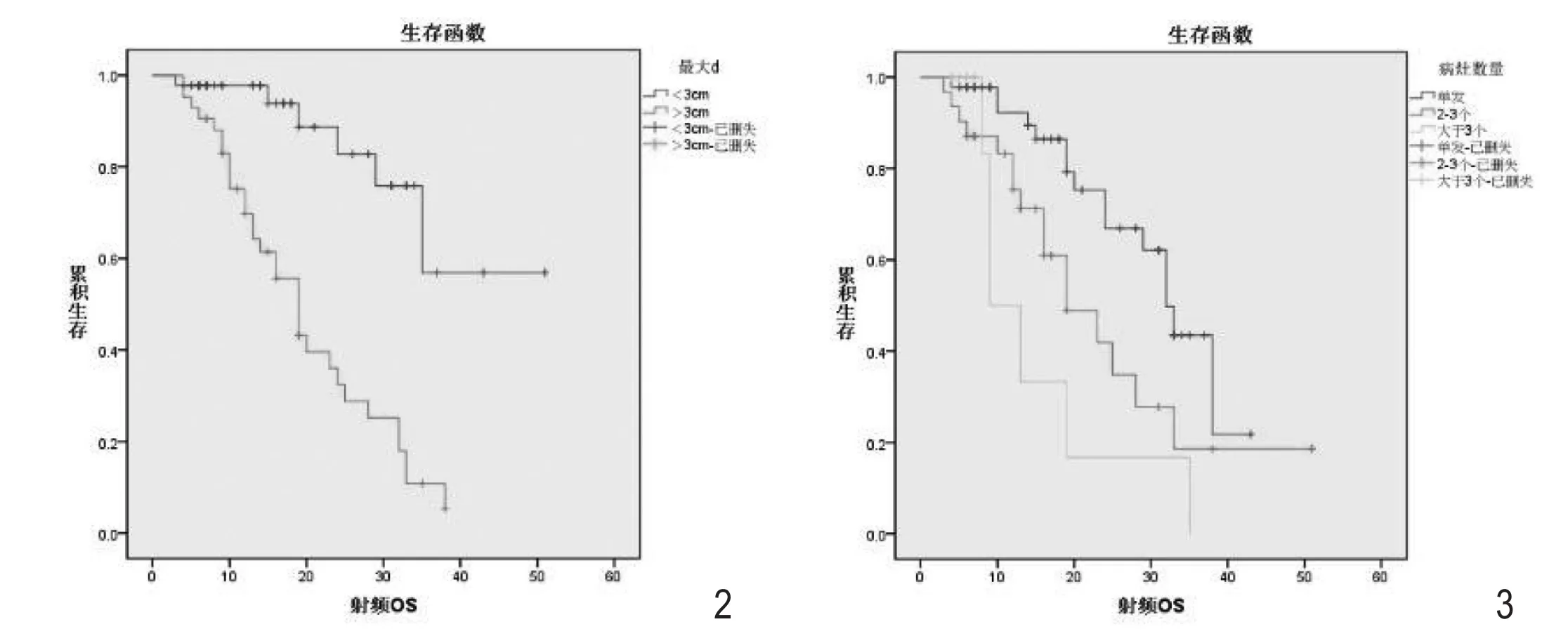
图2 肝脏肿瘤最大直径的射频后生存时间:肝脏肿瘤直径小于3cm的患者的中位射频后生存时间为33.8个月,明显高于肿瘤直径大于3cm患者的18.9个月(P=0.001)。图3 肝脏病灶数目的射频后生存时间:肝脏病灶数目单发的患者中位射频后生存时间为30.7个月,病灶数目为2~3个的患者中位射频后生存时间为24.3个月,而病灶数目多发(>3个)的患者中位射频后生存时间仅为15.5个月(P=0.004)。
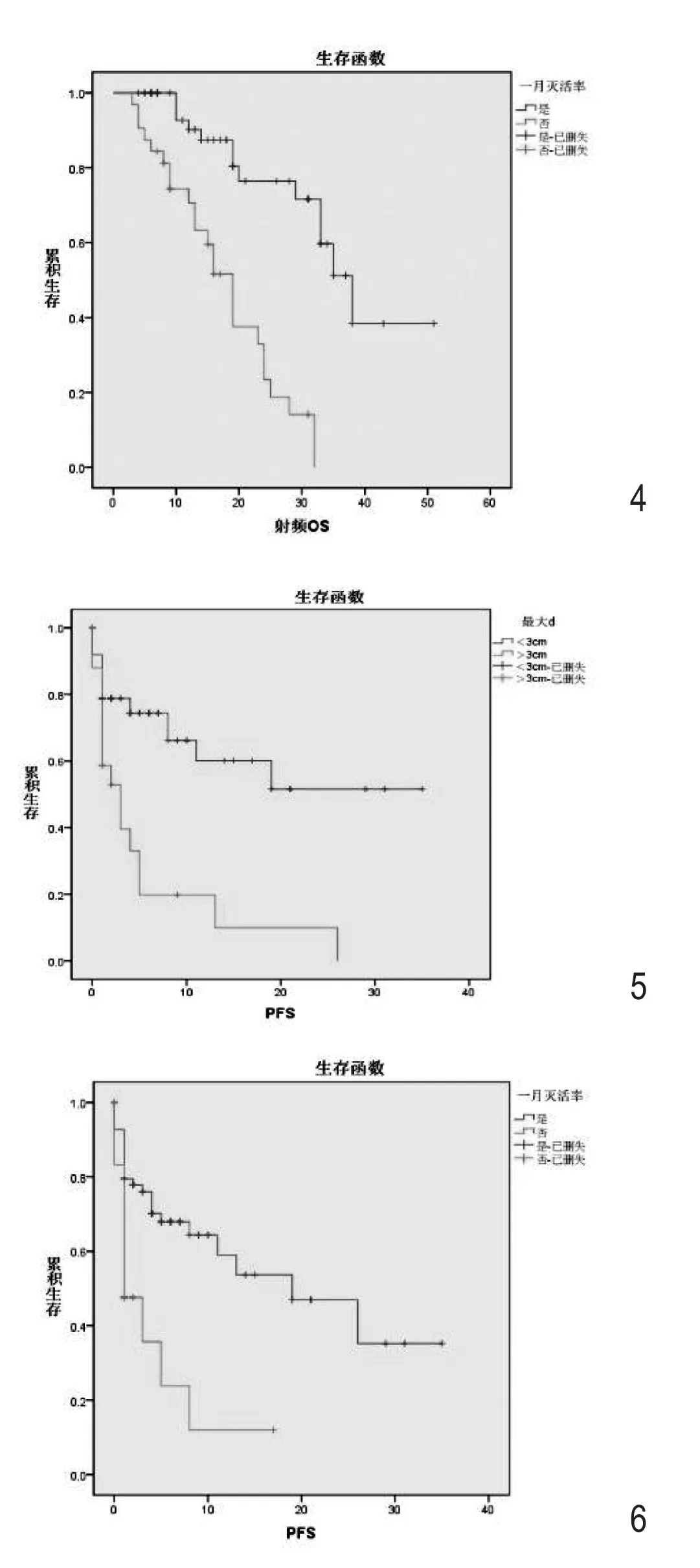
图4 RFA术后1个月肝脏病灶灭活情况射频后生存时间:RFA后评价肿瘤1个月灭活完全的患者中位射频后生存时间为31.2个月,而未完全灭活的患者中位射频后生存时间仅为16.8个月(P=0.001),具有明显统计学差异。图5 肿瘤最大直径无进展生存时间:肝脏肿瘤直径小于3cm的患者的中位无进展生存时间为21.3个月,明显高于肿瘤直径大于3cm的患者5.6个月(P=0.001)。图6 RFA术后1个月肿瘤灭活情况的无进展生存时间:RFA术后评估肿瘤1个月灭活完全的患者中位无进展生存时间为18.8个月,而未完全灭活的患者中位无进展生存时间仅为4.3个月(P=0.001),具有明显差异。
讨 论
肝转移发生于高达60%的结直肠癌患者,肝转移的治疗被认为是决定预后的一个重要因素[4-5]。射频消融术(RFA)是治疗不可切除的肝转移肿瘤最先进的技术之一,可以安全地使用经皮、腹腔镜或开放手术实施,逐渐成为原发性肝癌特别是小肝癌治疗的首选治疗手段,但是对于结直肠癌肝转移的疗效却莫衷一是。截至2015年底,国内外已有多篇文献对于结直肠癌肝转移患者RFA术后的多项临床特征进行了预后因素分析[6-8]。Riaz等人研究表明[9],结直肠癌肝转移患者的1年、3年和5年生存率分别为85%、35%和25%。本研究患者总生存时间约为45.1个月,射频后生存时间为28.3个月,无进展生存时间约为15.2个月,和Riaz等人的研究结果相符,本研究患者的总生存时间1、3、5年生存率分别为96%、67%、32%,射频后生存时间1、3、5年的生存率为90%、52%、24%,说明射频对于肝转移患者有益,有着较好的预后疗效。Lees等[10-11]研究表明,转移性结直肠癌肝转移患者中,病灶直径>3cm患者的手术治疗优势更明显,对于肿瘤体积较大的病例,射频消融一直是一个治疗的难点,这可能与当瘤体体积较大时,消融的单次热效应强度不够,从而需要重叠的射频效应,更容易引起射频消融的残余病灶复发,导致患者预后较差。本研究中,87例患者,62例患者病灶直径在3cm以内,25例大于3cm,经Kaplan-Meier分析得出病灶直径小于3cm的患者经射频术后获益更大(射频OS:33.8 个月vs.18.9个月),且PFS时间也更长(21.3个月vs.5.6个月),高于之前文献报道的肝脏转移仅手术治疗患者的术后生存时间,再加上RFA可以缩短住院日期,减少住院费用,降低并发症风险,可多次重复治疗等优点,所以临床上病灶直径在3cm以内的肝转移患者更倾向于选择射频治疗。
本研究通过Kaplan-Meier分析和Log-rank检验做单因素指标分析筛选后进行COX多因素回归分析,得到影响射频后OS的独立因素还有:①病灶数目多发的患者射频后生存时间降低(30.7个月vs 15.5个月),Abdalla等[12]人的研究也表明,病灶数目单发的患者具有明显的生存优势。不难想象转移的肿瘤数目越多提示病灶播散范围更广,患者预后也越差。②RFA术后1月经影像学复查后,完全消融的患者预后明显较好,笔者认为这可能与肿瘤大小、肿瘤病灶数目都有联系,当肿瘤直径小于3cm时,很容易通过一次单极针达到完全消融;当肿瘤体积大、病灶数目多时,往往采用多极针或者重叠覆盖消融的策略,肿瘤的残灶复发概率提高,对于射频完全灭活难度增加,使患者的射频后复发风险提高,远期预后较差。
同样的方法平行分析CRLM患者PFS的影响因素,PFS的独立影响因素为肝脏肿瘤病灶射频后1个月内的灭活情况和肿瘤的最大直径,当射频1个月内肿瘤完全灭活的情况下,患者PFS明显延长,而当肿瘤直径较小时,患者的PFS也明显更长,所以进一步验证了对于结直肠癌肝转移患者,当肝脏肿瘤直径较小时,射频治疗是治疗的首选方案之一,即使肿瘤负荷较大,射频治疗可重复操作,也能够较大程度地改善患者的无进展生存期和总生存期。
RFA的主要并发症包括发热、皮肤烧伤、穿刺点疼痛、肝功能损伤,未出现射频消融治疗相关性死亡病例,相对于肝脏切除手术的并发症,如腹腔出血、切口感染、胆漏、肝功能衰竭等严重并发症。说明RFA的安全性高,而经皮穿刺射频消融术更加微创、安全。对于直径小于3cm单发的CRLM,与手术切除肝脏肿瘤相比,RFA与之疗效相当,但适应证更广、安全性更高。
因此,射频消融术是一个重要的辅助治疗结直肠癌肝转移的方法,通过既往文献报道和本研究可以看出,射频消融治疗对于病灶单发和瘤体直径较小的结直肠癌肝转移患者获益更大,提高RFA术后1个月的灭活率,对患者的远期疗效也有优势,但本研究仍存在一些不足,病例数较少,不可避免地选择偏移可能会影响数据分析的结果。所以射频消融疗效分析,还有待于更多的临床研究和数据分析统计。
[ 1 ]施东华,王小林.大肠癌肝转移机制及诊治进展.中国医学计算机成像杂志,2010,16:81-86.
[ 2 ]张仲一,陈敏华,严 昆,等.经皮超声引导下射频消融治疗结直肠癌肝转移疗效分析.中国医学影像技术,2015,31:1246-1250.
[ 3 ]吴 斌,肖越勇,张肖,等.肝癌冷冻消融治疗中CT和MRI引导效果对照研究.中华放射学杂志, 2010,44: 852-856.
[ 4 ]Babawale SN, Jensen TM, Frokjar JB . Long-term survival following radiofrequency ablation of colorectal liver metastases: A retrospective study. World J Gastrointest Surg, 2015,7: 33-38.
[ 5 ]Treska V,SKalicky T,Sutnar A,et al.Surgical management of the colorectal carcinoma liver metastases.Rozhi Chir,2009,88:69-74
[ 6 ]ShiMing L. Ultrasonography-guided radiofrequency ablation in hepatocellular carcinoma∶ current status and future perspectives. J Med Ultrasound,2013, 21:9-15.
[ 7 ]Hur H,Ko YT,Min S,et a1.Comparative study of resection and radiofrequency ablation in the treatment of elitary colorectal liver metastases.Am J Surg,2009,1 97:728-736.
[ 8 ]Berber E,Teinberq M,Tellioglu G,et a1.Resection versus laparoscopic radiofrequency thermal ablation of solitary colorectal liver metastasis. J Qastrointest Surq,2008,12:1967-1972
[ 9 ]Riaz A, Lewandowski RJ, Kulik L, et al. Radiologicpathologic correlation of hepatocellular carcinoma treated with chemoembolization. Cardiovasc Intervent Radiol,2010,33∶1143-1152.
[10]Gillams AR,Lees WR.Five-year survival in 309 patients with colorectal liver metastases treated with radiofrequency ablation.Eur Radiol,2009,19: 1206-1213.
[11]Abitabile P,Hartl U,Lange J,et a1.Radiofrequency ablation permits an effective treatment for colorectal liver metastasis.Eur J Surq Oncol,2007,33:67-71.
[12]Abdalla, EK, Vauthey JN,Ellis LM,et al. Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastasis. Annals of Surgery, 2004,239: 818-827.
Analysis of Prognostic Factors of Radiofrequency Ablation for Colorectal Liver Metastases
DONG Yong1, ZHANG Wen-jun2, FANG Yong1
Purpose: To investigate the prognostic factors of radiofrequency ablation (RFA) for the treatment of colorectal liver metastases(CRLM). Methods: This study was carried out in the Sir Run Run Shaw Hospital affiliated to School of Medicine, Zhejiang University from June 1, 2010 to October 25, 2015. A total of 87 CRLM cases treated by RFA were selected. Potential prognostic factors were analyzed by Kaplan-Meier model, Log-rank test of univariate analysis and Cox regression model of multivariate analysis. Results: The OS after RFA was correlated with tumor counts, diameter and successive ablation of 1 month after RFA. Cox multivariate analysis indicated that PFS was correlated with tumor diameter and successive ablation of 1 month after RFA. Conclusion: RFA is a safe and effective therapeutic option for colorectal liver metastases, especially for those with diameter≤3cm and solitary tumor.
Colorectal neoplasms; Liver metastases; Radiofrequency ablation; Prognostic factors
射频消融(radiofrequency ablation,RFA) 是一种通过热效应灭活肿瘤的微创治疗方法,在近几十年中发展迅速。目前其对于肿瘤的治疗作用(特别是小肝癌的治疗)已经取得了广泛认可。虽然其在复发率和生存期上无法完全替代手术治疗,但其具有创伤小、最大程度保护肝脏储备、可重复治疗等优势。肝脏是结直肠癌最常见的转移灶[1],近年来,RFA在结直肠癌肝转移(colorectal liver metastases,CRLM) 治疗中的应用也越来越广泛,但远期疗效仍存在争议[2]。本研究回顾性分析87例接受RFA 治疗的CRLM患者资料,探讨其疗效及预后因素,旨在使更多的CRLM患者能够从中获益。
key projects of Health and Family Planning Commission in Zhejiang Province(NO.2016ZDB007)
R735.7
A
1006-5741(2016)-05-0429-06
中国医学计算机成像杂志,2016,22∶429-434
∶1浙江大学医学院附属邵逸夫医院肿瘤科
2 浙江省医学科学院分子医学中心
通信地址∶浙江省杭州市庆春东路3号, 杭州 310016
∶方勇 (电子邮箱∶307480770@qq.com)
∶ 浙江省卫计委平台重点项目(2016ZDB007)
Chin Comput Med Imag,2016,22∶429-434
1 Department of Oncology, Sir Run Run Shaw Hospital, School of Medicine, Zhejiang University,
2 Zhejiang Academy of Medical Sciences
Address: 3 Qingchun Rd., Hangzhou, 310016, P.R.C.
Address Correspondence to FANG Yong (E-mail: 307480770@qq.com)
2016.08.01;修回时间:2016.08.11)

