动态增强磁共振与HIF-1a预测食管鳞癌放化疗敏感性
李飞平卢 强唐 姣王 晖张百华周 斌于小平*
动态增强磁共振与HIF-1a预测食管鳞癌放化疗敏感性
李飞平1卢 强1唐 姣2王 晖2张百华3周 斌3于小平1*
目的:探讨动态增强磁共振(DCE-MRI)定量参数与乏氧诱导因子-1a(HIF-1a)预测食管鳞癌放化疗敏感性的价值。方法:对22例食管鳞癌患者行常规MRI、DWI、DCE-MRI检查及免疫组化染色。根据免疫组化结果分为HIF-1a阴性组(n=13)及HIF-1a阳性组(n=9),比较治疗前两组间DCE-MRI定量参数值之间的差异及治疗前后各参数值、肿块体积的差异。并以ROC曲线来评价治疗前Ktrans值区分HIF-1a阴性/阳性表达的效能。结果:①治疗前HIF-1a阴性组与阳性组间Ktrans值有显著差异(P=0.001);②治疗前后HIF-1a阴性组Ktrans值、肿块体积(V)有显著差异(P=0.002,P=0.001),而阳性组DCEMRI定量参数、肿块体积(V)无明显差异;③采用ROC曲线评价治疗前Ktrans值对判断食管鳞癌HIF-1a阴性/阳性表达的效能,曲线下面积为0.932,敏感性为100%,特异性为86.4%。结论:食管鳞癌HIF-1a阴性表达患者可能对放化疗更为敏感,治疗前Ktrans值对判断食管鳞癌HIF-1a阴性/阳性表达及对其放化疗敏感性的预测可能有一定的价值。
食管鳞癌;动态增强磁共振;乏氧诱导因子-1a
我国是食管癌的高发区,食管鳞癌约占全部食管癌的90%。手术治疗仍是食管癌最主要的治疗手段,但对于局部晚期食管癌,同步放化疗已成为目前公认有效的治疗方式[1]。因此,一个精确简便的预测食管癌患者对放化疗敏感性的指标对食管癌治疗方式的选择具有十分重要的意义,临床上可以依据预测结果为不同患者选择更为合理而有效的治疗方案。已有许多证据表明,肿瘤乏氧细胞的产生和存在不仅使肿瘤对放化疗的抗拒性增加,而且使肿瘤更具有侵袭性,容易发生转移[2],因此在放化疗前明确肿瘤内乏氧细胞存在与否有着重要的意义。动态增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging, DCE-MRI)能定量评估肿瘤微循环的性能,包括血管的通透性、流动异质性及其空间分布,该技术在肿瘤鉴别、早期疗效评估及预后判断的研究已有报道[3-5]。因此,本研究尝试探DCE-MRI定量参数与HIF-1a对食管鳞癌放化疗敏感性的预测价值,旨在为临床治疗方案的拟定提供有利的线索。
方 法
1.临床资料
收集2014年7月至2015年9月本院病理证实为食管鳞癌患者22例,年龄49~67岁,平均58.3岁,男性21例,女性1例。纳入标准:①患者知情同意参加临床试验,并接受随访;②经活检确诊的食管鳞癌初治患者,在入组前未接受针对食管癌的其他抗肿瘤治疗;③年龄18岁~70岁。排除标准:①MRI检查禁忌证;②不接受/耐受手术或放化疗;③身体状况较差,自主呼吸不平稳,不能耐受较长时间检查。经本院伦理委员会批准,所有患者在接受检查前均签署了知情同意书。
2 设备及扫描方法
所有患者分别在治疗前及放化疗结束行食管常规平扫、DWI、DCE-MRI检查。使用GE R360 1.5T超导型MR和8通道相控体部线圈,患者取仰卧位,头先进。DCE-MRI序列包括:①LAVA-T1WI平扫:Flip Angle 6o,TR 3.5ms,TE 1.2 ms,FOV 40×30cm,层厚4mm,层间距0mm。②多时相LAVA-T1WI动态增强扫描:Flip Angle 6°,其他参数同上,共扫描56个时相,每个时相6s、采集24幅图像,共耗时336s、采集1120幅图像。在动态增强扫描第5个时相,通过高压注射器经肘静脉注入对比剂钆双胺(剂量0.1mmol/kg体重,流率3ml/s),随后注入15ml生理盐水冲管(流率3ml/s)。
3.图像分析与数据采集
3.1 DCE-MRI参数测定:将DCE-MRI原始数据传输至GE Advantage Windows Workstation(版本4.6),应用CineTool软件包进行处理。选择病灶最大层面,采用手动绘制感兴趣区(ROI)勾画原发灶边界,尽量避开囊变、坏死及食管腔内气体区,然后由软件自动计算DCE-MRI的全定量参数(Ktrans、Kep、Ve)。
3.2 病灶体积的测定:在AW4.6工作站,利用Functool-reformat软件,将ADC图导入,结合轴位T2脂肪抑制图像,逐层勾画肿块的边界得出每个层面肿块的面积(单位mm2),然后将所有病变层面的面积累加得出肿瘤的体积(V)。
4.HIF-1a测定
所有标本经10%甲醛常规固定,石蜡包埋,4μm连续切片。HIF-1a一抗试剂均购自北京中山试剂公司。主要免疫组化步骤: 二甲苯脱蜡、梯度酒精至水,3%双氧水灭活内源性过氧化酶,PBS缓冲液振洗,采用专用微波炉进行抗原微波热修复,正常山羊血清封闭、一抗冰箱过夜,二抗、三抗各1 h,DAB显色10~15min,复染核脱水透明,中性树胶封片。结果判断: 着色细胞<10%为阴性,>10%为阳性。
5.统计学方法
应用SPSS 19.0统计软件包进行统计分析,DCE-MRI各参数值以均数±标准差(± s )表示,治疗前HIF-1a阴性组及HIF-1a阳性组DCE-MRI参数值之间的比较采用Mann-Whitney U 检验,治疗前后两组各参数值之间的比较采用Wilcoxon signed-rank配对检验,P<0.05表示有统计学意义。采用受试者工作特征(ROC)曲线分析DCE-MRI参数对HIF-1a阴性/阳性的判断效能。
结 果
26例食管鳞癌患者接受MRI检查,其中1例因病灶过小无法获取感兴趣区,2例因图像出现严重伪影,1例治疗过程中出现严重并发症放弃治疗被剔除,其余例22例纳入分析,其中HIF-1a阴性表达13例,HIF-1a阳性表达9例。
治疗前HIF-1a阴性组与HIF-1a阳性组DCEMRI定量参数值之间的比较:两组间Ktrans值有显著差异(P=0.001),两组间Kep、Ve值无明显差异(表1)。
HIF-1a阴性组及HIF-1a阳性组治疗前后DCEMRI定量参数值、肿块体积(V)的比较:HIF-1a阴性组Ktrans值、V有显著差异(P=0.002,P=0.002),Kep、Ve无明显差异(图1)。HIF-1a阳性组DCEMRI定量参数值及V无明显差异(图2,表2)。
采用ROC曲线评价治疗前Ktrans值对食管癌HIF-1a阴性/阳性表达的判断效能,ROC曲线下面积为0.932,当Ktrans取阈值为0.154/min时,约登指数最大(0.846),此时敏感性为100%,特异性为84.6%(图3)。
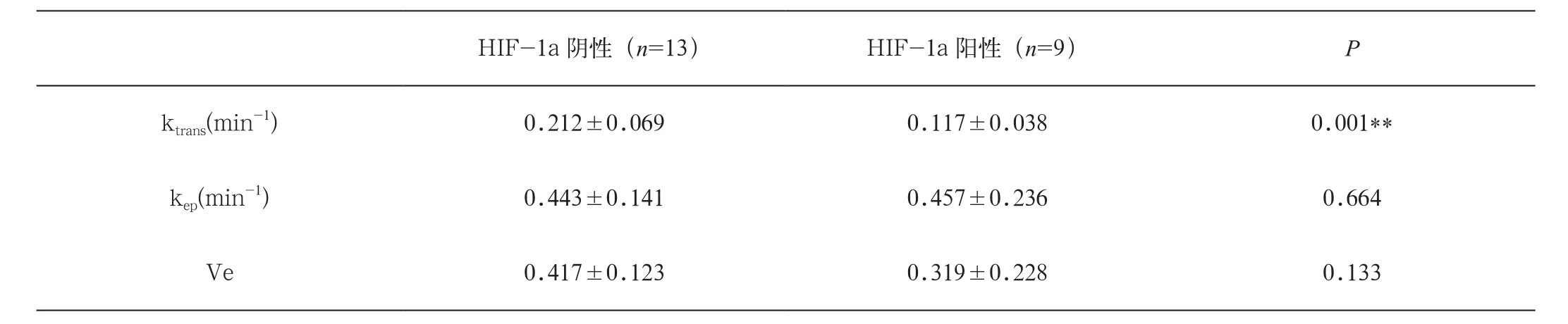
表1 治疗前HIF-1a阴性组及HIF-1a阳性组DCE-MRI定量参数值的比较
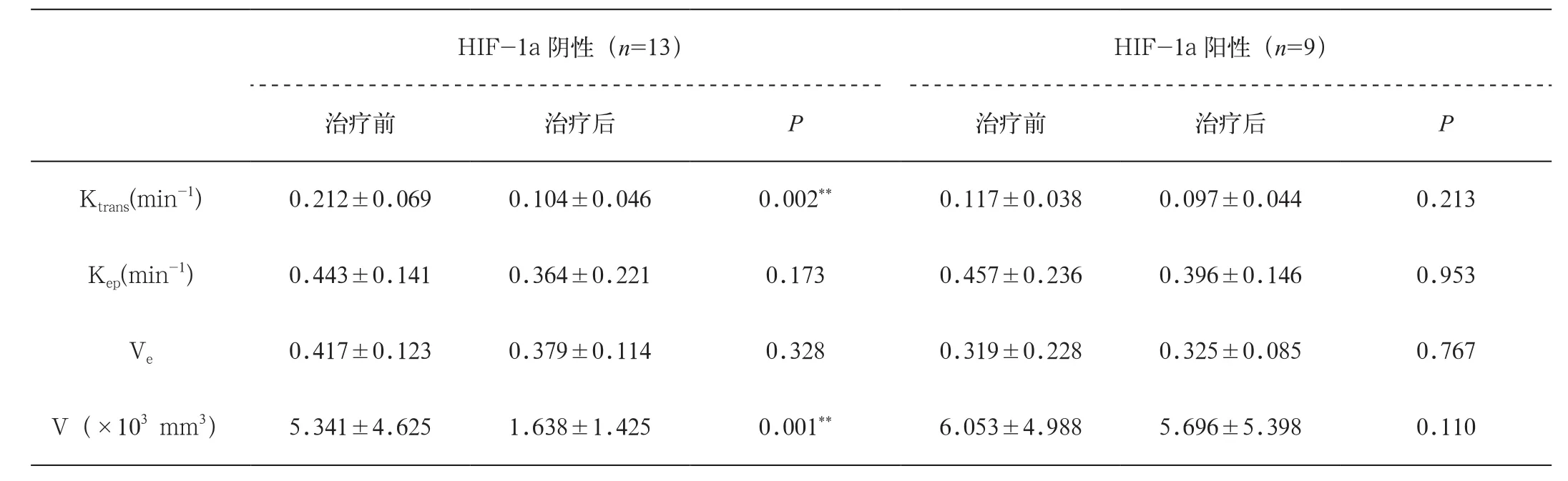
表2 HIF-1a阴性组、HIF-1a阳性组治疗前后DCE-MRI定量参数值、肿块体积(V)的比较
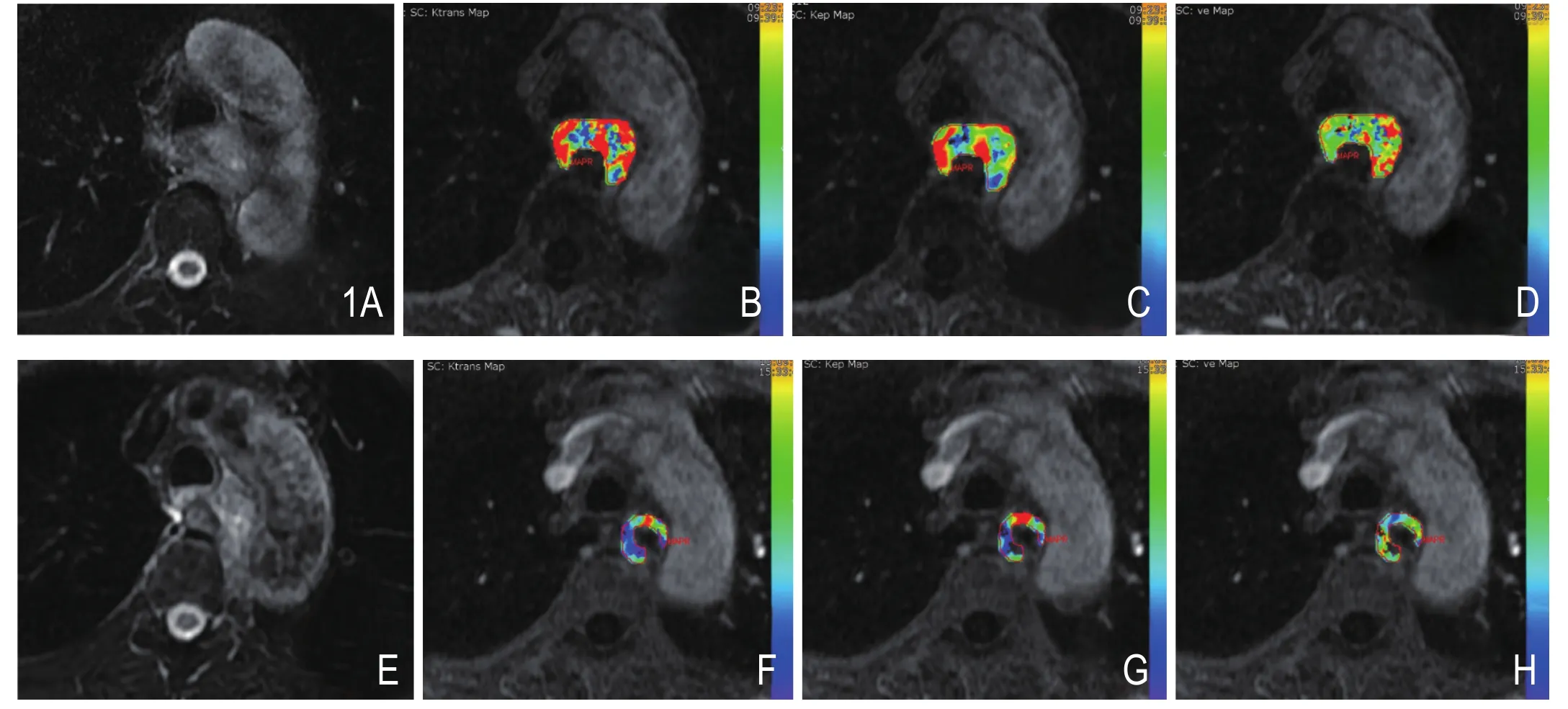
图1 患者男性,66岁,食管鳞癌,HIF-1a阴性。A~D.分别为放化疗前T2WI、Ktrans、Kep、Ve图,Ktrans、Kep、Ve值分别为0.202/min、0.363/min、0.568。E~H.分别为放化疗结束T2WI、Ktrans、Kep、Ve图,Ktrans、Kep、Ve值分别为0.096/min、0.315/min、0.586。治疗后Ktrans值及肿块体积较治疗前明显缩小。
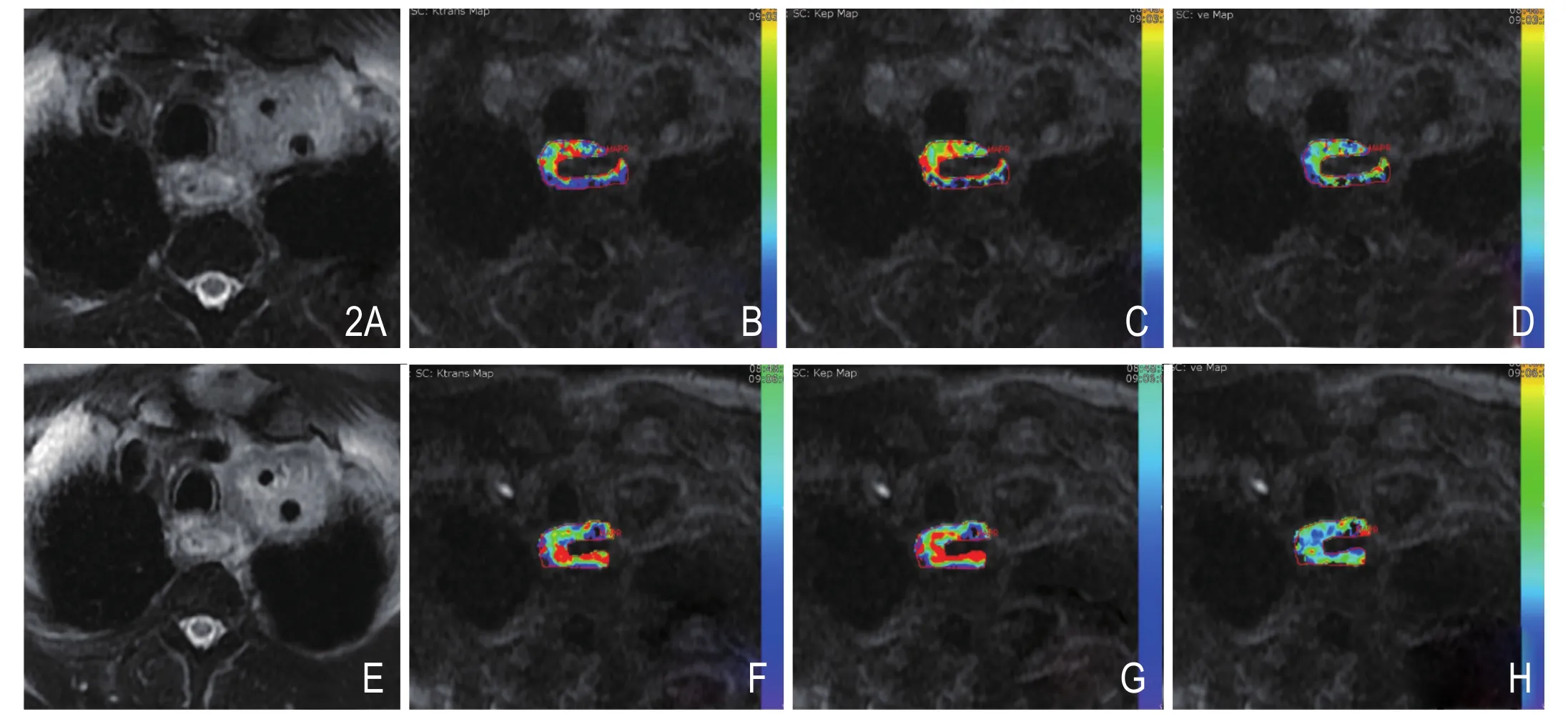
图2 患者男性,52岁,食管鳞癌,HIF-1a阳性。A~D.分别为放化疗前T2WI、Ktrans、Kep、Ve图,Ktrans、Kep、Ve值分别为0.125/min、0.382/min、0.344。E~H.分别为放化疗结束T2WI、Ktrans、Kep、Ve图,Ktrans、Kep、Ve值分别为0.118/min、0.338/min、0.304。治疗后Ktrans值及肿块体积较治疗前无明显变化。
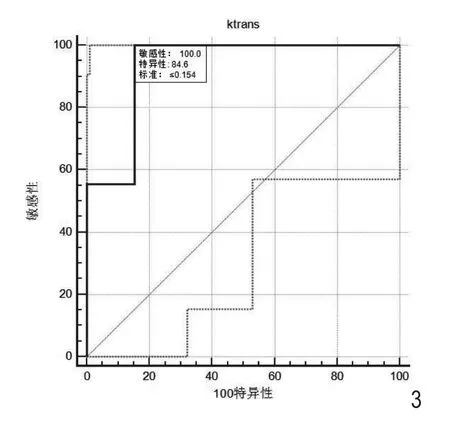
图3 治疗前Ktrans值判断食管鳞癌HIF-1a阴性、阳性表达效能ROC曲线。
讨 论
食管癌放化疗敏感性依赖肿瘤微血管状态,而肿瘤血管生成在肿瘤的发生、发展、侵袭及转移等方面都起着重要作用。肿瘤内异常的微血管结构与紊乱的微环境变化导致肿瘤内普遍存在着乏氧, 其中首要原因是血流灌注缺乏,而乏氧可使肿瘤生长、侵袭和转移能力增加以及放化疗敏感性降低[6-7]。因此,评价肿瘤血管生成状态有助于了解和预测肿瘤的侵袭性、转移潜能与放化疗敏感性。DCE-MRI定量分析是运用药物动力学模型技术,对时间-浓度曲线进行数学拟合,演算出各种能反映肿瘤血管结构和功能的定量参数[8-9],包括:Ktrans是指对比剂从血管内向血管外细胞外间隙(extravascular extracellular space, EES)的容积转运常数,主要与血流灌注和血管通透性有关;Kep是对比剂由EES转移至血浆的速度常数;Ve是对比剂在EES的分布容积。其中Ktrans值作为肿瘤血流的标志物已经获得公认[10],并被美国国立癌症研究所(USNCI)推荐为抗癌治疗试验的主要观察点之一,并将Ktrans值作为预测放疗疗效的指标。
本研究结果发现治疗前HIF-1a阴性组与阳性组间DCE-MRI定量参数Ktrans值存在显著差异(P=0.001),且前者高于后者,提示食管鳞癌HIF-1a阴性表达者较阳性表达者其肿瘤血管生成和/或渗透性要好。本研究还得出治疗后HIF-1a阴性组Ktrans值较治疗前明显下降(P=0.002),肿块体积(V)较治疗前明显缩小(P=0.001),而阳性组DCE-MRI定量参数及肿块体积(V)在治疗前后无明显差异,提示HIF-1a阴性表达者对放化疗敏感。其可能的原因为HIF-1a阴性表达者其肿瘤内氧供比较丰富,放射线照射肿瘤组织时,在富氧状态下能够形成更多的氢氧自由基,从而增强放射线对肿瘤细胞 DNA的损伤,同时放射治疗使肿瘤组织毛细血管壁肿胀、变性、坏死,管腔变窄,血栓形成导致血流灌注减少和血管渗漏性降低,甚至局部纤维化,因此Ktrans值降低,肿块体积缩小。而HIF-1a阳性表达者可能因其肿块内普遍存在乏氧,乏氧存在对放疗产生抗拒,因此DCE-MRI参数值无明显变化,肿块体积亦无明显缩小。Lei等[4]在食管癌放化疗疗效评价的研究中得出治疗前Ktrans值高其疗效好,O'connor等[11]在直肠癌的研究中也得出了类似的结论。研究显示头颈部恶性肿瘤放疗敏感组患者治疗前Ktrans值高于疗效中间组,且差异存在统计学意义[12-13];Chawla等[14]研究发现,头颈部鳞癌放疗有效组原发肿瘤及转移病灶Ktrans值高于无效组。上述研究均得出了与本研究类似的结果,进一步说明了治疗前Ktrans值对食管鳞癌放化疗敏感性的有一定的预测价值。
根据两组治疗前Ktrans值做ROC曲线分析得出,当Ktrans取阈值为0.154/min时对区分食管鳞癌HIF-1a阴性/阳性的敏感性达100%,特异性达84.6%,提示治疗前Ktrans值有可能成为判断食管鳞癌HIF-1a阴性/阳性表达的一种无创的检验方法。但是Borren[15]等在前列腺癌的研究中发现Ktrans值与HIF-1a的表达无明显相关性,因此该结果是否可靠有待扩大样本量进一步研究。
本研究联合DCE-MRI定量参数及HIF-1a共同预测食管鳞癌对放化疗的敏感性,得出了食管鳞癌HIF-1a阴性表达患者可能对放化疗更为敏感,治疗前Ktrans值对判断食管鳞癌HIF-1a阴性/阳性表达及对其放化疗敏感性的预测可能有一定的价值。但仍存在不足之处:①本研究样本量偏少,同步放化疗组病例临床分期主要集中在Ⅲ、Ⅳ期。②食管与胸部大血管及心脏毗邻,DCE-MRI图像伪影颇为严重,对感兴趣区(ROI)的获取有一定的影响。因此进一步研究应继续扩大样本量及补充分期较早的病例,继续优化DCE-MRI扫描参数。
[ 1 ]D’Journo XB,Thomas PA. Current management of esophageal cancer. J Thorac Dis, 2014, 6 : S253-264.
[ 2 ]Turkbey B, Thomasson D, Pang Y, et al. The role of dynamic contrastenhanced MRI in cancer diagnosis and treatment. Diagn Interv Radiol, 2010,16:186-192.
[ 3 ]Park M, Kim J, Choi YS, et al. Application of dynamic contrastenhanced MRI parameters for differentiating squamous cell carcinoma and malignant lymphoma of the oropharynx . AJR Am J Roentgenol, 2016, 206: 401-407
[ 4 ]Lei J,Han Q, Zhu S, et al. Assessment of esophageal carcinoma undergoing concurrent chemoradiotherapy with quantitatiVe dynamic contrast-enhanced magnetic resonance imaging . Oncol Lett, 2015,10: 3607-3612.
[ 5 ]Lee SH, Hayano K, Zhu AX, et al. Dynamic contrast-enhanced MRI kinetic parameters as prognostic biomarkers for prediction of survival of patient with advanced hepatocellular carcinoma: A pilot comparative study . Acad Radiol, 2015, 22: 1344-1360
[ 6 ]Giatromanolaki A, Fiska A, Pitsiava D, et al. Erythropoietin receptors in endometrial arcinoma as related to HIF1{alpha} and VEGF expression. In Vivo, 2009, 23: 699-703.
[ 7 ]Ku JH, Shin JK, Cho MC, et al. Effect of dutasteride on the expression of hypoxia-inducible factor-1alpha,vascular endothelial growth factor and microVessel density in rat and human prostate tissue . Scand J Urol Nephrol, 2009, 43:445-453
[ 8 ]Bajpai J, Gamanagatti S, Sharma MC, et al. NoninvasiVe imaging surrogate of angiogenesis in osteosarcoma .Pediatr Blood Can, 2010,54:526-531
[ 9 ]Wu X, Jeong EK, Emerson L, et al. Noninvasive evaluation of antiangiogenic effect in a mouse tumor model by DCE- MRI with Gd-DTPA cystamine copolymer .Mol Pharm, 2010,7: 41-48
[10]Zweifel M, Padhani AR. Perfusion MRI in the early clinical development of antivascular drugs: decorations or decision making tool. Eur J Nucl Med Mol Imaging,2010: S164-182.
[11]O'connor JP, Carano RA, Clamp AR, et al. Quantifying antivascular effects of monoclonal antibodies to vascular endothelial growth factor: insights from imaging . Clin Can Res, 2009,15:6674-6682.
[12]Agrawal S, Awasthi R, Singh A, et al. An exploratory study into the role of dynamic contrast- enhanced (DCE) MRI metrics as predictors of response in head and neck cancers .Clin Radiol,2012,67: e1-5
[13]Kim S, Loevner LA, Quon H, et al. Prediction of response to chemoradiation therapy in squamous cell carcinomas of the head and neck using dynamic contrast- enhanced Mr imaging . AJNR Am J Neuroradiol, 2010,31: 262-268
[14]Chawla S, Kim S, Dougherty L, et al. Pretreatment diffusion-weighted and dynamic ontrast- enhanced MRI for prediction of local treatment response in squamous cell carcinomas of the head and neck. American J Roentgenology, 2013, 200: 35-43.
[15]Borren A, Groenendaal G, van der Groep P,et al. Expression of hypoxia-inducible factor-1a and -2a in whole-mount prostate histology: relation with dynamic contrast-enhanced MRI and Gleason score.Oncol Rep,2013,29:2249-2254
Study of Dynamic Contrast-enhanced MRI and HIF-1a in Predicting the Sensitivity of Chemoradiotherapy in Esophageal Squamous Cell Carcinoma
LI Fei-ping1, LU Qiang1, TANG Jiao2, WANG Hui2, ZHANG Bai-hua3, ZHOU Bin3,YU Xiao-ping1
Purpose:To explore the value of the quantitative parameters of dynamic contrast-enhanced MRI (DCE-MRI) and the HIF-1a in predicting the sensitivity of chemoradiotherapy in esophageal squamous cell carcinoma (ESCC). Methods: Conventional MRI, DWI, DCE-MRI and immunohistochemistry were performed in 22 ESCC patients. HIF-1a negative group (n=13) and HIF-1a positive group (n=9) were divided according to the immunohistochemistry results. The differences of quantitative parameters of DCE-MRI before treatment betweenthe two groups were compared, and the differences of quantitative parameters and tumor volume (V) before and after treatment were also compared. ROC curves were used to evaluate the efficacy of pre-treatment Ktransvalue in differentiating HIF-1a negative and positive expression. Results: 1. The Ktransvalue showed significant difference between HIF-1a negative group and positive group (P=0.001). 2.The Ktransvalue and V showed significant differences in HIF-1a negative group between before and after treatment (P=0.002,P=0.001), and none of the quantitative parameters and V showed significant differences in the HIF-1a positive group. 3. ROC curve was used to evaluate the efficacy of pre-treatment Ktransvalue in differentiating HIF-1a negative and positive, the area under the curve, sensitivity and specificity was 0.932, 100%, 84.7%, respectively. Conclusion: ESCC patients with negative expression of HIF-1a may be more sensitive to chemoradiotherapy, the pre-treatment Ktransvalue might have value in differentiating HIF-1a negative from positive, and predicting the chemoradiotherapy sensitivity for ESCC.
1. Hunan Science and Technology Department(2014SR3131);2.The Provincial Key Clinical Specialty(Medical Imaging) Development Program from Health and Family Planning Commission of Hunan Province(2015/43);3.National Key Clinical Specialty(Oncology Department) National Health and Family Planning Commission of the PRC(2013/544)
Esophageal squamous cell carcinoma; DCE-MRI; HIF-1a
R814.42
A
1006-5741(2016)-05-0423-06
中国医学计算机成像杂志,2016,22∶423-428
∶1 湖南省肿瘤医院放诊科
2 湖南省肿瘤医院胸部放疗科
3 湖南省肿瘤医院胸外科
通信地址: 湖南省长沙市岳麓区桐梓坡路283号, 长沙 410013
∶于小平(yuxiaoping@hnszlyy.com)
∶1.湖南省科技厅(2014SR3131);2.湖南省临床重点专科(医学影像)建设项目(2015/43);3.国家临床重点专科建设项目单位基金项目(2013/544)
Chin Comput Med Imag,2016,22∶423-428
1 Department of Diagnostic Radiology, Hunan Cancer Hospital
2 Department of Thoracic Radiation Oncology, Hunan Cancer Hospital
3 Department of Thoracic Surgery, Hunan Cancer Hospital
Address: 283 Tongzipo Rd, Changsha 410013, P.R.C.
Address Correspondence to YU Xiao-ping (E-mail: yuxiaoping@hnszlyy. com)
2016.03.18;修回时间:2016.07.04)

