射频消融辅助手术切除腹腔巨大肿物的临床研究
刘海生

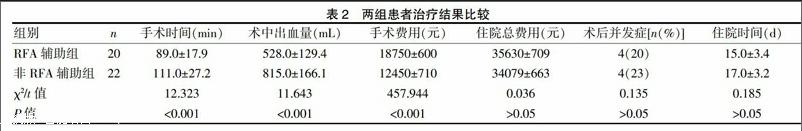
[摘要] 目的 探讨射频消融辅助手术切除复杂腹腔巨大肿物的优缺点、可行性及其治疗效果。 方法 回顾性分析2011年3月~2016年3月我院收治的42例复杂腹腔巨大肿物患者,男25例,女17例;年龄21~74岁,平均(57±10)岁;分为射频消融辅助组(n=20)和非射频消融辅助组(n=22),两组均为开腹手术且完整切除肿物。比较两组的手术时间、术中出血量、住院时间、住院总费用、手术费用及术后并发症等指标。 结果 42例患者手术均顺利完成。射频消融辅助组平均手术时间为(89±17.9)min,非射频消融辅助组(111±27.2)min;射频消融辅助组术中平均出血量为(528±129.4)mL,非射频消融辅助组为(815±166.1)mL;射频消融辅助组平均手术费用为(18750±600)元,非射频消融辅助组为(12450±710)元;差异均有统计学意义(P<0.05)。射频消融辅助组平均住院天数(15±3.4)d,非射频消融辅助组平均住院天数(17±3.2)d;射频消融辅助组平均住院总费用为(35630±709)元,非射频消融辅助组为(34079±663)元;射频消融辅助组术后并发症发生率为20%,非射频消融辅助组术为23%;差异均无统计学意义(P>0.05)。 结论 射频消融辅助腹腔肿物切除术具有效率高、手术时间短、出血量较少等优点,是一种可供选择的、有效的、相对简单易行的术式,但也存在手术费用昂贵的缺点。
[关键词] 射频消融辅助,手术切除,腹腔,巨大肿物
[中图分类号] R814.42 [文献标识码] B [文章编号] 1673-9701(2016)26-0046-03
近年来,射频消融(radiofrequencyablation,RFA)安全可靠、微创方便的特点受到国内外学者的肯定,随着器械的不断更新和完善及临床医师的治疗技术与经验的积累,射频消融术的适应证不断扩大,曾经是难以切除的腹腔巨大肿物也可在射频消融辅助下顺利完成,为难以切除的腹腔肿物手术治疗带来了希望。本文回顾性分析我院2011年3月~2016年3月收治的42例腹腔复杂巨大肿物的患者资料,其中行射频消融辅助的患者20例,同期行非射频消融辅助的患者22例,比较两种术式的优缺点、可行性及临床疗效,现报道如下。
1 资料与方法
1.1 临床资料
目前对于腹腔巨大肿物无明确标准,本资料将直径≥12 cm作为研究对象,本组共纳入患者42例,其中男25例,女17例,年龄最小43岁,最大70岁。患者均为复杂的腹部巨大肿物,肿瘤大小约12~30 cm,手术难度极大,患者均具备手术指征,且手术意愿强烈。根据治疗方法不同分为射频组20例、非射频组22例。射频组男12例,女8例,平均年龄(56±9.6)岁,非射频组男13例,女9例,平均年龄(57.0±10.5)岁;射频组胰腺肿瘤手术4例,十二指肠肿瘤切除术5例,腹膜后肿瘤切除术6例,肝脏肿瘤4例,肿瘤直径为(15±4)cm,非射频组胰腺肿瘤手术4例,十二指肠肿瘤切除术5例,腹膜后肿瘤切除术7例,肝脏肿瘤8例,肿瘤直径为(14±3)cm,两组基础资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 手术方法
两组患者入院后全面检查,包括实验室检查、超声、CT和(或)MRI等影像学检查。研究采用的射频发生器为美国RITA公司(Radiofrequency Interstitial Thermal Ablation Medical System of USA)生产,cool-tip集束针型号:ACTC2025(covidien Made in USA)。射频消融组术前均获得患者的知情同意,在患者两大腿分别贴上负极板。两组患者均在气管插管全麻下行开腹手术,麻醉完成后根据疾病不同采取不同的入腹切口,暴露肿瘤,由于肿瘤巨大无法充分显示,射频消融辅助组将cool-tip集束针放置到肿瘤所在部位,对显露处肿瘤进行射频消融,多点反复进行,使肿瘤表面血管凝固,由浅入深地消融,肿瘤变硬,体积明显缩小,再逐步将肿物从血管及周围组织上切掉,最后完整切除。非射频消融辅助组使用电刀,间断止血结扎或缝扎的常规手术方式。
1.3 观察指标
观察记录两组手术时间、术中出血量、手术费用、住院总费用、住院时间、术后并发症。
1.4 统计学方法
采用SPSS17.0软件对数据进行处理,计量资料以(x±s)表示,组间比较采用t检验,计数资料以[n(%)]表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2结果
两组患者均顺利切除肿物痊愈出院,其中射频消融辅助组平均手术时间(89.4±17.9)min,非射频消融辅助组(111.3±27.2)min;射频消融组术中平均出血量(528.0±129.4)mL,非射频消融组(815.0±166.1)mL;射频消融组手术费用(18750±600)元,非射频消融组(12450±710)元,差异均有统计学意义(P<0.05)。射频消融组平均住院天数(15±3.4)d,非射频消融组平均住院天数(17.0±3.2)d;射频消融组平均住院总费用(35630±709)元,非射频消融组(34079±663)元;射频消融辅助组术后出现粘连性肠梗阻1例,肺部感染2例,腹腔感染1例,术后并发症发生率为20%;非射频消融辅助组出现粘连性肠梗阻2例,肺部感染1例,腹腔感染1例,术后24 h内出血1例,术后并发症发生率为23%;患者术后出现粘连性肠梗阻均经保守治疗无效后再次手术治愈,肺部及腹腔感染均抗感染治疗后治愈,术后出血行二次手术止血治愈,两组术后并发症发生率比较,差异无统计学意义(P>0.05)。
3 讨论
近年来,微创外科治疗的兴起为复杂易出血的手术提供新的治疗发法,射频是一种高频电磁波,由交变电场和磁场组成,以375~500 kHz 的射频波产生的能量从发射器至治疗电击针经负极板在人体形成闭合回路。带电离子、带电胶体在射频形成的交流电场作用下高速振动互相摩擦产生热能使组织温度升高,发生凝固性坏死。治疗电击针周围温度可达50~110℃。当温度超过45~50℃时,细胞膜就会被破坏,蛋白变性,超过55℃ 时就会产生不可逆性坏死,从而在电极针周围组织产生一个消融区,可以达到杀灭切缘残留肿瘤细胞的作用[1]。由于射频的热凝止血特性,用射频消融治疗提高了治疗安全性。同时对于肿瘤靠近大血管或位置较深处,射频消融治疗能有效降低手术风险,现已广泛用于开腹、腹腔镜下手术[2,3],有很好的止血效果,同时也可避免开放性手术过程中对恶性肿瘤的挤压,导致癌细胞的扩散,热毁损封闭效应使周围血管凝固,有利于减少肿瘤转移途径[4]。
由于腹腔内巨大肿物常占据空间大与周围组织关系密切,易发生副损伤,给术者增加了极大的手术难度。常规手术切除往往会出现难以控制的大出血,而手术中出血量越多其术后的并发症发生率和病死率越高[5]。所以控制和减少切除肿物过程中出血是降低术后并发症发生率和手术死亡率的重要措施。而在射频消融辅助下行肿物切除术可有效地减少持续渗血和出血,减少出血量[6],缩短手术时间,减少麻醉打击,保证手术顺利推进。射频消融辅助巨大肿物切除还能够有效地降低肿瘤体积,为理清肿瘤与周边组织关系及手术操作提供了空间,为安全地分离周围器官及重要血管奠定了基础,为处理意外大出血提供了空间上的保障[7]。
对于腹腔巨大肿物,消融时要持有耐心,可采取分层、渐进、逐步蚕食、由周边向中心进行的方法,待消融完全后可以行剪刀剪开分离周围组织而创面几乎无出血,如再遇出血可继续局部追加射频消融[8]。巨大肿物射频消融常常会发生并发症,据报道溶血是几乎无法避免的并发症。而溶血直接导致的并发症包括血红蛋白尿、贫血、黄疸和暂时性肾损伤[9,10],因此术中及术后要积极预防和治疗血红蛋白尿对肝、肾功能的损害[11,12]。有报道术后可能引起ARDS,这可能与消融体积大及消融时间长引起明显的全身炎症反应相关[13]。术中高热与术后发热也是射频消融后常见并发症,这可能与巨大肿物射频时间长有关,术中需大量补液,术中需间断消融,减少持续消融时间过长,此外部分患者 RFA 术后有一过性发热(一般体温不超过39℃,7 d内降至正常),可能由于肿瘤坏死物质过多导致人体炎症细胞因子产生增多,也可能与术后感染有关[14,15],必要时行抗生素抗菌治疗。
综上所述,射频对手术出血的控制是明显的,提高了手术的安全性.射频虽然术中器械费用高,但可减少患者失血,缩短手术时间,减少去ICU的可能,减轻麻醉打击,总的费用与单纯手术无异,且减轻了患者痛苦、并发症的发生率及医疗纠纷的风险,在进行个体化、综合治疗的临床实践中值得推广。
[参考文献]
[1] 陈敏山,张耀军,李锦清,等. 射频消融治疗肝脏恶性肿瘤803例分析[J]. 实用医学杂志,2014,28(14):82-84.
[2] 王劭宏,孙文兵. 孤立性巨大肝细胞癌的射频消融策略[J].中国医刊,2015,50(11):4-5.
[3] Gao J,Ji Js,Ding XM,et al. Laparoscopic radiofrequency ablation for large subcapsular hepatic hemangiomas:Technical and clinical outcomes[J]. Plos One,2016,11(2):749-755.
[4] Hasegawa K,Makuuchi M,Takayama,et al. Surgical resection vs. percutaneous ablation for hepatocellular carcinoma:A preliminary eport of the Japanese nationwide survey[J]. Hepatol,2008,9(5):589-594.
[5] 王向涛,张永立,辛宗海,等. 外生性大肝癌射频消融策略[J]. 中国医刊,2014,49(10):61-68.
[6] WongST,EdwardsM J,ChaoC. Radiofrequency ablation for unresectable hepatic tumors[J]. Am J Surg,2001,182(6):552-557.
[7] 孙文兵,张延峰,蔡淑艳,等. 巨大腹膜后恶性副副神经节瘤切除一例[J]. 中华普通外科杂志,2006,21(12):906.
[8] 王冠男,王小明,胡明华,等. 射频消融辅助肝切除术15例分析[J]. 胆外科杂志,2013,21(4):279-281.
[9] 高君,丁雪梅,柯山,等. 射频消融治疗巨大肝海绵状血管瘤的初步经验[J]. 中华外科杂志,2011,49(7):659-661.
[10] 孙健,高君,王劭宏,等. 肝血管瘤射频消融致严重溶血和明显肾功能损害一例[J]. 中华普通外科杂志,2010, 25(8):691-692.
[11] 郑亚民,王悦华,刘东斌,等. 射频消融在肝巨大血管瘤手术中的应用[J]. 实用医学杂志,2013,29(2):274-275.
[12] Park SY,Tak WY,Jung MK,et al. Symptomatic-enlarging hepatic hemangiomasale effectively treated by percutaneous ultrasonography-guided radiofrequency ablation[J].Hepatol,2011,54(3):559-565.
[13] 王劭宏 高君,柯山,等. 射频消融治疗肝巨大血管瘤疗效及安全性[J]. 中华普通外科杂志,2014,29(3):172-176.
[14] 蒋天安,陈立斌,陈芬,等. 超声引导射频消融治疗肝恶性肿瘤的安全性研究[J]. 中华超声影像学杂志,2014,23(11):939-943.
[15] 刘倚河,毕建民,吴秀艳,等. 超声引导下经皮肝穿射频消融治疗肝癌的临床疗效观察[J]. 临床军医杂志,2014,42(7):697-700.
(收稿日期:2016-06-13)

