化学溶液浸种对荆条种子萌发和幼苗抗旱性的效应
陈德华,杜小姣,段雪娇,张甲上,梁小红
(1.深圳市彬绿园林有限公司,广东 深圳 518040; 2.深圳市日昇园林绿化有限公司,广东 深圳 518040;3.北京林业大学 草坪研究所,北京 100083)
化学溶液浸种对荆条种子萌发和幼苗抗旱性的效应
陈德华1,杜小姣2,段雪娇2,张甲上3,梁小红3
(1.深圳市彬绿园林有限公司,广东 深圳 518040; 2.深圳市日昇园林绿化有限公司,广东 深圳 518040;3.北京林业大学 草坪研究所,北京 100083)
为筛选出既能提高荆条种子发芽率又能增强荆条幼苗抗旱性的化学溶液处理方式,研究了不同化学溶液浸种处理对荆条种子萌发及幼苗抗旱性的影响。结果表明:0.1% GA3,0.2% H2O2和0.1% GA3+0.5% CaCl2混合溶液3种方式浸种24 h均能够显著提高荆条种子的发芽势、发芽率和发芽指数。同干旱胁迫相比,0.1% GA3+0.5% CaCl2混合溶液浸种能够在最大程度上提高荆条幼苗的相对含水量和叶绿素含量,降低电解质渗透率和丙二醛含量,并进一步增加APX,CAT和POD的活性。混合溶液0.1% GA3+0.5% CaCl2浸种能够提高荆条种子的发芽率,同时有效提高荆条幼苗的抗旱性。
荆条;种子萌发;抗旱性;浸种
生态护坡技术有着较好的社会效应和生态效应,近年来在护坡工程中被广泛应用。边坡生态防护主要是通过对边坡的植被恢复,建立人工群落,恢复裸露边坡的生态环境,以防止水土流失并重塑景观效果[1-2]。荆条(Vitexnegundovar.heterophylla)隶属马鞭草科牡荆属,是我国北方地区常见的野生落叶小灌木,也是重要的水土保持植物。荆条对环境具有极强的适应性,耐旱,耐贫瘠,侧根发达,须根少,穿透力强,分布深,且可以分泌出一种植物酸,能将坚固的岩石腐蚀分解,最终形成土壤,进而在土壤中形成牢固的根系网络,起到固结土体的作用。荆条的推广和应用对于改善边坡生态环境,减少水土流失具有很好的应用前景[3-4]。然而,荆条种子自然萌发率低,在干旱条件下其幼苗生长缓慢甚至停止生长,限制了荆条在边坡修复中的应用[4]。因此,提高荆条种子的发芽率和幼苗抗旱性对于早期植被恢复,减少水土流失,降低修复成本具有重要意义。试验表明,赤霉素(GA3)、低温层积以及低浓度的盐溶液可以在一定程度上提高荆条种子的发芽率[3-5]。以往的研究发现,适宜浓度的双氧水(H2O2)及氯化钙(CaCl2)溶液浸种亦可提高种子的发芽率[6-9];GA3和CaCl2混合浸种不仅可以提高小麦种子的发芽率,还可以增加其幼苗的抗旱性[10]。因此,试验采用GA3、H2O2、CaCl2以及GA3+CaCl2混合溶液浸种,进行对荆条种子萌发及幼苗抗旱性效应的研究,以期能够筛选出一种既能提高荆条种子发芽率又能提高荆条幼苗抗旱性的浸种方式及最适浓度,为荆条在边坡水土保持中的应用提供技术支撑。
1 材料和方法
1.1 试验材料
试验于2014年5月在北京林业大学草坪研究所人工气候箱进行,荆条种子由北京布莱特草业有限公司提供。
1.2 试验方法和处理
1.2.1 浸种方法 选择整齐一致且饱满的荆条种子,用10%的次氯酸钠溶液灭菌30 min,蒸馏水彻底清洗吸干水分,再分别用赤霉素(GA3)、双氧水(H2O2)、氯化钙(CaCl2),GA3和CaCl2混合溶液浸种24 h,以蒸馏水浸种作为对照(CK)(表1)。

表1 不同种类溶液浸种和处理浓度Table 1 Concentrations of different soaking solutions %
1.2.2 种子萌发试验 荆条种子萌发试验采用培养皿滤纸法[11]。首先,在直径为9 cm的培养皿中放置2层无菌滤纸,随后将40粒浸种后的种子均匀放置于无菌滤纸上,再将培养皿放入温度25℃、相对湿度为60%、14 h光照和10 h黑暗的人工气候箱中进行发芽试验,每个处理设4个重复。每天保持滤纸湿润,以胚根突出种皮的长度达到种子长度的一半视为发芽,并计算发芽势、发芽率和发芽指数。
GP(%)=(m/N)×100%
式中:GP为发芽势,m为前7 d内发芽粒数,N为供试种子总粒数;
GR(%)=(n/N)×100%
式中:GR为发芽率,n为发芽粒数,N为供试种子总粒数;
GI=ΣGt/Dt
式中:GI为发芽指数,Gt为第t天的发芽粒数,Dt为相应的发芽天数。
1.2.3 幼苗抗旱试验 根据发芽试验的结果,选择其中可以促进荆条种子发芽的化学溶液及其最适浓度。荆条幼苗抗旱试验共设置5个处理:处理A 蒸馏水浸种+正常浇水;处理B 蒸馏水浸种+干旱胁迫;处理C 0.10% GA3溶液浸种+干旱胁迫;处理D 0.20% H2O2溶液浸种+干旱胁迫;处理E 0.10% GA3+0.50% CaCl2混合溶液浸种+干旱胁迫。每个处理4个重复。将浸种后的荆条种子以15粒/盆的播种量播种于直径为30 cm的花盆中(基质为草炭∶沙∶蛭石,体积比为3∶2∶1),待种子发芽30 d后,在人工气候箱中采用自然干旱胁迫处理,即处理组在干旱胁迫开始后不再进行浇水,直至干旱胁迫处理结束,期间每隔7 d(0、7、14和21 d)对幼苗叶片进行1次取样,以进行各项生理指标的测定,取样时保持取叶部位和叶龄基本一致。
叶片相对含水量(RWC)参照文献[12]的方法进行测定,相对电导率(EL)参照文献[13]的方法测定,叶绿素(Chl)和丙二醛(MDA)含量参照文献[14]的方法测定,抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)和过氧化物酶(POD)活性参照文献[15]的方法测定。
1.3 数据分析
所有数据均取4次重复的平均值,采用Excel 2013软件对数据进行处理,用SPSS 18.0软件进行方差分析,用LSD法进行差异显著性多重比较,并使用Excel 2013作图。
2 结果与分析
2.1 化学溶液浸种对荆条种子发芽的影响
2.1.1 不同浓度GA3浸种对荆条种子发芽的影响 0.05%和0.10% GA3浸种后,荆条种子发芽势、发芽率与发芽指数与对照相比均显著提高(表2),其中0.10% GA3浸种后,荆条种子的发芽势、发芽率、发芽指数与对照相比分别提高了71.9%,74.5%和115.2%。0.05% GA3浸种后,荆条种子发芽势、发芽率、发芽指数分别提高了39.9%,53.7%和69.7%。当GA3浓度达到0.15%时,发芽率和发芽指数与对照相比无显著差异,发芽势则显著低于对照。

表2 不同浓度GA3浸种下荆条种子的发芽指标Table 2 Effects of GA3 with different concentrations on seed germination
注:不同小写字母表示同列数字差异显著(P<0.05)
2.1.2 不同浓度H2O2浸种对荆条种子发芽的影响 0.10%和0.20% H2O2浸种后的荆条种子,发芽势、发芽率及发芽指数与对照相比均显著提高,其中,0.20% H2O2浸种后,荆条种子的发芽势、发芽率、发芽指数与对照相比分别提高了45.6%,70.2%和75.8%。当H2O2浓度达到0.30%时,发芽率和发芽势依然显著高于对照,发芽指数与对照则无显著差异,但与0.10%和0.20% H2O2浸种相比三者均显著降低(表2)。
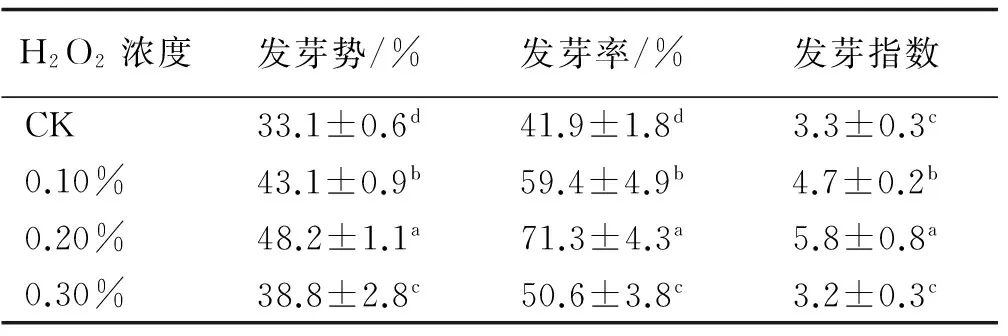
表3 不同浓度H2O2浸种下荆条种子的发芽指标Table 3 Effects of H2O2 with different concentrations on seed germination
2.1.3 不同浓度CaCl2溶液浸种对荆条种子发芽的影响 0.5%和0.8% CaCl2浸种后的荆条种子,发芽势、发芽率和发芽指数与对照间的差异不显著,甚至有所降低。1.0% CaCl2溶液浸种后的荆条种子发芽势、发芽率和发芽指数与对照相比分别降低了24.2%,24.1%和33.3%(表4)。

表4 不同浓度CaCl2浸种下荆条种子的发芽指标Table 4 Effects of CaCl2 with different concentrations on seed germination
2.1.4 不同浓度GA3+CaCl2混合溶液浸种对荆条种子发芽的影响 0.05%GA3+0.5%CaCl2、0.10% GA3+0.5% CaCl2、0.10% GA3+1.0% CaCl2混合溶液浸种后,荆条种子的发芽势、发芽率与发芽指数与对照相比均显著提高(表5)。与0.05% GA3+0.5% CaCl2和0.10% GA3+1.0% CaCl2混合溶液处理相比,0.10% GA3+0.5% CaCl2混合溶液浸种显著提高了荆条种子的发芽势和发芽指数。0.15% GA3+0.5% CaCl2、0.10% GA3+1.0% CaCl2以及0.15% GA3+1.0% CaCl2混合溶液浸种对提高荆条种子发芽势、发芽率和发芽指数的作用效果较小(表5)。
2.2 不同溶液浸种对干旱胁迫下荆条幼苗生理指标的影响
2.2.1 对幼苗叶片相对含水量和叶绿素含量的影响 随着干旱胁迫的持续,荆条幼苗叶片的相对含水量和叶绿素含量(图1A)均呈现逐渐下降的趋势,而GA3,H2O2和GA3+CaCl2混合溶液浸种均显著缓解了干旱胁迫下荆条幼苗叶片相对含水量和叶绿素含量的降低。其中,0.10% GA3+0.5% CaCl2混合溶液浸种作用效果最为显著,与单一干旱胁迫相比,在第21 d时,其使荆条幼苗叶片相对含水量和叶绿素含量分别升高了36.4%和81.1%。

表5 不同浓度GA3+CaCl2浸种下荆条种子的发芽指标Table 5 Effects of GA3+CaCl2 with different concentrations on seed germination

图1 不同溶液浸种处理干旱胁迫下的荆条幼苗相对含水量(A)和叶绿素含量(B)Fig.1 Effects of seed soaking treatments on RWC(A) and Chl content(B) in seedlings under drought stress注:同一处理时间下,不同小写字母表示不同处理之间差异显著(P<0.05),下图同
2.2.2 对幼苗叶片电解质渗透率和丙二醛含量的影响 干旱胁迫增加了荆条幼苗叶片的电解质渗透率和丙二醛含量(图2A,B)。第21 d时,与对照相比,单一干旱胁迫使荆条幼苗叶片的电解质渗透率和丙二醛含量分别增加了1.6倍和13.7倍。GA3,H2O2和GA3+CaCl2混合溶液浸种均在一定程度上缓解了干旱胁迫下荆条幼苗叶片电解质渗透率和丙二醛含量的升高,其中,0.10% GA3+0.5% CaCl2混合溶液浸种的缓解效果显著。在第21 d,与单一干旱胁迫相比,该混合溶液使荆条幼苗叶片电解质渗透率和丙二醛含量分别降低了29.4%和48.1%。

图2 不同溶液浸种下干旱胁迫的荆条幼苗电解质渗透率(A)和MDA含量(B)Fig.2 Effects of seed soaking treatments on EL(A) and MDA content(B) in seedlings under drought stress
2.2.3 对幼苗叶片抗氧化酶活性的影响 干旱胁迫下,荆条幼苗叶片APX,CAT 和POD活性均呈现出先升高后降低的变化趋势(图3)。在第14 d时,与对照相比,干旱胁迫使APX,CAT和POD活性分别增加了66.6%,65.1%和47.5%。在干旱胁迫第7 d时,GA3,H2O2和GA3+CaCl2混合溶液浸种较单一干旱胁迫均进一步显著提高了APX的活性,而在第14 d和第21 d时,只有0.10% GA3+0.5% CaCl2混合溶液浸种显著增加了APX活性。干旱胁迫下均只有0.10% GA3+0.5% CaCl2混合溶液浸种显著提高了CAT和POD的活性,而另外两种溶液浸种对CAT和POD活性则没有显著影响。
3 讨论
由于种皮和内部抑制物的共同抑制与阻碍作用,

图3 不同溶液浸种下荆条幼苗抗坏血酸的APX,CAT和POD活性Fig.3 Effects of seed soaking treatments on APX(A),CAT(B) and POD(C) activity in seedlings under drought stress
使得荆条种子的自然发芽率较低[4]。GA3可以提高淀粉酶活性,而H2O2浸种可以增加种皮透性,促进呼吸作用,因此,使用GA3和H2O2浸种可以在一定程度上促进种子的萌发[4,7]。此外,王磊[10]和陈士林等[16]研究表明,GA3与CaCl2的混合溶液浸种也可以促进种子萌发。研究结果表明,适宜浓度的GA3、H2O2、GA3和CaCl2混合溶液浸种均可提高荆条种子的发芽势、发芽率与发芽指数,而单独使用CaCl2溶液浸种对荆条种子萌发则无明显的促进作用,这与华智锐[8]和马文广等[17]的研究结果存在一定的差异,这可能与种子的差异、处理的时间及浓度等因素有关。
叶绿素作为植物光合作用中的必要物质,能够直接地反映叶片在胁迫下的受伤程度[18]。研究表明,干旱胁迫会通过抑制了叶绿素的合成、破坏叶绿体结构、降解光和色素来降低植物叶片的叶绿素含量[19]。叶片相对含水量则能够直接反映出植物体内的水分状况,衡量植物在干旱胁迫下受到损伤的程度[20]。试验中干旱胁迫显著降低了荆条幼苗叶片的相对含水量和叶绿素含量,而3种溶液浸种则有效缓解了两者的降低。吕彪等[21]研究同样表明赤霉素浸种可以提高干旱胁迫下番茄幼苗的叶绿素含量。这表明3种化学溶液浸种可以在一定程度上提高干旱胁迫下荆条幼苗叶片的叶绿素含量和相对含水量。
干旱胁迫会破坏植物的细胞膜系统,导致细胞膜透性增大,膜脂发生过氧化反应,进而引起电解质外渗和丙二醛含量的增加[22]。本研究中,干旱胁迫使荆条幼苗叶片的电解质渗透率和丙二醛含量均持续升高,这表明干旱胁迫已经对荆条幼苗叶片的细胞膜系统造成了伤害。GA3,H2O2和GA3+CaCl2混合溶液浸种都不同程度地缓解了干旱胁迫下荆条幼苗叶片电解质渗透率和丙二醛含量的升高,这表明3种化学溶液浸种可以在一定程度上阻止膜脂过氧化反应,保护干旱胁迫下荆条幼苗细胞膜结构的完整性,以维持细胞体内的正常生理生化代谢,进而提高其对干旱胁迫的抵御能力。
植物细胞膜脂的过氧化反应,是由于植物体内活性氧的积聚所致,因此,提高植物的抗氧化代谢能力,清除活性氧对植物抵御干旱胁迫至关重要[23]。从本研究的结果分析,干旱胁迫显著提高了荆条幼苗叶片抗氧化酶的活性,这表明干旱胁迫下荆条幼苗激活了酶促防御系统来抵御活性氧对细胞膜产生的伤害。3种溶液中只有0.1% GA3+0.5% CaCl2混合溶液浸种进一步提高了干旱胁迫下荆条幼苗叶片3种抗氧化酶的活性。这可能是由于Ca2+作为第二信使调控植物体内的多种生理生化过程,具有稳定细胞质膜结构,提高酶活性,调节气孔开度等多种作用[24]。这表明0.1% GA3+0.5% CaCl2混合溶液浸种可以通过进一步提高酶活来加强清除多余活性氧的能力,从而进一步缓解膜脂过氧化反应的发生,维持干旱胁迫下荆条幼苗叶片细胞膜的完整性,提高其抗旱能力。
4 结论
(1)0.1% GA3,0.2% H2O2和0.1% GA3+0.5% CaCl2混合溶液浸种能够显著提高荆条种子的发芽势、发芽率和发芽指数。
(2)干旱胁迫降低了荆条幼苗叶片的相对含水量和叶绿素含量,增加了电解质渗透率和丙二醛含量,使其APX,CAT和POD活性呈现先升高后降低的变化趋势。
(3)0.1% GA3,0.2% H2O2和0.1% GA3+0.5% CaCl2溶液浸种可以缓解干旱胁迫对荆条幼苗造成的伤害,其中0.1% GA3+0.5% CaCl2效果最佳,并且该浸种方式可以进一步提高干旱胁迫下荆条幼苗APX,CAT和POD的活性。因此,0.1% GA3+0.5% CaCl2混合溶液浸种既能促进荆条种子的萌发,又能提高荆条幼苗的抗旱性。
[1] 杨秉建,杜小姣,文沛玲.受损山体工人植物群落建植研究[J].草原与草坪,2014(3):85-89.
[2] 吴艳红.生态防护技术在边坡防护工程中的应用[J].广东水利水电,2006(3):12-14.[3] 王晓蓓,韩烈保,刘春霞.优良水土保持灌木——野生荆条种子发芽实验研究[J].辽宁林业科技,2007(4):30-32.
[4] 李义强,宋桂龙,郭宇.水浸与赤霉素处理对荆条种子萌发影响研究[J].种子,2012,31(3):10-13.
[5] 张洁明,孙景宽,刘宝玉.盐胁迫对荆条、白蜡、沙枣种子萌发的影响[J].植物研究,2006,26(5):595-599.
[6] 张万萍,杨民,江燕,等.H2O2浸种对羽衣甘蓝种子萌发及幼苗的影响[J].种子,2008,27(12):98-100.
[7] Gondim FA,Gomes-Filho1 E,Lacerda CF,etal.Pretreatment with H2O2in maize seeds:effects on germination and seedling acclimation to salt stress [J].Brazilian Journal of Plant Physiology,2010,22(2):103-112.
[8] 华智锐.CaCl2等浸种对小麦商5226 种子萌发特性的影响[J].浙江农业科学,2014,(11):1676-1678.
[9] Jung H J,Jung H H,Kim H J,etal.Effect of CaCl2on seed germination and growth of Dianthus japonicus Thunb.[J].Horticulture Environment and Biotechnology,2008,49(6):371-375.
[10] 王磊.钙与赤霉素混合浸种增强小麦抗旱性的机理研究[D].开封:河南大学,2004.
[11] 曾任森.化感作用研究中的生物测定方法综述[J].应用生态学报,1999,10(1):123-126.[12] Da Costa M,Huang B R.Changes in antioxidant enzyme activities and lipid peroxidation for bentgrass species in response to drought stress [J].Journal of the American Society for Horticultural Science,2007,132(3):319-326.
[13] Blum A,Ebercon A.Cell membrane stability as a measure of drought and heat tolerance in wheat [J].Crop Science,1981,21(1):43-47.
[14] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[15] Zhang J X,Kirkham M B.Antioxidant responses to drought in sunflower and sorghum seedling [J].New Phytologist,1996,132(3):361-373.
[16] 陈士林,王春虎.钙和赤霉素对棉花种子发芽力及活力的影响[J].中国农学通报,2004,20(3):112-113,123.
[17] 马文广,崔华威,李永平,等.不同药剂处理对低温逆境下烟草种子发芽和幼苗生长的影响[J].科技通报,2011,27(6):873-880.[18] 张仁和,郭东伟,张兴华,等.干旱胁迫下氮肥对玉米叶片生理特性的影响[J].玉米科学,2012,20(6):118-122.
[19] 曲东,邵丽丽,王保莉,等.干旱胁迫下硫对玉米叶绿素及MDA含量的影响[J].干旱地区农业研究,2004,22(2):91-94.
[20] 冯淑华.三叶草对干旱胁迫的反应及适应性研究[D].哈尔滨:东北农业大学,2012.
[21] 吕彪,许耀照,王治江,等.聚乙二醇胁迫下赤霉素浸种对番茄种子萌发和幼苗生长的影响[J].干旱地区农业研究,2009,27(4):136-139.
[22] Xu L X,Han L B,Huang B R.Antioxidant enzyme activities and gene expression patterns in leaves of Kentucky bluegrass in response to drought and post-drought recovery [J].Journal of the American Society for Horticultural Science,2011,136(4):247-255.
[23] Foyer C H,Noctor G.Oxidant and antioxidant signaling in plants:a re-evaluation of the concept of oxidative stress in a physiological context [J].Plant Cell and Environment,2005,28(8):1056-1071.
[24] 秦舒浩,张俊莲,孔令娟,等.高温强光下Ca2+对西葫芦幼苗膜质过氧化、抗氧化酶系统及热耗散的影响[J].中国生态农业学报,2012,20(3):343-347.
Effects of chemical solution soaking on seed germination and seedling drought resistance ofVitexnegundovar.heterophylla
CHEN De-hua1,DU Xiao-jiao2,DUAN Xue-jiao2,ZHANG Jia-shang3,LIANG Xiao-hong3
(1.ShenzhenBinlvGardeningCompanyLimited,Shenzhen518040,China;2.ShenzhenRishengGardeningCompanyLimited,Shenzhen518040,China; 3.InsittuteofTurfgrassScience,BeijingForestryUniversity,Beijing100083)
In order to find out the seed treatment methods for improving seed germination rate and drought resistance ofVitexnegundovar.heterophyllaseedling,the seeds were soaked in GA3,H2O2,CaCl2,GA3+CaCl2solutions with different concentrations for 24h,and the germination potential,germination rate and germination index were measured and the physiological index of seedlings under drought stress for 21 d were assayed as well.The results showed that the germination potential,germination rate and germination index could be significantly enhanced by seed soaking in GA3,H2O2and GA3+CaCl2solutions with suitable concentration,and the treatments of 0.1% GA3,0.2% H2O2and 0.1% GA3+0.5% CaCl2solutions were the best for seed germination.Soaking seed in 0.1% GA3,0.2% H2O2and 0.1% GA3+0.5% CaCl2solutions alleviated the drought-induced damage through increasing relative water content and chlorophyll content as well as decreasing electrolyte leakage and MDA content in seedlings,and 0.1% GA3+0.5% CaCl2solution was the most effective.Besides,soaking seed in 0.1% GA3+0.5% CaCl2solutions enhanced the activities of APX,CAT and POD of seedlings.
Vitexnegundovar.heterophylla;seed germination;drought resistance;seed soaking
2016-04-28;
2016-07-21
深圳市科技计划项目“城市绿地节水综合技术研究(CXZZ20140418110342522)”资助
陈德华(1966-),男,广东丰顺人,主要从事园林景观规划设计工作。
E-mail:896186534@qq.com
S 332
A
1009-5500(2016)05-0028-06
梁小红为通讯作者。

