贝伐单抗联合化疗治疗晚期宫颈癌的有效性及安全性的系统评价
印贤琴 靳 镭 侯 俐 周 燕.湖北省武汉市妇女儿童医疗保健中心妇科,湖北武汉 43006;.华中科技大学附属同济医院妇产科,湖北武汉 4300
贝伐单抗联合化疗治疗晚期宫颈癌的有效性及安全性的系统评价
印贤琴1靳镭2侯俐1周燕1
1.湖北省武汉市妇女儿童医疗保健中心妇科,湖北武汉430016;2.华中科技大学附属同济医院妇产科,湖北武汉430022
目的 系统性评价贝伐单抗联合化疗与单纯化疗治疗晚期宫颈癌的有效性及安全性。方法 计算机检索PubMed、Medline、Cochrane图书馆、CNKI、EMbase、VIP、万方数据库,辅以手工检索相关杂志并采用EndNote X6纳入研究使用的参考文献,查找关于贝伐单抗联合化疗治疗宫颈癌临床对照研究,将贝伐单抗联合化疗作为贝伐单抗联合组,单纯化疗者作为单纯化疗组,检索时限为2005年1月1日~2015年7月15日。按照纳入和排除标准进行文献筛选、资料提取及质量评估,采用RevMan 5.3软件进行Meta分析。 结果 共纳入5项研究,1020例患者,其中单纯化疗组513例,贝伐单抗联合组507例。Meta分析结果显示:①有效性方面:贝伐单抗联合组治疗有效率、中位生存期及再次获得手术的概率高于单纯化疗组(均P<0.05);②安全性方面:贝伐单抗联合组的不良反应事件发生率均高于单纯化疗组(均P<0.05)。结论贝伐单抗联合化疗不仅可以提高宫颈癌的和治疗效果和再次手术的机会,还可以提高中位生存期,但其可能增加心血管事件等不良反应,故治疗期间应注意预防不良事件的发生。
贝伐单抗;宫颈肿瘤;临床对照试验;M eta分析
宫颈癌是仅次于乳腺癌的第二大女性恶性肿瘤,发病率呈逐年上升趋势,其死亡率在发展中国家中位居第三[1]。目前,早期宫颈癌主要采用手术切除治疗,局部晚期宫颈癌采用盆腔外照射或者腔内近距离放疗治疗,对于晚期转移、治疗后肿瘤未控或复发者多采用化疗联合放疗治疗[2]。虽然化疗可以提高晚期宫颈癌患者的生存时间,但预后仍不乐观。近年来,研究发现肿瘤血管的形成与宫颈癌的发生发展及治疗效果密切相关[3]。对此,国内外的学者对宫颈癌的化疗进行深入研究,并尝试将抗血管内皮生长因子的靶向药贝伐单抗用于晚期宫颈癌的治疗[4],促使贝伐单抗成为研究领域的热点。由于大多数研究为单臂临床研究,缺乏对贝伐单抗有效性和安全性的客观评价。本研究针对晚期宫颈癌患者采用贝伐单抗联合化疗与单纯化疗的疗效、获得手术机会和不良反应进行客观系统评价,以期为临床治疗提供参考。
1 资料与方法
1.1检索策略
计算机全面检索 PubMed、Medline、Cochrane图书馆、CNKI、EMbase、VIP和万方数据库,结合手工检索相关杂志并采用Endnote X6纳入参考文献,查找关于贝伐单抗联合化疗和单纯化疗的临床对照研究。检索日期为2005年1月1日至2015年7月15日,收集国内外相关文献。英文检索词为:cervical cancer,Bevacizumab;中文检索词为:宫颈癌,贝伐单抗。
1.2纳入标准
1.2.1研究类型纳入所有贝伐单抗联合化疗的临床对照研究,无论是否采用盲法,语种限中英文。
1.2.2研究对象所有患者原发病灶及转移灶均经病理、盆腔检查、影像学检查确诊为晚期宫颈癌。局部肿瘤大于4 cm,且已处于癌症的中晚期(FIGO stageⅡB~ⅣA),失去手术机会,或者为复发晚期宫颈癌。所有入选患者肝、肾功能及骨髓造血功能均无明显异常,种族和国籍不限。对治疗前行手术切除、重复报道的数据、病案报告、无法取得数据的文献一律排除。
1.2.3干预措施 贝伐单抗联合组采用贝伐单抗(Roehe罗氏生产,5~10 mg/kg,2周/次)联合单纯化疗,单纯化疗组采用含铂类的化疗方案。PB方案:顺铂(DDP,注册证号H20040246,澳大利亚科鼎有限公司福尔丁大药厂)50 mg/m2,静脉滴注,d1、d2;博来霉素(BLM,国药准字H20055883,浙江海正药业股份有限公司)30 mg/m2,静脉滴注d2;每3周重复。PVB方案:第1天用DDP 50 mg/m2和长春新碱(VCR)1 mg/m2,dl~3用BLM 15 mg/m2,每3周重复。CP方案:顺铂50 mg/m2静脉滴注,d1~3,加上紫杉醇135~175 mg/m2,每3周重复。TP方案:拓扑替康0.75 mg/m2,静脉滴注,d1~3,加上紫杉醇175 mg/m2,每3周重复。GC方案:含铂方案化疗后复发进展的晚期宫颈腺癌,再用吉西他滨单药化疗2个周期。
1.2.4结局指标①疗效评价。每治疗两个周期后进行评价,按WHO抗肿瘤药物观察疗效标准分为完全缓解(complete remission,CR):所有可见病灶均消失,并在至少4周后复测证实即至少维持4周;部分缓解(partial remission,PR):双径可测病灶各病灶最大两垂直径乘积之和减少50%以上,并在至少4周后复测证实,单侧可测病灶,各病灶最大径之和减少50%以上至少维持4周;稳定(stable disease,SD):单径可测病灶,各病灶最大直径乘积之和(总和)增大<25%或者减少≤50%,并在至少4周后复测证实;进展(progress disease,PD):至少有1个病灶,双径乘积或者单径增大≥25%,或者出现新的病灶,新出现胸腹水,且细胞呈阳性,亦判定为PD。②重新获得手术的机会。比较治疗前后局部肿瘤的大小变化、患者的全身状况、心肺、肝肾功能等。③中位生存期(median overall survival time,mOS)。④血栓栓塞事件。⑤胃肠道瘘或穿孔。既往无胃肠道瘘及消化道溃疡的病史,用药2个周期以后出现。⑥高血压(2级及以上)。收缩压≥160~179 mmHg(1 mmHg=0.133 kPa)和/或舒张压≥100~109 mmHg。⑦泌尿生殖系统并发症。泌尿道瘘、穿孔、出血、蛋白尿等。
1.3排除标准
①无对照研究;②文献只有摘要而缺乏全文;③重要资料报告不全;④研究报道了相似或者相同的目标结果时,纳入质量更好或信息更全面的文章。
1.4资料提取
筛选出文章阅读全文后进行资料提取及方法学质量评价。内容包括研究的地点、设计类型、治疗方案、病例数、疗效评价、获得手术的机会、中位生存期、血栓栓塞、胃肠道瘘或穿孔、高血压、泌尿生殖系统并发症(泌尿道瘘或穿孔、血尿、蛋白尿)。如遇分歧由第三方研究人员协助解决,缺乏的资料尽量与原作者联系索取。
1.5纳入文献质量评价
按照根据 Cochrane系统评价员手册5.1版偏倚风险评估标准[5]评价纳入的文献。评价内容包括随机方法、分配隐藏、盲法、指标数据不全,其他偏移5条内容,各条目评价结果按“是”(低偏倚风险)“不清楚”及“否”(高偏倚风险)表示。
1.6统计学方法
Meta分析采用Cochrane协作网提供的Rev-Man 5.3软件进行。首先通过χ2检验对同类研究间的异质性进行评价,若P≥0.1,I2≤50%,说明研究间存在异质性的可能性小,使用固定效应模型(FE);若P<0.1,I2>50%,说明研究间具有异质性,使用随机效应模型(RE)则对其异质性来源进行分析,必要时采用敏感性分析来分析检验结果的稳定性,若异质性过大并不能判断其来源改为描述性分析。采用相对危险度(RR)、率比(OR)作为分析统计量,所有分析均计算95%可信区间(CI)。若临床试验提供数据不足,只对其进行描述性分析。
2 结果
2.1文献检索结果及纳入文献的基本特征
初检出相关文献1201篇,其中英文87篇,中文1114篇。通过阅读文题、摘要和全文排除1196篇,最终纳入 5篇[6-10],共 1120例患者,其中单纯化疗组513例,贝伐单抗联合组507例。文献检索流程及结果见图1。纳入文献的基本特征见表1。
2.2纳入文献的偏倚风险评估
根据Cochrane协作网推荐的偏移风险评价方法。纳入的5项研究有不同水平的偏移。其中除1项[10]采用自身对照,余下4项研究[6-9]均采用随机方法。有1项研究[10]未完整报道单纯化疗时的未报道肿瘤变化情况。所有的研究均未报道盲法和分配方案隐藏情况,其他偏倚均不清楚。
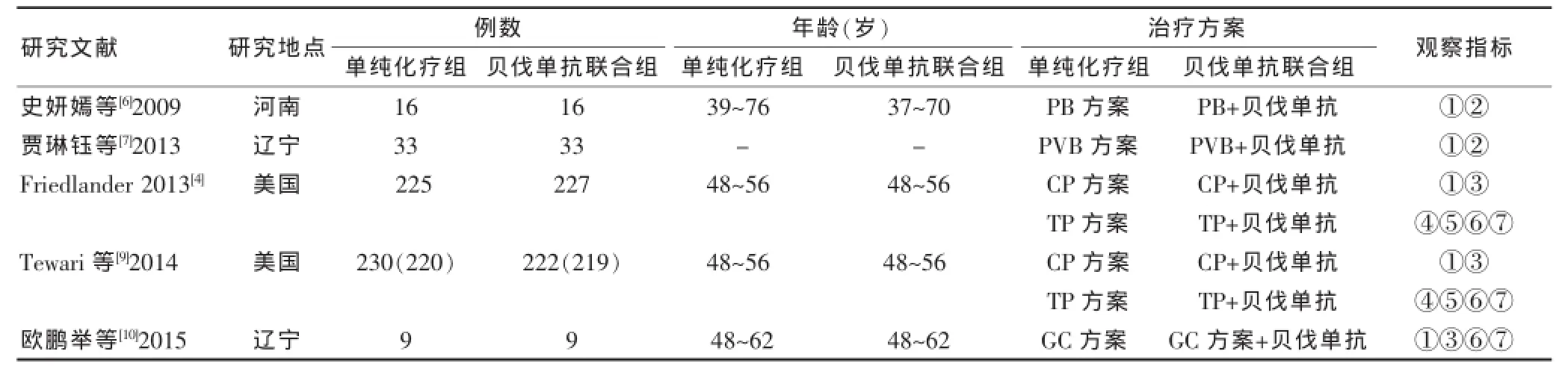
表1 纳入文献的基本特征

图1 文献筛选流程
2.3Meta分析结果
2.3.1贝伐单抗联合组与单纯化疗组的疗效评价共纳入5篇文献[6-10],贝伐单抗联合组与单纯化疗组有效率的比较,见图2。各研究间无统计学异质性(P= 0.20,I2=29%),故采用固定效应模型。Meta分析表明:两组在治疗有效率上差异有统计学意义(RR=1.28,95% CI:1.12~1.46,P=0.0002),贝伐单抗联合组优于单纯化疗组。贝伐单抗联合组与单纯化疗组病情无进展率的比较,差异无统计学意义(RR=0.85,95%CI:0.57~1.29,P=0.45)。因研究数量有限,未进行漏斗图分析。
2.3.2贝伐单抗联合组与单纯化疗组治疗后再次获得手术机会的分析共纳入3篇文献[6-7,10],各研究间无统计学异质性(P=0.38,I2=0%),故采用固定效应模型,Meta分析结果显示:贝伐单抗联合组治疗后再次获得手术的机会高于单纯化疗组比较,差异有统计学意义(RR=2.71,95%CI:1.48~4.96,P=0.001)。见图3。
2.3.3贝伐单抗联合组与单纯化疗组生存资料的Meta分析共纳入2篇文献[8-9],各研究间无统计学异质性(P=0.92,I2=0%),见图4。故采用固定效应模型,Meta分析结果显示:贝伐单抗联合组与单纯化疗组中位生存期的差异有统计学意义(HR=2.03,95%CI:1.82~2.27),P<0.00001),贝伐单抗联合化疗优于单纯化疗。其中有一篇文献[9]从不同化疗方案来比较联合组和单纯组的mOS的差异,分别是TP方案和贝伐单抗联合TP方案(HR=2.10,95%CI:1.70~2.59),CP方案和贝伐单抗联合CP方案(HR=1.97,95%CI:1.62~2.41)。
2.3.4贝伐单抗联合组与单纯化疗组安全性分析关于两种化疗毒性的比较,2项研究[8-9]比较了血栓栓塞事件及胃肠道瘘、穿孔,3项研究[8-10]比较了2级以上高血压及泌尿系统的并发症,见图5。各研究间同质性好(P=0.98,I2=0%),分析结果显示两组间差异有统计学意义(RR=10.36,95%CI:6.39~16.80,P<0.0000)],贝伐单抗联合组毒性高于单纯化疗组。

图2 贝伐单抗联合组与单纯化疗组疗效比较

图3 贝伐单抗联合组与单纯化疗组治疗后再次获得手术机会比较
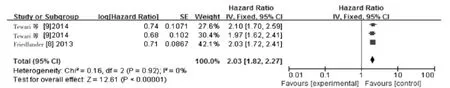
图4 贝伐单抗联合组与单纯化疗组中位生存期比较

图5 贝伐单抗联合组与单纯化疗组不良反应事件比较
3 讨论
血管内皮生长因子通过与血管内皮生长因子受体结合,促进内皮细胞增殖、新生血管形成[11],而肿瘤血管的形成为其生长和侵袭转移提供养份、生长因子、氧气、蛋白水解酶和激素[12-13]。因此,抗血管生长的药物为肿瘤的治疗开拓了新天地。2004年2月底美国食品和药品管理局(FDA)批准瑞士罗氏公司研发的贝伐单抗用于临床,也是全世界第一个被批准用于抑制血管生长的单克隆抗体药物[14]。截至2015年7月,以贝伐单抗联合化疗为主题的文献6000多篇文献,关于贝伐单抗联合治疗与宫颈癌的文献有1200多篇。然而,国内外缺乏关于贝伐单抗联合化疗有效性和安全性的研究。
本文研究显示:贝伐单抗联合化疗治疗晚期宫颈癌的有效率优于单纯化疗。Zighelhoim等[15]开展的一项多中心贝伐单抗联合化疗治疗难治性或复发性子宫颈癌的Ⅱ期临床研究证实贝伐单抗联合化疗治疗有效率为35%,且6个月的无进展生存期(PFS)率为59%。联合化疗使部分失去手术机会的患者再次获得手术机会也高于单纯化疗。Penson等[16]通过妇科肿瘤协议240(Gynecologic Oncology Group protocol 240)一项Ⅲ期随机调查研究对390例晚期宫颈癌患者进行了生活质量评估,结果发现贝伐单抗联合化疗与单纯化疗的FACT-Cx试验结局指数差异无统计学意义(P=0.27),即贝伐单抗联合化疗与单纯化疗相比生活质量改善不明显。
安全性分析表明:贝伐单抗联合组血栓栓塞事件、胃肠道瘘、穿孔、2级及以上高血压、泌尿生殖系统并发症均高于单纯化疗组。其中高血压是贝伐单抗最常见的不良反应,总发生率为22.4%[17],占本次研究贝伐单抗联合化疗不良事件比例的54.3%。因为贝伐单抗对正常血管和肿瘤血管的内皮细胞不具选择性[18],所以高血压患者要慎用,在用药时要监测血压值,必要时采用降压药对症处理。其次,血栓栓塞事件占不良事件的28.6%,主要与血管内皮的功能不良和缺损导致内皮下胶原暴露,导致血栓形成的发生率明显增加,故对有血栓栓塞病史的患者应慎用贝伐单抗联合化疗。贝伐单抗联合组中胃肠道瘘、穿孔和泌尿生殖系统的不良反应风险率分别为5.7%和11.4%,均高于单纯化疗组。另外,贝伐单抗联合化疗还可能引起骨髓抑制、中枢神经毒性、疼痛、发热、皮疹、口腔溃疡等不良反应,由于数据不够全面,样本量少,主观意识判定的结果缺乏客观性、严谨性和精确性等原因,有待进一步的研究证实。
本系统评价尚存在以下不足,有待于进一步研究和完善:①纳入的文献不全为随机对照研究,本身的证据等级不高。②部分研究的结局指标存在发表偏倚,因而不能排除潜在的发表偏倚。③纳入文献虽均为铂类化疗方案,但具体化疗方案不全相同,Monk等[19]报道了513例患者参加的一项Ⅲ期研究结果,其中比较了4个目前常用的二联化疗方案,CP方案的生存率稍优于VC(长春瑞滨+顺铂)、GC、TC(拓扑替康+顺铂)3个方案。大量研究[8-9,16]表明,TP和CP两方案治疗有效率、中位生存期及生活质量评估的差异无统计学意义。本研究所得结论仍需要设计更加严密的高质量研究证实。
综上所述,贝伐单抗联合化疗治疗晚期宫颈癌的有效率、再次获得手术的机会、中位生存期及中位无进展期均优于单纯化疗组。然而联合化疗的不良事件中高血压、血栓栓塞、胃肠道瘘、穿孔和泌尿生殖系统的风险率高于单纯化疗组,故当存在瘘或深静脉血栓形成的证据时应谨慎使用贝伐单抗。Phippen等[20]对贝伐单抗联合化疗的有效性及成本效益进行全面分析,即使美国国立综合癌症网络(NationalComprehensive Cancer Network,NCCN)进一步证明对于复发性或转移性子宫颈癌患者联合治疗是划算的,但贝伐单抗价格昂贵加重了患者的经济负担。因此,在应用贝伐单抗时应权衡该药的利弊,在其获得良好临床疗效的同时,不能忽视其所致的致死性不良反应。应进一步开展相关临床研究,更为全面地了解贝伐单抗不良反应及其发生机制,合理做好药物的评估,做好不良反应的预防,以期达到安全有效地使用贝伐单抗。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Koh WJ,Greer BE,Abu-Rustum NR,etal.CervicalCancer,Version 2.2015[J].J Natl Compr Canc Netw,2015,13(4):395-404.
[3]Lee JS,Kim HS,Park JT,et al.Expression of vascular endothelial growth factor in the progression of cervical neoplasia and its relation to angiesis and p53 status[J]. Anal Quant Cytol Histol,2003,25(6):303-311.
[4]Bizzarri N,Ghirardi V,Alessandri F,et al.Bevacaizumab for the treatment of cervical cancer[J].Expert Opinion On Therapeutic Patents,2016,16(3):407-419.
[5]Brozek J,Oxman A,Schünemann H.GRADEpro[computer program].Version 3.6 for Windows[Z].2008.http://ims.cochrane.org/revman/gradepro.
[6]史妍嫣,王丰莲.贝伐单抗联合PB方案治疗中晚期宫颈癌的临床观察[J].中国医疗前沿,2009,7(4):104-105.
[7]贾琳钰.贝伐单抗联合PVB方案治疗中晚期宫颈癌的临床研究[J].医学信息:下旬刊,2013,26(12):249-250.
[8]Friedlander ML.Commentary on the clinical trial reported by:Tewari KS,Sill M,Long HJ,et al.Incorporation of Bevacizumab in the treatment of recurrent and metastatic cervicalcancer:a phaseⅢrandomized trialofthe Gynecologic Oncology Group[J].J Clin Oncol,2013,3(1):6.
[9]Tewari KS,Sill MW,Long HJ,et al.Improved survival with Bevacizumab in advanced cervical cancer[J].N Engl J Med,2014,370(8):734-743.
[10]欧鹏举,安煜致.贝伐珠单抗联合单药化疗治疗晚期宫颈腺癌的疗效研究[J].中国全科医学,2015,18(11):1343-1345.
[11]Carmeliet P.VEGF as a key mediator of angiogenesis in cancer[J].Oncology,2005,69:4-10.
[12]Piha-PaulSA,Wheler JJ,Fu SQ,etal.Advanced gynecologic malignancies treated with a combination of the VEGF inhibitor Bevacizumab and the mTOR inhibitor temsirolimus[J].Oncotarget,2014,5(7):1846-1855.
[13]Hicklin DJ,Ellis LM.Role of the vascularendothelialgrowth factor pathway in tumor growth and angiogenesis[J]. Journal of Clinical Oncology,2005,23(5):1011-1027.
[14]黄海波,赵燕.贝伐单抗联合化疗治疗子宫颈癌研究进展[J].肿瘤研究与临床,2015,27(3):207-210.
[15]Zighelboim I,W right JD,Gao F,et al.Multicenter phaseⅡtrial of topotecan,cisplatin and Bevacizumab for recurrentor persistent cervical cancer[J].Gynecol Oncol,2013,130(1):64-68.
[16]Penson RT,Huang HQ,Wenzel LB,et al.Bevacizumab for advanced cervical cancer:patient-reported outcomes ofa randomised,phase 3 trial(NRG Oncology-Gynecologic Oncology Group protocol 240)[J].Lancet Oncol,2015,16(3):301-311.
[17]李洪波,彭枫.贝伐单抗临床研究进展[J].四川肿瘤防治,2006,19(1):54-56.
[18]裘雁冰,陆益,吴洪斌,等.贝伐单抗及其联用化疗方案的不良反应[J].药物不良反应杂志,2006,8(6):431-433.
[19]Monk BJ,Sill MW,McMeekin DS,et al.PhaseⅢtrial of four cisplatin-containing doublet combinations in stageⅣB,recurrent,or persistent cervical carcinoma:a gynecologic oncology group study[J].JClin Oncol,2009,27(28):4649-4655.
[20]Phippen NT,Leath CA,Havrilesky LJ,et al.Bevacizumab in recurrent,persistent,or advanced stage carcinoma of the cervix:is it cost-effective?[J].Gynecologic Oncology,2015,136(1):43-47.
System evaluation efficacy and safety of Bevacizumab combination of chemotherapy in the treatment of advanced cervical cancer
YIN Xianqin1JIN Lei2HOU Li1ZHOU Yan1
1.Department of Gynecology,Wuhan Maternity&Child Healthcare Hospital,Hubei Province,Wuhan430016,China; 2.Department of Obstetrics and Gynecology,Tongji Hospital,Huazhong University of Science and Technology,Hubei Province,Wuhan430022,China
Objective To systematically evaluate the efficacy and safety of Bevacizumab combined chemotherapy versus chemotherapy alone in the treatment of advanced cervical cancer.M ethods The clinical control trials on treatment of local advanced cervical cancer with Bevacizumab combination of chemotherapy,which regarded Bevacizumab combined chemotherapy as Bevacizumab combination group and chemotherapy alone as pure chemotherapy group,were identified by searching scientific literature databases(PubMed,Medline,Cochrane Library,CNKI,EMbase,VIP,Wanfang database) published between January 1st,2005 and July 15th,2015,and also by searching manually on relevant journals.Endnote X6 software was used to process the related publications.Investigators independently screened,extracted and assessed quality of the literature according to the inclusion criteria and exclusion criteria.At last,Meta-analysis was conducted with RevMan 5.3 software.Results Five clinical control trials with a total of 1020 patients with local advanced cervical cancer were selected and included in the final analysis.513 of which
chemotherapy alone,and the other 507 ones
Bevacizumab combination chemotherapy.The results of meta-analyses showed that:①efficacy indicator: the effective rate,median survival time and receiving chance of operation again of the Bevacizumab combination group were higher than those of the pure chemotherapy group(all P<0.05);②safety indicator:the incidence of adverse events of Bevacizumab combination group was higher than that of the pure chemotherapy group(all P<0.05). Conclusion Bevacizumab combination chemotherapy not only can improve the efficient of cervical cancer and surgery opportunity,also can extend the median survival.However,it should pay more attention to prevent toxic reaction such as cardiovascular events.
Bevacizumab;Cervical cancer;Controlled clinical trial;Meta analysis
R737.33
A
1673-7210(2016)04(b)-0088-06
湖北省武汉市科技局计划项目(WX14A08)。
印贤琴(1978.2-),女,硕士,主要从事妇科肿瘤研究。
(2016-01-09本文编辑:任念)

