慢性间歇性缺氧对大鼠认知功能及脑室旁白质胶质细胞胶质纤维酸性蛋白、S100B表达的影响
许盈盈 黄银辉 陈雅芳 林有榆 蔡若蔚
(福建医科大学附属第二医院神经内科,福建 泉州 362000)
慢性间歇性缺氧对大鼠认知功能及脑室旁白质胶质细胞胶质纤维酸性蛋白、S100B表达的影响
许盈盈 黄银辉1陈雅芳 林有榆1蔡若蔚
(福建医科大学附属第二医院神经内科,福建 泉州 362000)
目的 观察慢性间歇性缺氧(CIH)对大鼠认知功能、脑室旁白质胶质细胞的形态结构及胶质纤维酸性蛋白(GFAP)、S100B表达的影响。方法 60只健康雄性SD大鼠随机选取10只大鼠进行CIH预实验,每只大鼠缺氧前后均查血气分析,以判断是否达到低氧血症及低氧的程度。造模成功后,将剩余大鼠随机分为3组,CIH组20只、空白对照组(UC组)15只、空气模拟对照组(AC组)15只。CIH组每日间歇缺氧8 h,连续8 w。AC组与CIH组共用控制系统,不同的是所有吹入气体均为空气。UC组正常饲养,未加干扰。所有大鼠在实验结束后进行Morris水迷宫测试,检测其学习和记忆能力,并用免疫组织化学染色法检测大鼠脑室旁胶质细胞GFAP和S100B表达水平变化,用光镜观察大鼠白质超微结构改变。结果 Morris水迷宫学习成绩:定位航行实验:第5天训练结束时,CIH组的逃避潜伏期明显长于同期的UC组和AC组(P值分别为0.009,0.004),UC组与AC组不存在统计学差异(P=0.803)。空间搜索实验:CIH组的穿越平台次数较UC和AC组显著减少(P分别为0.031,0.010);CIH组明显比UC组及AC组穿越平台次数少(P值分别为0.007,0.004)。而UC组与AC组之间的差异无统计学意义(P>0.05)。CIH大鼠脑室旁白质区GFAP、S100B较UC、AC组表达升高(P<0.05)。CIH大鼠脑室旁白质区GFAP、S100B和认知功能损害程度呈负相关(r=-0.121,-0.015,P=0.028,0.015)。结论 CIH导致的认识功能损害可能与脑室旁白质病变有关。
慢性间歇性缺氧;认知功能;胶质细胞
阻塞性睡眠呼吸暂停综合征(OSAS)与神经系统疾病关系密切,一方面,许多神经系统疾病,如脑卒中等,其并发睡眠呼吸暂停的发生率很高,另一方面,OSAS是导致日间嗜睡、认知功能障碍和某些神经系统疾病的重要原因之一,并可能与阿尔茨海默病(AD)发病密切相关〔1,2〕。Alchanatis等〔3〕和Zimmer-man等〔4〕应用磁共振波谱(MRS)及神经生物化学方法等研究方法发现OSAS的患者可出现额叶白质等区的受损。有研究提示OSAS对脑室旁脑白质的损害有选择性〔4〕。而许多研究认为,脑白质病变与认知功能下降等密切相关,是血管性痴呆与AD认识功能障碍的主要发病机制之一〔5,6〕,Hirono等〔7〕甚至认为通过测量脑室旁白质损害容量的大小可以评估痴呆程度。所以OSAS的脑室旁白质损害与认知功能减退的可能机制,成为当前的研究热点。认知功能属于脑的高级神经活动,学习主要是指人或动物通过神经系统接受外界环境信息而影响自身行为的过程,记忆是指获得的信息或经验在脑内贮存和再现的神经活动过程,二者密切相关不可分割,均属于脑的高级功能或高级神经活动〔8〕。慢性间歇性缺氧(CIH)在OSAS患者学习记忆功能下降的发生发展中发挥了重要作用〔9〕。本研究探讨CIH对大鼠学习记忆功能及脑室旁白质胶质纤维酸性蛋白(GFAP)和S100B表达的影响。
1 材料与方法
1.1 主要仪器和试剂 间歇性缺气系统S-450氧气检测报警仪加拿大BW.Technologies公司;医用压缩氧气(浓度 > 99%)、压缩氮气(浓度>99%)、压缩空气(福州氧气厂提供);Atman-6500空气泵(创星电器公司);自制密闭有机玻璃箱(预留进出气孔,出气孔使用单向活瓣);自制控制微电脑控制系统(由微电脑芯片、继电器、电磁阀、显示器等组成,编写控制软件进行程序控制);Morris水迷宫(福建医科大学神经生物学研究室);鼠抗人GFAP免疫组化单克隆抗体(福州迈新生物技术开发公司);鼠抗牛S100B多克隆抗体(美国SANTA CRUZ公司);二氨基联苯胺(DAB)显色试剂(福州迈新生物技术开发公司);0.1 mol/L(福州博科生物技术有限公司);无水乙醇(福州博科生物技术有限公司);甲醛(福州博科生物技术有限公司);苏木素(美国Sigma公司);10%水合氯醛(福建医科大学附属二院药剂科);其他常规试剂(福建医科大学动物实验中心);切片机RM2245型(德国Lexica);电热恒温鼓风干燥箱DHG-9023A型(上海精宏实验设备有限公司);生物组织摊烤片机JK-5型(武汉俊杰电子有限公司光学);包埋机(日本樱花);光学显微照相系统(日本东京OlimpusBX51);医用低温电冰箱(日本日立公司);HW-2恒温水浴箱(天津天大天发科技有限公司);电子天平(北京赛多利公司)。
1.2 实验动物 清洁级健康雄性8周龄SD大鼠60只,体重 180~200 g,由上海斯莱克实验动物中心提供,许可证号:SCXK(沪)2007-0005。
1.3 实验方法
1.3.1 实验动物及分组 随机选取10只大鼠进行CIH预实验,每只大鼠缺氧前后均抽血查血气分析,以判断是否达到低氧血症及低氧的程度。造模成功后,按照随机数字法,将大鼠分为以下3组:空白对照组(UC组,n=15),CIH组(n=20),空气模拟对照组(AC组,n=15)。
1.3.2 大鼠CIH预实验 为了验证慢性间歇缺氧舱的效果,测定10只大鼠在此间歇低氧条件下动脉血氧饱和度变化情况,参照文献〔10,11〕方法:先将大鼠用苯巴比妥钠100 mg/kg腹腔注射麻醉,将其腹部朝上固定在缺氧舱内解剖台上,局部消毒后,切开腹部皮肤,分离腹主动脉,其中5只在缺氧舱内氧浓度最低点30 s内直视下抽取腹主动脉血行血气分析,另外 5只大鼠在循环充气过程中当缺氧舱内氧浓度恢复至21%时按同样方法抽取。在缺氧循环中,当氧浓度达到8.3%左右时,大鼠动脉血氧饱和度(SaO2)为36.4%~60.5%,血氧分压23.9~32.6 mmHg,当氧浓度达到21%左右时,大鼠SaO2为93.2%~97.4%,动脉血氧分压为74.7~108.4 mmHg,其SaO2符合人类重度OSAS(SaO2<80%)的诊断标准。
1.3.3 CIH动物模型制作 参照文献〔10,11〕方法对CIH的动物模型加以改进。①自制CIH舱:自制密闭有机玻璃箱,预留多个操作孔,由透明薄膜密封进出气孔,其中出气孔使用单向活瓣。使用医用塑料导管连接密闭箱与控制系统。实验过程中,箱内气体不断流动,以避免二氧化碳潴留。②气体控制通路:氧气和氮气分别有不同的通气管道,均由程序控制的电磁阀开关进行控制。通过调整进入气孔的位置,保证缺氧舱内各个位置的氧气氮气浓度大致一致。通过控制程序及设定各种气体的吹入时间及流量,调控箱内氧浓度。设定每一间断性缺氧循环时间为4 min,其中各种气体吹入时间顺序为:氮气120 s;静息30 s;氧气60 s;空气30 s;各种气体流入状态可通过控制程序经显示器读出。箱内氧浓度由箱内氧气检测报警仪读出,在进行动物实验前,连续 20个循环每隔20s记录箱内的氧浓度,取平均值,作循环中箱内氧浓度变化趋势图。每一次循环间歇缺氧舱内最低氧浓度达(8.29±0.31)%,最高氧浓度(23.30±0.47)%。③CIH实验:每日8:00至16:00时将慢性间断性缺氧组大鼠置于间断缺氧系统的密闭箱中进行间歇性缺氧,16:00时以后使大鼠生活于大气环境中。缺氧过程中,大鼠自由活动,不进食水及食物。AC组与CIH组共用控制系统,使用相同的密闭箱,以造成相似环境,不同的是所有吹入气体均为空气。UC组未加干扰。大鼠在CIH实验完成后立即进行下一步的实验。
1.3.4 Morris水迷宫试验 ①定位航行试验:共5 d,每天训练4次。将大鼠面向池壁分别从四个象限的入水点放入水中,记录其在60 s内寻找到平台的时间,即为逃避潜伏期。如果大鼠60 s内不能找到平台,则由实验者用手牵引其到平台上停留10 s,然后取下休息30~60 s,再进行下一次训练。此项试验反映大鼠的学习能力。②空间探索试验:实验第6天,撤除平台,将大鼠任意选1个入水点放入水中,记录其60 s的游泳轨迹,分别计算首次到达平台的时间及跨越平台次数,以此项反映大鼠的空间记忆能力。水迷宫试验结束后,各组实验动物立即随机等分为两部分:一部分用于HE染色观察脑室旁白质的结构改变,另一部分用于GFAP和S100B免疫组织化学染色。
1.3.5 用于免疫组化的大鼠的灌注与取材 将实验大鼠取仰卧位固定于手术台上,用10%的水合氯醛(0.5 ml/100 g体重)腹腔注射深度麻醉,剪开腹腔,暴露膈肌,小心剪破膈肌,然后向上剪破胸壁与心包,暴露心脏。用灌注穿刺针沿着心脏的纵轴方向经心尖刺入左心室至主动脉根部,止血钳固定,在右心耳剪一小口,可见血液流出,先用温生理盐水50 ml灌注,待右心耳流出的液体变清亮时,再用4℃预冷的4%多聚甲醛磷酸缓冲液(0.1 mol/L,pH 7.2~7.4)150~200 ml灌注,一般灌注时间不少于30 min。灌注完成后,断头取脑,4℃预冷的4%多聚甲醛磷酸缓冲液(0.1 mol/L,pH 7.2~7.4)中后固定过夜后,以视交叉和其后4 mm处两点冠状切片,片厚4 mm,经梯度酒精脱水,二甲苯透明,石蜡包埋,以备HE染色和免疫组织化学染色。GFAP和S100B免疫组织化学染色结果判定:GFAP阳性细胞为胞质黄染,S100B阳性细胞为细胞质及胞核黄染。免疫组化检测设阳性对照,用从福州迈新公司购买的阳性对照片作阳性对照,结果阳性;阴性对照,用PBS液代替一抗作空白对照,结果阴性。
1.3.6 摄片 将每张切片于镜下随机选取6个不重叠的400倍视野,使用显微照相摄片。在使用数码相机拍摄切片照片时,电源的电压保持稳定,不能调解光源亮度及聚光镜,以保持显微镜的亮度在拍摄一组照片的过程中前后一致。同时,数码相机需手动设置曝光时间、变焦、光圈,关闭自动白平衡功能。
1.3.7 图像分析 所摄照片用Image-Pro Plus 6.0图像分析软件(美国Media Cybernetics公司),测量平均光密度值(MOD)。MOD值为阳性细胞区域内所有像素点光密度值的平均,染色阳性程度越高,MOD值越低,所测得值的均值即分别为GFAP和S100B的含量。
1.4 统计学方法 采用SPSS17.0软件进行秩和检验和Spearman相关性分析。
2 结 果
2.1 Morris水迷宫测试结果
2.1.1 定位航行试验 CIH组和UC、AC组不同时间点逃避潜伏期有显著差异(F=228.47,P=0.003),从第1天开始,CIH组的逃避潜伏期明显长于同期的UC组和RH组(均P<0.05),UC组与AC组不存在统计学差异(P>0.05)。见表1。
2.1.2 空间探索试验 CIH组首次达平台时间明显较UC组及AUC组均延长(P值分别为0.031,0.010);CIH组的穿越平台次数较UC组显著减少(P=0.003),说明处理组间存在差异,再进行两两比较,校正自由度α′=0.012 5,CIH组明显比UC组及AC组穿越次数少(P值分别为0.002,0.004)。见表2。
2.2 脑室旁白质的HE染色所见 UC组及AC组脑组织的结构正常,未见缺血缺氧性改变。CIH组见神经元皱缩、部分神经元脱失,染色浅,细胞间质疏松明显,核淡染,部分核不规则,核仁不清。见图1。
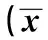
表1 各组大鼠平均潜伏期的比较±s,s)
与同时点UC组比较:1)P<0.05
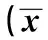
表2 三组大鼠记忆能力测定±s)
与UC照组比较:1)P=0.003,2)P=0.02;与AC组比较:3)P=0.004

图1 各组大鼠脑室旁白质的HE染色(×400)
2.3 免疫组织化学染色光镜观察
2.3.1 GFAP的免疫组化表达 UC组和AC组脑室旁白质可见少量GFAP阳性细胞,GFAP阳性细胞胞质为棕黄色,胞体较小,周围有放射状突起,突起较小,较细。而在CIH组脑室旁白质GFAP阳性细胞的表达明显增多,细胞形态也有明显改变,胞体较大,周围的放射性突起粗大,深染,见图2。各组脑室旁白质GFAP表达水平的比较显示,CIH组GFAP阳性产物IOD值高于UC组和AC组(P<0.01),UC组与AC组之间没有差异(P>0.05)。见表3。
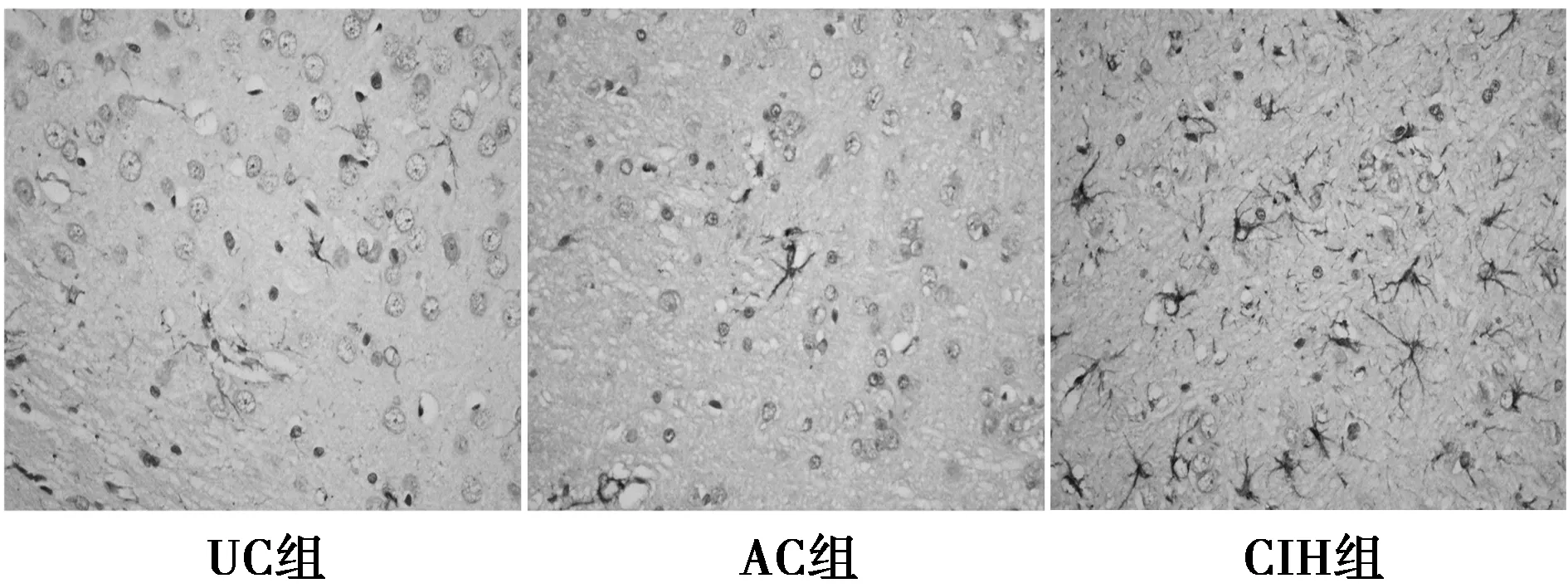
图2 各组大鼠脑室旁白质GFAP阳性表达(DAB,×400)

组别nGFAPS100BCIH组200.0722±0.01571)0.0829±0.02292)UC组150.1225±0.02060.1368±0.0397AC组150.1227±0.02030.1389±0.0331
与UC组比较:1)P=0.00,2)P=0.01
2.3.2 S100B的免疫组化表达 UC组和AC组脑室旁白质可见少量S100B阳性细胞。UC组和AC组的S100B细胞胞质为棕黄色,胞体较小,染色较淡。而在CIH组脑室旁白质S100B阳性细胞的表达明显增多,细胞形态也有明显改变,胞体较大,细胞质及细胞核均深染,见图3。故CIH组IOD与其余两组比较差异有显著意义(F=4.75,P<0.05)。各组脑室旁白质S100B表达水平的比较显示,CIH组S100B阳性产物IOD值高于UC组和AC组(P<0.01)。UC组与AC组之间没有差异(P>0.05)。见表3。
2.4 大鼠脑室旁白质GFAP、S100B表达分别与认知功能受损之间的相关性 大鼠认知功能损害程度和脑室旁白质GFAP、S100B表达呈负相关(r=-0.121,-0.015;P=0.028,0.015)。
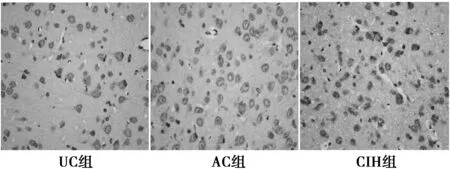
图3 各组大鼠脑室旁白质S100B阳性表达(DAB,×400)
3 讨 论
由于OSAS患者夜间反复呼吸暂停需较长时间才可能导致各系统较严重并发症,故目前在人类进行OSAS与白质关系的前瞻性研究比较困难,且临床研究存在许多干扰因素,使得很多研究在人体上进行有一定的局限性,所以建立适当的OSAS的动物模型对于阐明OSAS白质损害及认识功能减退的研究是非常重要的。近年来随着对其研究的深入,各国学者针对其病理生理的特点制作出了各种动物模型,但仍然无法很好地模拟OSAS的病理生理过程,故我们尝试对现有的模型加以改进,建立CIH大鼠模型,试图更好地研究OSAS的发生发展过程。本研究建立的模型很好地模拟了OSAS的病理生理过程,利于对OSAS的进一步研究。
记忆损害常是OSAS患者就诊的主要症状之一,一些研究认为OSAS患者主要出现执行功能的减退,包括无法形成新的记忆以及选择性及持续的注意力减退等〔12〕。OSAS患者在智力和语言表达功能上的损害难以被察觉,但是在觉醒性和执行功能上有明显的障碍〔13〕。目前OSAS患者的认知功能障碍是否可逆还没有定论,但是在OSAS患者观察到的大脑结构性的改变可能支持认知功能减退是不可逆的〔14〕。OSAS引起的认知功能损害,主要表现在记忆力、注意力、执行能力等方面〔15〕。本研究结果显示CIH不但可以造成大鼠的学习能力进行性下降,从而经过训练获得有效经验的能力下降,而且可以造成空间定位记忆能力的损害。
GFAP作为星形胶质细胞活化的一个重要特征,其合成量的多少对脑损伤程度有直接影响。少突胶质细胞是脑白质的主要胶质细胞,它主要功能为合成髓鞘,包绕有髓神经。髓鞘主要是为有髓神经纤维提出了一个高的膜阻抗和低的电容,保证了冲动的跳跃式传导〔16〕。S100B是脑组织中主要的S100蛋白,在灰质及皮层由星形胶质细胞表达,在白质由少突胶质细胞表达〔17〕。Naegele等〔18〕发现,在大脑慢性持续低灌注的大鼠模型中,S100B的表达在其白质损害的部位广泛地增多。故S100B表达的上调与脑白质的损害程度正相关。本研究发现S100蛋白及GFAP在CIH组大鼠脑室旁白质表达较UC、AC组明显升高。
VD的病理机制主要在于血管栓塞及小血管疾病。典型的皮质下缺血性血管病广泛累及室周和深部白质,特别是内囊膝部或前肢、放射冠前部和半卵圆中心前部,常常累及前额叶皮质下环路,从而影响认识知功能,这与临床上我们看到的OSAS造成的脑室旁白质损害的部位类似,而血管梗死的病因多为高血压、动脉粥样硬化及各种栓塞性疾病,这恰与OSAS的高危因素相同,同时VD中小血管的病理改变也与OSAS因低氧而引起的血管的改变类似,提示OSAS脑室旁白质损害对认知功能的损害的机制可能与VD的机制相似。Cavalieri等〔8〕甚至认为通过测量脑室旁白质损害容量的大小可以评估痴呆程度,进一步提示了OSAS的认知功能减退与脑室旁白质损害的相关性。
Zhang等〔19〕认为慢性间断性睡眠低血氧通过对前额及后头部(ERP)的影响所致的前额中央执行系统功能损害可能是OSAS患者记忆障碍的病理基础。由于与记忆、情绪行为等智能有关的三种边缘环路(内侧边缘环路、基底外侧边缘环路和防御环路)均位于脑室周围,故当脑室周围白质发生病损时,环路中断,患者就可能表现为记忆障碍、情感及行为异常,记忆障碍主要表现为近记忆力明显下降,定向力、计算力减退。同时,脑白质的损害破坏联络性传导,导致感觉、运动及高级神经活动障碍,同时具有一定的隐匿性和延迟性。另外,皮质和皮质下投射系统的分离可加重白质损伤,最终引起认知功能的损害。Du等〔20〕研究表明白质病变可引起脑皮质萎缩,而且对其他脑皮质区域的影响要比对内嗅区和海马皮质的影响要大。另外脑室旁的白质纤维多由额叶投射纤维组成,因此白质病变可延伸至额叶,引发精神运动下降,逐渐形成痴呆。本实验结果说明GFAP、S100B越高,脑室旁白质损害越厉害,大鼠的空间学习和记忆能力越差。
1 Marikp E.Leptin,obesity,and obstructive sleep apnea〔J〕.Chest,2000;118(4):569-71.
2 Li HY,Huang YS,Chen NH,etal.Mood improvement after surgery for obstructive sleep apnea〔J〕.Independent Papers Laryngosc,2004;114(6):1098-102.
3 Alchanatis M,Deligiorgis N,Zias N,etal.Frontal brain lobe impairment in obstructive sleep apnea:a proton MR spectroscopy study〔J〕.Eur Respir J,2004;24(6):980-6.
4 Zimmerman E,Aloia MS.A review of neuroimaging in obstructive sleep apnea〔J〕.J Clin Sleep Med,2006;(4):461-71.
5 张向前,陆兵勋,李涛平.阻塞性睡眠呼吸暂停综合征白质损害特点与记忆功能的关系〔J〕.南方医科大学学报,2009;29(4):825-9.
6 Van Gijm J.Leukoaraiosis and vsacular dementia〔J〕.Neurology,1998;52(3):3-8.
7 Hirono N,Kitagaki H,Kazui H,etal.Impact of white matter changes on clinical manifestation of Alzheimer’s disease:a quantitative study〔J〕.Stroke,2003;31(6):2182-8.
8 Cavalieri M,Enzinger C,Petrovic K,etal.Vascular dementia and Alzheimer's disease-are we in a Dead-End Road〔J〕? Neurodegener Dis,2010;7(1-3):122-6.
9 岳伟华,郝 伟,刘破资,等,睡眠呼吸暂停综合征患者的认知功能〔J〕.国外医学精神病学分册,2003;30(1):24-7.
10 Alchanatis M,Zias N,Deligiorgis N.Sleep apnea-related cognitive deficits and intelligence:an implication of cognitive reserve theory〔J〕.J Sleep Res,2005;14(1):69-75.
11 谭胜玉,杨 宇,罗荧荃,等.慢性间歇性缺氧大鼠模型的初步研究〔J〕.中国医学工程,2006;14(6):595-8,601.
12 宋爱玲,曾奕明.慢性间断性缺氧对小鼠肾组织结构、基质金属蛋白酶及其组织抑制因子表达的影响〔J〕.国际呼吸杂志,2007;27(11):808-12.
13 Fletcher EC,Lesske J,Qian W,etal.Repetitive,episodic hypoxia causes diurnal elevation of blood pressure in rats〔J〕.2009;22(5):273-51.
14 Drager LF,Jun JC,Polotsky VY.Metabolic consequences of intermittent hypoxia:relevance to obstructive sleep apnea〔J〕.Best Pract Res Clin Endocrinol Metab,2010;24(5):843-51.
15 Xie H,Leung KL,Chen L,etal.Brain-derived neurotrophic factor rescues and prevents chronic intermittent hypoxia-induced impairment of hippocampal long-term synaptic plasticity〔J〕.Neurobiol Dis,2010;40(1):155-62.
16 王新德.应重视成人痴呆的诊断和治疗〔J〕.中华神经科杂志,1998;31(2):133-4.
17 Beebe DW.Groesz L,Wells C,etal.The neruopsychological effects of obstructive sleep apnea:a meta-analysis of norm-referenced and case-controlled data〔J〕.Sleep,2003;26:298-307.
18 Naegele B,Thouvard V,Pepin JL,etal.Deficits of cognitive executive functions in patients with sleep apnea syndrome〔J〕.Sleep,1995;18(5):43-52.
19 Zhang X,Wang YP.Eraly detection of recognitive impairment in patientswith obstructive sleep apnea syndrome:allevent-related potential study〔J〕.Neurosci Lett,2002;325(2):99-102.
20 Du AT,Schuff N,Chao LL,etal.White matter lesions are associated with cortical atrophy more than entorhinal and hippocampal atrophy〔J〕.Neurobiol Aging,2005;26(2):553-9.
〔2015-02-11修回〕
(编辑 苑云杰/曹梦园)
许盈盈(1981-),女,主治医师,硕士,主要从事脑血管病研究。
R743
A
1005-9202(2016)20-4987-04;
10.3969/j.issn.1005-9202.2016.20.020
1 晋江市医院神经内科

