短期饲喂镰刀菌毒素饲粮诱导断奶仔猪阴户、血清代谢和氧化应激指标的改变
杨立杰,牛群升,张崇玉,张桂国,姜淑贞,杨维仁
(山东农业大学,山东 泰安 271018)
短期饲喂镰刀菌毒素饲粮诱导断奶仔猪阴户、血清代谢和氧化应激指标的改变
杨立杰,牛群升,张崇玉,张桂国,姜淑贞*,杨维仁*
(山东农业大学,山东 泰安 271018)
该试验旨在研究霉变饲粮中镰刀菌毒素对断奶仔猪阴户、血清代谢和氧化应激指标的影响。选用28日龄平均体重(9.59 ± 0.79)kg的健康三元杂交(杜 × 长 × 大)断奶雌性仔猪15头,随机分为3个处理。对照组饲喂基础饲粮,50%镰刀菌毒素组[玉米赤霉烯酮(ZEN),0.90 mg/kg;呕吐毒素(DON),1.43 mg/kg;烟曲霉毒素(FUM),5.85 mg/kg]和100%镰刀菌毒素组[ZEN,1.69 mg/kg;DON,2.03 mg/kg;FUM,9.05 mg/kg]分别用50%和100%的霉变玉米和霉变玉米蛋白粉代替基础饲粮中的玉米和玉米蛋白粉,预试期7 d,试验期15 d。结果表明:与对照组相比,50%和100%镰刀菌毒素组试验第6 d的阴户面积显著增大(P<0.05);50%和100%镰刀菌毒素组仔猪阴户面积的线性斜率和试验第15 d的阴户长、宽和面积均显著大于对照组(P<0.05)。100%镰刀菌毒素组试验第8 d和第15 d仔猪血清中胆固醇和尿素均显著高于对照组(P<0.05);而50%镰刀菌毒素组显著提高试验第15 d胆固醇和尿素水平(P<0.05)。与对照组相比,50%和100%镰刀菌毒素组均显著提高仔猪试验第8 d和第15 d血清中GSH-Px和SOD活性(P<0.05);而MDA含量则相反(P<0.05)。试验条件下,自然霉变饲粮饲喂断奶仔猪6 d显著增加其外阴大小,8 d便显著改变血清代谢产物和抗氧化酶活性,这些结果对指导仔猪健康生产具有重要意义。
仔猪;镰刀菌毒素;阴户;代谢产物;氧化应激
镰刀菌是农作物中最常见的污染性霉菌,生长过程中产生的有毒代谢产物镰刀菌毒素包括玉米赤霉烯酮、呕吐毒素、烟曲霉毒素等。全球范围内用于动物生产的谷物和饲料受到镰刀菌毒素的严重污染[1]。在中国,谷物收获条件的限制和油料加工过程的落后使镰刀菌毒素的污染加重,低质量的玉米和粮食加工副产品,特别是非常规原料的广泛使用,使我国镰刀菌毒素的污染程度远远超出国外[2-4]。镰刀菌毒素不仅能够引起断奶仔猪阴户红肿、乳腺增大、子宫增生、生殖激素分泌紊乱以及卵泡病理性发育[5],而且对动物氧化应激[6]和血清代谢产物具有重要影响[7]。尽管国内外针对镰刀菌毒素进行了大量的研究,但是大部分研究是采用纯毒素形式进行[7-10],而生产中往往是多种镰刀菌毒素的联合作用,且镰刀菌毒素短期饲喂断奶仔猪对其阴户、血清代谢产物和抗氧化指标的研究尚未见报道。本试验旨在研究饲喂自然霉变玉米和玉米蛋白粉中镰刀菌毒素短时间(8 d和15 d)内对断奶仔猪阴户、血清代谢产物和氧化应激的影响,为仔猪健康及生产提供理论依据。
1 材料与方法
1.1 试验动物与管理
选择28日龄的三元杂交(杜 × 长 × 大)断奶雌性仔猪15头(平均体重9.59 ± 0.79 kg),随机分为3个处理,每个处理5个重复,每个重复1头猪,各处理组间初始体重差异不显著(P > 0.05)。
试验猪采用单体笼(0.48 m2)饲养。单体笼均使用塑料漏缝地板,笼内安装有乳头饮水器和料槽,试验猪自由采食、自由饮水。试验开始前对猪舍进行全面清扫、消毒,试验期间保持猪舍清洁的同时,每周定期进行一次猪舍消毒。猪舍内安装红外保温灯,第1周猪舍内环境温度维持在30 ℃左右,之后将舍内环境温度调整在26~28 ℃,相对湿度保持在65%左右(试验在山东农业大学畜牧科技园进行)。

表1 饲粮组成(风干基础)
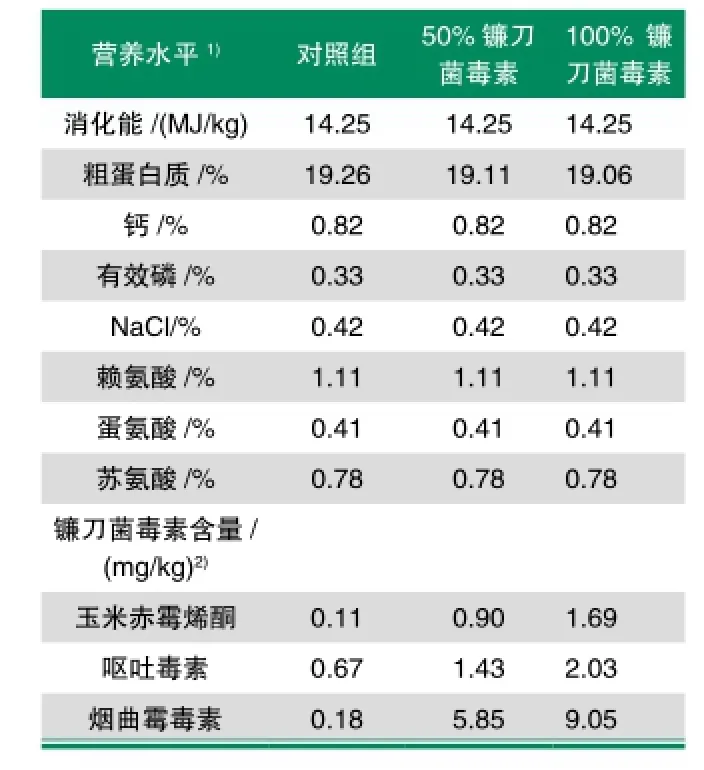
表2 饲粮营养(风干基础)及毒素水平
1.2 试验饲粮与试验设计
断奶仔猪基础饲粮参考美国NRC(1998)营养需要配制,饲粮组成及营养水平见表1、表2。试验采用单因子试验设计,对照组(Contr.)饲喂基础饲粮,50%镰刀菌毒素组(Fusarium Toxins 50%,FT-50)和100%镰刀菌毒素组(Fusarium Toxins 100%,FT-100)分别用50%和100%的霉变玉米和霉变玉米蛋白粉代替基础饲粮中的玉米和玉米蛋白粉,预试期7 d,试验期15 d。
1.3 试验饲粮的配制、养分含量和毒素水平的测定
1.3.1 镰刀菌毒素饲粮的配制
先配制对照饲粮;再用全部自然霉变玉米代替基础饲粮中的玉米,用霉变玉米蛋白粉代替基础饲粮中的玉米蛋白粉配制100%镰刀菌毒素饲粮;然后用等量的对照饲粮和100%镰刀菌毒素饲粮混合配制成50%镰刀菌毒素饲粮。试验期间所需饲粮于试验正式开始前1周一次性配制完成,分别在试验开始前和结束后对饲粮进行取样,用以分析饲粮中的毒素和粗蛋白质水平[11]。
1.3.2 饲粮毒素测定
玉米赤霉烯酮(ZEN)、黄曲霉毒素(AFL)和烟曲霉毒素(FUM)的测定采用酶联免疫吸附(ELISA)和荧光测定法,呕吐毒素(DON)的测定采用高效液相色谱法(HPLC)。ZEN、DON、AFL和FUM的最低检测限分别为0.1 mg·kg-1、0.1 mg·kg-1、1.0 μg·kg-1和0.25 mg·kg-1。饲粮毒素水平见表2,黄曲霉毒素未检出或低于检测限水平。
1.4 阴户面积
试验期间每隔3 d用游标卡尺测量仔猪阴户长、宽,并计算阴户面积。仔猪阴户近似菱形,所以本研究以菱形的面积公式(长×宽)/2来近似计算仔猪阴户面积(图1),以比较各组仔猪阴户的增大效果。
1.5 血样的采集、处理与测定
试验中期(第8 d)和结束(第15 d),对仔猪进行前腔静脉空腹采血(约30 mL),3 000 r/min 下离心10 min 分离血清,待测定血清代谢产物、血清抗氧化物酶和丙二醛含量。
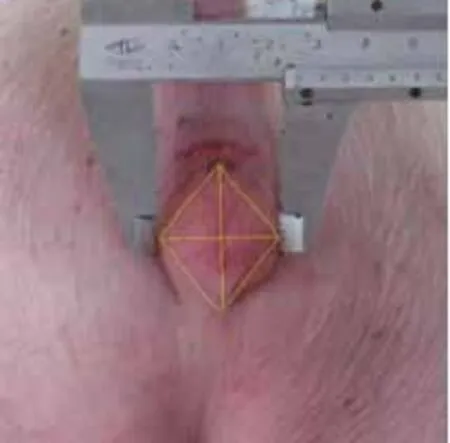
图1 阴户大小的测量与计算
1.5.1 血清代谢产物
血清代谢产物胆固醇、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和尿素含量测定采用COBAS MIRA Plus(Roche DiagnosticSystem Inc., 瑞士)全自动生化分析仪测定。
1.5.2 血清抗氧化物酶和丙二醛分析
谷胱甘肽过氧化物酶(GSH-Px)采用可见光法测定,超氧化物歧化酶(SOD)采用羟胺法测定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定。GSH-Px测试盒(A005)、SOD测试盒(A001-1)和MDA测试盒(A003-1)购自南京建成生物工程研究所(南京),具体测定方法均按试剂盒说明书进行。
1.6 数据统计分析
数据采用SAS 9.1统计软件进行单因素方差分析(one-way ANOVA),差异显著性采用Duncan氏法进行多重比较。通过普通截距多元线性回归分析评价仔猪阴户大小随时间的变化规律,并根据t-检验确定线性斜率的显著性,显著性水平P < 0.05。

表3 镰刀菌毒素对断奶仔猪阴户大小的影响

图2 仔猪阴户面积随时间的线性关系。同一时间点不同字母表示差异显著(P<0.05)

表4 镰刀菌毒素对断奶母猪阴户面积影响的普通截距多元线性回归(d-0, 3, 6, 9, 12 and 15)
2 结果与分析
2.1 阴户大小
镰刀菌毒素对断奶仔猪阴户大小的影响见表3、图2和表4。试验开始时(0 d)所有处理仔猪的阴户长、宽和面积差异均不显著(P > 0.05);试验结束时(15 d)50%和100%镰刀菌毒素组仔猪的阴户长、宽、面积及其增量都显著大于对照仔猪(P < 0.05);但50%与100%镰刀菌毒素组之间仔猪(15 d)阴户长、宽、面积及其增量差异均不显著(P > 0.05)。随着饲养时间的延长,仔猪的阴户面积线性增加(P< 0.05,图2),试验第6 d 开始50%和100%镰刀菌毒素组阴户面积均显著大于对照组(P< 0.05)。对照组、50%和100%镰刀菌毒素组阴户面积的线性斜率分别为1.93、10.21和11.64,对不同处理的线性斜率进行t-检验,50%和100%镰刀菌毒素组阴户面积的线性斜率均显著大于对照组(P< 0.05,表4)。
2.2 血清代谢产物
镰刀菌毒素对断奶仔猪血清代谢产物的影响见表5。100%镰刀菌毒素组仔猪试验第8 d和第15 d血清中胆固醇含量和尿素水平均显著高于对照组(P< 0.05)。试验第15 d,50%镰刀菌毒素组仔猪血清中胆固醇含量和尿素水平均显著高于对照组(P< 0.05)。不管是试验第8 d,还是试验第15 d,50%和100%镰刀菌毒素组之间测定指标差异均不显著(P> 0.05)。

表5 镰刀菌毒素对断奶仔猪血清代谢产物的影响

表6 镰刀菌毒素对断奶仔猪血清谷胱甘肽过氧化物酶、超氧化物歧化酶和丙二醛的影响
2.3 血清谷胱甘肽过氧化物酶、超氧化物歧化酶和丙二醛
镰刀菌毒素对断奶仔猪血清谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)和丙二醛(MDA)的影响见表6。无论试验第8 d,还是试验第15 d,50%镰刀菌毒素组仔猪血清中GSH-Px和SOD活性均显著低于对照组(P< 0.05),100%镰刀菌毒素组仔猪血清中GSH-Px和SOD活性均显著低于50%镰刀菌毒素组(P < 0.05)。无论试验第8 d,还是试验第15 d,50%镰刀菌毒素组仔猪血清中MDA含量显著高于对照组(P < 0.05),100%镰刀菌毒素组仔猪血清中MDA含量显著高于50%镰刀菌毒素组(P < 0.05)。
3 讨论
试验中尽管我们选择优质原料配制对照饲粮,但是遗憾的是对照饲粮中也检测到不同程度的毒素含量,这进一步说明我国镰刀菌毒素污染的普遍性及本研究的迫切性。本试验对照饲粮中玉米赤霉烯酮(ZEN)、呕吐毒素(DON)和烟曲霉毒素(FUM)的水平低于我国饲料卫生标准定的小于0.5 mg/kg(GB13078.2-2006)、1 mg/kg(GB13078.3-2007)(我国对于饲料中FUM还没有制定相应的限量标准)以及欧盟关于仔猪饲粮中ZEN、DON和FUM小于0.1 mg/kg、0.9 mg/kg和5 mg/kg(EC,2006)的最高限量规定。而试验饲粮中ZEN、DON和FUM均超过我国饲料卫生标准和欧盟仔猪饲粮中的最高限量,且试验组镰刀菌毒素水平梯度增加,因此对照组镰刀菌毒素的含量不影响试验组结果的判断。本试验100%镰刀菌素组平均日采食量和日增重均显著低于对照组,而50%镰刀菌素组仅平均日增重显著低于对照组,其他差异不显著[12]。
3.1 阴户大小
镰刀菌毒素对断奶仔猪阴户大小的影响主要是霉变玉米和霉变玉米蛋白粉中含有的ZEN。姜淑贞等(2010)研究发现,低剂量ZEN(1.1~3.2 mg/kg)能够显著增加断奶仔猪生殖器官指数和阴户大小,且随ZEN增加呈剂量依赖特性。本试验条件下,无论是50%还是100%镰刀菌毒素组,试验第6 d仔猪外阴比对照组明显红肿,阴户长、宽及阴户面积较对照组均明显增大且差异显著,进一步证实自然霉变饲粮中0.9 mg/kg ZEN足以诱导仔猪生殖系统毒性,但是本试验中DON和FUM是否加重ZEN的生殖毒性还有待进一步体内外试验证实。
3.2 血清代谢产物
本试验条件下,100%霉菌毒素组在试验第8 d胆固醇水平便显著高于对照组,试验第15 d两个镰刀菌毒素组胆固醇水平均显著高于对照组。血清尿素水平与蛋白质代谢有密切关系,血清尿素含量与饲粮氮利用率成反比,能够衡量饲粮蛋白质的生物学价值[7,13]。Drochner等(2006)分别用DON含量0、300、600和1 200 μg/kg饲粮饲喂仔猪时,证实仔猪血清中血糖与尿素含量呈负相关,并提出可能是由于DON破坏了氨基酸的正常代谢[14]。本试验中100%镰刀菌毒素组在试验第8 d血清尿素水平便显著高于对照组,试验第15 d两个镰刀菌毒素组尿素水平均显著高于对照组,表明镰刀菌毒素促进了蛋白质的分解代谢。
3.3 血清谷胱甘肽过氧化物酶、超氧化物歧化酶和丙二醛
谷胱甘肽过氧物酶(GSH-Px)超氧化物歧化酶(SOD)是机体重要的抗氧化酶,能够清除氧自由基,而丙二醛(MDA)则是脂质过氧化反应的产物,通过检测仔猪血清中GSH-Px和SOD活性以及MDA含量,可以判断组织氧化损伤程度[15]。研究发现,ZEN浓度在10 μmol/L以上即能诱导Caco-2细胞膜的脂质过氧化反应,同时ZEN和DON均使细胞MDA产生增加[16]。ZEN(40 mg/kg BW)处理小鼠肝脏SOD和GSH-Px活性显著降低[17]。姜淑贞(2010)研究发现2.0和3.2 mg/kg ZEN处理仔猪血清和肝脏中SOD和GSH-Px的活性显著低于对照组,同时MDA浓度则显著升高。Mobio等(2000)进一步证实了6 μmol/L FUM便可诱导大鼠胶质神经细胞的脂质过氧化反应[18]。不同毒素诱导氧化应激的能力是不同的,Kouadio等(2005)证实在1~150 μmol/L浓度范围内FUM比ZEN和DON更容易诱导人体Caco-2细胞的氧化应激,且3种毒素诱导氧化应激的能力为FUM>DON>ZEN。本试验中50%和100%镰刀菌毒素组仔猪血清GSH-Px和SOD活性无论试验第8 d还是试验第15 d均显著低于对照组,而MDA含量显著高于对照组,表明本试验条件下,3种镰刀菌毒素诱导仔猪氧化应激,降低了仔猪清除氧自由基的能力,增强了脂质过氧化反应,但其联合作用及其机制尚需进一步证实。
4 结论
本试验条件下,与对照组相比,镰刀菌毒素在试验第6 d使断奶仔猪阴户显著红肿;在试验第8 d显著提高血清中胆固醇、尿素和MDA水平,降低血清GSH-Px和SOD的活性。
[1] CHAYTOR A C,HANSEN J A,VAN HEUGTEN E,et al.Occurrence and decontamination of mycotoxins in swine feed [J].Asian-Australasian Journal of Animal Sciences, 2011,24: 723-738.
[2] 王若军, 苗朝华, 张振雄,等.中国饲料及饲料原料受霉菌毒素污染的调查报告[J]. 饲料工业,2003,24(7): 53-54.
[3] 付鹏程, 李荣涛, 谢刚, 等. 稻谷真菌毒素污染调查与分析[J]. 粮食储藏,2004, 32(4): 49-51.
[4] 张丞, 刘颖莉, 吴裕本, 等. 2009 年中国饲料和原料中霉菌毒素污染情况调查总结报告[J]. 饲料与畜牧: 新饲料,2010 (4): 30-33.
[5] 姚宝强.玉米赤霉烯酮和吸附剂对断奶仔猪生殖发育、 血液生化指标和组织形态学的影响[D].泰安:山东农业大学, 2009.
[6] MCLEAN M. The phytotoxicity of Fusarium metabolites: An update since 1989[J]. Mycopathologia, 1996,133(3): 163-179.
[7] 姜淑贞. 玉米赤霉烯酮对断奶仔猪的毒性初探及改性蒙脱石的脱毒效应研究[D]. 泰安: 山东农业大学, 2010.
[8] ABBèS S,OUANES Z,SALAHABBèS J B,et al.Preventive role of aluminosilicate clay against induction of micronuclei and chromosome aberrations in bone-marrow cells of Balb/c mice treated with Zearalenone[J].Mutation Research/ Genetic Toxicology and Environmental Mutagenesis,2007, 631(2):85-92.
[9] BUENO D J, DI MARCO L, OLIVER G,et al.In vitro binding of zearalenone to different adsorbents[J].Journal of Food Protection®,2005,68(3):613-615.
[10] SPERANDA M, LIKER B, SPERANDA T, et al. Haematological and biochemical parameters of weaned piglets fed on fodder mixture contaminated by zearalenone with addition of clinoptilolite[J].Actaveterinaria, 2006,56(2-3): 121-136.
[11] 张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2003.
[12] 刘宁, 杨在宾, 杨维仁, 等. 自然霉变玉米和玉米蛋白粉对仔猪生长性能、养分表观消化率及血清酶水平的影响[J]. 中国畜牧兽医,2015(3):583-588.
[13] MALMLOF K.Amino acid in farm animal nutrition metabolism, partition and consequences of imbalance[J].Swidish Journal of Agriculture Research, 1988, 18(4): 191-193.
[14] DROCHNER W, SCHOLLENBERGER M, GOTZ S, et al. Subacute effects of moderate feed loads of isolated Fusarium toxin deoxynivalenol on selected parameters of metabolism in weaned growing piglets[J]. Journal of Animal Physiology and Animal Nutrition, 2006, 90(9-10): 421-428.
[15] SIES H.Oxidative stress: from basic research to clinical application[J].The American Journal of Medicine,1991, 91(3): S31-S38.
[16] KOUADIO J H,MOBIO T A,BAUDRIMONT I, et al. Comparative study of cytotoxicity and oxidative stress induced by deoxynivalenol,zearalenone or fumonisin B1 in human intestinal cell line Caco-2[J].Toxicology, 2005, 213(1): 56-65.
[17] SALAH-ABBèS J B,ABBES S,OUANES Z,et al. Tunisian radish extract (Raphanus sativus) ameliorates the antioxidant status and mediates the oxidative stress of Zeralenone in Balb/c mice[J]. Journal of Applied Toxicology, 2007, 28: 6-14.
[18] MOBIO T A,ANANE R, BAUDRIMONT I, et al. Epigenetic Properties of Fumonisin B1: Cell Cycle Arrest and DNA Base Modification in C6 Glioma Cells[J]. Toxicology and applied pharmacology, 2000, 164(1): 91-96.
2016-01-13)
山东省现代农业产业技术体系生猪创新团队建设(SDAIT-06-022-05)
杨立杰(1992 ),男,山东农业大学,动物营养与饲料,硕士研究生,E-mail:724832205@qq.com
*通讯作者:姜淑贞,副教授,硕士生导师,E-mail:shuzhen305@163.com;杨维仁,教授,硕士生导师,E-mail:wryang@sdau.edu.cn

