异苞滨藜两种异型种子对幼苗生长状况的影响
马赫,王喜勇,2,马尔孜亚·叶尔斯别克,魏岩
(1.新疆农业大学草业与环境科学学院/新疆草地资源与生态重点实验室,乌鲁木齐 830052;2.中国科学院新疆生态与地理研究所,乌鲁木齐 830052;3.新疆维吾尔自治区草原总站,乌鲁木齐 830049)
异苞滨藜两种异型种子对幼苗生长状况的影响
马赫1,王喜勇1,2,马尔孜亚·叶尔斯别克3,魏岩1
(1.新疆农业大学草业与环境科学学院/新疆草地资源与生态重点实验室,乌鲁木齐 830052;2.中国科学院新疆生态与地理研究所,乌鲁木齐 830052;3.新疆维吾尔自治区草原总站,乌鲁木齐 830049)
【目的】研究异型种子对后代生态适应机制的影响。【方法】采用室外仿自然条件培育方法,观察异苞滨藜异型种子萌发物候,以及幼苗早期形态生长特征。【结果】异型种子的萌发物候不同步,异型种子萌生植株子叶存留时间长,且黑色种子萌生幼苗的子叶和褐色种子萌生幼苗的子叶留存时间有差异,褐色种子3月27日萌发,萌生幼苗的子叶持续时间长达39 d;黑色种子4月3日萌发,萌生幼苗的子叶持续30 d;褐色种子萌生幼苗的子叶大小、根长、地上生物量、地下生物量均显著大于黑色种子萌生幼苗(P<0.05);异型种子萌生幼苗在地上、地下生物量分配方面有差异(P<0.05),褐色种子萌生幼苗在子叶期的四次测量中其地上、地下生物量均显著大于黑色种子萌生幼苗,至5月1日最后一次测量,褐色种子萌生幼苗的地上生物量为(2.312±0.183)g,地下生物量为(0.098±0.008)g,黑色种子萌生幼苗的地上生物量为(0.402±0.05)g,地下生物量为(0.043±0.006)g;褐色种子萌生幼苗的根冠比逐渐降低,黑色种子萌生幼苗的根冠比逐渐升高。【结论】源于不同类型种子的幼苗在萌发物候、子叶存留时间、生长特性和根冠比指标参数方面表现出显著差异,这些差异是异苞滨藜长期适应荒漠异质环境而进化产生的生态适应机制,这种生态适应机制是异苞滨藜能够在荒漠异质环境中生存和繁衍的重要保障。
异苞滨藜;异型种子;萌发物候;幼苗;两头下注
0 引 言
【研究意义】种子异型性(Seed heteromorphism)指同一植株产生不同形状或不同生态学行为的种子的现象[1]。种子异型性被认为是植物对恶劣异质环境的一种两头下注的适应策略[2-4]。在具异型种子的植物种类中,不同类型的种子通常在外形、颜色和存有的附属物方面有所差异[5],并在生态指标方面显著不同,这些差异亦会反映在一年或者两年的萌芽期[6]、生存或生殖时间[7]、散布期[8,9]、种子库动态期[9]。藜科植物是荒漠、半荒漠和盐碱地上分布最广的植物,在我国主要分布在西北、东北地区和内蒙古[10];在新疆荒漠地区形成各种群落,是重要的建群种和共建种,很多藜科植物还是优良牧草,在植被景观和荒漠利用上都起着很重要的作用[11]。【前人研究进展】到目前为止,具有种子异型性的植物共有26科129属292种[12,13]。藜科植物是具有种子异型性的第二大科,占据种子异型性植物的13%,隶属于12个属[13];主要集中在盐角草属(Salicornia)、滨藜属(Atriplex)、碱蓬属(Suaeda)、猪毛菜属(Salsola)、节藜属(Arthrocnemuum)等属中[14,15]。目前,有关种子异型性的研究主要集中在异型种子的形态结构特征、异型种子的萌发和休眠特性、异型种子的传播特点等方面[16],有关种子异型性植物其异型种子产生的植株在生命周期方面的一些差异已有逐步的发现[5,12]。异苞滨藜是藜科滨藜属一年生植物,在我国主要分布在新疆和甘肃北部,果实和种子具有二型性:小型苞片包被的黑色小种子和大型苞片包被的褐色大种子,褐色种子成熟后即具有一定的萌发能力,最终萌发率都在80%以上;黑色种子处于非深度生理休眠状态,低温层积处理能够有效地加速和提高其萌发[15]。异苞滨藜是具有很强的抗干旱、抗盐碱和耐贫瘠能力,在改良土壤、维持荒漠生态平衡、维持天然牧草资源方面都起着重要的作用[11]。【本研究切入点】异苞滨藜两头下注策略产生的两种异型种子在萌发物候上的差异,后代幼苗的生长特征上的差异,影响异苞滨藜适应荒漠异质环境的生态适应机制。国内外的研究中尚未见报道。以异苞滨藜为对象,对比研究其异型种子的萌发物候及萌生幼苗早期生长的差异。【拟解决的关键问题】研究可能存在的差异探究异型种子对其萌生植株产生的影响,为验证种子异型性的两头下注策略提供科学依据,同时也为开发利用这一荒漠野生牧草资源提供基础资料。
1 材料与方法
1.1 材 料
材料于2013年10月中旬采自准噶尔盆地南缘的自然种群(43°45′44″~43°47′25″N,87°33′16″~87°34′56″E),植被类型为小半灌木荒漠小蓬(Nanophytonerinaceum)群系。该区属中温带荒漠区,海拔900~1 300 m,年降水量266.9 mm,年蒸发量2 731 mm,为典型的干旱区荒山,昼夜温差大,夏季热量充足,冬季寒冷,持续时间长,自每年的11月中旬至翌年3月上旬。在自然种群中随机选取30株植株,将植株用剪刀从根部剪下,装入塑料袋中带回实验室,在实验室内自然晾干,将两种异型种子分离,选取成熟饱满的种子,然后将选取的种子装入纸袋中做好标记,在阴暗室温条件下储藏备用。
1.2 方 法
1.2.1 试验设计
试验地位于新疆农业大学校园内(43°48′37″N,87°33′44″E),海拔836.7 m。选择平整地块,仿自然条件于2013年11月中旬播种;试验田4 m×3 m,将标记好的黑色种子和褐色种子每隔0.5 m均匀撒播成行,黑色种子与褐色种子各4行,共8行;播种后,用厚约3 cm的细土均匀覆盖。
1.2.2 异型种子萌发物候、子叶留存和脱落时间的观察
异苞滨藜是双子叶植物,其幼苗属子叶出土幼苗。自2014年3月10日开始,每天观察试验地内种子萌发破土情况,记录子叶出土时间。
当幼苗出土后,测量子叶出土时的长度和宽度,观察并记录子叶留存时间、枯落时间。
1.2.3 幼苗形态、生长特征的观察与测定
子叶出土后,每隔10 d取样,用小铁锹将幼苗从地里挖出,在取样过程中深挖,以保证根的完整,然后带回实验室进行测量。测量子叶的长度和宽度、胚轴和根的长度,并用剪刀将子叶、胚轴、根分割,在千分之一的电子秤上测量其鲜重和干重。至2014年5月5日后,幼苗的子叶均出现蜷曲脱落现象,即停止取样。
1.3 数据统计
用SPSS 20.0统计软件对同类型不同时间、同一时间不同类型幼苗的子叶长、子叶宽、根长、生物量、根冠比数据采用单因素方差分析进行差异显著性检验。用Sigmaplot对所得数据制图。
2 结果与分析
2.1 两种异型种子的萌发物候和子叶寿命
研究表明,褐色种子3月27日开始萌发破土,3月28日大量萌发,萌发持续2 d;子叶自3月27日出现,至5月5日脱落消亡,持续生存39 d。黑色种子4月3日开始萌发破土,在整个试验观察中始终未出现大量萌发的现象,但试验田中黑色种子的萌发时间持续了17 d;子叶4月3日出现,5月3日脱落消亡,持续30 d。异苞滨藜两种异型种子萌发物候不同步,子叶留存时间有差异。
2.2 两种幼苗子叶的形态和生长动态
研究表明,两种异型种子萌生幼苗子叶出土时大小不同。其中,褐色种子萌生幼苗子叶出土时的长度为(0.69±0.08)cm,宽度为(0.27±0.03)cm;黑色种子萌生幼苗子叶出土时的长度为(0.31±0.03)cm,宽度为(0.17±0.02)cm;褐色种子萌生幼苗出土时的子叶长度是黑色种子萌生幼苗出土时子叶长度的2.23倍,宽度是黑色种子萌生幼苗的1.59倍。在整个子叶生长期,褐色种子萌生幼苗的子叶均大于黑色种子萌生幼苗子叶的长度和宽度。
研究表明,褐色种子萌生幼苗的子叶在4月11日长和宽达到最大值,其生长速率通过直线斜率即可看出,4月1~11日是整个子叶期子叶生长速率最快的一段时期,其后子叶长度慢慢蜷缩变短。黑色种子萌生幼苗在4月21日达到最大生长量(图1①),之后逐渐蜷缩脱落,从图中折线斜率可以看出,黑色种子萌生幼苗的子叶在达到最大生长量以后,其蜷缩退化速度比褐色种子萌生幼苗子叶的蜷缩退化速度快。图1
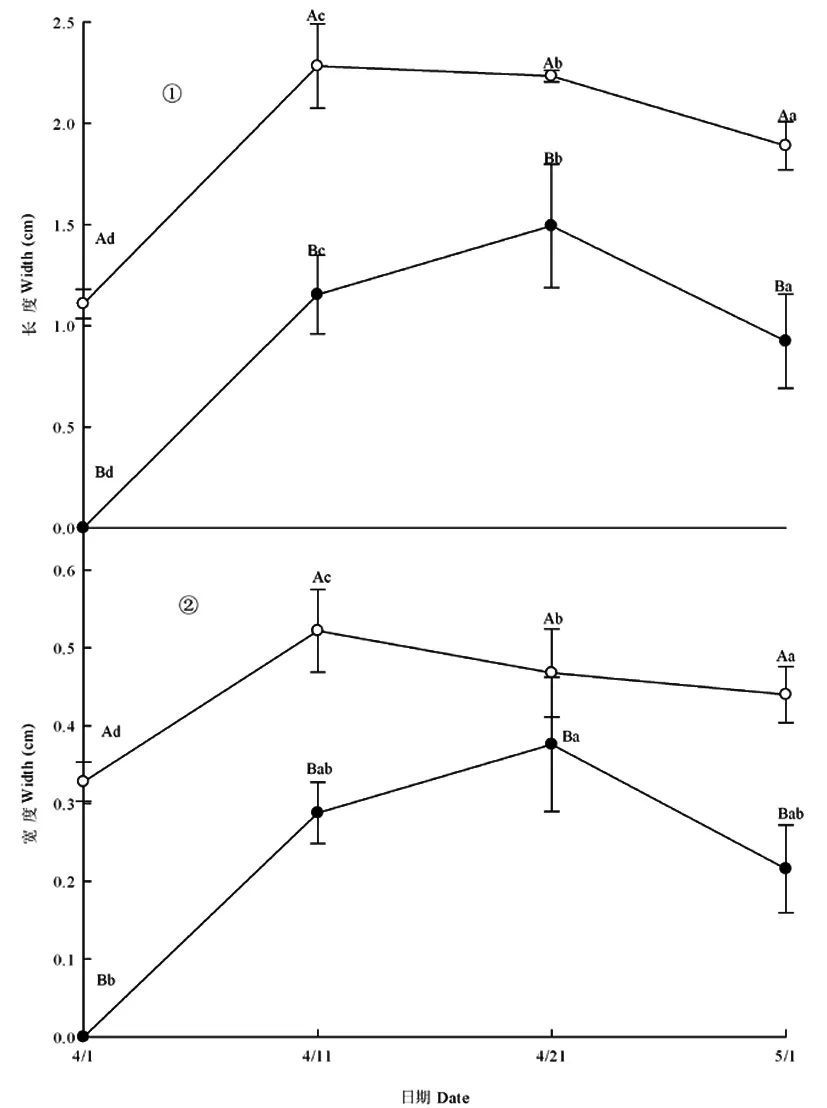
注:图中不同字母(a、b、c)表示同型幼苗不同时间的差异;(A、B)表示不同型幼苗在同一时间的差异(Duncan post-hoc 多重比较,P<0.05)。下同
Notes: Different case letters(a, b, c) each lines indicate significant differences in all stages; Different capital letters(A, B ) indicate significant differences between two lines at same stage (Duncan post-hoc test;P=0.05). The same as below
图1 黑色(●)、褐色(○)种子萌生幼苗的子叶长度(①)和宽度(②)
Fig. 1 The cotyledon length(a) and width(b)of seedlings grown from black seeds(●)and brown seeds(○)
2.3 两种异型种子萌生幼苗的生长动态和根冠比
两种异型种子幼苗的根长在整个测量期间都呈不断增长的趋势,褐色种子萌生幼苗的根在整个试验测量期间都比黑色种子萌生幼苗的根长(图2)。褐色种子萌生幼苗的地上生物量和地下生物量也大于黑色种子的萌生幼苗(图3①,3②)。褐色种子萌生幼苗的根冠比(干重)在4月21日前大于黑色种子萌生幼苗的根冠比(图4);但黑色种子萌生幼苗的根冠比(干重)自4月1日~5月1日始终呈上升趋势,褐色种子萌生幼苗的根冠比自4月1日~5月1日始终呈下降趋势;子叶脱落前最后一次测量的结果表明,黑色种子萌生幼苗的根冠比大于褐色种子萌生幼苗的根冠比。图2~4
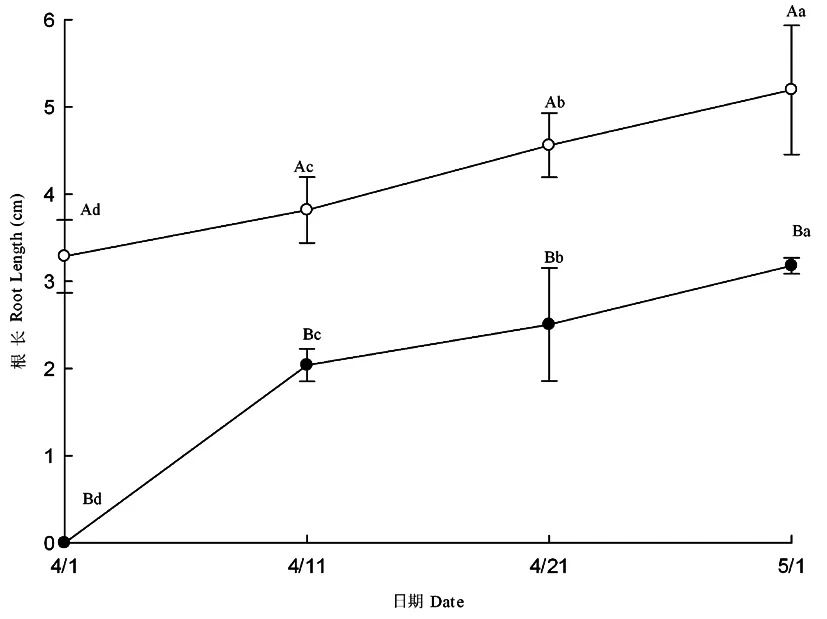
图2 黑色(●)、褐色(○)种子萌生幼苗的根长动态Fig. 2 The root length dynamic of seedlings grown from black seeds(●)and brown seeds(○)
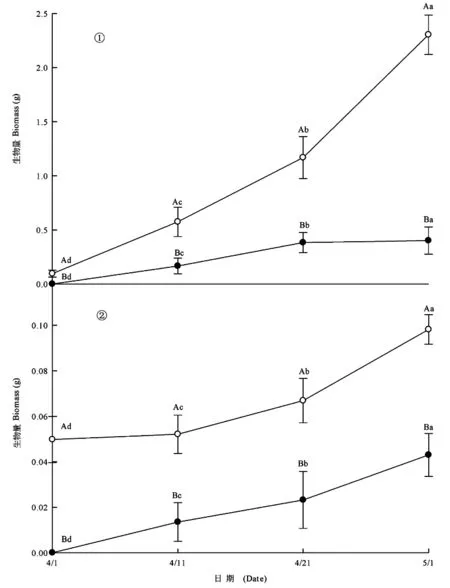
图3 黑色(●)、褐色(○)种子萌生幼苗的地上(①)、地下(②)生物量动态Fig. 3 The shoot(a) and root(b) biomass dynamic of seedlings grown from black seeds(●) and brown seeds(○)
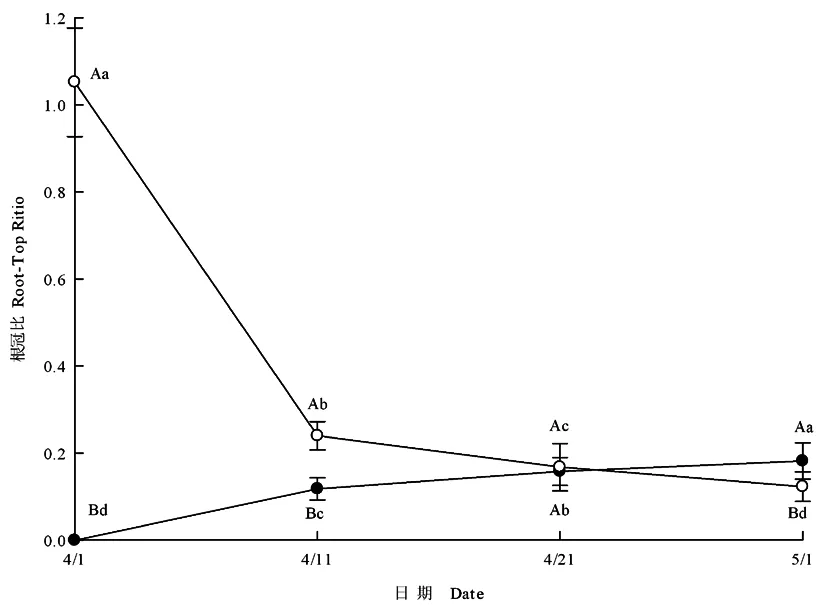
图4 黑色(●)、褐色(○)种子萌生幼苗的根冠比动态Fig. 4 The root-top ratio dynamic of seedlings grown from black seeds (●)and brown seeds(○)
3 讨 论
研究结果表明,异苞滨藜两种异型种子萌发物候不同步,褐色种子较黑色种子早萌发7 d。两种种子在初始萌发时间以及萌发持续时间上的差异验证了藜科植物在生活史对策方面采取了两头下注的策略[1,2,4],即黑色种子采取谨慎的萌发策略,体现其低风险对策[1];而褐色种子采取机会主义的萌发策略,体现其高风险对策[17,18]。在实验中褐色种子能够大量萌发,黑色种子始终未出现大量萌发的现象,这也印证了休眠种子是土壤种子库的主要贡献种[19]。相似的现象也出现在同属植物Atriplextriangulari[20]和A.sagittata[21]中。
具有异型种子的植物,个头大的种子会长出更大的幼苗[3,5,22],对不利环境具有较强的抵抗忍耐能力[23]。实验数据表明褐色种子大,萌发早,形成的幼苗子叶大;黑色种子小,萌发晚,形成的幼苗子叶小。子叶被认为是植物最早的叶子,子叶出土以后,在幼苗真叶出现前,是植物幼苗进行光合作用的唯一营养器官,既是植物幼苗的营养保存库,又是植物幼苗生长的营养源[24]。异苞滨藜两种异型种子萌生幼苗的子叶均为绿色,幼苗的子叶存留时间长,但两者子叶存留时间有差异,黑色种子幼苗子叶出土晚,脱落的早,真叶出现的早。褐色种子萌生幼苗子叶出土早,脱落的晚,真叶出现得晚,这些差异可能与异苞滨藜两种异型种子大小有关,因为黑色种子小,营养物质储存少,子叶、根、幼苗均较小,为了在恶劣的环境中成功生存,黑色种子萌生的幼苗为摆脱不利处境,尽早利用真叶进行光合作用,尽可能增加同化产物以促进幼苗的生长,这是荒漠植物两头下注策略对植物幼苗的直接影响,荒漠植物在荒漠异质环境中成功生存的重要生态适应机制。
根作为植物的重要生长器官,对植物有固着和支持、吸收疏导水分和矿物质、贮藏营养物质、合成和分泌激素等作用,对植物的生长有着不可替代的作用,在植物适应环境的过程中,其早期幼苗的生长状况能够直接决定其在生境中的成功定居[25]。两种异型种子萌生幼苗在整个测量期间,根的生长一直呈增长状态,褐色种子萌生幼苗的根长始终大于黑色种子萌生幼苗的根,这说明在同等的生活条件下,褐色种子萌生幼苗由于拥有较大的根系,在环境中能够更好的生存,为种群的更新提供保障。
植物地下部分和地上部分是植物生长过程中的重要器官,二者在功能以及所处环境上存在着巨大的差异,在荒漠半荒漠等干旱多变的生境中,植物必须依靠强大的根系来维持其生长发育;根冠比是植物光合作用产物分配的重要体现,植物根冠比的增长能够使植物增大对养分和水分的吸收量,使植物的抗旱能力增强,对植物适应不良环境具有重要的作用[25];实验中,褐色种子萌生幼苗在子叶长、子叶宽、根长、生物量积累方面都显著大于黑色种子萌生幼苗。但黑色种子萌生幼苗的根冠比一直呈增长状态,褐色种子萌生幼苗的根冠比在整个测量期间呈下降趋势,在5月1日子叶脱落前的最后一次测量中,黑色种子幼苗的根冠比高于褐色种子幼苗的根冠比。褐色种子萌生幼苗大,根冠比始终降低,说明褐色种子萌生幼苗在生物量分配方面更加倾向于地上部分,长出健壮的幼苗以抵抗荒漠环境中可能存在的各种不利条件,保证种群的更新。黑色种子小,萌发后幼苗、根均较小,黑色种子萌生幼苗在生物量分配方面更加倾向于地下部分,通过在早期的生长过程中将同化产物最大限度的输送到地下部分,通过增强根系尽可能增加其在恶劣环境中存活的机会,为幼苗的补充提供可能。
4 结 论
4.1 异苞滨藜两种异型种子的萌发策略不同,褐色种子3月27日萌发,集中萌发,萌发数量大,黑色种子4月3日萌发,延迟萌发,萌发数量少。两种异型种子萌发物候不同步,黑色种子较褐色种子晚萌发7 d,异型种子萌生幼苗的子叶留存时间有差异,褐色种子萌生幼苗子叶留存30 d,黑色种子萌生幼苗子叶留存39 d,褐色种子幼苗的子叶显著大于黑色种子幼苗的子叶。
4.2 异苞滨藜褐色种子萌生幼苗的根长、地上生物量、地下生物量在子叶期显著大于黑色种子萌生幼苗。
4.3 在子叶期,异苞滨藜两种异型种子萌生幼苗对同化资源的分配方式不同,褐色种子萌生幼苗主要将同化资源输送到地上部分,黑色种子萌生幼苗主要将同化资源输送到地下部分。
源于不同类型种子的幼苗在萌发物候、子叶存留时间、生长特性和根冠比指标参数方面表现出显著差异,这些差异是异苞滨藜长期适应荒漠异质环境而进化产生的,这种适应机制是异苞滨藜能够在荒漠异质环境中生存和繁衍的重要保障。
References)
[1] Venable, D. L. (1985). Ecology of achene dimorphism in heterotheca latifolia. iii. consequences of varied water availability.JournalofEcology, 73(3):757-763.
[2] Lloyd, D. G. (1984). Variation strategies of plants in heterogeneous environments.BiologicalJournaloftheLinneanSociety, 21(4):357-385.
[3] Venable, D. L., & Levin, D. A. (1985). Ecology of achene dimorphism in heterotheca latifolia. ii. demographic variation within populations.JournalofEcology, 73(3):743-755.
[4] Meyers, L. A., & Bull, J. J. (2002). Fighting change with change: adaptive variation in an uncertain world.TrendsinEcology&Evolution, 17(12):551-557.
[5] Mandák, B. (1997). Seed heteromorphism and the life cycle of plants: a literature review.Preslia. 69:129-159.
[6] Mandák, B., & Petr, P. (2001). Fruit dispersal and seed banks in atriplex sagittata: the role of heterocarpy.JournalofEcology, 89(2):159-165.
[7] Cheplick, G. P., & Quinn, J. A. (1982). Amphicarpum purshii, and the "pessimistic strategy" in amphicarpic annuals with subterranean fruit.Oecologia, 52(52):327-332.
[8] Koller, D., & Roth, N. (1964). Studies on the ecological and physiological significance of amphicarpy in gymnarrhena micrantha (compositae).AmericanJournalofBotany, 51(1):26-35.
[9] Mandák, B., & Petr, P. (2001). The effects of light quality, nitrate concentration and presence of bracteoles on germination of different fruit types in the heterocarpous atriplex sagittata.JournalofEcology,89(2):149-158.
[10] 毛祖美. 新疆植物志(第2卷 第一分册)[M]. 乌鲁木齐: 新疆科技卫生出版社, 1994:84-106.
MAO Zu-mei. (1994).FloraXinjiangensis.(Vol.2 )[M]. Urumqi: Xinjiang Science & Technology & Hygiene Publishing House:84-106. (in Chinese)
[11] 许鹏. 新疆草地资源及其利用[M]. 乌鲁木齐: 新疆科技卫生出版社,1993.
XU Peng. (1993).XinjiangGrasslandResourcesandItsUtilization[M]. Urumqi: Xinjiang Science & Technology & Hygiene Publishing House. (in Chinese)
[12] Imbert, E. (2002). Ecological consequences and ontogeny of seed heteromorphism.PerspectivesinPlantEcologyEvolution&Systematics, 5(1):13-36.
[13] 王雷, 董鸣, 黄振英,等. 种子异型性及其生态意义的研究进展[J]. 植物生态学报, 2010,34(5):578-590.
WANG Lei, DONG Ming, HUANG Zhen-ying, et al. (2010). Review of research on seed heteromorphism and its ecological significance [J].ChineseJournalofPlantEcology, 34(5):578-590. (in Chinese)
[14] Wei, Y., Dong, M., & Huang, Z. Y. (2007). Seed polymorphism, dormancy and germination of salsola affinis (chenopodiaceae), a dominant desert annual inhabiting the junggar basin of xinjiang, china.AustralianJournalofBotany, 55(4):464-470.
[15] 刘鹏伟, 魏岩. 准噶尔荒漠异苞滨藜的种子二型性及其萌发行为[J]. 生态学报, 2007,27(10):4 234-4 239.
LIU Peng-wei, WEI Yan. (2007). Seed dmiorphism and germination behavior of Atriplex micrantha, an annual inhabiting Junggar desert [J].ActaEcologicaSinica, 27(10):4,233-4,239. (in Chinese)
[16] Imbert, E. (2011). The effects of achene dimorphism on the dispersal in time and space in crepis sancta (asteraceae).CanadianJournalofBotany, 77(4):508-513.
[17] Wertis, B. A., & Ungar, I. A. (1986). Seed demography and seedling survival in a population of atriplex triangularis wild.AmericanMidlandNaturalist, 116(1):152-162.
[18] Venable, D. L., & Espinosa, F. (1987). The ecology of seed heteromorphism in heterosperma pinnatum in central méxico.Ecology, 68(1):65-76.
[19] Roberts, H. A., & Neilson, J. E. (1980). Seed survival and periodicity of seedling emergence in some species of atriplex, chenopodium, polygonum and rumex.AnnalsofAppliedBiology, 94(94):111-120.
[20] Ellison, A. M. (1987). Effect of seed dimorphism on the density-dependent dynamics of experimental populations of atriplex triangularis (chenopodiaceae).AmericanJournalofBotany, 74(8):1,280-1,288.
[21] Mandák, B., & Pysek, P. (2005). How does seed heteromorphism influence the life history stages of atriplex sagittata, (chenopodiaceae).Flora, 200(6):516-526.
[22] Imbert E, Escarre J, Lepart J. (1996). Achene dimorphism and among-population variation in Crepis sancta (Asteraceae) .InternationalJournalofPlantSciences. 157(3):309-315.
[23] 武高林, 杜国祯. 植物种子大小与幼苗生长策略研究进展[J]. 应用生态学报, 2008,19(1):191-197.
WU Gao-lin, DU Guo-zhen. (2008). Relationships between seed size and seedling growth strategy of herbaceous plant: A review [J].ChineseJournalofAppliedEcology, 19(1):191-197. (in Chinese)
[24] 张世挺, 杜国祯, 陈家宽, 等. 不同营养条件下24种高寒草甸菊科植物种子重量对幼苗生长的影响[J]. 生态学报, 2003,23(9): 1 737-1 744.
ZHANG Shi-ting, DU Guo-zhen, CHEN Jia-kuan, et al. (2003). Effects of seed weight on seedling growth under different nutrient conditions in twenty-four species of Compositae in an Alpine Meadow [J].ActaEcologicaSinica, 23(9):1,737-1,744. (in Chinese)
[25] 彭益全, 周峰, 万红建, 等. 碱蓬和三角叶滨藜幼苗生长光合特性对不同盐度的响应[J]. 草业学报,2012,21(6):64-74.
PENG Yi-Quan, ZHOU Feng, WAN Hong-jian, et al. (2012).Response of plant growth and photosynethetic characteristics in Suaeda glauca and Atriplex triangularis seedlings to different concentration of salt treatments [J].ActaPrataculturaeSinica, 21(6):64-74. (in Chinese)
Fund project:Supported by NSFC "The adaptive evolution of Junggar desert seed plants of Chenopodiaceae heteromorphyism"(31560113)
The Effects of Heterocarpic Seeds on Posterity Seedlings in Early Stage inAtriplexmicrantha
MA He1, WANG Xi-yong1,2, Maerziya Yeersibieke3, WEI Yan1
(1. College of Pratacultural and Environmental Sciences / Xinjiang Key Laboratory of Grassland ResourcesandEcology,XinjiangAgriculturalUniversity,Urumqi830052,China; 2.XinjiangEcologyandGeographyResearchInstitute,ChineseAcademyofSciences,Urumqi830011,China;3.GrasslandMasterStationofXinjiangUygurAutonomousRegion,Urumqi830049,China)
【Objective】 This study aims to explore the ecological adaptation mechanism of plants with seed heteromorphism.【Method】Using molecular markersPina-D1b,Pinb-D1b, andnon-Pinb-D1bof complemental gene to identify distribution .【Result】(1) The germination phenology of heterocarpic seeds was not synchronous. The heterocarpic seed germination had a long retention time, and there were differences in the cotyledon retention time of the seed germination and brown seed germination and black seed germination. The brown seeds ofA.micranthagerminated on March 27 th, cotyledon lasted 39 days, while black seeds germinated on April 3 rd, the cotyledon lastinged 30 days; (2) Compared with black seeds, seedlings grown from brown seeds had bigger size in cotyledon, seedling, root length and biomass of above and below ground. (3) The biomass distribution of above and below ground on the sprouting seedling of both seeds was different. The experiment dates showed that the root-top ratio of early seedlings grown from brown seeds decreased gradually, while the root-top ratio of seedlings grown from black seeds increased gradually.【Conclusion】Seedlings from the different types of seeds showed significant differences in germination phenology, cotyledon retention time, growth characteristics and parameters of root-top ratio indicators. These differences areAtriplexmicranthalong-term adaptation to heterogeneous environment and ecological evolution of desert adaptation mechanism. This is an important indemnification for the ecological adaptation mechanism ofAtriplexmicranthathat can survive and thrive in the desert in a heterogeneous environment.
Atriplexmicrantha; heterocarpic seeds; germination phenology; seedlings ; bet-hedging
10.6048/j.issn.1001-4330.2016.08.017
2016-04-05
国家自然科学基金项目“准噶尔荒漠藜科植物种子异型性的适应进化”(31560113)
马赫(1987-),男,新疆人,硕士研究生,研究方向为草地植物繁殖生态,(E-mail)253992102@qq.com
魏岩(1966-),女,河南人,教授,博士生导师,研究方向为荒漠植物生活史特征及生态适应,(E-mail)weiyan1966@163.com
S54
A
1001-4330(2016)08-1487-07

