养心氏对巨噬细胞极化及活化的调节
侯 亮,路英进,丁彦春
·基础医学论著/研究·
养心氏对巨噬细胞极化及活化的调节
侯 亮1,路英进1,丁彦春2
目的 以人单核细胞株THP-1细胞为基础,观察养心氏对THP-1源性巨噬细胞极化和活化的影响,为养心氏抗动脉粥样硬化机制提供理论依据。方法 分别以不同浓度(10 mg/L,25 mg/L和50 mg/L)的氧化型低密度脂蛋白(ox-LDL)刺激THP-1源性巨噬细胞24 h,以空白为对照组,用ELISA法测定上清液中的单核细胞趋化蛋白-1(MCP-1)和巨噬细胞移动抑制因子(MIF)的浓度,用流式细胞术检测巨噬细胞表面CD16及CD68的表达。用不同浓度的养心氏(10 mg/L,50 mg/L和100 mg/L)预处理THP-1源性巨噬细胞12 h,再用50 mg/L的 ox-LDL刺激THP-1源性巨噬细胞24 h,检测上清液中MIF、MCP-1的浓度以及CD16及CD68的表达情况。结果 ox-LDL能以剂量依赖的方式诱导THP-1源性巨噬细胞分泌MCP-1和MIF,其中50 mg/L 组表达最高,MCP-1(29.30±1.48)pg/mL,对照组为(5.71±1.94) pg/mL;MIF(18.67±0.15) ng/mL,对照组为 (4.61±0.40) ng/mL(P<0.01)。ox-LDL能改变巨噬细胞表面抗原CD16、CD68的表达,50 mg/L组能显著下调CD16、CD68的表达(CD16:26.9 vs对照组29.8;CD68:22.3 vs对照组25.2)。养心氏能够以剂量依赖的方式抑制ox-LDL所致的THP-1源性巨噬细胞分泌MCP-1和MIF,随着养心氏刺激浓度的增加,MCP-1和MIF的分泌减少。结论 养心氏可能通过抑制巨噬细胞炎性活化,抑制巨噬细胞向促炎表型转化进而抑制动脉粥样硬化的形成和发展。
动脉粥样硬化;巨噬细胞极化;养心氏;单核细胞趋化蛋白-1;巨噬细胞移动抑制因子
单核-巨噬细胞在动脉粥样硬化(AS)的形成和发展中具有重要意义。在动脉粥样斑块中聚集着大量的单核-巨噬细胞,巨噬细胞可分泌多种炎症因子,如单核细胞趋化蛋白-1(MCP-1)和巨噬细胞移动抑制因子(MIF),促进炎症发生。此外活化的巨噬细胞还可以表达MCH Ⅱ类分子与T细胞结合使其活化,分泌各种炎性因子,如肿瘤坏死因子-α(TNF-α)、干扰素-γ(INF-γ)等共同促进炎症反应[1]。巨噬细胞是一种异质性很强的细胞群,按照功能可分成不同的亚型。人们按照Th1和Th2细胞的划分方法,将巨噬细胞划分为经典活化型M1型和替代活化型M2型,其中M1型巨噬细胞可被IFN-γ、TNF-α、内毒素(LPS)活化,分泌IL-1、IL-12等炎性细胞因子,促进一氧化氮等活性氧合成,参与抗原呈递及炎症反应,具有很强的组织侵袭力和分解力,促进斑块进展和破裂。M2型巨噬细胞在AS病变进展中却起到与M1相反的作用,分泌IL-10、转化生长因子-β(TGF-β)等抗炎因子,并表达清道夫受体、甘露糖受体,促进创伤愈合、斑块稳定、抵御寄生虫感染,具有抗炎作用。巨噬细胞亚型与AS之间的关系日渐成为研究的热点[2]。促炎型巨噬细胞和抗炎型巨噬细胞共同参与AS的发展,如何影响巨噬细胞亚型的改变,使巨噬细胞向抗炎型极化或抑制促炎型巨噬细胞的生成,成为AS防治的一个新方向。
养心氏片(上海医药集团青岛国风药业股份有限公司,国药准字号2370211027)是中药复方制剂,由人参、灵芝、黄芪、淫羊藿、丹参、当归、葛根和山楂等中药组成,有效成分是葛根总黄酮、丹参酮、淫羊藿总黄酮、人参皂苷、黄芪皂苷、阿魏酸和灵芝多糖等,具有抗炎、抗血小板聚集、调脂和改善循环等多种效应,能从多靶点干扰AS进程,发挥治疗冠心病的效能,但具体的机制尚不完全清楚。利用ox-LDL刺激THP-1源性巨噬细胞,并加入不同浓度养心氏干预,研究养心氏对巨噬细胞分泌炎性因子及巨噬细胞表型改变可能产生的影响,探讨养心氏在抗AS作用中的机制。
1 材料与方法
1.1 实验材料 人单核细胞系THP-1购自中科院上海细胞库,ox-LDL购自北京欣源佳和生物科技有限公司,人MIF ELISA试剂盒购自上海细胞生物公司,人MCP-1 ELISA试剂盒购自达科为生物技术有限公司,流式细胞抗体CD16-FITC、CD68-FITC、IgG2a-FITC购自BD公司,其他试剂为国产或进口分析纯。
1.2 细胞培养及THP-1细胞的诱导分化 THP-1单核细胞培养于含10%胎牛血清的RPMI1640培养液中,于37℃、5%CO2条件下培养。倒置显微镜下可见细胞呈单个、圆形、悬浮生长。每2 d~3 d按1∶2~1∶3传代一次。选取3~4代以后细胞,以1×106/mL细胞密度接种于6孔板,以160 nmol/L PMA诱导24 h后,细胞贴壁,变成不规则形或梭形,伸出伪足,诱导形成巨噬细胞。
1.3 养心氏的制备 用RPMI1640培养液溶解养心氏,配制为1.0 g/L的原液。37℃水浴30 min,充分振荡30 min,超声溶解1 min,1 000 r/min离心10 min,取上清液过滤灭菌,用于细胞培养。预实验中应用MTT法检验养心氏对THP-1源性巨噬细胞的毒性作用,分别以养心氏终浓度500 mg/L、400 mg/L、200 mg/L、100 mg/L、50 mg/L和10 mg/L刺激THP-1源性巨噬细胞24 h,并重复3次,所有浓度养心氏对细胞均无毒性作用。结合预实验结果及临床实际情况,本研究中养心氏预处理的终浓度确定为10 mg/L、50 mg/L和100 mg/L。
1.4 实验分组及处理 依照实验处理因素,以不同浓度ox-LDL(10 mg/L、25 mg/L和50 mg/L)分别刺激THP-1源性巨噬细胞24 h,以空白为对照组。以不同浓度养心氏(10 mg/L、50 mg/L和100 mg/L)预处理THP-1源性巨噬细胞12 h,以空白为对照组,再用ox-LDL(50 mg/L)刺激THP-1源性巨噬细胞24 h。
1.5 ELISA法检测细胞培养物上清液中细胞因子MIF、MCP-1的浓度 收集培养物的上清液,储存在-80℃冰箱。按照ELISA试剂盒说明书方法,将试剂盒提供的原倍标准品在 EP 管中加入标准品稀释液倍比稀释,分别设空白孔、标准品孔、待测样品孔。在标准孔中加标准品100 μL,待测样品100 μL,37℃温箱孵育90 min,洗板5次,除空白孔外加入生物素化抗体工作液,封板胶封孔,37℃温箱孵育60 min,洗板5次,除空白孔外,加入酶结合物工作液,封板胶封孔,37℃温箱避光孵育30 min。洗板5次,加入显色液,37℃温箱避光孵育15 min,迅速加入终止液,混匀后即刻在450 nm波长下读值,测定MIF、MCP-1的浓度。
1.6 细胞流式学检测THP-1源性巨噬细胞表面抗原CD16、CD68表达 采用流式细胞仪(FACSCaLibar,美国BD公司)测定细胞表面抗原CD16、CD68的表达水平。在流式专用试管中分别加入20 μL 荧光素标记的CD16、CD68单克隆抗体(美国BD公司),100 μL细胞悬液振荡混匀,室温避光15 min孵育,震荡混匀,室温避光孵育10 min,2 500 r/min离心3 min,弃上清,加入PBS 0.5 mL混匀,重悬细胞上机检测。以荧光素标记的IgG2a-FITC作为同型对照。用CeLQuest软件分析结果,以荧光阳性的细胞的平均荧光强度来表示。

2 结 果
2.1 ox-LDL对THP-1源性巨噬细胞培养物上清液中炎症因子表达的影响ox-LDL能以剂量依赖的方式诱导巨噬细胞表达MCP-1和MIF。随着ox-LDL刺激浓度的增加,MCP-1和MIF的分泌增加,其中50 mg/L组ox-LDL表达最高。详见表1。

表1 不同浓度ox-LDL刺激THP-1源性巨噬细胞表达MCP-1和MIF结果(±s)
2.2 养心氏对巨噬细胞活化的抑制 以不同浓度养心氏溶液预处理THP-1源性巨噬细胞12 h,以空白为对照组,加入50 mg/L ox-LDL刺激24 h,利用ELISA法检测细胞上清液MIF、MCP-1的浓度,结果发现养心氏能以浓度依赖的方式抑制ox-LDL诱导的THP-1源性巨噬细胞分泌MIF和MCP-1,其中100 mg/L组最显著。详见表2。

表2 不同浓度养心氏对ox-LDL诱导的THP-1源性巨噬细胞分泌MCP-1及MIF的影响(±s)
2.3 ox-LDL对THP-1源性巨噬细胞表面抗原CD16和CD68的影响 不同浓度ox-LDL刺激THP-1源性巨噬细胞24 h,以利用流式细胞术测定CD16和CD68的表达,结果发现随着oxLDL刺激浓度的增加,巨噬细胞表面抗原CD16和CD68的表达改变,与对照组相比,50 mg/L组能显著下调CD16、CD68的表达(见图1、表3)。
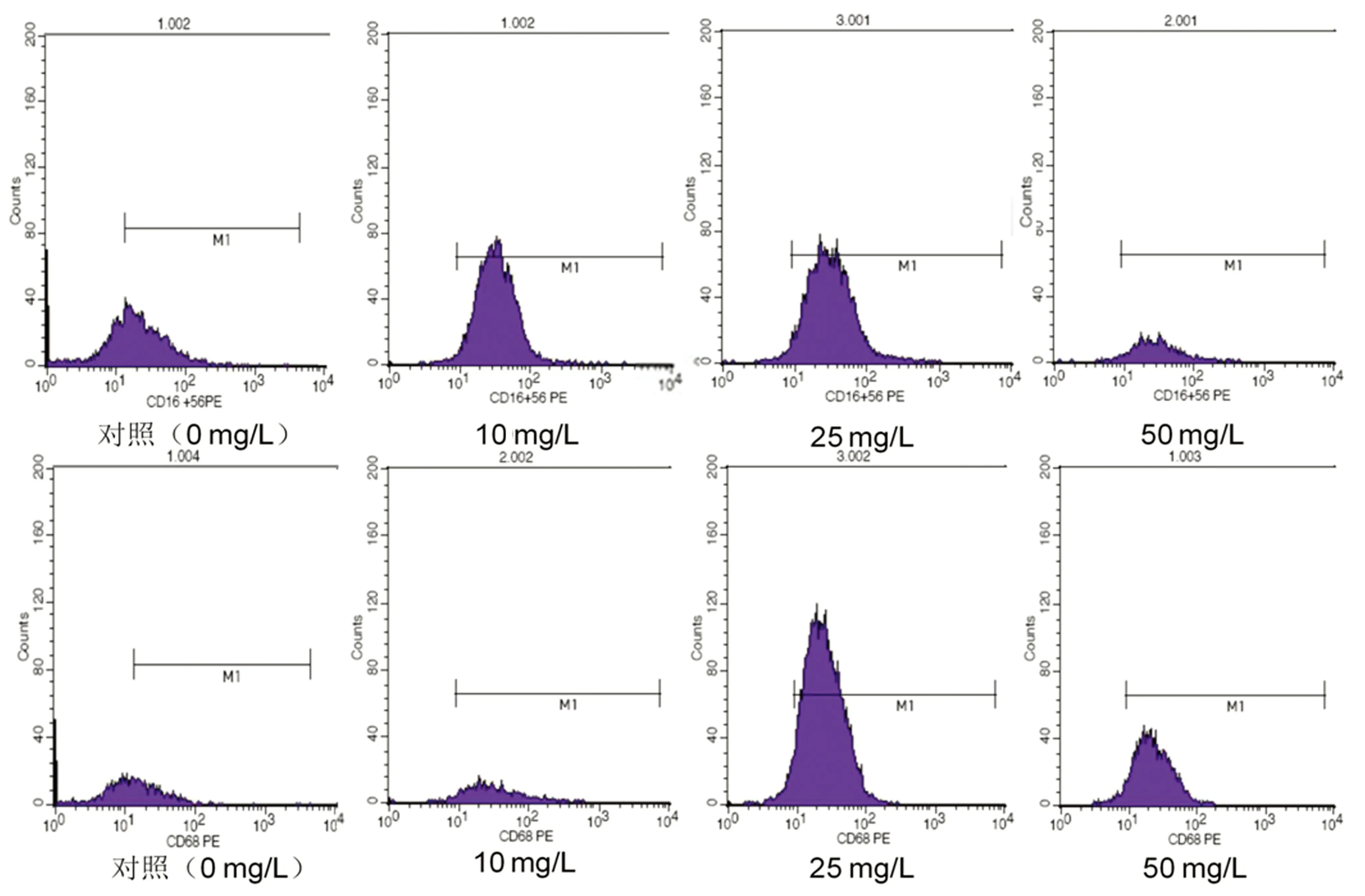
图1 不同浓度ox-LDL刺激THP-1源性巨噬细胞表面抗原CD16和CD68的FACS检测

组别CD16CD68对照组(0mg/L)25.2±0.629.8±0.410mg/L组28.3±1.630.9±0.725mg/L组23.7±0.71)29.9±1.750mg/L组 21.3±0.62)3)4) 26.9±0.92)3)4) 与对照组比,1)P<0.05,2)P<0.01;与10mg/L组比,3)P<0.01;与25mg/L组比,4)P<0.01。
2.4 养心氏对ox-LDL激活的THP-1源性巨噬细胞表面抗原CD16和CD68的影响 养心氏能够以剂量依赖的方式改变巨噬细胞表面抗原CD68、CD16的表达,随着养心氏刺激浓度的增加,CD16和CD68的表达上调,100 mg/L组表达最高(见图2、表4)。
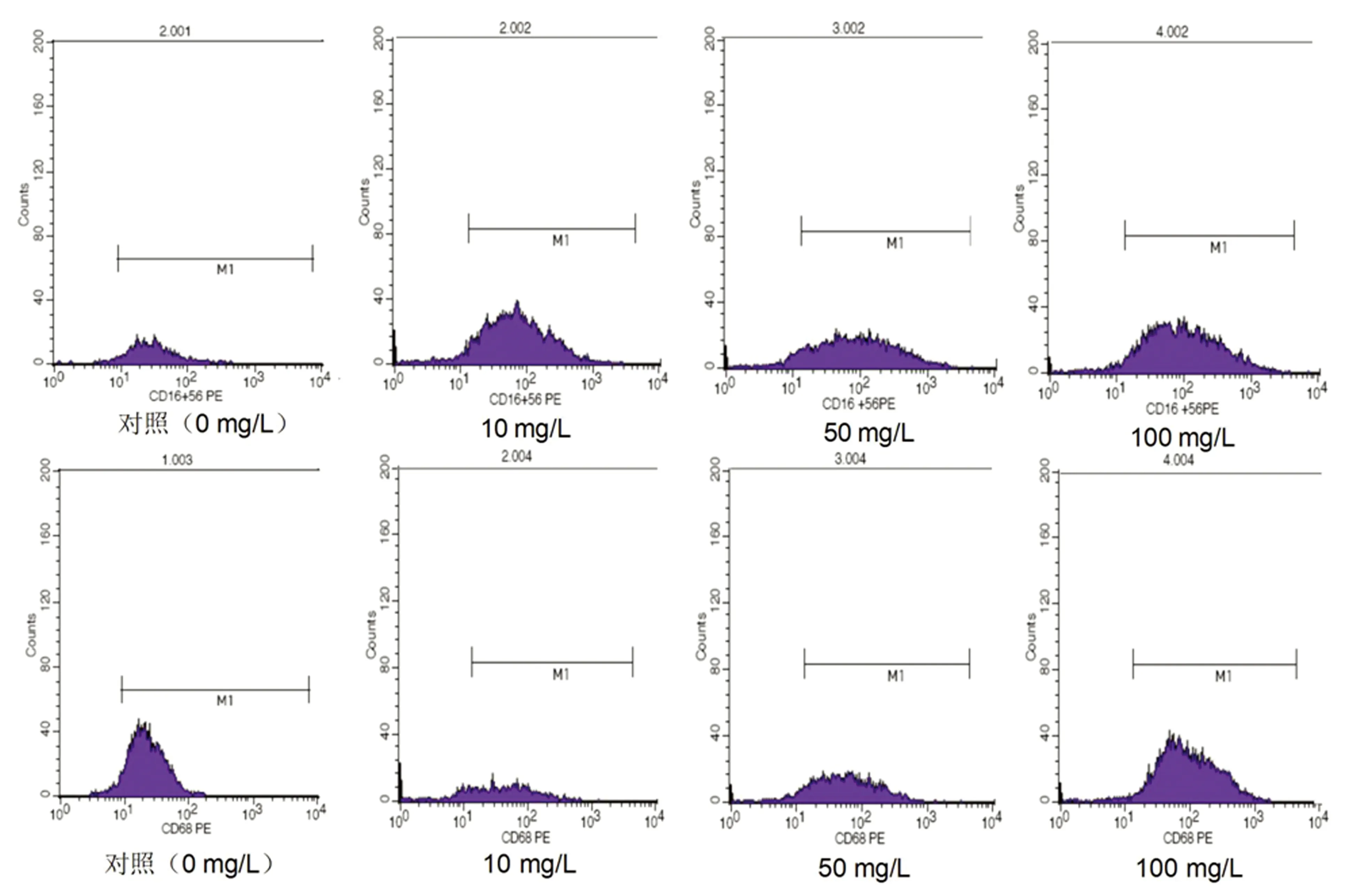
图2 不同浓度养心氏刺激THP-1源性巨噬细胞表面抗原CD16和CD68的FACS检测
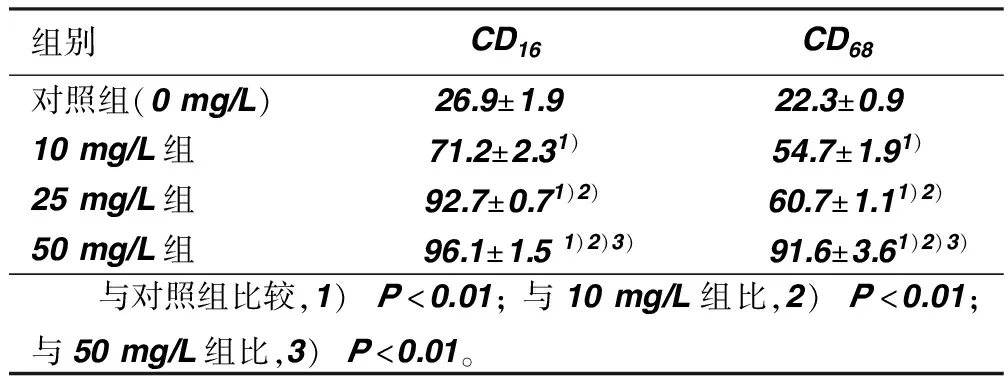
组别CD16CD68对照组(0mg/L)26.9±1.9 22.3±0.910mg/L组71.2±2.31)54.7±1.91)25mg/L组92.7±0.71)2)60.7±1.11)2)50mg/L组 96.1±1.51)2)3) 91.6±3.61)2)3) 与对照组比较,1)P<0.01;与10mg/L组比,2)P<0.01;与50mg/L组比,3)P<0.01。
3 讨 论
关于免疫细胞在AS炎症反应中异常改变的研究日渐成为热点,特别是单核-巨噬细胞,具有很强的可塑性及异质性,作为炎症细胞和免疫细胞,被认为是参与AS形成过程中的关键,它们能够分泌促炎因子和其他炎症介质影响斑块损伤形成和斑块的稳定性[3]。ox-LDL作为一种强致AS的损伤相关的分子模式,可以介导巨噬细胞的激活、分泌、增殖,有研究表明ox-LDL能够刺激巨噬细胞MIFmRNA的表达增加[4],研究发现ox-LDL可以以浓度依赖的方式增加MCP-1和MIF的分泌,但是经养心氏提前处理巨噬细胞后,ox-LDL诱导的MCP-1和MIF的分泌被抑制,提示养心氏可以在泡沫细胞形成的过程中抑制巨噬细胞炎症因子的分泌,从而抑制巨噬细胞炎性活化。
养心氏作为一种复方中药制剂,能从多靶点干扰AS进程,发挥治疗冠心病的效能,但具体的机制尚不完全清楚。有研究表明养心氏可以显著降低血中内皮素的水平,而内皮素可以提高单核细胞的趋化性以及参与低密度脂蛋白的氧化修饰[5]。本研究中发现随着养心氏刺激浓度的增加,MCP-1和MIF的分泌减少。MCP-1是由内皮细胞和平滑肌细胞合成的一种趋化蛋白,是内膜单核/巨噬细胞募集到受损部位的主要因素[6]。MIF是来源于淋巴细胞和单核细胞/巨噬细胞的一种蛋白质,可抑制单核细胞、巨噬细胞游走移动,使其聚集在炎症部位,促进细胞增殖和分泌细胞因子,加剧炎症反应,MIF还能刺激细胞基质金属蛋白表达和一氧化氮的释放,细胞基质金属蛋白能降解细胞基质,使斑块失去稳定性,最后导致破裂[7]。这些都提示养心氏可以抑制巨噬细胞的炎症因子的分泌,从而发挥抗AS的作用。
M1 型和M2 型巨噬细胞以动态的比例存在于AS的斑块中,已经分化的巨噬细胞仍可以相互转化。本研究选择巨噬细胞表面抗原CD16、CD68作为巨噬细胞亚型的表面标记。Bouhle等[8]在动脉斑块中发现CD68+细胞群能够表达甘露糖受体,而甘露糖受体是M2巨噬细胞的表面标志。CD16主要表达于单核细胞,通常认为M1型巨噬细胞表达CD16[9-10],但TGF-β也能诱导血液中单核细胞表达CD16[11],而TGF-β是一种能够被M2型巨噬细胞分泌的抗炎因子[12]。本研究发现高浓度的ox-LDL可以使巨噬细胞表面抗原CD16,CD68表达下降,但经养心氏处理后,巨噬细胞表面抗原CD16,CD68表达升高,提示ox-LDL可以刺激巨噬细胞向M1型转化,而养心氏可以抑制这种转变并促使巨噬细胞向M2型转化,从而发挥抗炎作用。养心氏可以抑制巨噬细胞的炎性活化及抑制巨噬细胞向促炎型转化,这可能是其抗AS的主要机制。
养心氏可以抑制巨噬细胞的炎性活化及抑制巨噬细胞向促炎型转化,这可能是其抗AS的主要机制。尽管养心氏对机体的作用机制仍需进一步明确,但本研究为其抗AS的作用提供了实验依据,为其更广泛的临床应用提供了理论基础。
[1] Ilhan F,Kalkanli ST.Atherosclerosis and the role of immune cells [J].World Journal of Clinical Cases, 2015, 3(4): 345-352.
[2] De Paoli F,Staels B, Chinetti-Gbaguidi G.Macrophage phenotypes and their modulation in atherosclerosis [J].Circulation Journal, 2014, 78(8): 1775-1781.
[3] Yan ZQ, Hansson GK.Innate immunity, macrophage activation, and atherosclerosis [J].Immunological Reviews, 2007, 219:187-203.
[4] Atsumi T,Nishihira J, Makita Z, et al.Enhancement of oxidised low-density lipoprotein uptake by macrophages in response to macrophage migration inhibitory factor [J].Cytokine, 2000, 12(10): 1553-1556.
[5] 严冬,钱玉良,唐蜀华.养心氏对气虚血瘀型冠心病心绞痛患者ET、NO、CRP的影响[J].中西医结合心脑血管病杂志,2011,9(6):656-658.
[6] Lin J,Kakkar V, Lu X.Impact of MCP-1 in atherosclerosis [J].Current Pharmaceutical Design, 2014, 20(28): 4580-4588.
[7] Muller II, Muller KA, Schonleber H, et al.Macrophage migration inhibitory factor is enhanced in acute coronary syndromes and is associated with the inflammatory response [J].PloS One, 2012, 7(6): e38376.
[8] Bouhlel MA,Derudas B, Rigamonti E, et al.PPAR gamma activation primes human monocytes into alternative M2 macrophages with anti-inflammatory properties [J].Cell Metabolism, 2007, 6(2): 137-143.
[9] Sica A,Schioppa T, Mantovani A, et al.Tumour-associated macrophages are a distinct M2 polarised population promoting tumour progression: potential targets of anti-cancer therapy [J].European Journal of Cancer (Oxford, England: 1990), 2006, 42(6):717-727.
[10] Wahl SM,Allen JB, Welch GR, et al.Transforming growth factor-beta in synovial fluids modulates Fc gamma RII (CD16) expression on mononuclear phagocytes [J].Journal of Immunology,1992,148(2):485-490.
[11] Iwahashi M,Yamamura M, Aita T, et al.Expression of toll-like receptor 2 on CD16+ blood monocytes and synovial tissue macrophages in rheumatoid arthritis [J].Arthritis and Rheumatism, 2004,50(5):1457-1467.
[12] Hakkinen T,Karkola K, Yla-Herttuala S.Macrophages, smooth muscle cells, endothelial cells, and T-cells express CD40 and CD40L in fatty streaks and more advanced human atherosclerotic lesions.Colocalization with epitopes of oxidized low-density lipoprotein, scavenger receptor, and CD16(Fc gammaRⅢ) [J].Virchows Archiv: an International Journal of Pathology, 2000, 437(4): 396-405.
(本文编辑王雅洁)
Regulation of Yangxinshi Tablets in the Macrophage Polarization and Activation
Liang Hou,Lu Yingjin,Ding Yanchun
Dalian Medical University, Dalian 116044,Liaoning,China
Ding Yanchun(The Second Affiliated Hospital of Dalian Medical University, Dalian,Liaoning,China)
Objective To explore the anti-atherosclerotic mechanism of Yangxinshi tablets(YXST), we stimulated THP-1 derived macrophages with YXST and observed its effects on macrophage polarity switch and activation.Methods Human monocytic cell line THP-1 were differentiated into macrophages by stimulated with 160 nmol/L phorbol 12-myristate 13-acetate (PMA) for 24 h.Then THP-1 derived macrophages were stimulated by different concentrations of oxidized low-density lipoprotein (ox-LDL) for 24 h, which were 10mg/L, 25mg/L and 50mg/L, and blank was used as control.The secretion of monocyte chemotactic protein 1 (MCP-1) and macrophage migration inhibition factor (MIF) were detected by ELISA, and the membrane molecule CD16 and CD68 were tested by flow cytometry.THP-1 derived macrophages were pretreated with different concentrations of YXST (10 mg/L, 50 mg/L and 100 mg/L)12 h.Then we stimulated these cells by ox-LDL (50 mg/L) for 24 h and detected the secretion of MIF, MCP-1 and the expression of CD16 and CD68 again.Results The ox-LDL up-regulatet the secretion of MCP-1 and MIF as a dose-dependent manner in THP-1 derived macrophages.With the increasing concentration of ox-LDL, the secretion of MCP-1 and MIF increased, 50mg/L group reached their secretion peaks after 24h(MCP-1:29.30±1.48 pg/mL vs.control 5.71±1.94 pg/mL;MIF:18.67±0.15 ng/mL vs.control 4.61±0.40 ng/mL;P<0.01).The expression of CD16 and CD68 were varied with different ox-LDL concentrations.The mean fluorescence intensity of CD16 and CD68 was significantly reduced in 50mg/L group (CD16:26.9 vs.control 29.8;CD68:22.3 vs.control 25.2).YXST inhibited the expression of MCP-1 and MIF induced by ox-LDL as a dose-dependent manner.With the increasing concentration of Yangxinshi, the secretion of MCP-1 and MIF decreased.The 100mg / L group declined mostly(MCP-1:9.95±2.09 pg/mL vs.control 33.30±2.37 pg/mL;MIF:4.85±0.12 ng/mL vs.control 18.65±0.15 ng/mL;P<0.01).Yangxinshi change the expression of CD16 and CD68 reduced by ox-LDL as a dose-dependent manner, the mean fluorescence intensity of CD16 and CD68 was significantly up-regulated in 100 mg/L group (CD16:96 vs.control 26.9;CD68:91.6 vs.control 22.3).Conclusion YXST may execute its anti-atherosclerotic effect by inhibiting macrophage inflammatory activation and affecting macrophage polarity switch.
atherosclerosis;macrophage polarization;Yangxinshi tablets;monocyte chemotactic protein-1;macrophage migration inhibition factor
1.大连医科大学2013级研究生(辽宁大连 116044);2.大连医科大学附属第二医院
丁彦春,E-mail:yanchunding@aliyun.com
R541 R289.5
A
10.3969/j.issn.1672-1349.2016.15.008
1672-1349(2016)15-1722-05
2015-09-07)

