单唾液酸神经节苷脂对急性低压氧脑水肿后MMP9表达的影响
李虎 刘洪 王百忍 巩固
(1成都军区总医院麻醉科,四川 成都 610083; 2川北医学院麻醉科,四川 南充 637000; 3第四军医大学全军神经科学研究所,陕西 西安 710032)
·论著·
单唾液酸神经节苷脂对急性低压氧脑水肿后MMP9表达的影响
李虎1,2刘洪1,2王百忍3巩固1*
(1成都军区总医院麻醉科,四川 成都 610083;2川北医学院麻醉科,四川 南充 637000;3第四军医大学全军神经科学研究所,陕西 西安 710032)
目的观察单唾液酸四己糖神经节苷脂(GM1)对急性低压氧后基质金属蛋白酶9(MMP9)表达的影响,探讨MMP9在GM1预防低压氧脑水肿中可能的机制。方法24只雄性C57BL/6小鼠随机分成4组(n=6):分别为对照(control)组、急性低压氧(HH)组、GM1治疗(GM1+HH)组、单纯给药( GM1)组。control组:置于低压氧舱外的常氧舱内;HH组:置于6 000 m海拔模拟舱内24 h;HH+GM1组:连续腹腔注射GM1 3 d(30 mg/kg),最后一次给药后30 min行急性低压氧处理,方法同HH组;GM1组:前期GM1处理同HH+GM1组,后期同control组处理。小鼠在急性低压氧处理24 h后应用免疫荧光和Western blot检测MMP9蛋白表达水平,通过湿重比和伊文思蓝定量评价脑水肿程度。结果GM1降低急性低压氧24 h后血脑屏障损伤,减少湿重比(Plt;0.05)和伊文思蓝渗出量(Plt;0.05),并抑制MMP9表达上调(Plt;0.05),减弱星形胶质细胞MMP9荧光强度。结论GM1抑制MMP9表达上调,可能参与其预防急性低压氧脑水肿的机制中。
单唾液酸神经节苷脂; 基质金属蛋白酶9; 急性低压氧
高原脑水肿(high altitude cerebral edema, HACE)是机体近期抵达高原后,在低压氧环境下迅速出现的一种特殊的急性重症高原病[1]。目前多数学者认为HACE主要是血管源性脑水肿,其发生、发展及预后与血脑屏障通透性迅速变化密切相关[2]。基质金属蛋白酶(matrix metalloproteinases, MMPs)是一类能降解细胞外基质成分的蛋白水解酶,MMP9是其中的主要成员。低氧应急环境下,MMP9通过降解细胞外基质引发血脑屏障通透性增加,在脑水肿发展过程中扮演着重要角色[3,4]。
外源性神经节苷脂神作为临床一线药现广泛应用于神经退行性病变、中枢神经系统损伤中。可自由穿过血脑屏障(blood brain barrier, BBB),整合于神经细胞膜上,通过增强神经营养因子作用,维持线粒体结构稳定、减少自由基、降低兴奋性氨基酸毒性等作用参与神经保护[5]。前期研究证实单唾液酸神经节苷脂(monosialotetrahexosylganglioside, GM1)在多种神经损伤模型中通过抑制MMP9表达,维持血脑屏障完整性性来减轻脑水肿[6]。但是GM1能否通过抑制MMP9上调,减轻低压氧脑水肿还不清楚。
因此,本研究拟探讨GM1预防用药对急性低压氧脑损伤后MMP9表达变化,从而探索MMP9在GM1预防低压氧脑水肿中的潜在作用。
材料与方法
一、动物实验
1.时间点选择实验:健康成年雄性C57BL/6小鼠24只,质量22~25 g,第四军医大学实验动物中心提供。按随机数字表法分为四组(n=6),分别为对照组、低压低频6 h组、低压低氧12 h组、低压低氧24 h组,对照组置于低压氧舱外常氧舱中,并于24 h后断头取脑。低压低氧6 h组、低压低氧12 h组、低压低氧72 h组分别置于低压氧舱中处理6 h、12 h、24 h后断头取脑后,通过Western blot检测MMP9蛋白表达。实验结果示低压低氧24 h组MMP9表达量明显增加(图1),故取此时间点进行下步实验。
2.GM1预防急性低压氧脑水肿效果评价:健康成年雄性C57BL/6小鼠24只,质量22~25 g,第四军医大学实验动物中心提供,按随机数字表法分为四组(n=6),分别为对照组、急性低压氧组、神经节苷脂治疗组、单纯给药组。通过伊文思蓝定量和湿重比评价BBB通透性,通过Western blot和免疫荧光检测MMP9表达。
二、急性低压氧模型建立
C57BL/6小鼠置于密闭低压氧舱(风雷,中国)后以50 m/s上升速度在5 min内达到模拟6 000 m海拔(350 mmHg,6%~7% O2);低压氧舱内湿度维持在40%~50%,温度控制在22~24℃;小鼠在低压氧舱中自由饮水、摄食,光暗周期控制在24 h。
三、主要试剂
GM1(TRB公司, 阿根廷)兔抗小鼠MMP9(Abcam公司, 美国),兔抗小鼠β-Tubulin(康为试剂, 中国),山羊抗兔辣根过氧化物酶二抗(科昊生物, 中国),山羊抗小鼠星形胶质细胞抗体(glial fibrillary acidic protein, GFAP)(Santa公司, 美国),兔抗山羊、小鼠抗兔荧光二抗(Millipore公司, 美国),伊文思蓝染料(恒远, 中国),BCA法蛋白浓度检测试剂盒(碧云天, 中国)。
四、观察指标和检测方法
1.蛋白检测:使用Western blot方法检测脑组织MMP9蛋白含量。小鼠急性低压氧24 h后4%水合氯醛麻醉后端头取脑,脑组织称重后置于裂解液中溶解30 min,4℃ 16 000 r/min离心5 min,提取上清后定量,加入蛋白上样缓冲液95℃进行变性。相同蛋白量(30 μg/孔)加入10%聚丙烯酰氨凝胶电泳胶中电泳后转膜,5%牛奶室温封闭1 h后加入MMP9(1 ∶1 000),β-Tubulin(1 ∶1 500)一抗,4℃摇床过夜。洗涤10 min×3次,然后加入山羊抗兔二抗(1 ∶10 000),室温孵育2 h。再次洗涤10 min×3次,每条带加入200 μl显影液进行发光,Image J软件灰度值测定,以β-Tubulin为内参,计算MMP9条带与其的灰度值比值。
2.免疫荧光检测:急性低压氧处理24 h后立刻深度麻醉,暴露心脏,自心尖部插入灌注针至升主动脉,剪开右心耳,快速推入20 ml生理盐水,冲洗干净血液后,换入100 ml含4%多聚甲醛的磷酸缓冲液(phosphate buffered saline, PBS)进行快速固定,然后慢滴250 ml上述相同液体,灌毕后立即断头取脑,标本放入含20%、30%蔗糖的PBS液内梯度脱水,进行冰冻切片。自视交叉每隔5张切片取一张切片,厚度为10 μm,贴于明胶处理过的载玻片上。冰冻切片复温并晾干,画圈笔标记, 1% Triton X-100的PBS洗片,5 min×3次,甩干,每片加入20 μl MMP9及GFAP抗体的混合抗体,4℃孵育24 h后,PBS 5 min×3次,加入荧光二抗,室温孵育2 h,甘油封片,荧光显微镜下观察(Olympus,日本)。
3.脑组织含水量检测:采用脱颈椎法处死小鼠后,小心游离、取出整个大脑,去除小脑及脑干。用滤纸小心擦拭脑组织表面血迹后,在精密电子天平上迅速称量并记录组织块湿重。然后在 70℃干燥箱中烘烤,72 h后称量干重,达恒重后(两次称量干重误差小于0.002 g)记录组织块干重。按Elliot公式计算脑组织含水百分比。 Elliot 公式:WC(%)=(湿重一干重)/湿重×100%。
4.伊文思蓝(Evans blue, EB)含量的测定:小鼠在急性低压氧处理24 h后立即用 腹腔注射4%水合氯醛(350 mg/kg)麻醉,经尾静脉注入 2% EB 生理盐水溶液(4 ml/ kg)1 h 后,开胸通过左心室灌注生理盐水 ,直到右心房流出无色液体为止,断头取脑。样品称重并置入1.5 ml 50 %三氯乙酸溶液中。匀浆和离心(10 000 r/min , 20 min)后取上清液,四倍稀释于无水乙醇中。荧光值通过荧光分光光度计检测。根据光密度数值,从标准曲线上算出脑组织中 EB 含量,根据公式计算出 EB 含量:脑组织 EB 含量(ng/g湿脑组织)=标准品 EB 含量(ng/ml)×50 %三氯乙酸量(ml)/脑湿重(g)。
五、 统计学分析
分析采用SPSS 18.0统计学软件进行分析,对计量资料使用mean±SD进行表示,计数资料则使用中位数±四分位间距表示。使用单因素方差分析法,即one-way ANOVA进行差异性统计,使用Tukey检验进行组间检验、校正。所有数据比较,Plt;0.05认为有统计学差异。
结 果
一、急性低压氧24 h后MMP9表达上调
急性低压氧6 h即出现MMP9蛋白表达上调,至24 h表达明显高于control组(Plt;0.05, 图1)。
二、GM1抑制急性低压氧后MMP9表达上调
提前给予GM1处理,可以有效抑制急性低压氧后MMP9表达上调(Plt;0.05, 图2)。
三、GM1减弱星形胶质细胞MMP9免疫荧光强度
图3为MMP9与星形胶质细胞标志物GFAP的双标免疫荧光,红色为MMP9,绿色为星形胶质细胞标志物GFAP,黄色为二者共表达。结果显示,与对照组相比,GM1组MMP9免疫荧光强度无明显改变,低压低氧组MMP9免疫荧光增强,且MMP9/GFAP共表达增加;与低压低氧组相比,GM1+低压低氧组显著降低MMP9荧光强度,减少MMP9与星形胶质细胞标记物重叠。
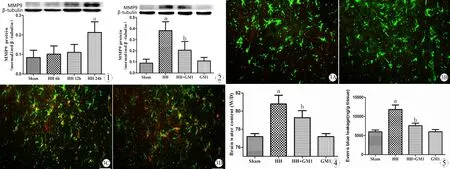
图1 对照组、低压低氧6 h组、低压低氧12 h组及低压低氧24 h组MMP9蛋白表达
Fig 1 The protein expression of MMP9 in control group, HH 6 h group, HH 12 h group and HH 24 h group.
aPlt;0.05,vscontrol group.
图2 对照组、低压低氧组及GM1+低压低氧组、GM1组MMP9蛋白表达
Fig 2 The protein expression of MMP9 in control, HH, GM1+HH and GM1 groups
aPlt;0.05,vscontrol group;bPlt;0.05,vsHH group.
图3 GM1对急性低压氧后星形胶质细胞MMP9免疫荧光强度的影响
Fig 3 GM1 decreased the number of MMP9 positive glial cells
A: No change of the number of MMP9 positive glial cells in control group; B: GM1 without HH did not change the number of MMP9 positive glial cells; C: HH increased the number of MMP9 positive glial cells; D: GM1 decreased the number of MMP9 positive glial cells.
Bars=20 μ.
图4 对照组、低压低氧组及GM1+低压低氧组、GM1组湿重比
Fig 4 The wet/dry in control , HH, GM1+HH and GM1 groups
aPlt;0.05,vscontrol group;bPlt;0.05,vsHH group.
图5 对照组、低压低氧组及GM1+低压低氧组、GM1组MMP9蛋白表达
Fig 5 The Evans blue extravasation in control, HH , GM1+HH and GM1 groups.
aPlt;0.05,vscontrol group;bPlt;0.05,vsHH group.
四、GM1降低急性低压氧BBB破坏,减轻脑水肿
血脑屏障的通透性主要通过湿重比(图4)和伊文思蓝定量(图5)评价。湿重比结果显示:与对照组相比,低压低氧组湿重比明显增加(Plt;0.05);与低压低氧组相比,GM1+低压低氧组湿重比显著降低(Plt;0.05)。伊文思蓝定量显示:与对照组相比,低压低氧组伊文思蓝大量渗出(Plt;0.05);与低压低氧组相比,GM1+低压低氧组伊文思蓝渗出明显减少(Plt;0.05)。
讨 论
本研究证实急性低压低氧24 h后,MMP9表达上调,提前给予GM1腹腔注射可抑制MMP9表达上调,减轻急性低压氧血脑屏障损破坏,减少伊文思蓝渗出量和脑含水量。表明提前给予GM1抑制MMP9表达上调,可能参与其预防急性低压氧后脑水肿的机制中。
HACE作为高原脑病的终末阶段,主要表现为严重头疼、呕吐、共济失调和进行性意识障碍。HACE可根据Lake Louise临床诊断标准分为两类:血管源性HACE是未经AMS过程,而伴有相关精神症状和共济失调;细胞毒性HACE是由急性高山病进一步发展而来,并伴有精神改变或者共济失调[7]。HACE 具有起病急、进展速度快、病程变化复杂、并发症多而重、治疗不及时预后差、病死率高等临床特点,已成为高原危重病中研究的热点和难点[8]。最近研究报道急性低压氧后神经营养因子等明显增加,给予一系列干预措施可通过上调神经营养因子表达,可减轻急性低压氧后脑损伤[9]。神经节苷脂主要分布在神经细胞膜上,在维持细胞结构稳定和修复神经细胞损伤中发挥着重要作用。外源性单唾液酸四己糖神经节苷脂钠可自由通过BBB,整合于神经细胞膜上,并通过激活神经营养因子下游保护通路,发挥神经保护作用[10,11]。前期研究表明,持续给予大剂量GM1可有效减轻神经系统损伤后脑水肿[12]。本研究首次证实GM1通过保护BBB完整性有效预防急性低压氧脑水肿。
BBB由脑毛细血管内皮细胞及其间的紧密连接、基膜、周细胞与星形胶质细胞的终足组成。其中内皮细胞和紧密连接是维持血脑屏障功能的关键结构。急性低压氧环境下,一系列调节因子可影响内皮细胞的转运系统和酶系统,从而改变了血脑屏障的通透性[13]。MMP9是MMPs家族中明胶酶的一种,目前研究发现MMP9参与多种神经系统疾病的发生发展。近年来,研究认为MMP9与在早期脑水肿发生关系密切,但其具体机制目前尚不清楚。Guo等研究指出MMP9可能通过降解层粘连蛋白参与早期脑脑水肿[14]。Feiler等报道称MMP9通过促进脑水肿形成,进而促进后早期脑损伤的发展[15]。本实验结果显示,急性低压氧处理24 h后小鼠MMP9表达显著增加,提前给予GM1有效抑制MMP9表达上调。这一结果证实了MMP9可能参与了GM1预防急性低压氧脑水肿。
综上所述,本研究证实提前给予GM1可通过抑制MMP9上调,减轻急性低压氧脑水肿,表明下调MMP9可能是其脑保护的机制。
1Bailey DM, Bartsch P, Knauth M, et al. Emerging concepts in acute mountain sickness andhigh-altitude cerebral edema: from the molecular to the morphological [J]. Cell Mol Life Sci, 2009, 66(22): 3583-3594.
2Baneke A. What role does the blood brain barrier play in acute mountain sickness? [J]. Travel Med Infect Dis, 2010, 8(4): 257-262.
3Tang X, Zhong W, Tu Q, et al. NADPH oxidase mediates the expression of MMP-9 in cerebral tissue after ischemia-reperfusion damage [J]. Neurol Res, 2014, 36(2): 118-125.
4Wang Y, Jia J, Ao G, et al. Hydrogen sulfide protects blood-brain barrier integrity following cerebral ischemia [J]. J Neurochem, 2014, 129(5): 827-838.
5Cuello AC. Gangliosides, NGF, brain aging and disease: a mini-review with personal reflections [J]. Neurochem Res, 2012, 37(6): 1256-1260.
6Zhang Q, Furukawa K, Chen HH, et al. Metastatic potential of mouse Lewis lung cancer cells is regulated via ganglioside GM1 by modulating the matrix metalloprotease-9 localization in lipid rafts [J]. J Biol Chem, 2006, 281(26): 18145-18155.
7Zafren K. Prevention of high altitude illness [J]. Travel Med Infect Dis, 2014, 12(1): 29-39.
8Wilson MH, Newman S, Imray CH. The cerebral effects of ascent to high altitudes [J]. Lancet Neurol, 2009, 8(2): 175-191.
9Jain V, Baitharu I, Barhwal K, et al. Enriched environment prevents hypobaric hypoxia induced neurodegeneration and is independent of antioxidant signaling [J]. Cell Mol Neurobiol, 2012, 32(4): 599-611.
10 Cuello AC. Gangliosides, NGF, brain aging and disease: a mini-review with personal reflections [J]. Neurochem Res, 2012, 37(6): 1256-1260.
11 Stojanov K, Georgieva JV, Brinkhuis RP, et al. In vivo biodistribution of prion- and GM1-targeted polymersomes following intravenous administration in mice [J]. Mol Pharm, 2012, 9(6): 1620-1627.
12 Sano R, Annunziata I, Patterson A, et al. GM1-ganglioside accumulation at the mitochondria- associated ER membranes links ER stress to Ca (2+)-dependent mitochondrial apoptosis [J]. Mol Cell, 2009, 36(3): 500-511.
13 Julian CG, Subudhi A W, Wilson MJ, et al. Acute mountain sickness, inflammation, and permeability: new insights from a blood biomarker study [J]. J Appl Physiol (1985), 2011, 111(2): 392-399.
4 Guo Z, Sun X, He Z, et al. Matrix metalloproteinase-9 potentiates early brain injury after subarachnoid hemorrhage [J]. Neurol Res, 2010, 32(7): 715-720.
15 Feiler S, Plesnila N, Thal SC, et al. Contribution of matrix metalloproteinase-9 to cerebral edema and functional outcome following experimental subarachnoid hemorrhage [J]. Cerebrovasc Dis, 2011, 32(3): 289-295.
EffectofgangliosideGM1onexpressionofMMP9afteracutehypobariccerebraledema
LIHu1,2,LIUHong1,2,WANGBairen3,GONGGu1
1DepartmentofAnesthesiology,GeneralHospitalofChengduMilitaryCommand,Chengdu610083;2DepartmentofAnesthesiology,NorthSichuanMedicalCollege,Nanchong637000;3DepartmentofNeuroimmunomodulation,InstituteofNeuroscienceofPLA,FourthMilitaryMedicalUniversity,Xi'an710032, China
ObjectiveThe effect of monosialotetrahexosylganglioside (GM1) on expression of matrix metalloproteinase-9 (MMP9) after acute exposure to hypoxia and hypobaric conditions was investigated.MethodsAdult male C57 mice were randomly divided into 4 groups (control, HH, GM1+HH, GM1,n=6). Mice in control group were kept under normal atmospheric pressure; mice in HH group were placed in a decompression chamber which simulated the environment of an altitude of 6 000 m ; mice in HH+GM1 group were exposed to acute hypoxia hypobaric after intra-peritoneal administration of GM1 (30 mg/kg/d) for 3 d; mice in GM1 group were kept outside the decompression chamber after intra-peritoneal administration of GM1 (30 mg/kg/d) for 3 d. The expression of MMP9 was analyzed by Western blot and immunofluorescence staining 24 h after acute hypoxia hypobaric. The integrity of the BBB was evaluated by using Evans blue extravasation and wet/dry ratio methods.ResultsAt 24 h after hypoxia hypobaric, the expression of MMP9 in HH group was increased (Plt;0.05), and in GM1+HH group MMP9 level was down-regulated compared with HH group (Plt;0.05). GM1 reduced the Evans blue extravasation (Plt;0.05) and wet/dry ratio (Plt;0.05).ConclusionGM1 plays a significant neuroprotection by suppressing expression of MMP9 after acute hypoxia hypobaric exposure.
Ganglioside GM1; Matrix metalloproteinase-9; Acute hypoxia hypobaric
1671-2897(2016)15-042-04
R 322.61
A
国家自然科学基金资助项目(0670666)
李虎,硕士研究生,E-mail: 418837376@qq.com
*通讯作者:巩固,副主任医师,硕士生导师,E-mail: gonggu68@163.com
2015-05-23;
2015-07-30)

