采用大分子单体稳定印迹牛血清白蛋白
钱立伟,李 季,宋文琦,胡小玲,管 萍
(1.陕西科技大学轻工科学与工程学院,西安710021;2.西北工业大学理学院,西安710072)
采用大分子单体稳定印迹牛血清白蛋白
钱立伟1,李 季2,宋文琦2,胡小玲2,管 萍2
(1.陕西科技大学轻工科学与工程学院,西安710021;2.西北工业大学理学院,西安710072)
以牛血清白蛋白为模板蛋白质,聚(丙烯酸羟乙酯⁃乙烯基咪唑⁃1⁃(烯丙基乙酯)⁃3⁃乙烯基咪唑氯)[P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)]为大分子功能单体和交联剂,通过氧化还原引发聚合法制备了蛋白质印迹水凝胶.圆二色光谱和同步荧光光谱结果表明,P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)能够较好地维持牛血清白蛋白结构稳定性,而相同质量的HEA,VIM和氯化1⁃(烯丙基乙酯)⁃3⁃乙烯基咪唑([AVIM]Cl)的混合物对牛血清白蛋白的结构破坏严重.选择性吸附和竞争吸附的结果表明,用P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)制备的印迹水凝胶比用HEA,VIM和[AVIM]Cl制备的印迹水凝胶具有更强的选择性和识别能力.在制备过程中维持模板蛋白质结构的稳定性有利于得到具有高识别能力和选择性的印迹聚合物.采用大分子单体印迹蛋白质的方法,可以有效地克服蛋白质在印迹过程中的结构容易变性的缺点,对蛋白质印迹技术的发展具有重要意义.
分子印迹技术;蛋白质印迹;蛋白质结构稳定;圆二色光谱;同步荧光光谱
分子印迹技术是分析化学领域热门的课题之一,其中生物小分子模板的印迹技术发展已经十分纯熟[1,2],而生物大分子[3]特别是蛋白质和酶的印迹技术却发展得相对缓慢.这主要是由于蛋白质在印迹过程中结构易变,导致制备的印迹聚合物识别性大幅下降.
Krysico等[4,5]认为,蛋白质在印迹过程中结构易变是由传统功能单体和交联剂的破坏引起的.研究发现,在牛血清白蛋白、溶菌酶和牛血红蛋白溶液中分别加入传统的小分子功能单体和交联剂后,蛋白质的二级结构会发生大幅度改变,当这些功能单体的浓度远低于制备传统蛋白质分子印迹聚合物所需的用量时,蛋白质的二级结构依然遭到严重破坏.在以传统小分子功能单体和交联剂制备的分子印迹聚合物中,由于模板分子结构的改变,其印迹孔穴的识别性大幅降低,这也是大部分蛋白质分子印迹聚合物的选择性和识别性都远低于以小分子为模板的分子印迹聚合物的主要原因.
研究发现,传统功能单体和交联剂因具有分子体积小及分子运动灵活的特点而容易进入蛋白质内部,从而影响维持蛋白质结构稳定的氢键,从而导致蛋白质结构的破坏[Scheme 1(A),(B)][6,7].与之相比,大分子单体由于其分子体积较大、分子运动较为不灵活,只能与蛋白质表面的官能团进行作用[Scheme 1(C),(D)],因而能够有效地维持蛋白质结构的稳定性,有助于提高蛋白质印迹聚合物的识别能力.
为进一步验证采用大分子单体稳定印迹蛋白质方法的普适性,并深入研究大分子单体与蛋白质之间的作用机理,本文以丙烯酸羟乙酯(HEA)、乙烯基咪唑(VIM)和氯乙酸丙烯酯(Aca)为反应单体,通过无规共聚反应和烷基化反应,制备了大分子单体聚(丙烯酸羟乙酯⁃乙烯基咪唑⁃1⁃(烯丙基乙酯)⁃3⁃乙烯基咪唑氯)[P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)],采用圆二色光谱和同步荧光光谱研究了P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)和其组成小分子单体混合物[即HEA、VIM和氯化1⁃(烯丙基乙酯)⁃3⁃乙烯基咪唑([AVIM]Cl)]对模板蛋白质二级结构和其内部微环境的影响,采用吸附等温实验、选择性吸附和竞争吸附实验研究了印迹水凝胶的吸附机理和识别能力,得到印迹过程中蛋白质结构稳定性与印迹聚合物识别性之间的重要关系.
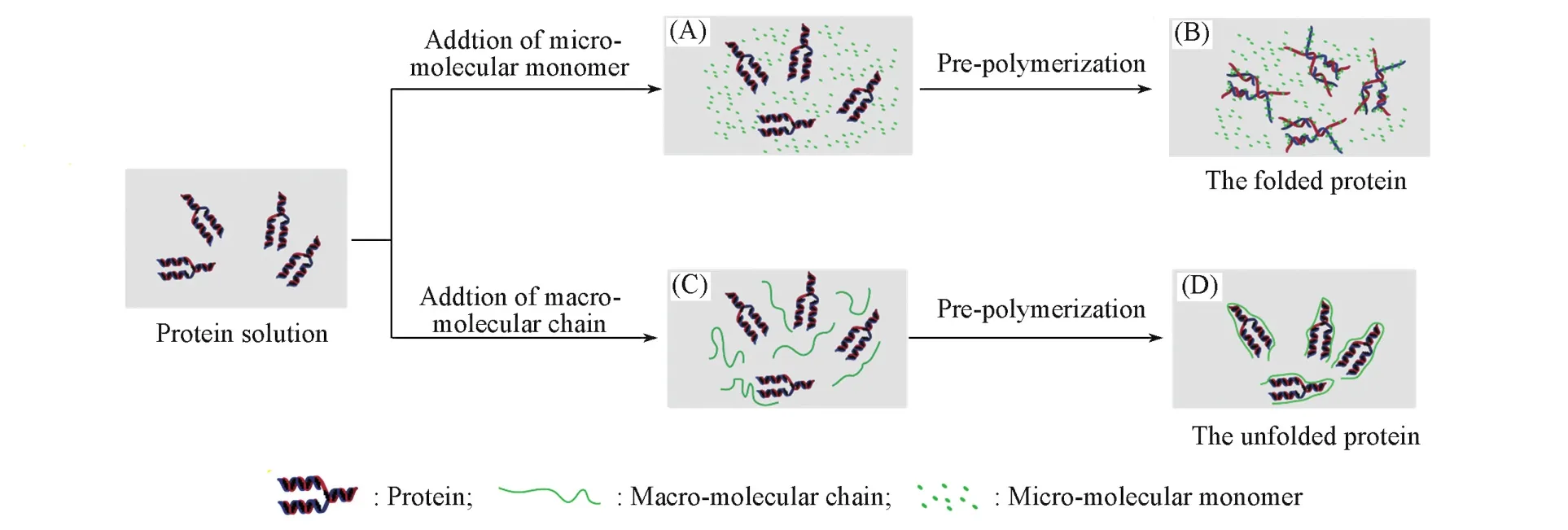
Scheme 1 Influence ofmacromolecular chain and m icromolecular monomer on the conformation of template protein[6,7]
1 实验部分
1.1 试剂与仪器
丙烯酸羟乙酯(HEA)、1⁃乙烯基咪唑(VIM)和氯乙酸丙烯酯(ACa),Alfa Aesar化学试剂公司;牛血红蛋白(Hb,Mw=64500,p I=6.8~7.0)、溶菌酶(Lyz,Mw=14400,p I=10.7)、卵清白蛋白(OVA,Mw=45000,p I=4.7)和牛血清白蛋白(BSA,Mw=66400,p I=4.8),Sigma公司(St.Louis,MO,USA);N,N,N,N⁃四甲基乙二胺(TEMED)、过硫酸铵(APS)和2,2⁃偶氮二异丁腈(AIBN),天津科密欧化学试剂公司;蛋白质分子量标记,上海金穗生物技术有限公司.
TENSOR27型傅里叶变换红外光谱(FTIR)仪,德国布鲁克公司;Avance 300 MHz型核磁共振氢谱(1H NMR)仪,德国布鲁克公司;Kratos Axis Ultra DLD型X射线光电子能谱(XPS),日本岛津公司;Cary⁃1E型紫外⁃可见(UV⁃Vis)分光光度计,美国瓦里安公司;Inca Oxford型扫描电子显微镜(SEM),英国牛津仪器有限公司;Chirascan型圆二色光谱(CD)仪,英国应用光物理公司;F⁃4500型荧光光谱仪,日本 Hitachi公司;50C型凝胶渗透色谱(GPC),美国Waters公司;DYY⁃6C型电泳仪,北京六一厂.
1.2 P(HEA⁃co⁃VIM)和P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)的合成
将1.4mL(10.9mmol)HEA和0.6mL(6.1mmol)VIM加入10mL乙醇中,再加入20mg AIBN,超声溶解5 min,并通N2气15 min后,于70℃反应6~12 h,用乙醚沉淀并洗涤,产物于50℃真空干燥1 h,得到P(HEA⁃co⁃VIM).
将3 g P(HEA⁃co⁃VIM)溶于8 mL DMF中,在50℃下通过恒压滴液漏斗加入0.6 mL ACa(4.0 mmol),反应18 h,用20 mL乙醚沉淀产物,得到淡黄色黏稠固体P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)粗产物.粗产物用100 mL乙醚多次洗涤后溶于5 mL去离子水中,用截留分子量为20000的透析袋透析3 d,水溶液经过冷冻干燥,得到1.7 g P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl).
1.3 氯化1⁃(烯丙基乙酯)⁃3⁃乙烯基咪唑离子液体的合成
在25℃下,将2.69 g(20mmol)ACa溶于10mL丙酮中,加入1.88 g(20mmol)VIM,于40℃磁力搅拌10~12 h,溶液分为两相;通过分液漏斗收集上层溶液,并用20 mL丙酮洗涤,将得到的固体用10 mL水溶解,并通过冷冻干燥得到氯化1⁃(烯丙基乙酯)⁃3⁃乙烯基咪唑([AVIM]Cl),产率86%,图1给出[AVIM]Cl的1H NMR谱图.
1.4 BSA印迹水凝胶的制备
将66mg BSA和0.8mL磷酸缓冲液(0.01mol/L,pH=7.0)加入φ25mm×40mm的称量瓶中,再加入132.8 mg P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)和2 mg APS,于25℃预聚合20min,通入N2气15 min,再快速加入2μL TEMED,密封后于25℃反应3 h;反应完成后,将生成的印迹水凝胶(MIH)用打孔器打成φ6 mm×1.5 mm的圆片.将MIH样品在25℃下浸泡在100 mL 0.5 mol/L的NaCl溶液中进行洗
脱,直到在紫外⁃可见光谱中观察不到洗脱液中模板蛋白质的特征吸收峰.当完全洗脱模板蛋白质后,用去离子水除去水凝胶中残留的NaCl,将凝胶片进行冷冻干燥.将BSA印迹水凝胶命名为MIH⁃C⁃BSA[其中C代表P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)].

Fig.11H NMR spectrum of[AVIM]Cl in CDCl3
采用相同的方法制备非印迹水凝胶(NIH),并在其合成过程中不加入模板蛋白质.制备的非印迹水凝胶命名为NIH⁃C⁃BSA.
用86.9mg HEA,10mg VIM和35.9mg [AVIM]Cl代替132.8 mg P(HEA⁃co⁃VIM⁃ co⁃[AVIM]Cl),制备基于小分子单体的印迹和非印迹水凝胶,分别命名为MIH⁃M⁃BSA和NIH⁃M⁃BSA(其中M代表小分子单体).
1.5 分子印迹水凝胶的吸附
在25℃下,将50 mg凝胶干片在磷酸缓冲液(0.01 mol/L,pH=7.0)中溶胀平衡,将凝胶片转移至0~1.2 mg/mL BSA的磷酸缓冲溶液中吸附3 h;收集吸附后的BSA溶液,通过紫外⁃可见分光光度法检测其吸光度.凝胶干片对蛋白质的吸附量(Q)通过Q=(c0-ce)V/m计算,其中c0(mg/mL)和ce(mg/mL)分别为BSA溶液的初始和吸附后的浓度,V(mL)为蛋白质溶液的体积,m(g)为水凝胶干片的质量.用印迹因子(IF)[IF=QMIH/QNIH,其中,QMIH和QNIH分别是MIH和NIH对蛋白质的吸附量]衡量MIH对模板蛋白质或其类似物特异性识别能力.
在25℃下,将50 mg凝胶干片在磷酸缓冲溶液(0.01 mol/L,pH=7.0)中溶胀平衡,然后将凝胶片转移至1.0 mg/mL BSA的磷酸缓冲溶液中进行吸附,通过紫外⁃可见分光光度法检测凝胶片在不同吸附时间内对BSA的吸附量.
在25℃下,将50 mg凝胶干片在磷酸缓冲溶液(0.01 mol/L,pH=7.0)中溶胀平衡,然后将水凝胶转移到浓度为1.0 mg/mL蛋白质溶液中吸附3 h;收集吸附后的蛋白质溶液,用紫外⁃可见分光光度法进行检测.选择性因子(β)通过β=IFtemp/IFana计算,其中IFtemp和IFana分别是MIH对模板蛋白质和其类似物的IF值.
在25℃下,将50 mg凝胶干片在磷酸缓冲溶液(0.01 mol/L,pH=7.0)中溶胀平衡,然后将水凝胶转移到含有1.0 mg/mL BSA,OVA和Lyz蛋白质混合溶液中吸附3 h;用0.5 mol/L的NaCl溶液对水凝胶进行洗脱,直到在紫外⁃可见光谱中观察不到洗脱液中蛋白质的特征吸收峰;收集洗脱液(并用截留分子量为500的透析袋透析脱盐;将透析液冷冻干燥,将产物溶于3mL磷酸缓冲液(0.01mol/L,pH=7.0)中,采用SDS⁃PAGE对上述溶液进行检测,其中聚丙烯酰胺的分离胶浓度为12.5%,浓缩胶的浓度为5%.
2 结果与讨论
2.1 P(HEA⁃co⁃VIM)和P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)的表征
图2给出P(HEA⁃co⁃VIM)和P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)的1H NMR谱图.由图2谱线a可见,δ7.6,7.2和6.9处的吸收峰分别对应咪唑环上氢原子的特征峰;δ4.9,4.0和3.5处的吸收峰为丙烯酸羟乙酯结构单元中羟基和亚甲基中氢原子的特征峰.P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)含有HEA,VIM和[AVIM]Cl结构单元,在图2谱线b中,除了P(HEA⁃co⁃VIM)的特征峰外,在δ9.5和7.9处出现了离子化的咪唑环上氢原子的特征峰,并且在δ6.1和5.4处生成的新峰归属于碳碳双键中氢原子的特征峰,可见,ACa通过与咪唑基团的烷基化反应,已经成功接枝到大分子单体中.
图3给出P(HEA⁃co⁃VIM)和P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)的XPS谱图.P(HEA⁃co⁃VIM)存在HEA和VIM 2种小分子单元.在图3谱线a中,除了氢元素,P(HEA⁃co⁃VIM)中只含有C,O和N 3种
元素.而P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)中存在P(HEA⁃co⁃VIM)单元以外的第三种单体,即交联剂单元[AVIM]Cl,因而在图3谱线b中,除了含有C,O和N元素外,还含有Cl元素.P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)中C,O,N和Cl原子组成含量为68.31%,23.71%,6.14%和1.84%,可以推断出,P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)中HEA,VIM和[AVIM]Cl结构单元的质量比为65.4∶7.5∶27.1.
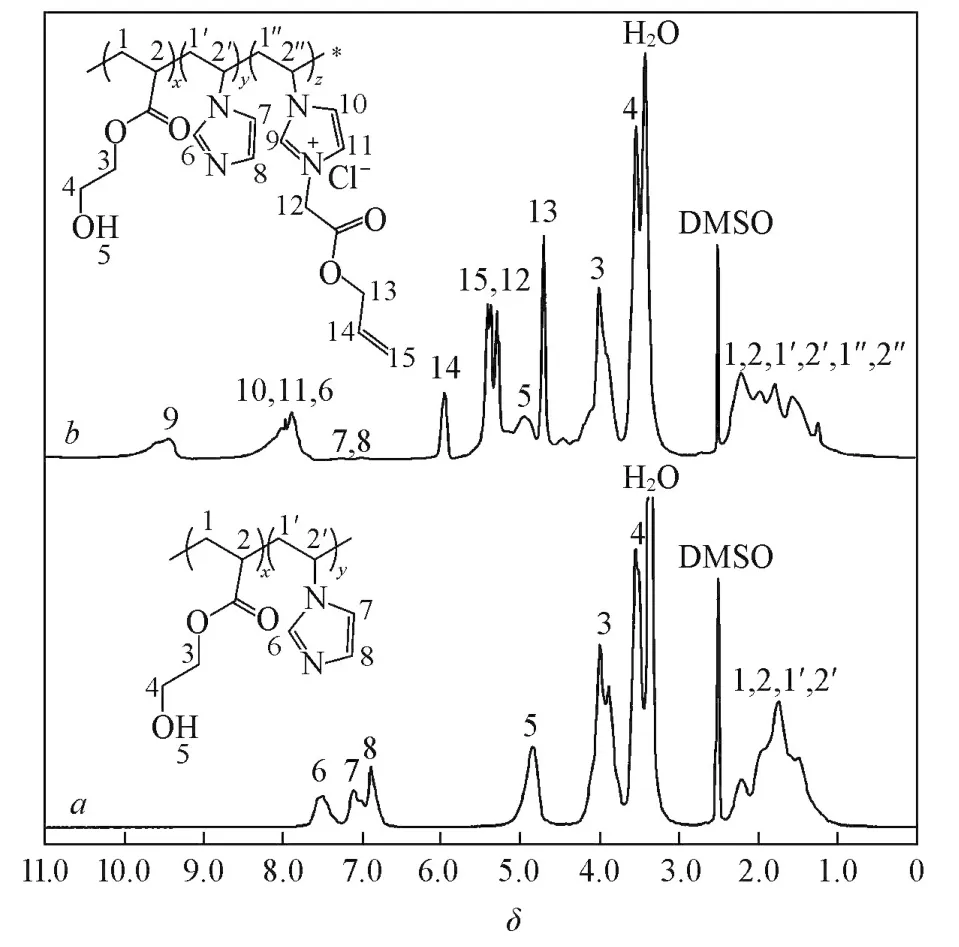
Fig.21H NMR spectra of P(HEA⁃co⁃VIM)(a)and P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)(b)

Fig.3 XPS spectra of P(HEA⁃co⁃VIM)(a)and P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)(b)
图4给出P(HEA⁃co⁃VIM)和P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)的GPC结果.其数均分子量()分别为27761和28615,分子量分布较窄,PDI可达到1.1以下.
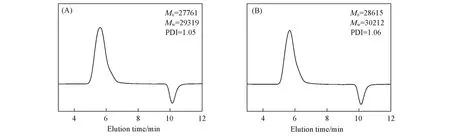
Fig.4 GPC analysis of P(HEA⁃co⁃VIM)(A)and P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)(B)
2.2 P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)及HEA,VIM,[AVIM]Cl对蛋白质结构的影响
CD光谱可用于测量和评估蛋白质二级结构的变化[8,9].BSA在208和222 nm处的负峰可以提供α⁃螺旋结构的信息,特别是208 nm处的负峰,对外界环境变化的影响更为敏感.图5(A)给出25℃时BSA与小分子单体(即HEA,VIM和[AVIM]Cl)相互作用后的CD谱.由图5(A)可见,当小分子单体与BSA的质量比为1∶1时,BSA的2个特征负峰发生了不同程度的改变,208 nm处的变化更加明显,通过神经网络算法(CDNN,由应用光物理公司提供)可得,其α⁃螺旋结构含量从天然结构的60%下降到14%.继续增加小分子单体的含量,小分子单体对蛋白质二级结构的破坏愈加严重.由图5(B)可见,当P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)和BSA相互作用后,BSA在208和222 nm处的特征峰能够保持相对完好,当P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)与BSA的质量比低于2∶1时,BSA的α⁃螺旋结构保持在58%以上,说明蛋白质的二级结构几乎未发生任何改变,证明P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)对BSA具有十分明显的稳定效果.
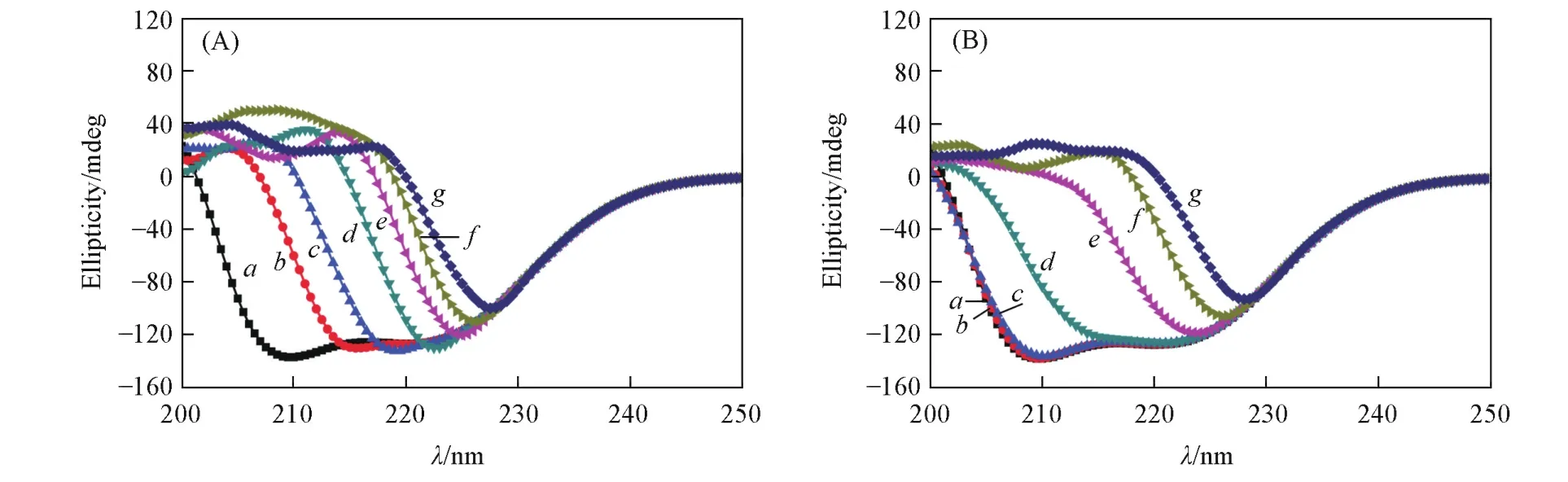
Fig.5 Effects ofm icromolecular monomers(A)and P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)(B)on the secondary structure of BSA
高浓度的P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)依然能够对蛋白质的二级结构产生一定破坏作用,这可能是因为在低浓度下P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)自身的物理缠结效应较低,可较为自由地与蛋白质表面的官能团(如羧基、氨基)作用,因而贴合在蛋白质表面[Scheme 2(A),(B)].当P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)在溶液中浓度较高时,P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)分子有较大几率进行相互缠结[Scheme 2(C),(D)],使其刚性大大增强,当蛋白质表面官能团与P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)缠结体具有较强的相互作用时,这种较强的作用分别延伸至P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)缠结体内部(物理交联点)和蛋白质内部(维持蛋白质结构稳定的氢键作用),当缠结作用足够大时,维持蛋白质结构稳定的氢键被破坏,因而构象发生改变[Scheme 2(D),(E)].这种现象类似于固体界面对蛋白质吸附后导致蛋白质结构改变的行为[10].

Schem e 2 Influence of different concentrations ofmacromolecular chain on the conformation of protein
为了进一步研究P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)和HEA,VIM及[AVIM]Cl对蛋白质结构的影响,本文采用同步荧光光谱研究其对蛋白质内部微环境的影响[11].同步荧光光谱是一种敏感的检测手段,用于研究发色基团周围局部微环境的变化.这种光谱是通过同时扫描激发和发射波长来获得,当激发和发射波长差(Δλ)恒定为15 nm或60 nm时,同步荧光光谱能分别获得关于蛋白质内部酪氨酸残基或色氨酸残基的信息[12,13].另外发射峰的偏移与发色基团周围微环境变化有关,一般来说,峰的红移代表周围微环境极性增强,而蓝移说明发色基团周围微环境变得更加疏水.
由图6(A)可见,当小分子单体与BSA相互作用后,BSA的酪氨酸残基的荧光强度下降,并伴随着发射峰的红移,说明在加入小分子单体后,酪氨酸残基周围的极性变大.在图6(C)中,BSA色氨酸
残基的荧光强度也随着小分子含量的增加而下降,发射峰也发生了明显的红移.当P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)与BSA相互作用后[图6(B)和(D)],发射光谱中的特征峰仅出现荧光猝灭,而峰的位置基本不发生改变.研究结果表明,小分子单体可以容易地渗透到蛋白质内部,因而能够改变蛋白质内部微环境;而大分子单体可能更倾向于与蛋白质表面官能团进行作用,并且较大的分子体积使其难以扩散到蛋白质内部,破坏蛋白质的内部结构.
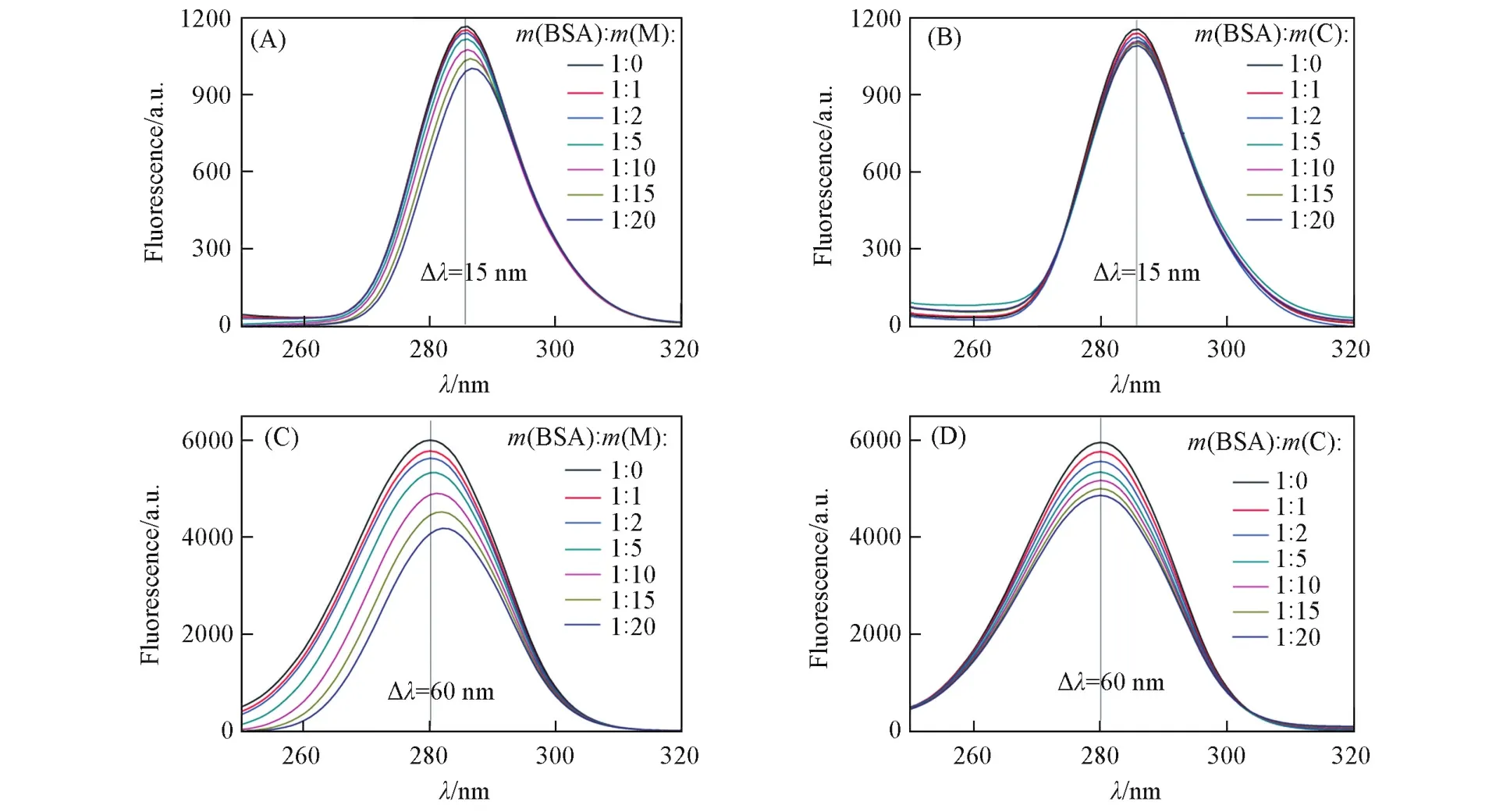
Fig.6 Synchronous fluorescence spectra of BSA influenced by m icromolecular monomers(A,C)or macromolecular chains(B,D)
2.3 印迹水凝胶的形貌表征
图7给出MIH⁃C⁃BSA,MIH⁃M⁃BSA,NIH⁃C⁃BSA和NIH⁃M⁃BSA的SEM照片.由图7可见,印迹和非印迹水凝胶的表面形貌均为不规则的通孔结构,孔径为20~50μm,这种大孔结构能够有效增强蛋白质的传质行为[14,15],因而促进水凝胶的洗脱和吸附过程.

Fig.7 SEM images of M IH⁃C⁃BSA(A),M IH⁃M⁃BSA(B),NIH⁃C⁃BSA(C)and NIH⁃M⁃BSA(D)
2.4 印迹水凝胶的吸附动力学
图8给出MIH⁃C⁃BSA,MIH⁃M⁃BSA,NIH⁃C⁃BSA和NIH⁃M⁃BSA的吸附动力学结果.由图8可见,在1.0 mg/mL的BSA溶液中,MIH⁃C⁃BSA和MIH⁃M⁃BSA的吸附速率在120 min内远远高于NIH⁃C⁃BSA和NIH⁃M⁃BSA,说明在MIH⁃C⁃BSA中存在着BSA形状的印迹孔穴,使MIH⁃C⁃BSA对BSA具有更强的吸附作用.研究发现,MIH⁃C⁃BSA吸附速率要高于MIH⁃M⁃BSA的吸附速率,说明MIH⁃C⁃BSA内部作用位点对BSA作用力更强,这可能是由于MIH⁃C⁃BSA在印迹过程中BSA的结构和构象保持完整,因而存在更为精确的印迹孔穴.所有水凝胶在180 min左右都可以到达吸附平衡,这是由于所制备
水凝胶的通孔形貌决定了蛋白质在其中有效且快速的传质,加速了蛋白质的吸附平衡过程;另一方面,在组成水凝胶的结构中,存在对蛋白质具有较强作用的离子化咪唑基团,这种基团会加速对蛋白质吸附平衡过程[16,17].
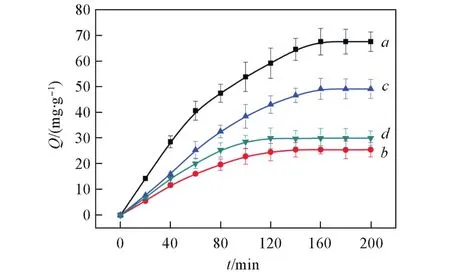
Fig.8 AdsorptiondynamiccurvesofMIH⁃C⁃BSA(a),NIH⁃C⁃BSA(b),MIH⁃M⁃BSA(c)andNIH⁃M⁃BSA(d)forBSA,respectively
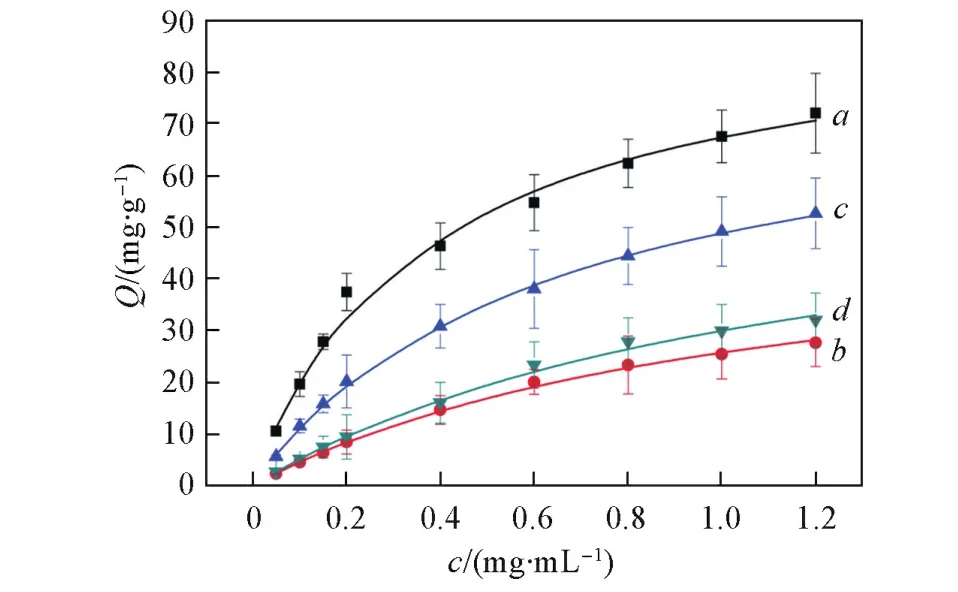
Fig.9 AdsorptionisothermofMIH⁃C⁃BSA(a),NIH⁃C⁃BSA(b),MIH⁃M⁃BSA(c)andNIH⁃M⁃BSA(d)forBSA,respectively
2.5 印迹水凝胶的吸附等温特性
图9给出MIH⁃C⁃BSA,MIH⁃M⁃BSA,NIH⁃C⁃BSA和NIH⁃M⁃BSA的吸附等温线.由图9可见,所有的印迹水凝胶和非印迹水凝胶的平衡吸附量都随着BSA初始浓度的增大而增大.同时还可以发现,MIH⁃C⁃BSA和MIH⁃M⁃BSA的平衡吸附量都高于NIH⁃C⁃BSA和NIH⁃M⁃BSA,说明在印迹水凝胶中存在印迹孔穴[18,19].可以发现,MIH⁃C⁃BSA的平衡吸附量及识别效果均优于MIH⁃M⁃BSA,说明MIH⁃C⁃BSA内部的印迹孔穴数目更多,印迹孔穴的形状更加精确,因此具有对BSA更高的吸附量和更好的识别能力.
为了进一步研究上述印迹和非印迹水凝胶对BSA的亲合作用(Km)及理论最大吸附量(Qm),本文采用Langmuir吸附模型对吸附等温曲线进行拟合[20,21],Langmuir吸附模型参考公式ce/Qe=1/KmQm+ce/Qm,拟合结果如表1所示.2种印迹水凝胶对BSA的Km与Qm均高于非印迹水凝胶,进一步证明BSA被印迹到水凝胶内部.另外,分析MIH⁃C⁃BSA的Qm和Km值分别为91.7mg/g和2.79mL/mg,都明显高于MIH⁃M⁃BSA的Qm和Km值,说明由P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)制备的印迹水凝胶具有更加优异的吸附量和识别能力,与文献[6,7]研究结果相符.

Table1 Theoreticalmaximumcapacity(Qm)andLangmuiradsorptionequilibriumconstant(Km)fromtheLangmuirmodel
2.6 印迹水凝胶的选择性吸附
为了研究水凝胶对模板蛋白质的选择性,将MIH⁃C⁃BSA,MIH⁃M⁃BSA,NIH⁃C⁃BSA和NIH⁃M⁃BSA分别用于蛋白质的选择性吸附研究.OVA,Hb和Lyz分别选为参比蛋白质.由表2可见,MIH⁃M⁃BSA 对Lyz具有较好的选择能力,分离因子β值达到2.38.而对与BSA分子体积和等电点相似的Hb和OVA只有相对较差的选择性,其β值分别为1.53和1.79.说明虽然MIH⁃M⁃BSA中具有印迹孔穴,但由于在MIH⁃M⁃BSA的制备过程中BSA结构被破坏,因而在印迹水凝胶内部形成的印迹孔穴不具有精确识别模板蛋白的能力.与之相比,MIH⁃C⁃BSA除了对结构相差较大的Lyz具有优异的选择性外,对Hb和OVA的β值分别达到4.52和3.86,说明制备印迹水凝胶的过程中,完整的蛋白质结构可以增强其印迹孔穴的准确性,因而能够提高印迹聚合物的选择和识别能力.

Table 2 Selective adsorption experiments for M IH and NIH
2.7 印迹水凝胶的竞争吸附
图10为印迹和非印迹水凝胶对蛋白质混合溶液吸附结果的凝胶电泳图.图10中泳道2为蛋白质混合溶液,在14.4×103,45×103,66.2×103处分别对应Lyz,OVA和BSA.泳道3~6分别对应 MIH⁃C⁃BSA,MIH⁃M⁃BSA,NIH⁃C⁃BSA和NIH⁃M⁃BSA在三元混合蛋白质溶液中的吸附结果.与泳道4和6相比,泳道3和5在66.2×103处的条带颜色更深,同时在14.4×103和45×103处的条带颜色相对较浅,说明MIH⁃C⁃BSA和MIH⁃M⁃BSA可以在混合蛋白质溶液中选择性吸附BSA.另外,与泳道5相比,泳道3在66.2×103处的条带颜色更深,并且在14.4×103和45×103处的条带颜色更浅,说明MIH⁃C⁃BSA比MIH⁃M⁃BSA对BSA具有更好的识别能力.因此上述研究结果再次证明,由于P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)对BSA的良好稳定效果,使得MIH⁃C⁃BSA能够产生更加精准的印迹孔穴,提高了其对BSA的特异性识别作用,有利于其对BSA的高效分离.
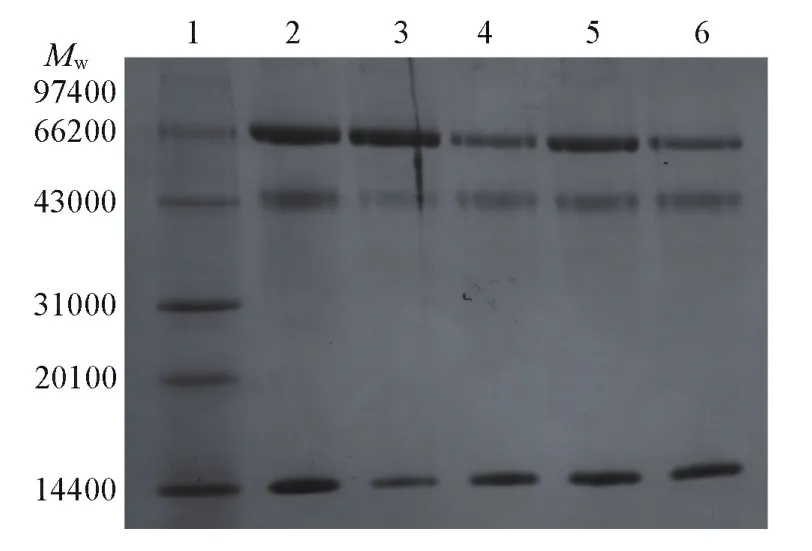
Fig.10 SDS⁃PAGE analysis of competitive adsorption of M IH⁃C⁃BSA and M IH⁃M⁃BSA
3 结 论
本文以P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)作为唯一的功能单体和交联剂,在水相中对BSA进行了印迹.CD光谱和同步荧光光谱研究证明,小分子单体可以较为容易的渗透到蛋白质内部,因而能够破坏维持其结构稳定的氢键,使得蛋白质结构和构象发生改变;而P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)更倾向于与蛋白质表面官能团进行作用,因而能够在印迹过程中对BSA具有良好的稳定效果.吸附等温实验结果表明,MIH⁃C⁃BSA比MIH⁃M⁃BSA具有更高的吸附量和印迹因子.选择性和竞争性吸附结果也表明,MIH⁃C⁃BSA具有更好的选择性和识别能力.因此,采用大分子单体来稳定印迹蛋白质的策略可以有效地克服印迹过程中蛋白质的结构易变而难以准确印迹的难题,提高了印迹聚合物对模板蛋白质的特异性识别能力,对蛋白质印迹技术的发展具有重要意义.
[1] Chen L.X.,Wang X.Y.,Lu W.X.,Wu X.Q.,Li J.H.,Chemical Society Reviews,2016,45(8),2137—2211
[2] Chen L.X.,Xu S.F.,Li J.H.,Chemical Society Reviews,2011,40(5),2922—2942
[3] Zhang Z.,Li J.H.,Fu J.Q.,Chen L.X.,RSC Advances,2014,4(40),20677—20685
[4] Kryscio D.R.,Fleming M.Q.,Peppas N.A.,Macromolecular Bioscience,2012,12(8),1137—1144
[5] Kryscio D.R.,Fleming M.Q.,Peppas N.A.,Biomedical Microdevices,2012,14(4),679—687
[6] Qian L.W.,Hu X.L.,Guan P.,Wang D.,Li J.,Du C.B.,Song R.Y.,RSC Advances,2015,5(73),59062—59069
[7] Qian L.W.,Hu X.L.,Guan P.,Wang D.,Li J.,Du C.B.,Song R.Y.,Wang C.L.,Song W.Q.,Analytica Chimica Acta,2015,884,97—105
[8] He W.,Li Y.,Xue C.,Hu Z.,Chen X.,Sheng F.,Bioorganic Medicinal Chemistry,2005,13(5),1837—1845
[9] Kamat B.P.,Journal ofPharmaceutical and Biomedical Analysis,2005,39(5),1046—1050
[10] Roach P.,Farrar D.,Perry C.C.,Journal of the American Chemical Society,2005,127(22),8168—8173
[11] Hu Z.,Tong C.,Analytica Chimica Acta,2007,587(2),187—193
[12] Pan X.,Liu R.,Qin P.,Wang L.,Zhao X.,Journal of Luminescence,2010,130(4),611—617
[13] Zhang G.,Hu X.,Zhao N.,LiW.,He L.,Pesticide Biochemistry and Physiology,2010,98(2),206—212
[14] Qin L.,He X.W.,Zhang W.,LiW.Y.,Zhang Y.K.,Analytical Chemistry,2009,81(17),7206—7216
[15] Hawkins D.M.,Stevenson D.,Reddy S.M.,Analytica Chimica Acta,2005,542,61—65
[16] BiW.,Tian M.,Row K.H.,Journal ofChromatography A,2012,1232,37—42
[17] Fan J.P.,Tian Z.Y.,Tong S.,Zhang X.H.,Xie Y.L.,Xu R.,Qin Y.,Li L.,Zhang J.H.,Ouyang X.K.,Food Chemistry,2013,141(4),3578—3585
[18] Bossi A.,Bonini F.,Turner A.P.F.,Piletsky S.A.,Biosensors and Bioelectronics,2007,22(6),1131—1137
[19] Hiratani H.,Macromolecular Bioscience,2005,5(8),728—733
[20] Reddy S.M.,Phan Q.T.,El⁃Sharif H.,Govada L.,Stevenson D.,Chayen N.E.,Biomacromolecules,2012,13(12),3959—3965
[21] Tsermentseli S.K.,Manesiotis P.,Assimopoulou A.N.,Papageorgiou V.P.,Journal ofChromatography A,2013,1315(20),15—20
Utilizing Macromolecular Chain as Functional Monomer and Crosslinker to Imprint BSA with Preserving the Structural Integrity of Tem plate†
QIAN Liwei1∗,LIJi2,SONGWenqi2,HU Xiaoling2,GUAN Ping2
(1.College of Bioresources Chemical and Materials Engineering,Shaanxi University ofScience and Technology,Xi'an 710021,China;2.School ofNatural and Applied Science,Northwestern Polytechnical University,Xi'an 710072,China)
Protein imprinted hydrogels were prepared via redox initiated polymerization by utilizing bovine serum albumin(BSA)as a template and poly(hydroxyethylacrylate⁃vinylimidazole⁃[1⁃(allylacetate)⁃3⁃vinyl⁃imidazolium]chloride)[P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)]as the macromolecularly functionalmonomer and crosslinker.The analytical results of circular dichroism and synchronous fluorescence spectrum demonstrated that P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)could effectively maintain the structural stability of BSA,while the equivalent HEA,VIM and[AVIM]Cl denatured the template protein.The selective and competitive adsorp⁃tion experiments showed that the imprinted hydrogels made by P(HEA⁃co⁃VIM⁃co⁃[AVIM]Cl)obtained better selectivity and recognition ability compared with thosemade by HEA,VIM and[AVIM]Cl.Therefore,the above results suggested the significant advantage ofmaintaining the structural and conformational stability of template protein during the preparation of imprinted polymers.The strategy of usingmacromoleculemonomer to imprint protein could effectively overcome the difficulty ofmutability of protein,thereforewould promote the development and application of protein imprinting technology.
Molecularly imprinting technology;Protein imprinting;Stability of protein;Circular dichroism;Synchronous fluorescence spectrum
O632.16;O658.2
A
10.7503/cjcu20160437
(Ed.:W,Z)
†Supported by the National Natural Science Foundation of China(No.21174111)and the Key projectsof National Natural Science Foundation of China(No.51433008).
2016⁃06⁃17;
日期:2016⁃09⁃20.
国家自然科学基金(批准号:21174111)和国家自然科学基金重点项目(批准号:51433008)资助.
联系人简介:钱立伟,男,博士,讲师,主要从事分子印迹技术研究.E⁃mail:qianliwei@mail.nwpu.edu.cn

