高效液相色谱法同时测定保健品中雌二醇和黄体酮的含量
李强,黄丽杰(河南省食品药品审评查验中心/郑州市食品药品检验所,郑州450000)
高效液相色谱法同时测定保健品中雌二醇和黄体酮的含量
李强,黄丽杰△
(河南省食品药品审评查验中心/郑州市食品药品检验所,郑州450000)
目的建立测定某品牌减肥参茶(样品1)、某品牌排毒养颜口服液(样品2)中非法添加雌二醇和黄体酮含量的方法。方法采用Agilent C18柱(4.6 mm×250.0 mm,5 μm),以乙腈-水(70∶30)为流动相,流速1.0 mL/min;检测波长225 nm;柱温30℃。结果雌二醇在5.7~57.2 μg/mL时线性关系良好(r=0.999 5),黄体酮在0.57~22.70 μg/mL时线性关系良好(r=0.999 6);雌二醇和黄体酮的平均加样回收率(n=6)分别为98.51%、99.37%。样本1中雌二醇、黄体酮含量分别为47.32、166.85 μg/g;样品2中雌二醇、黄体醇含量分别为54.71、392.56 μg/g。结论高效液相色谱方法简便、快速,重复性好,结果准确,可作为保健品中雌二醇和黄体酮含量测定的方法。
色谱法,高压液相;雌二醇;孕酮;营养保健品
激素是具有高度生物活性的物质,在极低的浓度下就可起作用[1]。雌激素主要由卵巢和胎盘产生,除了防治疾病,还用以丰乳、美容、治疗痤疮等[2]。雌二醇常用于治疗女性性功能疾病、更年期综合征等[3]。黄体酮是由卵巢黄体分泌的一种天然孕激素,在体内对雌激素激发过的子宫内膜有显著形态学影响[4],主要用于月经失调,如闭经和功能性子宫出血及绝经后的激素替代治疗等[5-6]。该类药物若使用不当,可能引起内分泌失调、肝功能改变、胆结石等不良反应[7]。
保健品是保健食品的通俗说法,保健品是食品中的一个种类,其具有一般食品的共性,能调节人体功能,改善人体健康,适用于特定人群食用,但却不以治疗疾病为目的。保健品的保健作用在当今社会中正在逐步被广大群众所接受,样品种类越来越多,销售市场越来越扩大化,由此也突显了关于保健品的各种问题。本试验通过对各种条件的摸索研究,最终确定了同时测定保健品中雌二醇和黄体酮含量的方法,该方法简便、快速、稳定,可为雌二醇和黄体酮的含量测定提供参考。
1 材料与方法
1.1材料
1.1.1仪器Agilent 1260型高效液相色谱仪(DAD检测器,美国安捷伦有限公司);XS205DU型电子天平(梅特勒-托利多公司);元素型1820C摩尔纯水机(上海摩勒科学仪器有限公司);FN202-2型电热干燥箱(长沙仪器仪表厂);HWS型水浴锅(上海一恒科学仪器有限公司);HH-6型恒温水浴锅(江苏金坛市宏华仪器厂)。
1.1.2药材与试剂雌二醇对照品(批号:100182-201205);黄体酮对照品(批号:100027-201209);某品牌减肥参茶(样品1);某品牌排毒养颜口服液(样品2);甲醇、乙腈均为色谱纯[月旭科技(上海)股份有限公司];水为娃哈哈纯净水。
1.2方法
1.2.1色谱条件与系统适用性试验色谱柱Agilent C18(4.6 mm×250.0 mm,5 μm),流动相:乙腈-水(70∶30)等梯度洗脱,流速1.0 mL/min;检测波长225 nm;柱温30℃;进样量10 μL。
1.2.2提取工艺的考察
1.2.2.1不同提取方法的考察精密称取样品1约1 g,精密加入乙腈20 mL,称定质量,分别采用超声和回流提取2种方法进行考察。超声条件:时间30 min,功率40 kHz,温度30℃。回流条件:时间1.5 h,温度65℃,冷却至室温,称定质量,加乙腈补足损失质量,滤过,取续滤液,用0.22 μm微孔滤膜滤过后注入高效液相色谱仪中,记录峰面积,计算雌二醇和黄体酮的含量。结果显示,超声提取的雌二醇和黄体酮的含量与回流提取的含量相差不大,考虑回流提取条件复杂且用时较长,超声提取简便、快速,故选择回流提取。
1.2.2.2提取溶剂的考察精密称取5份样品1各1 g,分别精密加入甲醇、80%甲醇、乙醇、80%乙醇、乙腈50 mL,超声提取30 min,冷却至室温,用相应溶剂补足损失的质量,滤过,取续滤液,用0.22 μm微孔滤膜滤过,注入高效液相色谱仪,记录峰面积。结果显示,乙腈提取后所得的雌二醇和黄体酮含量较其他提取液所得的含量高,周围杂峰较少,且色谱峰分离度好,因此选择乙腈作为提取溶剂。
1.2.2.3提取时间的考察精密称取5份样品1各1 g,各精密加入乙腈20 mL。超声提取,时间分别为0.10、0.25、0.50、1.00、1.50 h,冷却至室温,用乙腈补足损失质量,滤过,取续滤液,用0.22 μm微孔滤膜滤过后注入高效液相色谱仪中,计算峰面积。结果显示,随着提取时间的增加,银锻苷提取率逐渐升高,但在0.5 h后增加缓慢,故最终选择0.5 h为提取时间。
1.2.2.4提取次数的考察精密称取5份样品1各1g,各精密加入乙腈20 mL。重复超声提取3次,每次0.5h,冷却至室温,用乙腈补足损失质量,滤过,取续滤液适量,用0.22 μm微孔滤膜滤过后注入高效液相色谱仪中,记录峰面积。结果显示,随着提取次数的增加,雌二醇和黄体酮提取率逐渐升高但变化不大,综合考虑最终确定提取次数为1次。
1.2.2.5不同提取溶剂体积的考察精密称取5份样品1各1 g,各精密加入乙腈10、15、20、25、30 mL。超声提取0.5 h,冷却至室温,用乙腈补足损失质量,滤过,取续滤液适量,用0.22 μm微孔滤膜滤过,注入高效液相色谱仪,记录峰面积。结果显示,随着溶剂体积的增加,雌二醇和黄体酮提取率逐渐升高,但升高缓慢。故最终确定20 mL为最佳提取溶剂体积。
1.2.3溶液的制备
1.2.3.1对照品溶液的制备分别精密称取雌二醇和黄体酮适量,加乙腈稀释并定容至100mL量瓶中,摇匀,制成浓度分别为0.11 mg/mL的黄体酮对照品溶液和0.11 mg/mL的雌二醇对照品溶液。
1.2.3.2供试品溶液的制备取一次使用量的供试品,加乙腈20 mL超声提取30 min,取出,放置室温,加乙腈定容至25 mL的容量瓶中,滤过,取续滤液,即得。
1.2.4方法学考察
1.2.4.1线性试验精密量取1.2.3.1项下的对照品溶液适量,加乙腈制成雌二醇质量浓度为57.2、28.6、22.9、17.1、11.4、5.7 μg/mL;以及黄体酮质量浓度为0.57、1.10、5.70、10.40、17.10、22.70 μg/mL的一系列混合溶液,摇匀,即得。按1.2.1项下色谱条件进样分析,记录色谱图。以峰面积为纵坐标、浓度为横坐标,绘制标准曲线。
1.2.4.2精密度试验精密吸取1.2.3.1项下对照品溶液(雌二醇22.9 μg/mL、黄体酮5.70 μg/mL)10 μL,按1.2.1项下色谱条件重复进样6次,记录色谱峰面积,计算雌二醇和黄体酮的相对标准偏差(RSD)。
1.2.4.3稳定性试验取同一批样品,按1.2.3.2项下方法制备供试品溶液,室温下放置,分别于0、2、4、8、12、24 h下进样,记录色谱峰面积,计算RSD。
1.2.4.4重复性试验取同一批样品,按1.2.3.2项下方法制备供试品溶液,平行制备6份,按1.2.1项下色谱条件测定,记录色谱峰面积,计算雌二醇和黄体酮的RSD。
1.2.4.5最低检测限将雌二醇和黄体酮对照品的储备液进行一系列的倍比稀释,然后进行测定。当进样量为10 μL,信噪比(S/N)=3时,雌二醇的最低检测浓度为0.01 μg/mL,黄体酮的最低检测浓度为0.05 μg/mL。
1.2.4.6加样回收率试验取6份已知含量的样品1各2 g,分别精密加入1.2.3.1项下的雌二醇、黄体酮对照品溶液适量,按1.2.3.2项下制备供试品溶液,取10μL注入液相色谱仪,按1.2.1项下色谱条件进行测定,记录色谱峰面积,计算回收率。
1.2.5含量测定取样品1、样品2的一次使用量,按1.2.3.2项下方法制备供试品溶液,按1.2.1项下色谱条件进样,记录色谱峰面积,按外标法计算样品中雌二醇、黄体酮的含量。
2 结果
2.1色谱条件与系统适用性雌二醇和黄体酮的理论塔板数均不低于3000,分离度均大于1.5,拖尾因子0.95~1.05,色谱图见图1。
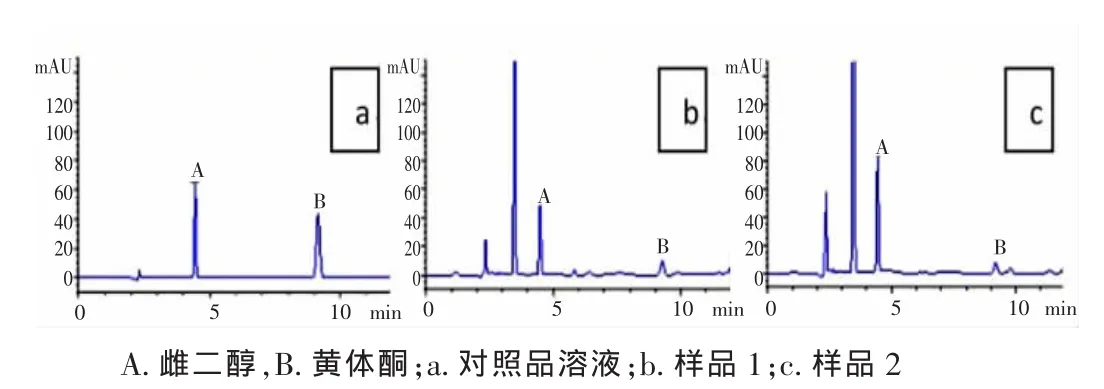
图1 色谱图
2.2线性范围雌二醇的回归方程为Y=19.539X-1.597 4(r=0.999 5),黄体酮的回归方程为Y=15.994X+ 0.904 9(r=0.999 6)。结果表明,雌二醇的进样浓度在5.7~57.2 μg/mL时与峰面积呈良好的线性关系,黄体酮的进样浓度在0.57~22.70 μg/mL时与峰面积呈良好的线性关系。
2.3精密度试验雌二醇的RSD为0.40%,黄体酮的RSD为0.77%。表明仪器精密度良好。
2.4稳定性试验雌二醇的RSD为0.60%,黄体酮的RSD为0.69%。表明样品在24 h内稳定。
2.5重复性试验雌二醇的RSD为0.37%,黄体酮的RSD为1.19%。表明该试验重复可行。
2.6加样回收率试验雌二醇的RSD为1.51%,黄体酮的RSD为1.10%。表明该方法的准确度良好。见表1。
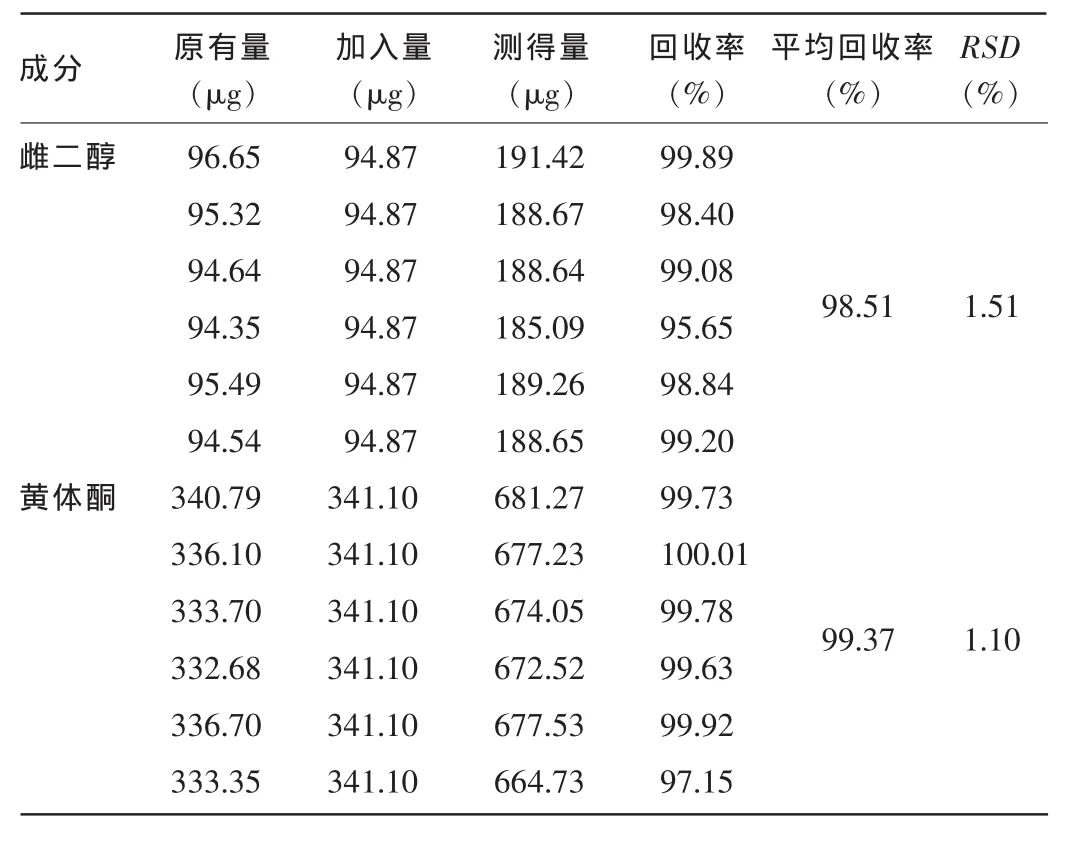
表1 加样回收率试验结果(n=9)
2.7含量测定样品1中雌二醇、黄体酮含量分别为47.32、166.85 μg/g;样品2中雌二醇、黄体酮含量分别为54.71、392.56 μg/g。
3 讨论
3.1波长的选择参考文献[8-9]雌二醇的含量测定方法,雌二醇的最大吸收波长在205 nm附近,另外在225、280nm附近也有吸收,黄体酮的最大吸收波长处在230nm,故最终选择最佳波长为225 nm。
3.2流动相的选择参考文献[10-12]考察了甲醇-水、乙腈-水、甲醇-乙腈-水等流动相,结果显示,乙腈-水作为流动相,雌二醇和黄体酮出峰时间均较为合适,且峰形好,基线平稳,故最终确定使用乙腈-水作为流动相。对乙腈-水作为流动相,考察了不同比例的乙腈-水作为流动相,雌二醇和黄体酮的出峰时间、峰面积大小、峰形尖锐与否、分离度大小等因素,结果显示,以乙腈-水(70∶30)为流动相各项指标都能达到满意效果,故最终决定以乙腈-水(70∶30)作为流动相。
3.3柱温的选择考察了不同柱温(20、25、30、35、40℃)对雌二醇和黄体酮分离效果的影响,结果显示柱温在30℃时,雌二醇和黄体酮的分离效果均较好。
综上所述,本试验旨在为保健品质量检测提供参考,为改善人们的生活质量,提供安全可靠的保健品。在我国化妆品规范2007年版中规定,化妆品中禁止添加性激素,其中就包括雌二醇和黄体酮。市面上某些保健品为见效快,也会添加如雌二醇和黄体酮等雌激素。由于目前保健品质量标准尚未规范,因此在利益驱使下市场投机之举频频出现。而随着保健品越来越被人们所认可,对保健品质量的控制和规范亟须解决。尤其是随着人口老龄化程度的加深,与健康相关的用药问题尚处于注意盲区,老年人未经医生或药师指导,自行盲目使用保健品的现象尤为广泛。这不但影响老年人的健康,还可能延误对疾病的诊断和治疗。而且近几年,针对不同人群的特定保健品也日益增多,从婴幼儿到老年人,几乎覆盖了各个年龄段,因此,在选择保健品时应尤为慎重。为规范保健品的生产、流通、使用,保健品质量控制标准的早日制定、市场的规范运营等,均需要继续努力改进和完善力,只有做到合理、规范、完善,才能切实保护广大人民的身体健康。
[1]曹阳,张若文,钱忠直,等.RP-HPLC法测定林蛙卵中雌二醇的含量[J].中药新药与临床药理,2010,21(5):540-542.
[2]刘畅,夏晶,胡青,等.保健食品中违禁添加6种雌激素类药物的LC_MS_n定性检测[J].中国医药工业杂志,2009,40(7):517-520.
[3]郑虎.药物化学[M].5版.北京:人民卫生出版社,2004:355.
[4]翟宇,黄青.HPLC法测定黄体酮亚微乳注射剂的含量及其制剂稳定性研究[J].宁夏医学杂志,2014,36(4):341-343.
[5]曹泽毅.中华妇产科学[M].北京:人民卫生出版社,1999:2118-2128.
[6]邹毅,杨芳炬,韩旭,等.黄体酮药膜的局部应用试验[J].四川生理科学杂志,2004,26(2):53-55.
[7]汪明性.新编实用药物学[M].北京:科学出版社,2000:441.
[8]张明伟,肖学成,陶竞.HPLC测定雌二醇凝胶中雌二醇的含量[J].中国药学杂志,2010,45(11):876-877.
[9]国家药典委员会.中华人民共和国药典:二部:2015年版[M].北京:中国医药科技出版社,2015:1506.
[10]李静,赵刚,苏庆,等.高效液相色谱法测定聚乙二醇单甲醚-聚D,L-乳酸微球中雌二醇的含量[J].中国医院药学杂志,2010,30(23):2038-2039.
[11]李婷,王铮,张海波,等.高压液相色谱法测定林蛙油、中华绒鳌蟹卵和鲫鱼卵中雌二醇的含量[J].食品安全质量检测学报,2014,5(1):53-58.
[12]常占瑛,王梅,刘桂花,等.天然黄体酮凝胶剂的制备及含量测定[J].中国医院药学杂志,2014,34(24):2091-2095.
Simultaneous determination of estradiol and progesterone contents in health care products by HPLC
Li Qiang,Huang Lijie△
(Henan Provincial Food and Drug Evaluation and Inspection Center/Zhengzhou Municipal Institute for Food and Drug Control,Zhengzhou 450000,China)
Objective To establish a method for the determination of estradiol and progesterone contents illegally added in some brand ginseng tea reducing weight(sample 1)and some brand Paidu Yangyan oral liquid(sample 2).Methods The chromatographic Agilent C18column(4.6 mm×250.0 mm,5 μm)was adopted with acetonitrile-water(70∶30)as the mobile phase;the flow rate was 1.0 mL/min,the detection wavelength was 225 nm and the column temperature was 30℃.Results Estradiol in the range of 5.7~57.2 μg/mLhadgoodlinearity(r=0.9995),progesterone inthe range of 0.57~22.70 μg/mL had good linearity(r=0.999 6);the average recovery rates(n=6)of estradiol and progesterone were 98.51%and 99.37%respectively.The contents of estradiol and progesterone in the sample 1 were 47.32,166.85 μg/g respectively and which in the sample 2 were 54.71,392.56 μg/g respectively.Conclusion This HPLC method is simple and quick with good repeatability and accurate detection results,and can be used as the determination method of estradiol and progesterone contents in the health care products.
Chromatography,high pressure liquid;Estradiol;Progesterone;Dietary supplements
10.3969/j.issn.1009-5519.2016.21.011
A
1009-5519(2016)21-3292-03
李强(1984-),硕士研究生,主要从事食品药品审评查验工作。
△,E-mail:H20160314@126.com。
(2016-04-27
2016-06-01)

