新型5-氟尿嘧啶前药的合成与抗肿瘤活性研究
杨 浩,单媛媛,曹 舫,马 瑛
(1.西安交通大学第一附属医院药学部,西安 710061;2.陕西省肿瘤医院药剂科,西安 710061)
·化学·
新型5-氟尿嘧啶前药的合成与抗肿瘤活性研究
杨 浩1,2,单媛媛1,曹 舫2,马 瑛1
(1.西安交通大学第一附属医院药学部,西安 710061;2.陕西省肿瘤医院药剂科,西安 710061)
目的 寻找新型、高效的5-氟尿嘧啶(5-Fu)前药并测定其抗肿瘤活性。方法 在5-氟尿嘧啶的N1和N3位引入具有抗肿瘤活性的取代基,合成其前体药物,利用MTT方法测定其对不同肿瘤细胞的增殖抑制活性。结果 合成的6个5-氟尿嘧啶前体药物均显示了较好的肿瘤细胞增殖抑制活性。结论 新型5-氟尿嘧啶前药对肿瘤细胞有较好的抑制活性,值得进一步研究。
5-氟尿嘧啶;前体药物;抗肿瘤;肿瘤细胞株
恶性肿瘤已经成为影响人类健康的主要疾病之一,人类因恶性肿瘤而引起的死亡率占所有疾病的第2位,仅次于心脑血管疾病[1]。目前恶性肿瘤的治疗很大程度上仍以化疗为主,但是化疗药物已经从传统的细胞毒性药物逐渐转变为具有靶向性且对肿瘤细胞具有高选择性的靶向小分子药物[2-4]。5-氟尿嘧啶是最早广泛应用于治疗恶性肿瘤的抗代谢类药物之一,是胸腺嘧啶合成酶抑制剂。5-氟尿嘧啶抗肿瘤作用疗效确切,但是5-氟尿嘧啶在体内半衰期短,临床使用一般需要静脉持续灌注给药,毒性和不良反应较高,限制了其在临床上的应用[5]。因此,设计合成疗效高、毒性和不良反应低的氟尿嘧啶衍生物一直是研究的热点之一。
阿托夫定是较早上市的5-氟尿嘧啶前体药物,体内代谢稳定性好,能缓慢释放5-氟尿嘧啶发挥抗肿瘤作用。本课题通过在5-氟尿嘧啶的N1和N3位引入具有抗肿瘤活性的小分子片段,进而延长其在体内的半衰期并增强其抗肿瘤活性。近年来研究发现,甲醛在增加抗肿瘤活性方面发挥着重要的作用,同时在诱导肿瘤细胞分化和死亡方面是一个关键的抗肿瘤因子。通过改变基因表达和诱导细胞凋亡,能够改善母体药物的抗肿瘤活性[6]。二氯乙酸能够通过转移代谢从有糖酵解到葡萄糖氧化促进肿瘤细胞凋亡,抑制肿瘤细胞生长[7]。在非毒性的药物浓度下,丙戊酸能够妨碍肿瘤细胞生长、诱导分化以及通过非毒性机制增加肿瘤细胞的免疫原性[8]。
为了克服5-氟尿嘧啶的缺点,我们在其结构中引入具有抗肿瘤作用的小分子片段,如:甲醛、二氯乙酸和丙戊酸等,合成新型5-氟尿嘧啶前体药物,使其在体内能够同时释放具有不同作用机制的小分子及5-氟尿嘧啶,进而对肿瘤细胞进行多靶点作用。活性筛选结果显示,我们所合成的5-氟尿嘧啶前体药物均具有一定程度的抗肿瘤活性,为5-氟尿嘧啶前体药物的研究开发奠定一定的基础。
1 仪器与材料
1.1 仪器SGWX-4A型显微熔点测定仪(温度未经校正,上海仪电物理光学仪器有限公司);VarianunityINOVA-400MHz核磁共振仪(溶剂CDCl3,内标TMS,美国Varian公司);Agilent1100MSD-Trap-VL质谱仪(日本Agilent公司)。
1.2 试药 合成试剂:5-氟尿嘧啶、2,2-二氯乙酰氯、乙酰氯、氯甲酸异丁酯、丙戊酰氯(南京多点化工)、吡啶、乙酸乙酯、无水硫酸钠、乙醚、二氯甲烷和甲醛(天津科密欧),所用试剂和溶剂均为分析纯,按照常规方法处理。
1.3 材料 人非小细胞肺癌细胞(A549)、人肝癌细胞(7721)、人乳腺癌细胞(MCF-7)和人结肠癌细胞(LOVO)细胞株,由西安交通大学药学院天然药物研究中心惠赠。
活性实验:RPMI1640粉末培养基、胎牛血清(Gibco公司);牛胰岛素(Sigma公司);胰蛋白酶(北京华美生物工程公司);青霉素和链霉素(华北制药集团)。
2 方法
2.1 化合物的制备 所有目标化合物均以5-氟尿嘧啶为起始原料,与不同的具有抗肿瘤活性片段酰化制得。本文采用的具有抗肿瘤活性的酰化片段包括:2,2-二氯乙酰氯、乙酰氯、氯甲酸异丁酯和丙戊酰氯。我们设计的第1个系列5-氟尿嘧啶前体药物是在N3位引入各种具有抗肿瘤活性的酰基片段,分别合成了N3-酰化的5-氟尿嘧啶前药。这些前药在体内的代谢产物为活性抗肿瘤片段和5-氟尿嘧啶,通过在体内释放5-氟尿嘧啶使其保持相对稳定的血药浓度,从而克服5-氟尿嘧啶代谢稳定性差的特性,同时代谢产生的活性小分子片段能够协同发挥抗肿瘤作用,具体合成路线见图1。
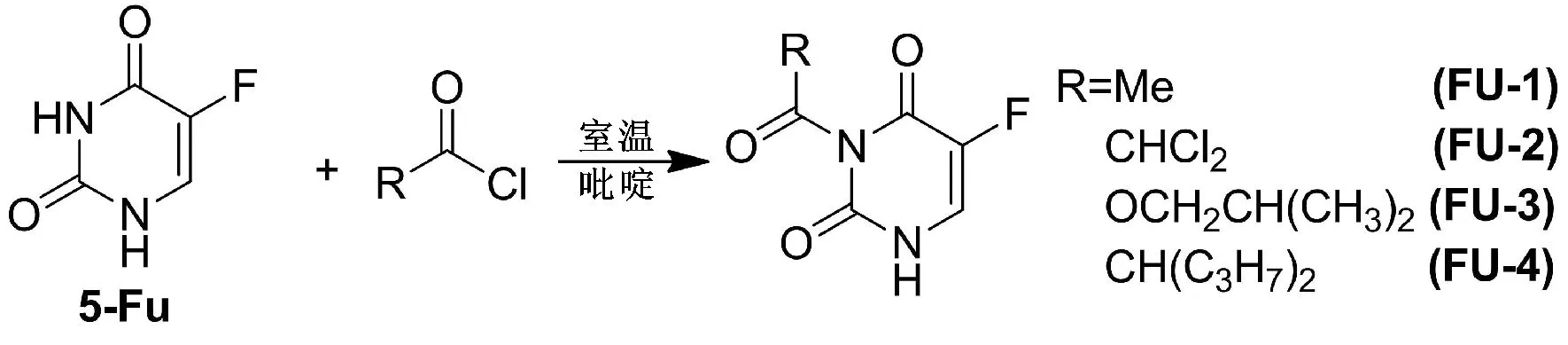
图1 5-氟尿嘧啶的N1取代前体药物合成路线
Fig.1ThesynthesisrouteofN1replaceprecursordrugsof5-Fu
2.1.1 N3-乙酰基-5-氟尿嘧啶(FU-1)的制备 冰浴条件下,将2.60g(20mmol) 5-氟尿嘧啶的吡啶溶液(48mL)在10min内逐滴加入到40mmol(5.70mL)乙酰氯的吡啶溶液(15mL)中。滴加完成后,混合物在室温条件下反应3h[9]。TLC检测反应进程,待反应完全后,将混合物倒入冰水中,用乙酸乙酯萃取,水洗有机相,无水硫酸钠干燥。减压蒸除溶剂后得粗品,乙醚重结晶得到白色固体(2.30g,产率67.0%),熔点:112~114 ℃。ESI/MS(m/z):173.1 [M+H];1H-NMR(400MHz,CDCl3) δ 2.61 (s,3H),7.31 (d,J=7.0Hz,1H)。
2.1.2 N3-二氯乙酰基-5-氟尿嘧啶(FU-2)的制备 冰浴条件下,将2.60g(20mmol) 5-氟尿嘧啶的吡啶溶液(48mL)在10min内逐滴加入到40mmol(3.85mL) 2,2-二氯乙酰氯的吡啶溶液(10mL)中。滴加完成后,混合物在室温条件下反应6h。TLC检测反应进程,待反应完全后,将混合物倒入冰水中,用乙酸乙酯萃取,水洗有机相,无水硫酸钠干燥。减压蒸除溶剂后得粗品,乙醚重结晶得到白色固体(2.55g,产率53.0%),熔点:185~187 °C。ESI/MS(m/z): 241.2 [M+H];1H-NMR(400MHz,CDCl3) δ 7.68 (d,J=7.0Hz,1H),7.15 (s,1H)。
2.1.3 N3-丙戊酰基-5-氟尿嘧啶(FU-3)的制备 冰浴条件下,将0.39g(3mmol) 5-氟尿嘧啶的吡啶溶液(10mL)在10min内逐滴加入到5mmol丙戊酰氯的吡啶溶液(5mL)中。滴加完成后,混合物在室温条件下反应8h。TLC检测反应进程,待反应完全后,将混合物倒入冰水中,用乙酸乙酯萃取,水洗有机相,无水硫酸钠干燥。减压蒸除溶剂后得粗品,乙醚重结晶得到白色固体(2.55g,产率53.0%),熔点:101~102 ℃。ESI/MS(m/z): 257.3 [M+H];1H-NMR(400MHz,CDCl3) δ 7.88 (d,J=6.7Hz,1H),2.52~1.55 (m,4H),1.58~1.62 (m,4H),1.50~1.54 (m,4H),1.07 (t,J=6.4Hz,6H)。
2.1.4 N3-异丁氧甲酰-5-氟尿嘧啶(FU-4)的制备 冰浴条件下,将24mmol氯甲酸异丁酯的吡啶溶液(10mL) 在10min内逐滴加入到2.60g(20mmol) 5-氟尿嘧啶的吡啶溶液(35mL)中。滴加完成后,混合物在室温条件下反应7h。TLC检测反应进程,待反应完全后,将混合物倒入冰水中,用乙酸乙酯萃取,水洗有机相,无水硫酸钠干燥。减压蒸除溶剂后得粗品,二氯甲烷重结晶得到白色固体(3.27g,产率71.0%),熔点:172~174 ℃。ESI/MS(m/z): 231.1 [M+H];1H-NMR(400MHz,CDCl3) δ 8.22 (d,J=6.0Hz,1H),4.07 (d,J=6.7Hz,1H),2.12~1.33 (m,1H),1.08 (t,J=6.6Hz,6H)。
甲醛是一种高度有毒的化合物,近年来研究发现,甲醛在增加抗肿瘤活性方面有重要作用,能够诱导癌细胞分化。此外,甲醛能够改变癌基因表达和诱导细胞凋亡,从而增强母体药物的抗肿瘤活性。因此,我们将甲醛与5-氟尿嘧啶反应得到1,3-二羟甲基-5-氟尿嘧啶,进而在其结构式引入具有抗肿瘤活性的酰基片段,化合物合成路线见图2。
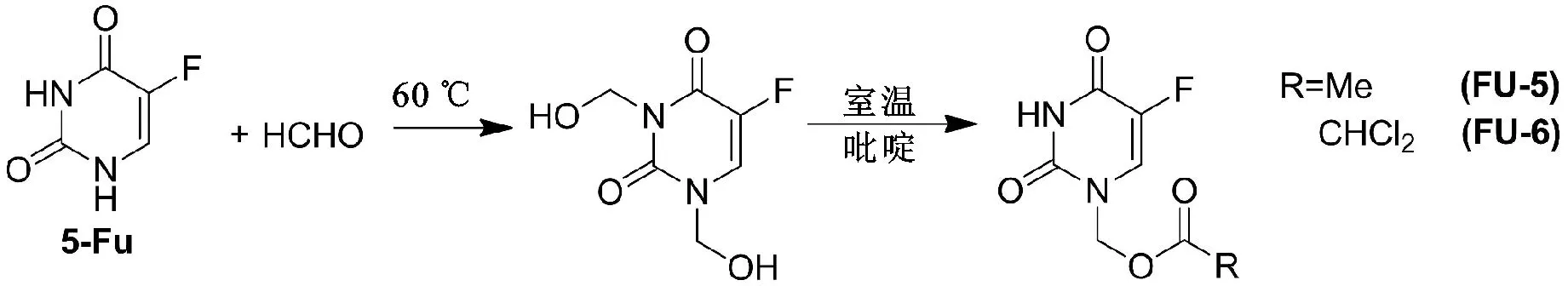
图2 5-氟尿嘧啶的N3取代前体药物合成路线
Fig.2ThesynthesisrouteofN3replaceprecursordrugsof5-Fu
2.1.5 N1-乙酰氧亚甲基-5-氟尿嘧啶(FU-5)的制备 将0.52g的 5-氟尿嘧啶(4mmol)加入到5mL体积分数为37%的甲醛水溶液中。混合物在60 ℃条件下搅拌至固体完全溶解,继续在60 ℃条件下反应1h。减压蒸除溶剂和过量甲醛,得到无色透明油状物,为1,3-二羟甲基-5-氟尿嘧啶[10]。ESI/MS(m/z): 191.0 [M+H];1H-NMR(400MHz,CDCl3) δ 7.78 (d,J=6.0Hz,1H),5.38(s,2H),5.40(s,2H)。
将上述油状物溶于10mL吡啶中,冰浴条件下再向吡啶溶液中缓慢滴加8mmol(1.14mL)乙酰氯的吡啶溶液(10mL)。滴加完成后,混合物在室温条件下反应7h。TLC检测反应进程,待反应完全后,将混合物倒入冰水中,用乙酸乙酯萃取,水洗有机相,无水硫酸钠干燥。减压蒸除溶剂后得粗品,乙醚重结晶得到白色固体(0.44g,产率54.0%),熔点:125~127 ℃。ESI/MS(m/z): 203.1 [M+H];1H-NMR(400MHz,CDCl3) δ 7.83(d,J=6.0Hz,1H),5.72 (s,2H), 2.08(s,3H)。
2.1.6 N1-乙酰氧亚甲基-5-氟尿嘧啶(FU-6)的制备 将上述油状物溶于10mL吡啶中,冰浴条件下再向吡啶溶液中缓慢滴加8mmol2,2-二氯乙酰氯的吡啶溶液(10mL)。滴加完成后,混合物在室温条件下反应8h[11]。TLC检测反应进程,待反应完全后,将混合物倒入冰水中,用乙酸乙酯萃取,水洗有机相,无水硫酸钠干燥。减压蒸除溶剂后得粗品,乙醚重结晶得到白色固体(0.66g,产率61.0%),熔点:189~191 ℃。ESI/MS(m/z): 271.1 [M+H];1H-NMR(400MHz,CDCl3) δ 8.03 (d,J=5.7Hz,1H),7.12 (s,2H)。
2.2 体外抗肿瘤活性筛选 采用MTT方法测定所合成的6个5-氟尿嘧啶前体药物对人非小细胞肺癌细胞(A549)、人肝癌细胞(7721)、人乳腺癌细胞(MCF-7)和人结肠癌细胞(LOVO)的体外抗肿瘤活性,以5-氟尿嘧啶为阳性对照[12]。将处于对数生长期的肿瘤细胞用质量浓度为2.5g·L-1的胰酶消化后稀释成2×104·mL-1,在96孔板中每孔加入100μL,在37 ℃下孵育24h。在每孔中加入不同浓度的待测化合物及相应溶剂对照的新鲜培养基,每孔加100μL(DMSO终浓度<0.5%),每个化合物设6个浓度梯度,每组设3个复孔。37 ℃培养48h后,弃上清液,每孔加入20μLMTT溶液(质量浓度为5mg·mL-1),继续在37 ℃下孵育4h,弃去上清液,每孔加入200μL的DMSO溶解甲簪沉淀,用微型振荡器振荡混匀,用酶标仪在参考波长450nm,检测波长570nm条件下测定每孔的吸光度,分别计算其抑制率和IC50。
3 结果
6个5-氟尿嘧啶前体药物对4种肿瘤细胞株的增殖抑制活性结果见表1。活性筛选结果表明,这6种前体药物对4种常见的人肿瘤细胞均具有不同程度的增殖抑制活性。对于人肝癌细胞7721来说,FU-6的抗肿瘤活性最好;此外,FU-6对人肺癌细胞(A549)和乳腺癌细胞(MCF-7)的抑制活性也是最好的,特别是对乳腺癌细胞,其抗肿瘤活性优于5-氟尿嘧啶,IC50值为5.06μmol·L-1,有较好的发展前景。在我们设计、合成的6个化合物中,化合物FU-6在抗肺癌和结肠癌药物的研究中具有一定的发展前景。见表1。
表1 5-氟尿嘧啶前体药物对不同肿瘤细胞株的抗增殖活性
Tab.1Theanti-proliferativeactivityof5-Fuprecursordrugsindifferenttumorcelllines
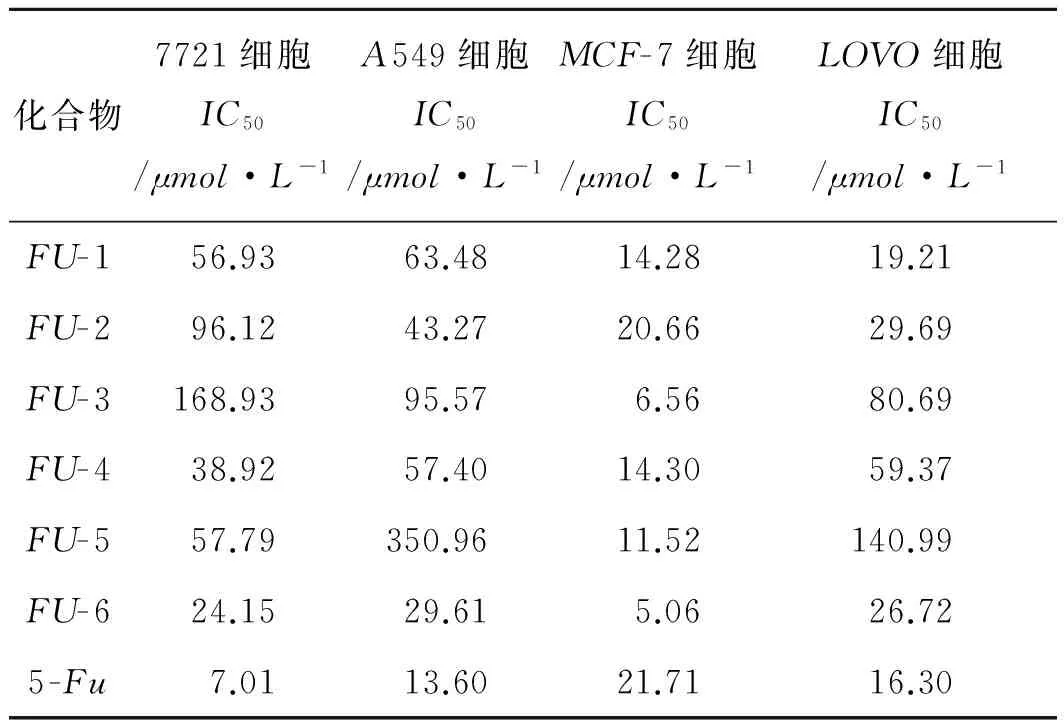
化合物7721细胞IC50/μmol·L-1A549细胞IC50/μmol·L-1MCF-7细胞IC50/μmol·L-1LOVO细胞IC50/μmol·L-1FU-156.9363.4814.2819.21FU-296.1243.2720.6629.69FU-3168.9395.576.5680.69FU-438.9257.4014.3059.37FU-557.79350.9611.52140.99FU-624.1529.615.0626.725-Fu7.0113.6021.7116.30
4 小结
在本文中我们设计、合成了6个5-氟尿嘧啶前体药物,初步的体外抗肿瘤活性筛选结果表明,这6个前体药物对于4种常见的人肿瘤细胞均具有一定程度的增殖抑制活性。特别是对人乳腺癌细胞MCF-7的抑制活性均优于阳性对照,进一步的体内抗肿瘤活性筛选实验正在进行中。研究结果表明,这一类新型含抗肿瘤片段的5-氟尿嘧啶前体药物具有较好的应用前景。
5-氟尿嘧啶一般需要静脉持续给药,给患者带来极大的不便和痛苦。药物消除动力学的非线性特性,使得患者自身或者患者之间会出现明显的个体差异,这些都限制了5-氟尿嘧啶的临床效果。因此,寻找代谢稳定、半衰期长、疗效好且毒性低的新型5-氟尿嘧啶前体药物,进而发现新一代氟尿嘧啶类抗肿瘤药物,具有十分广阔的应用前景。
[1] 王永川,魏丽娟,刘俊田,等.发达与发展中国家癌症发病率与死亡率的比较与分析[J].中国肿瘤临床,2012,39(10):679-682.
[2] 孙燕.肿瘤治疗的新里程碑——靶向药物治疗[J].肿瘤药学,2011,1(1):1-5.
[3] 马瑛,田薇,杨浩.氟脲嘧啶微球的研制[J].西北药学杂志,1996,11(3):121-122.
[4] 连佳芳,张三奇.5-氟尿嘧啶剂型研究进展[J].西北药学杂志,2005,20(5):238-240.
[5] 闫美兴,徐文方,李德爱.5-Fu多级前体药物的设计合成与体内抗肿瘤作用[J].中国新药杂志,2006,15(13):1067-1070.
[6]EngelD,NudelmanA,TarasenkoN,etal.Novelprodrugsoftegafurthatdisplayimprovedanticanceractivityandantiangiogenicproperties[J].JMedChem,2008,51(2):314-323.
[7]KametaniT,KigasawaK,HiiragiM,etal.Studiesonthesynthesisofchemotherapeutics.10.SynthesisandantitumoractivityofN-acylandN-(alkoxycarbonyl)-5-fluorouracilderivatives[J].JMedChem,1980,23(12):1324-1329.
[8]PhillipsA,BullockT,PlantN.Sodiumvalproateinducesapoptosisintherathepatomacellline,FaO[J].Toxicology,2003,192(2/3): 219-227.
[9]KametaniT,KigasawaK,HiiragiM,etal.Studiesonthesynthesisofchemotherapeutics.12.SynthesisandantitumoractivityofN-Phthalidyl-5-fluorouracilderivatives[J].JMedChem,1982,25(10):1219-1222.
[10]OuyangL,HeD,ZhangJ,etal.Selectivebonetargeting5-fluorouracilprodrugs:synthesisandpreliminarybiologicalevaluation[J].BioorgMedChem, 2011,19(12): 3750-3756.
[11]蒋庆琳,吴林艳,吴勇.N1-(芳)烷酰氧亚甲基-5-氟尿嘧啶的合成及其初步抗肿瘤活性的研究[J].华西药学杂志,2005,20(1):12-14.
[12]秦爱方,李燕,宋宏锐,等.含吡啶-2-酰肼结构的索拉非尼类似物的设计、合成及其抗肿瘤活性[J].药学学报,2012,47(12):1623-1629.
Synthesis and anticancer evaluation of 5-fluorouracil prodrugs
YANGHao1,2,SHANYuanyuan1,CAOFang2,MAYing1*
(1.DepartmentofPharmacy,theFirstAffiliatedHospitalofXi′anJiaotongUniversity,Xi′an710061,China;2.DepartmentofPharmacy,ShaanxiProvincinalTumorHospital,Xi′an710061,China)
ObjectiveTosynthesizeandevaluatenovelandpotentprodrugsof5-fluorouracil(5-Fu).MethodsSixprodrugsof5-FuwerepreparedbyincorporatedvarioussubstituentsonN1andN3position.Thein vitroantiproliferativeactivityagainstfivecancercelllineswasevaluatedbyMTTassay.ResultsAllthesixprodrugsof5-Fudisplayedpotentantiproliferativeactivityagainstcancercelllines.ConclusionThesenovelprodrugsexhibitedpotentanticanceractivity,andwereworthoffurtherinvestigation.
5-fluorourail;prodrugs;anticancer;cancercelllines
陕西省社会发展攻关项目(编号:2013K14-02-08)
杨浩,男,副主任药师
*通信作者:马瑛,女,硕士,主任药师
10.3969/j.issn.1004-2407.2016.06.018
R
A
2016-02-27)

