四环素对芘污染农田土壤微生物修复的影响及响应过程①
沈方圆,孙明明,2, 焦加国*,武 俊,田 达,刘 款,李辉信,胡 锋,SCHWAB A. Paul
(1 南京农业大学资源与环境科学学院土壤生态实验室,南京 210095;2 中国科学院土壤环境与污染修复重点实验室 (南京土壤研究所),南京 210008;3 美国德州农工大学土壤与作物科学系,德克萨斯州大学城 77843-2474)
四环素对芘污染农田土壤微生物修复的影响及响应过程①
沈方圆1,孙明明1,2, 焦加国1*,武 俊1,田 达1,刘 款1,李辉信1,胡 锋1,SCHWAB A. Paul3
(1 南京农业大学资源与环境科学学院土壤生态实验室,南京 210095;2 中国科学院土壤环境与污染修复重点实验室 (南京土壤研究所),南京 210008;3 美国德州农工大学土壤与作物科学系,德克萨斯州大学城 77843-2474)
针对城郊农田土壤中多环芳烃和抗生素复合污染的新特征,通过室内模拟土培实验,研究四环素(Tetracycline, TC) 胁迫下,降解菌Sphingobium sp.PHE3 对长三角典型农田土壤中芘的降解效果和影响机制。研究表明,接种降解菌处理(B)能明显促进土壤中芘的降解,TC的引入可显著抑制土壤中芘的深度降解过程(P<0.05)。经过90天培养后,B处理与接菌+添加TC处理(BTC)的降解率分别为40.1%、25.7%,较对照分别提高了23.0倍、14.1倍。通过土壤微生物群落结构多样性分析发现,降解菌数量在经历90天的土壤环境适应期后逐渐快速增加,其数量变化与污染物芘在土壤中含量消减趋势呈负相关;引入芘和四环素对土壤细菌群落结构多样性和功能稳定性具有显著影响(P<0.05),然而对土壤真菌群落影响不显著(P>0.05)。此外,B和BTC处理条件下,土壤过氧化氢酶活性、荧光素二乙酸酯酶活性和土壤微生物生物量碳氮值显著高于单独添加芘处理(P)和单独添加TC处理(TC),但P处理与TC处理之间无显著差异(P>0.05),说明外源污染物(芘或四环素)对于土壤酶活性和微生物生物量碳氮具有显著抑制作用(P<0.05),致使降解菌功能作用受到抑制。综上研究结果表明TC可明显抑制土壤中典型四环多环芳烃的微生物降解过程,针对多环芳烃与抗生素复合有机污染农田土壤的微生物强化修复技术有待深入研究。
多环芳烃;土壤污染;芘;四环素;微生物降解
在我国很多城市周边或近郊共同分布了许多焦化厂、钢铁厂、煤电厂、医疗废弃物处理厂和畜禽养殖场等企业[1]。随着我国“退二进三”、“退城进园”等政策的深入实施,这些污染企业逐渐被关闭或搬迁,随之出现了大量的城郊农田污染土壤[2]。此类土壤中往往含有典型非极性有机污染物多环芳烃(Polycyclic aromatic hydrocarbons, PAHs),PAHs是一类由两个或多个苯环以不同方式聚合而成的一组有机污染物,具有致癌、致畸、致突变等毒性作用[3]。除此之外,此类土壤中往往还含有高浓度的极性有机污染物抗生素(antibiotics)药物。由于在城郊畜禽养殖过程中,大量的兽药类抗生素被用于防治疾病和促进畜禽生长,然而当抗生素进入畜禽体内后,并不能被完全吸收,有研究表明近30% ~ 90% 的抗生素会以母体化合物或中间代谢产物的形式随着畜禽粪便、尿液和体液排出体外,进而导致抗生素进入周边农田土壤环境中[4-5]。这些非极性和极性有机污染物在时间和空间尺度上的同时存在,致使城郊农田土壤呈现出PAHs和抗生素复合污染的全新特征,并且这些复合有机污染物也会随着食物链的传递作用,严重威胁人体健康和环境安全,是亟需解决的土壤环境问题,给修复治理带来了很大挑战。微生物降解PAHs污染农田土壤作为一种环境友好、经济高效的修复技术已得到了深入研究和较广泛的实际应用[6],然而,针对抗生素胁迫下微生物强化降解修复PAHs污染农田土壤的效果和机制仍有待进一步探明。
因而,本研究基于我国城郊农田土壤PAHs与抗生素复合污染的新特征,采用室内模拟土培的方式,研究四环素类抗生素胁迫下土壤中典型四环PAHs污染物芘的微生物降解过程,在探明不同浓度四环素消减过程对土壤中芘的降解动态变化的影响后,揭示降解过程中特异性降解菌和土著微生物生态功能变化的响应机制,以期为我国PAHs与抗生素复合有机污染农田土壤的微生物修复提供理论基础和技术支撑。
1 材料与方法
1.1 供试材料
1.1.1 供试土壤 供试土壤采自江西进贤江西省红壤研究所内(116°26’E,28°37’N),典型农田土壤水稻土;采集的土样风干磨细,过2 mm孔径筛后保存于4 ℃冰箱中。供试土壤理化性状见表1。土样的基本理化性质采用常规分析方法,具体参考文献[7]。
1.1.2 实验仪器与试剂 污染物:芘(四环多环芳烃);抗生素:四环素; 荧光素二乙酸酯(fluorescein diacetate, FDA)及荧光素试剂均由Aladdin Industrial Corporation提供,纯度≥97%;降解菌:Sphingobium sp. PHE3 (中国菌种保藏中心No. CCTCC AB 2010362),分离筛选自南京某钢铁厂附近污染农田土壤[8]。甲醇、乙腈、二氯甲烷(色谱纯)和甲酸(分析纯>98%) 购自德国Merck公司;磷酸盐/EDTA缓冲液;硝酸镁/氨水混合溶液(使用之前即时配制);具体配制方法参考Awad等[9]的实验方法。抗生素标准溶液:准确称取10.0 mg四环素标准物质,以100.0 mL甲醇配成100.0 mg/L的标准储备液,-20 ℃避光存放;从上述储备液中准确吸取0.1 ml于10 ml容量瓶中,用甲醇定容,配成1.0 mg/L 的四环素标准溶液,并用甲醇逐级稀释制备成5 ~ 500 μg/L 标准工作液,4 ℃避光存放。水为双蒸水;其他试剂均为国产分析纯。

表1 供试土壤理化性状Table1 Characteristics of tested soil
芘与四环素的分析采用AB Sciex(LC20ADAPI3200MS/MS) 高效液相色谱/串联质谱仪;样品干燥采用SIGMA CHRIST冷冻干燥机;固相萃取使用CNW固相萃取装置及Waters Oasis HLB 500 mg 6 ml固相萃取柱;实验用品清洗采用KQ 600VDE三频数控超声波清洗器;样品浓缩使用Anpel 氮吹仪;样品过滤采用Anpel公司的PTFE针式滤器。
1.2 试验设计
为考查不同浓度四环素对土壤中芘的微生物降解影响,本研究设计5个处理:原始农田土壤(CK);添加了1.0 mg/kg芘的污染土壤(P);1.0 mg/kg芘污染土壤 + 4%(w/v)降解菌(B);1.0 mg/kg芘污染土壤 + 20.0 mg/kg四环素(TC);1.0 mg/kg芘污染土壤 + 4%(w/v)降解菌 + 20.0 mg/kg四环素(BTC)。每个处理重复3次。
芘与四环素的添加:准确称取12.0 mg的芘溶于10.0 ml丙酮中,然后将其先添加到土壤总量的1/10当中,待丙酮挥发至干后,再用剩下的土与污染土混合,为保证混合均匀,将混合好的土壤反复过2 mm筛多遍。最终土壤中芘的浓度为1.0 mg/kg。将混合好的土壤在暗处静置直至丙酮完全挥发并充分老化至稳定后,进行土培试验。准确称取120.0 mg四环素溶于适量纯水中,具体添加方式与芘相同,最终使其终浓度为20.0 mg/kg。
降解菌液的配制与添加: 在无菌条件下将菌株PHE3接种于LB液体培养基中,28℃下200 r/min 振荡培养至对数生长期,离心后收集菌体,并用无菌水洗涤3次,再用无菌水将菌液调节吸光度(OD 600)至适当浓度备用,含菌量约为2.5×1010CFU/ml,降解菌的加入量为40.0 ml/kg。
由于企业公允价值确认在大多数时是一个估计的结果,所以,其在企业实际应用过程中极易被利用成为操纵利润的工具。同时,企业会计准则不是一种技术手段,不同准则会生成不同的企业会计信息。企业公允价值变动被计入到当期损益之中,其对企业的实际经济收益情况造成了改变,比如当企业交易性金融资产公允价值发生变动时,其将会使得企业产生经济利得或造成经济损失,从而改变企业的短期投资,且只确认了资产的减值,并未确认资产的升值收益;而企业衍生金融工具,其不但能够增加企业的资产或负债,同时还能够直接对企业当期损益情况造成影响。
培养瓶选用250 ml棕色培养瓶,每瓶100.0 g土样。培养期间,使样品含水量达到田间饱和持水量的60%。定期通气补水,25 ℃下避光培养3个月。分别在第1、5、7、14、21、35、50、75、90 天进行破坏性采样。土样混匀后均匀采集土样,所有土样均于4 ℃避光保存,待后续分析。
1.3 试验方法
1.3.1 土壤中芘降解试验 土壤样品前处理及测定条件:供试土壤用二氯甲烷索氏抽提24 h,提取液于旋转蒸发仪上浓缩至干,用环己烷定容至2.0 ml,取0.5 ml 转移至装有1.0 g 硅胶的预处理柱中,再用正己烷/二氯甲烷(1∶1)混合液洗脱,弃去第一组分1.0 ml洗脱液,收集2.0 ml 第二组分的洗脱液,氮气吹干,乙腈定容至1.0 ml,待HPLC分析。液相色谱为日本岛津Class-vp高效液相色谱分析系统,配荧光检测器RF-10AXL,柱温箱OTO-10ASVP,柱温30℃,二元梯度泵LC-10AT,流动相为乙腈/水(60:40),流速为1.5 ml/min;色谱分离柱为美国Varian公司的ChromSpher 5 PAH (VPODS150-4.6 mm, particle size 5 mm, Shimadzu)[10]。
1.3.2 土壤四环素残留量测定试验 土壤样品前处理及测定条件:准确称取2.0 g土壤样品于50.0 ml棕色玻璃离心瓶中,加入磷酸盐/EDTA缓冲液15.0 ml、硝酸镁/氨水混合溶液5.0 ml,涡旋1 min,超声提取15 min,5 000 r/min离心10 min,收集上清液。再按照上述方法重复提取2次,合并提取液,用滤膜(0.45 μm)过滤后超纯水稀释至500.0 ml。固相萃取时,预先用10.0 ml甲醇和10.0 ml超纯水对HLB固相萃取柱进行活化,然后使提取液以3.0 ~ 5.0 ml/min的流速上柱,进行萃取富集。富集完毕后,用10.0 ml超纯水淋洗小柱,并用氮气吹干20 min,除去柱中残留水分,之后用含0.1%甲酸的甲醇溶液进行洗脱,收集的洗脱液在氮吹仪上吹至近干,再用含0.1% 甲酸的甲醇溶液定容至1.0 ml,涡旋混匀后经0.22 μm针式滤器过滤至2.0 ml棕色小样品瓶中,待测。具体方法步骤见参考文献[11]。
1.3.3 土壤微生物过氧化氢酶活性测定 过氧化氢酶活性采用高锰酸钾滴定法测定,其活性以每克风干土壤滴定所需0.1 mol/L KMnO4毫升数(对照与试验测定的差)表示。
1.3.4 土壤微生物荧光素二乙酸脂酶(FDA)活性测定 FDA酶活性采用高锰酸钾滴定法测定,其活性大小用荧光素吸光度值(μg/(g·h))表示。
1.3.5 土壤微生物C/N测定试验 土壤微生物生物量碳用氯仿熏蒸、0.5 mol/L K2SO4提取,用消煮炉定碳;土壤微生物生物量氮用氯仿熏蒸、0.5 mol/L K2SO4提取,用凯氏定氮仪测定。
1.3.6 土壤微生物计数以及降解菌计数试验 采用无机盐培养基(MSM)作为生长底物来富集培养微生物。加入100.0 mg/L的含芘溶液(10 μl/well)作为唯一碳源;将不同稀释度悬液(20 μl)加入96孔板。室温下培养2周后,加入3.0 g/L的INT(碘硝基氯化四氮唑蓝)(50 ul/well),最终观察孔板颜色变化并计数,具体方法参考文献[12]。
所有数据为3次重复样的平均值,利用OriginPro 8.5 SR1和软件 SPSS 21进行数据统计分析。图表采用OriginPro 8.5和Microsoft Excel 2013 软件绘制。
2 结果与讨论
2.1 土壤中芘的降解动态
在 90 天培养过程中,不同处理土壤中芘含量动态变化情况如图 1所示。随着培养时间的延长,土壤芘含量逐渐降低。自然条件下芘降解非常缓慢。由图1可见,在单一芘处理(P)下,与本底值(1.0 mg/kg)相比,芘的浓度未出现明显变化,且芘的消除率仅为1.7%,说明土壤芘降解过程非常缓慢,几乎没有降解效果;由图1A可见,接种降解菌的芘污染土壤处理(B),在培养的前15天,芘的浓度未出现明显变化。经过15天的驯化以后,降解菌才显现出对芘的显著降解活性(P<0.05),降解率逐渐增加,说明降解菌对芘的降解作用存在一定的滞后期。这可能是由于芘的苯环数目较多、分子量大,难被微生物快速降解利用[13]。当降解菌进入土壤经过一段时间的驯化后,降解菌逐渐显现出对土壤中芘的强化降解作用。芘的最终残留浓度为0.6 mg/kg,其降解率达到40.1%(图1),说明降解菌降解效果显著(P<0.05);对芘与四环素复合污染的处理(TC),芘的消除率仅为1.4%。而在接种降解菌的芘与四环素复合污染土壤处理 (BTC) 条件下,芘的最终残留浓度为0.7 mg/kg,降解率为25.7%。相对P、B处理来分析,该降解效果受到显著抑制 (P<0.05),说明在试验浓度下四环素对降解菌的功能表达表现出一定的抑制作用[14],当抗生素进入土壤环境后,土壤微生物群落组成及多样性可能会受到较大扰动和破坏[13-16],进而显著抑制芘的降解修复。
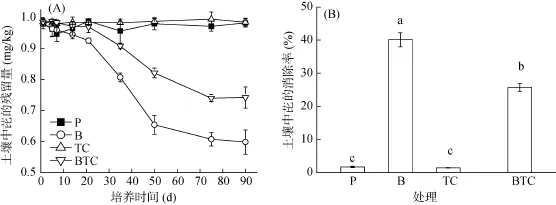
图1 土壤中芘的降解动态 (A. 芘的残留量,B. 芘的去除率)Fig. 1 Degradation dynamics of pyrene (A. residues of pyrene, B. removal rate of pyrene)
2.2 土壤中四环素的消减动态
经过90 天培养后,土壤中四环素的消减动态及消除率见图2。TC、BTC处理下,四环素含量呈现“L”的变化规律,均表现为前期迅速下降,中后期逐渐平稳的规律。这与前人的研究结果相似[17-18]。TC处理下,四环素进入土壤后最终残留量为3.9 mg/kg,消除率为80.2%。在培养前期,四环素在土壤中的消减较快,四环素的半衰期约为14天。这主要是与抗生素种类、土壤温度、湿度、通气状况和土壤性质等因素有关[19]。培养至35天时,四环素残留量为5.2 mg/kg。培养结束后最终残留浓度为3.9 mg/kg,说明四环素进入土壤后在短时期内会有较大幅度的消除,但不能被完全消除,仍有部分浓度会残留到土壤中。这可能是由于初始进入土壤中的抗生素浓度较高,显著抑制了土著微生物的活性与功能,产生了毒害作用,进而导致对四环素消除能力的下降。也可能由于四环素进入土壤环境后以母体或衍生物的形式与土壤有机-无机复合物产生了吸附解吸的老化过程,生物可吸附性显著降低,因而未能完成彻底的消减过程[20]。BTC处理下,四环素最终残留量为2.6 mg/kg,消除率为86.7%。相对TC处理,增加了8.1%,说明接种降解菌可在一定程度上促进四环素的消减过程。这可能是由于外源添加的有益降解菌促进了其他土著微生物的活性,间接地促进了污染土壤中四环素的深度消减。此外,本研究还发现培养结束时,土壤环境中残留四环素含量依然超过了我国长三角许多农田土壤中抗生素含量的普查均值,而未经处理的畜禽粪便年复一年地施于农田,将会增加四环素类抗生素在土壤中的累积和长期持留[14,21-23]。抗生素滥用造成抗性基因的环境污染问题, 抗生素抗性基因的产生和传播扩散已经成为一个备受瞩目的公共安全问题[24-26]。因此,需要深入关注农田土壤中残留抗生素的潜在生态风险。

图2 土壤中四环素的消减动态 (A. 土壤中四环素的残留量,B. 土壤中四环素的去除率)Fig. 2 Changes of the concentration of tetracycline (A. residual of tetracycline in soil, B. dissipation rates of tetracycline)
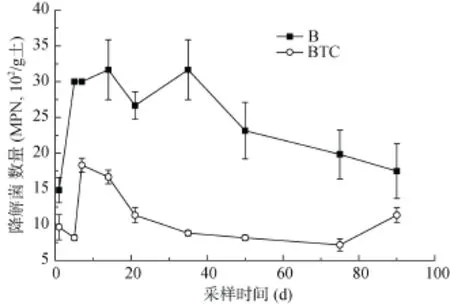
图3 降解菌数量变化Fig. 3 Number dynamics of degrading bacterium
2.3 土壤降解菌数量变化
微生物强化降解土壤中PAHs是一种常见的环境友好型修复技术[27]。在本研究中,芘降解菌数量动态变化情况如图3所示,对于B处理,降解菌进入土壤第1天时并未占据优势生态位,降解菌在短暂适应后的2 ~ 5天内,开始逐渐增殖,表明该处理下降解菌在土壤中具有较强的定殖能力。在随后的5、7、14、21、35天降解菌数量一直维持在较高水平。这可能是接种的降解菌适应了土壤环境。35 ~ 90 天,降解菌数量逐渐降低趋于稳定,可能与微生物自身生长周期有关。相对于B处理,BTC处理对土壤微生物数量具有强烈的抑制作用。由图可见,在整个培养期间,BTC处理下降解菌数量显著低于B处理(P<0.05),这可能是由于四环素的引入对于降解菌具有显著的抑制作用。第5天至第7天,BTC处理降解菌数量逐渐升高,可能是由于四环素的毒性作用随着其母体化合物的降解过程逐渐减弱,因而对降解菌的抑制效果也逐渐降低。第14天以后,降解菌数量逐渐降低趋于稳定,可能与微生物自身生长周期有关。同时发现降解菌数量与污染物芘在土壤中消减趋势呈负相关作用,其数量变化也与污染物芘的含量变化相呼应。该部分研究结果说明四环素不仅对农田土壤环境造成了较大的潜在威胁,而且也会进一步对土壤中多环芳烃等有机污染物的深度降解修复带来较大的干扰作用。
2.4 土壤微生物多样性与结构功能变化
兽药类抗生素主要是用于治疗畜禽细菌或真菌类疾病,但此类抗生素进入土壤后, 势必会对土壤的微生物群落结构和多样性带来影响。土壤微生物多样性指标是有效评估污染物对微生物群落影响程度的方法之一。本实验采用Shannon-Wiener多样性指数对土壤微生物多样性高低进行评价,计算方法如下:Shannon-Wiener多样性指数:H = -∑(Pi)(log2Pi),Pi为此物种个体数占总个体数比例。由表2可见,TC和BCT处理对细菌种群的影响开始表现为抑制作用,在培养第一天,TC、BTC的多样性指数相对CK处理分别降低了23.4%,43.0%,两种处理下细菌多样性显著降低 (P<0.05)。处理至培养结束时,P、B、TC、BTC处理的土壤细菌种群多样性指数相对于第一天降低了41.9%,29.3%,59.2%, 20.5%。这说明细菌种群在整个培养期都处于抑制状态。真菌的多样性指数,培养第1天,除了TC处理,其他处理无显著差异,说明本试验中TC对真菌种群数量表现为显著的抑制作用 (P<0.05);其他处理在培养第1天和第90天没有显著差异 (P>0.05),说明经过90天的培养,本试验处理对土壤真菌无明显影响。

表2 土壤微生物香农多样性指数Table2 Shannon’s diversity indices of soil microbiology

图4 不同处理下土壤微生物群落结构的主成分分析(A. 细菌;B. 真菌)Fig. 4 Principal component analyses of community structure for soils treated with different treatments under different incubation period
利用末端限制性片段长度多态性分析 (T-RFLP)技术对土壤细菌和真菌群落结构进行分析,T-RFLP细菌和真菌数据的主成分分析 (Principal component analysis, PCA) 结果如图4。由图4A可见,在培养1天,各处理参数完全分开,说明污染物对土壤微生物的作用开始显现,即不同污染物处理培养短期内能够对细菌群落结构有显著影响 (P<0.05)。其中相对CK与P处理的距离来说,CK与B 两个处理间距离更近,说明接种降解菌可显著降低土壤中污染物芘对土壤细菌群落结构的影响 (P<0.05);在培养的90天,对比第1天时未完全分开,P与B处理完全分开,说明第1天培养,P、B两处理未出现明显变化,短时间内处理效果并未显现。经过90天的培养时间,降解菌对于芘污染土壤有显著影响 (P<0.05) ,且该结果与表2中细菌多样性指数结果一致。TC与BTC处理没有分开,说明两处理对比下,降解菌的作用被抑制,这与四环素降低降解菌的数量有关。由图4B可见,在培养第1天,CK、B、P、BTC处理下,4个点未完全分离;TC与其他4个处理点完全分离,说明该处理对土著真菌群落影响显著 (P<0.05),其余4个处理对土著真菌群落没有显著影响 (P>0.05),土著真菌群落结构在此阶段变异趋势不清晰。在培养的90天,此阶段中土著真菌群落在P与B处理间显著分离 (P<0.05),表明加入降解菌对于土著真菌结构有较大的影响。而这一结果可能是由于接种降解菌后,直接影响了土著菌的群落结构组成,进而间接改变了土著真菌的群落结构。
2.5 土壤微生物酶活性变化
土壤中酶活性的变化可以反映土壤中微生物降解有机污染物的能力[28-30]。近年来,国外学者展开了土壤酶活性与有机污染物关系的研究,并将土壤酶活性作为评价土壤质量监测指标的研究[31-32]。本研究选取了过氧化氢酶、荧光素二乙酸脂酶(FDA)两种有代表性的土壤酶来表征污染物处理对土壤酶活性的影响。
2.5.1 过氧化氢酶活性变化 过氧化氢酶一定程度上可反映微生物对污染物的解毒能力,是表征土壤生物特性的重要酶[33]。在90天培养过程中,土壤脱氢酶活性变化情况如图5所示。污染物对土壤过氧化氢酶总体表现为抑制→激活→恢复的过程。由于添加外源污染物对酶具有抑制效应,培养第7 ~ 35天,P、B、TC和BTC处理中土壤过氧化氢酶活性随培养时间的延长而整体呈下降趋势,说明不同污染物处理条件下的土壤过氧化氢酶活性受到不同程度的抑制。第35 ~ 50 天,各处理酶活性随着培养时间的延长而迅速升高,50天后升高速率变慢,趋于平缓。且过氧化氢酶活性与芘的降解率呈显著正相关。这可能是由于土壤微生物的降解、土壤有机质的吸附等多种原因引起[34]。对于B和BTC处理来说,过氧化氢酶活性在35天后迅速增加,这可能是接种微生物后,土壤中微生物数量迅速增加进而过氧化氢酶活性提高;随后升高速率变慢,可能是随着时间的延长微生物活性减小。同时也验证了接种降解菌通过提高土壤酶活性而提高了芘的微生物降解效率。
2.5.2 荧光素二乙酸脂酶(Fluorescein diacetate lipase,FDA) 该酶可以用来评价土壤微生物的总体活性[35]。在 90 天培养过程中,FDA酶活性动态变化见图6。各处理条件下的土壤FDA酶活性随着培养时间的延长先升高后下降。培养前14天,各处理条件下的土壤FDA酶活性随培养时间的延长而逐渐升高,土壤FDA酶呈现一定的激活作用,在10天左右各处理组激活作用均达到最高峰,这可能是由于微生物能够利用芘作为碳源和能源刺激自身的生长。另外也有研究表明,抗生素进入土壤也可显著激发土壤酶活性[36](P<0.05)。在培养第14 ~ 35天,P、B、TC、BTC 4个处理酶活性逐渐下降,随后趋于平缓。在培养前20天,相对P处理,B处理酶活性显著提高(P<0.05)。说明接种降解菌可提高土壤微生物对污染物芘的降解。相对未添加四环素的对照处理,添加四环素的处理能够显著降低土壤FDA酶活性(P<0.05)。在培养后期,由于污染物含量减少,酶活性的抑制逐渐减弱。

图5 不同处理下土壤过氧化氢酶活性Fig. 5 Activities of soil catalaseunder different treatments
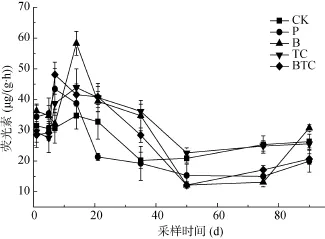
图6 不同处理下土壤荧光素二乙酸脂酶活性Fig. 6 Activities of soil fluorescein diacetate lipase under different treatments
2.6 土壤微生物生物量碳氮的变化
微生物生物量非常敏感,可以作为土壤污染的预警指标[37-38]。土壤微生物生物量碳的变化见图7。由图 7A可以看出,P处理下土壤微生物生物量碳急剧降低,7 天时,微生物生物量碳降为初始浓度的17.7%。从第8 天开始,微生物生物量碳降低的速度减弱;至 35 天时,微生物生物量碳降至最低,仅为初始浓度的30.6%。说明前35天芘对微生物的抑制占据主导地位。35 天以后,微生物生物量碳开始回升,这可能是由于具有耐性的种和未受影响的种的填补作用,微生物生态系统在一定程度上得以维持。B处理通过接种降解菌来专性降解芘,由图7A从第5天至14天内迅速升高,随后逐渐降低。这可能是接种微生物后,土壤中微生物数量迅速增加提高了微生物生物量碳;随后逐渐降低可能是随着时间的延长微生物活性减小。由图7B可见,TC处理从第7 天开始,土壤微生物生物量碳急剧降低;至 14 天时,微生物生物量碳降至最低,加入TC处理的微生物生物量碳为85.2 ~ 100.3 mg/kg,仅为初始浓度的16.7% ~21.5%。14 天以后,加入TC处理的微生物生物量碳开始回升。这可能是因为土壤中微生物在高浓度四环素处理条件下更容易产生抗性。有研究表明,施入含有四环素的畜禽粪便后,土壤中四环素抗性菌数量比对照有明显增加[39]。至 90天时,TC处理的微生物生物量碳恢复至初始值的94.0%。这可能是由于土壤中微生物种类众多,四环素是一种广谱抗菌素,不仅对革兰氏阳性菌、阴性菌、立克次体、滤过性病毒、螺旋体属有抑制作用,乃至原虫类都有很好的抑制作用,但对结核菌、变形菌等则无效。因此,土壤被四环素污染后,土壤微生物生态系统处于开始受干扰的紊乱阶段,但随胁迫时间延长,可能会有几种更具耐性的种群和未受影响的种群来填补,从而微生物生态系统在一定程度上得以维持。且培养时间越长,恢复到原始水平也越容易;对比TC处理,发现BTC处理中微生物量碳所受的抑制作用减弱。说明接种降解菌可显著提高土壤微生物数量(P<0.05),进而提高土壤微生物生物量碳。如图7C、7D可见,微生物生物量氮与微生物生物量碳的变化趋势是相同的。该结果与之前的其他研究人员的研究结果接近一致[40-41]。

图7 土壤微生物生物量碳氮Fig. 7 Soil microbial biomass carbon and nitrogen
从本研究结果可以看出,与对照相比,污染物处理抑制了土壤微生物生长,这可能是由于土壤微生物在四环素胁迫下,微生物为了维持正常的生命活动就需要消耗更多的能量以维持其自身新陈代谢,而相应的用于生长繁殖的能量则相对较少[42],进而致使微生物种群的结构发生改变,从而导致微生物数量减少,进而使得土壤中的微生物量碳氮降低。但也有文献认为有机污染物存在会造成土壤中微生物的生物量、基础呼吸等诸指标的上升[43],不同的有机污染物类型、浓度以及不同的土壤性质均可能是造成这种研究结果不同的主要原因。如果污染物容易成为微生物利用的底物,则会对微生物起到刺激作用。相反,当污染物不能(或较难)被微生物所利用,这时往往会对微生物产生抑制作用。另外,也有研究认为土壤中污染物对微生物是产生刺激还是抑制作用不但与土壤性质以及微生物种类有关,而且与污染物在土壤中的含量有关[44]。
3 结论
1) 接种降解菌处理能有效促进土壤中芘的降解,而添加四环素则显著抑制了土壤芘微生物降解过程 (P<0.05) 。经过90天的培养,B和BTC处理下,芘的降解率分别为40.1%、25.7%,较对照分别提高了23.0倍、14.1倍。
2) P和TC处理对土壤细菌多样性和功能结构有显著影响 (P<0.05) ,但对土壤真菌群落结构的影响不显著(P>0.05)。四环素的添加不仅降低了降解菌的数量与活性,也抑制了芘的深度降解过程。
3) P和TC处理对于土壤酶活性和微生物生物量碳氮有显著抑制作用(P<0.05);接种降解菌处理明显提高了芘污染土壤中过氧化氢酶、FDA酶活性及土壤微生物生物量碳氮含量。
PAHs与抗生素复合污染土壤的新特征,给常规微生物强化修复效果带来了很大程度上的阻碍和干扰,该修复处理可以有效去除多环芳烃,但是对于抗生素的去除效果不太理想。因此需要对抗生素的潜在微生物风险给予高度重视,且今后在实际微生物修复过程中应对抗生素胁迫下对微生物的负面效应予以深入研究。
[1] 刘增俊, 滕应, 黄标, 等. 长江三角洲典型地区农田土壤多环芳烃分布特征与源解析[J]. 土壤学报, 2010, 47(6):1 110-1 117
[2] 孙明明, 滕应, 骆永明, 等. 甲基β环糊精对污染场地土壤中多环芳烃的异位增效洗脱修复研究[J]. 环境科学,2013, 34(6): 2 428-2 435
[3] 马晋荣, 占新华, 周立祥, 等. 表征复合型有机污染场地土壤污染程度的生态指标研究[J]. 南京农业大学学报,2010(4): 69-74
[4] 吴楠, 乔敏. 土壤环境中四环素类抗生素残留及抗性基因污染的研究进展[J]. 生态毒理学报, 2010, 5(5):618-627
[5] Tsibart A S, Gennadiev A N. Polycyclic aromatic hydrocarbons in soils: Sources, behavior, and indication significance (a review) [J]. Eurasian Soil Science, 2013,46(7): 728-741
[6] 侯梅芳, 潘栋宇, 黄赛花, 等. 微生物修复土壤多环芳烃污染的研究进展[J]. 生态环境学报, 2014(7): 1 233-1 238
[7] 尹春艳, 骆永明, 滕应, 等. 典型设施菜地土壤抗生素污染特征与积累规律研究. 环境科学, 2012, 33(8):2 810-2 816
[8] Sun M M, Ye M, Wu J, et al. Impact of bioaccessible pyrene on the abundance of antibiotic resistance genes during Sphingobium sp.- and sophorolipid-enhanced bioremediation in soil[J]. Journal of Hazardous Materials,2015, 300: 121-128
[9] Awad Y M, Kim S, Abd El-Azeem S A M, et al. Veterinary antibiotics contamination in water, sediment, and soil near a swine manure composting facility[J]. Environmental Earth Sciences, 2014, 71(3): 1 433-1 440
[10] 周妍, 滕应, 姚伦芳, 等. 植物-微生物联合对土壤不同粒径组分中PAHs的修复作用[J]. 土壤, 2015, 47(4):711-718
[11] 罗凯, 李文红, 章海波, 等. 南京典型设施菜地有机肥和土壤中四环素类抗生素的污染特征调查[J]. 土壤,2014, 46(2): 330-338
[12] De Man J C. MPN tables, corrected.pdf[J]. Eur. J. Appl. Microbiol. Biotechnol., 1983, 17: 301-305
[13] 孙明明, 骆永明, Peter C, 等. 甲基β环糊精强化微生物修复PAH污染农田土壤[A]//中国化学会环境化学专业委员会、中国环境科学学会环境化学分会、中国毒理学会分析毒理专业委员会. 第六届全国环境化学大会暨环境科学仪器与分析仪器展览会摘要集[C]. 中国化学会环境化学专业委员会、中国环境科学学会环境化学分会、中国毒理学会分析毒理专业委员会, 2011
[14] Liu F, Wu J, Ying G G, et al. Changes in functional diversity of soil microbial community with addition of antibiotics sulfamethoxazole and chlortetracycline[J]. Applied Microbiology and Biotechnology, 2011: 1-9
[15] 毛健, 骆永明, 滕应, 等. 高分子量多环芳烃污染土壤的菌群修复研究[J]. 土壤学报, 2010, 47(1): 163-167
[16] Pinna M V, Castaldi P, Deiana P, et al. Sorption behavior of sulfamethazine on unamended and manure- amended soils and short- term impact on soil microbial community[J]. Ecotoxicology and Environmental Safety, 2012, 84(1):234-242
[17] 牛秋雅. 基于堆肥化和高效降解菌的多环芳烃降解研究[D]. 长沙: 湖南大学, 2013
[18] 张静, 马丽丽, 焦加国, 等. 菲、芘在单一和复合污染条件下不同老化阶段的提取率及其生物有效性. 土壤,2010 42(3): 385-389
[19] Bandowe B A M, Wilcke W. Analysis of polycyclic aromatic hydrocarbons and their oxygen-containing derivatives and metabolites in soils[J]. Environ. Qual.,2010, 39: 1 349-1 358
[20] 贺德春, 许振成, 吴根义, 等. 四环素类抗生素的环境行为研究进展[J]. 动物医学进展, 2011, 32(4): 98-102
[21] 俞慎, 王敏, 洪有为. 环境介质中的抗生素及微生物生态效应[J]. 生态学报, 2011, 31(15): 4 437-4 446
[22] Daghrir R, Drogui P. Tetracycline antibiotics in the environment: A review[J]. Environmental Chemistry Letters, 2013, 11(3): 209-227
[23] Kwon-Rae K, Gary O, Soon-Ik K, et al. Occurrence and environmental fate of veterinary antibiotics in the terrestrial environment[J]. Water, Air, & Soil Pollution, 2011, 214(1):163-174
[24] Bassil R J, Bashour I I, Sleiman F T, et al. Antibiotic uptake by plants from manure-amended soils[J]. J. Environ. Sci. Health B, 2013, 48: 570-574
[25] Zhao L, Dong Y H, Wang H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Sci. Total Environ., 2010, 408:1 069-1 075
[26] Watanabe N, Bergamaschi B A, Loftin K A, et al. Use and environmental occurrence of antibiotics in freestall dairy farms with manured forage fields[J]. Environ. Sci. Technol.,2010, 44: 6 591-6 600
[27] Jechalke S, Focks A, Rosendahl I, et al. Structural and functional response of the soil bacterial community to application of manure from difloxacin-treated pigs[J]. Fems. Microbiology Ecology, 2014, 87(1): 78-88
[28] Hu X G, Zhou Q X, Luo Y. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, northern China[J]. Environmental Pollution, 2010, 158(9): 2 992-2 998
[29] 段伦超, 王风贺, 纪营雪, 等. 不同环境因素下太湖中四环素的自然消减[J]. 环境科学, 2014, 35(4): 1 318-1 325
[30] 张健, 关连珠, 颜丽. 鸡粪中3种四环素类抗生素在棕壤中的动态变化及原因分析[J]. 环境科学学报, 2011(5):1 039-1 044
[31] 鲍艳宇, 周启星, 鲍艳姣, 等. 3种四环素类抗生素在石油污染土壤上的吸附解吸[J]. 中国环境科学, 2012, 32(7):1 257-1 262
[32] 鲍艳宇, 周启星, 万莹, 等. 3种四环素类抗生素在褐土上的吸附和解吸[J]. 中国环境科学, 2010(10): 1 383-1 388
[33] Hammesfahr U, Kotzerke A, Lamshoft M, et al. Effects of sulfadiazine-contaminated fresh and stored manure on a soil microbial community[J]. European Journal of Soil Biology, 2011, 47(1): 61-68
[34] 万莹, 鲍艳宇, 周启星. 土壤有机质和镉对金霉素吸附-解吸的影响[J]. 环境科学, 2010, 31(12): 3 050-3 055
[35] Zhang H B, Luo Y M, Wu L H, et al. Residues and potential ecological risks of veterinary antibiotics in manures and composts associated with protected vegetable farming. Environmental Science and Pollution Research, 2015,22(8): 5 908-5 918
[36] 申龙. 鸡粪和四环素对土壤酶活性及微生物数量的影响[D]. 沈阳: 沈阳农业大学, 2013
[37] Ling W T, Zeng Y C, Gao Y Z, et al. Availability of polycyclic aromatic hydrocarbons in aging soils[J]. Journal of Soils and Sediments, 2010, 10(5SI): 799-807
[38] Opperman T J, Williams J D, Houseweart C, et al. Efflux-mediated bis-indole resistance in Staphylococcus aureus reveals differential substrate specificities for MepA and MepR[J]. Bioorganic & Medicinal Chemistry, 2010,18(6): 2 123-2 130
[39] Gullberg E, Cao S, Berg O G, et al. Selection of resistant bacteria at very low antibiotic concentrations[J]. PLoS Pathog. 2011, 7(7): 395-396
[40] 王华金, 朱能武, 杨崇, 等. 石油污染土壤生物修复对土壤酶活性的影响[J]. 农业环境科学学报, 2013, 32(6):1 178-1 184
[41] 梽袁德. 土壤中抗生素残留对土壤微生物活性与功能的影响[J]. 江苏农业科学, 2014, 42(8): 319-321
[42] Unger I M, Goyne K W,Kennedy A C, et al. Antibiotic effects on microbial community characteristics in soils under conservation management practices[J]. Soil Science Society of America Journal, 2013, 771: 100-112
[43] 姚建华, 牛德奎, 李兆君, 等. 抗生素土霉素对小麦根际土壤酶活性和微生物生物量的影响[J]. 中国农业科学,2010, 43(4): 721-728
[44] Essumang D K, Kowalski K, Sogaard E G. Levels,distribution and source characterization of polycyclic aromatic hydrocarbons (PAHs) in topsoils and roadside soils in Esbjerg, Denmark[J]. Bull. Environ. Contam. Toxico., 2011, 86: 438-443
Effects and Response Process of Tetracycline on Bioremediation of Pyrene-contaminated Soil
SHEN Fangyuan1, SUN Mingming1,2, JIAO Jiaguo1*, WU Jun1, TIAN Da1,LIU Kuan1, LI Huixin1, HU Feng1, SCHWAB A. Paul3
(1 Laboratory of Soil Ecology, College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China; 2 Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 3 Department of Soil and Crop Sciences, Texas A & M University, College Station, Texas,United States 77843-2474)
An inoculation experiment in thermostatic incubator was carried out to investigate the effects and mechanisms of polycyclic aromatic hydrocarbons (PAHs) degrading bacteria Sphingobium sp.PHE3 inoculation (B) on pyrene dissipation in arable soil co-polluted with tetracycline (TC). The results indicated that PHE3 inoculation significantly increased the degradation rate of PAHs (P<0.05), while tetracycline existence in the soil obviously inhibited microbial degradation of pyrene in soil. At the end of the 90 days of incubation, the removal rates of pyrene in the treatment with sole PHE3 inoculation and combined inoculation of PHE3 with TC addition (BTC) were 40.12% and 25.72%, respectively, which were 23.0 and 14.1 times higher than that of the control (CK). Meanwhile, a significant increase of soil microbial diversity and function structure were also observed after transient adaptation by PHE3 inoculation to the soil (P<0.05), suggesting a negative correlation between soil microbial activity and pyrene content in the soil. In addition, soil catalase activity, FDA enzyme activity and soil microbial biomass carbon and nitrogen (MBC/N) in the treatments B and BTC were also significantly higher than those of with pyrene addition (P)treatment and TC treatment. However, no significant difference was found for the soil enzyme activity and MBC/N between P and TC treatments (P>0.05), indicating that exogenous pollutants had a significant inhibition on soil microbial activity, and B weakened the inhibition. Therefore, it can be concluded that as the typical tetracyclic pollutant, TC can obviously inhibit the biodegradation of pyrene in soil, and the potential threat posed by the tetracyclines from organic fertilizer application has become a concern and need further monitoring for the soil environment.
PAHs; Soil contamination; Pyrene; Tetracyclines; Bioremediation
X53
10.13758/j.cnki.tr.2016.05.017
国家自然科学青年基金项目(41401254,41401347,41201252,41201252)、江苏省自然科学青年基金项目(BK20141050,BK20140723)和中国科学院土壤环境与污染修复重点实验室基金项目(SEPR2014-01)资助。
*通讯作者(jiaguojiao@njau.edu.cn)
沈方圆(1989—),女,河南漯河人,硕士研究生,主要从事有机污染农田土壤微生物修复研究。E-mail: 2013103029@njau.edu.cn

