大豆胰蛋白酶抑制剂失活的研究
王瑞军
(黑龙江农垦科技职业学院,黑龙江哈尔滨 150431)
大豆胰蛋白酶抑制剂失活的研究
王瑞军
(黑龙江农垦科技职业学院,黑龙江哈尔滨150431)
利用酶、温度、酸碱度、底物质量分数4个因素对胰蛋白酶抑制剂的影响及相互作用,将胰蛋白酶抑制剂降至最低。试验得到最适酶为胃蛋白酶,其用量为0.001 2 g/3 g,温度为70℃,pH值为7,底物质量分数为9%;其中,酶的用量和温度的升降对胰蛋白酶抑制剂有显著的影响。经过验证试验表明,该结果有效可靠。
胰蛋白酶抑制剂;大豆;失活
0 引言
通过鲍曼·贝尔克和库尼兹2位科学家的努力,研究人员对胰蛋白酶抑制剂(Trypsin inbitor,TI)有了一定的了解[1-7]。目前,国内外主要采用加热的方法去除大豆中的胰蛋白酶抑制剂,但会对大豆中营养成分有所损害,不益于人体健康。因此,应采用多种因素对胰蛋白酶抑制剂进行影响,使大豆中的营养成分损失最低。本试验通过对酶温度、pH值、底物质量分数4个因素对胰蛋白酶抑制剂的影响,选择4个因素最适水平范围进行正交试验,经方差分析和多重比较得出最优组合,然后进行验证试验,得出结论。
1 大豆胰蛋白酶抑制剂失活的研究
1.1试验设备及材料
1.1.1试验材料及试剂
大豆、胰蛋白酶(Sigma公司)、胃蛋白酶、木瓜蛋白酶、盐酸、磷酸二氢钠、磷酸氢二钠、酪蛋白、三氯乙酸、蒸馏水。
1.1.2试验仪器设备
紫外分光光度计,北京普哲通用仪器有限公司产品;HH-1型水浴锅,江苏省金坛市仪器制造有限公司产品;PHS-3C型pH计,上海精密科学仪器有限公司产品;电子天平,上海民桥精密科学仪器有限公司产品;LD5-2A型离心机,北京医用离心机厂产品;分析天平,北京医用天平厂产品。
1.2试验方法
1.2.1最适波长的测定
取胰蛋白酶0.5 g,加50.0 mL蒸馏水溶解,配制成1%胰蛋白酶溶液,通过紫外分光光度计,对波长在275~300 nm的吸光度进行测定,得到最大吸收波长为283 nm。
1.2.2胰蛋白酶抑制剂活性的测定[8]
在35℃,水浴20 min条件下,主要是应用三氯乙酸使胰蛋白酶抑制剂失活的机理,通过调整提取液与三氯乙酸加入的顺序不同,先测出胰蛋白酶活性,之后用三氯乙酸使提取液中的胰蛋白酶抑制剂失活,再用二者的差值得出胰蛋白酶抑制剂活性。
胰蛋白酶抑制活性测定见表1。
对上述配制溶液进行离心(转速为3 000 r/min)10 min,取上清液于最适波长处测光密度值。
1.2.3计算活性
(1)胰蛋白酶活性单位。每1 min水解蛋白在最适波长处增加0.01个吸收度的活性为1个单位。公式为:

表1 胰蛋白酶抑制活性测定
(2)胰蛋白酶抑制因子活性单位。每1 min使胰蛋白在最适波长处降低一个吸收度的活性为1个单位。公式为:胰蛋白酶抑制因子活性=
1.3溶液的配制
1.3.1豆粉溶液的制备
市售有机大豆,用石磨研磨3次,过80目筛,得粉末,干燥保藏。准确称取豆粉3 g,置于试管中,用150 mL蒸馏水稀释,混匀。
1.3.1磷酸缓冲液的配制[9]
(1)0.1 mol/L Na2HPO4制备。取Na2HPO4·12H2O 17.91 g加水溶解并定容至500 mL。
(2)0.1 mol/L NaH2PO4制备。取NaH2PO4·2H2O 7.805 g加水溶解并定容至500 mL。
取435.0 mL 0.1 mol/L Na2HPO4溶液与65.0 mL 0.1 mol/L NaH2PO4溶液混合,调整pH值至7.6,即为0.1 mol/L磷酸缓冲液。
1.3.2胰蛋白酶液的制备
精密吸取25.0 mg胰蛋白酶,溶解于0.001 mol/L盐酸溶液中,定容至100 mL。
1.4试验方案
1.4.1单因素试验
(1)pH值对胰蛋白酶抑制剂的影响。在温度为25℃,底物质量分数为2%的原溶液中,确定pH值为4,5,7,8,9,测定每个水平TI的活性。
(2)温度对胰蛋白酶抑制剂的影响。在pH值为6,底物质量分数为2%的原溶液中,确定温度为50,60,70,80,90℃,测定每个水平TI的活性。
(3)底物质量分数对胰蛋白酶抑制剂的影响。在温度为25℃,pH值为6的原溶液中,确定底物质量分数为5%,9%,13%,17%,20%,测定每个水平TI的活性。
(4)胃蛋白酶对胰蛋白酶抑制剂的影响。在pH值为2,底物质量分数为2%的原溶液中分别加入0.000 6,0.001 2,0.001 8,0.002 4,0.003 0 g胃蛋白酶,温度为40℃,加热10 min,测定每个水平TI的活性。
(5)木瓜蛋白酶对胰蛋白酶抑制剂的影响。在pH值为6,底物质量分数为2%的原溶液中分别加入0.000 6,0.001 2,0.001 8,0.002 4,0.003 0 g木瓜蛋白酶,温度为65℃,加热10 min,测定每个水平TI的活性。
1.4.2正交试验
因素与水平设计见表2。
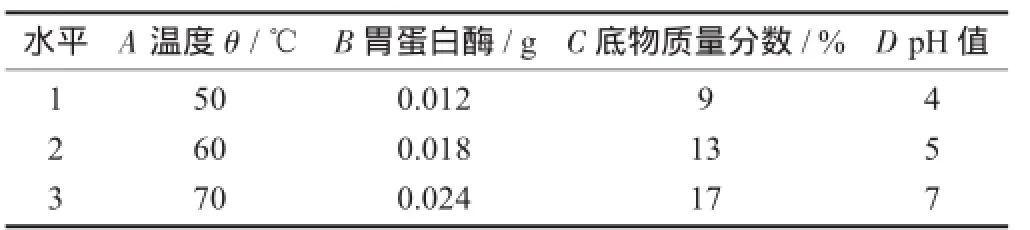
表2 因素与水平设计
1.4.3验证试验
通过正交试验分析可得到最优组合,与正交试验最大值相比较进行验证。
2 结果与分析
2.1单因素试验
2.1.1pH值对胰蛋白酶抑制剂的影响
pH值对胰蛋白酶抑制剂的影响见图1。

图1 pH值对胰蛋白酶抑制剂的影响
由图1可知,最适pH值为4,5,7。
胰蛋白酶抑制剂只有在最适pH值条件下才稳定,过酸或过碱都会引起胰蛋白酶抑制剂的变性而改变其活性。因为随着pH值的变化会影响胰蛋白酶抑制剂上许多极性基团的离子特性,在不同pH值条件下,这些基团的解离状态不同,只有在胰蛋白酶抑制剂最佳状态下,才能发挥其最大活性。
2.1.2温度对胰蛋白酶抑制剂的影响
温度对胰蛋白酶抑制剂的影响见图2。
由图2可知,最适温度为50,60,70℃。
当温度升高时,反应速度加快,这与一般化学反应一样,从而提高胰蛋白酶抑制剂的活性;然而,随着温度升高而使胰蛋白酶抑制逐步变性,进而降低胰蛋白酶抑制剂活性。
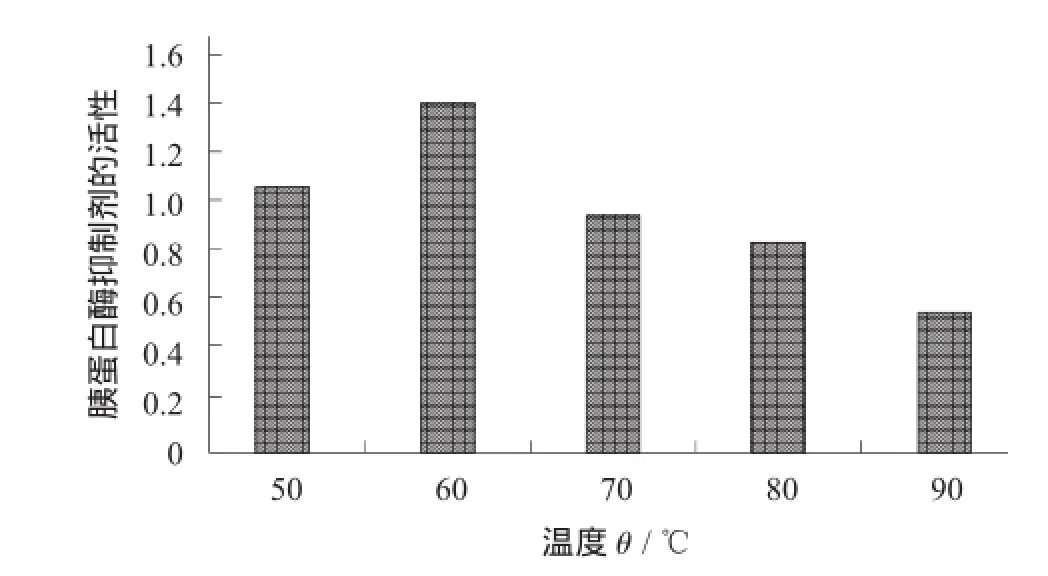
图2 温度对胰蛋白酶抑制剂的影响
2.1.3底物质量分数对胰蛋白酶抑制剂的影响
底物质量分数对胰蛋白酶抑制剂的影响见图3。
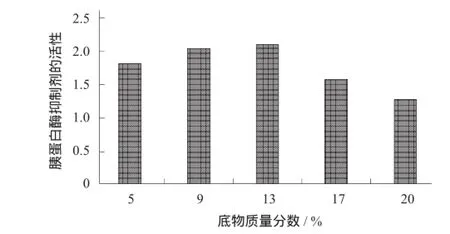
图3 底物质量分数对胰蛋白酶抑制剂的影响
由图3可知,最适底物质量分数为9%,13%,17%。
胰蛋白酶抑制剂有一定的大小和几何形状,因此对底物进行选择。大小和几何形状不合适的分子不能与活性接触,而且只有进行有效碰撞才能进行反应。随原溶液底物质量分数的增大,底物与胰蛋白酶抑制剂接触的几率增大,胰蛋白酶抑制剂活性升高。然而,底物质量分数达到一定程度就会阻碍反应物的有效碰撞,从而使胰蛋白酶抑制剂的活性降低。
2.1.4胃蛋白酶对胰蛋白酶抑制剂的影响
胃蛋白酶对胰蛋白酶抑制剂的影响见表3。
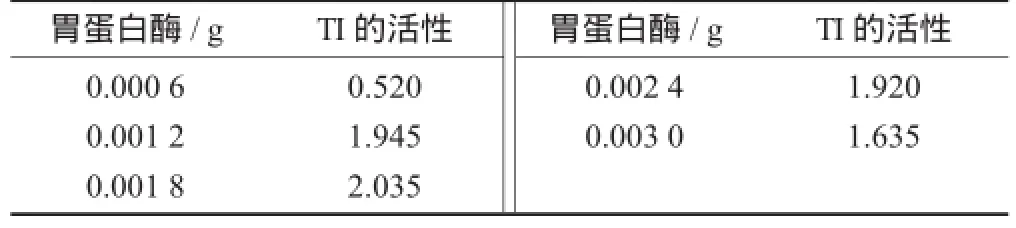
表3 胃蛋白酶对胰蛋白酶抑制剂的影响
2.1.5木瓜蛋白酶对胰蛋白酶抑制剂的影响
木瓜蛋白酶对胰蛋白酶抑制剂的影响见表4。
2.1.6对比[10]
对比2种酶(胃蛋白酶、木瓜蛋白酶)对胰蛋白酶抑制剂失活的影响,选择最佳的酶。
木瓜蛋白酶与胃蛋白酶对比见图4。表4木瓜蛋白酶对胰蛋白酶抑制剂的影响
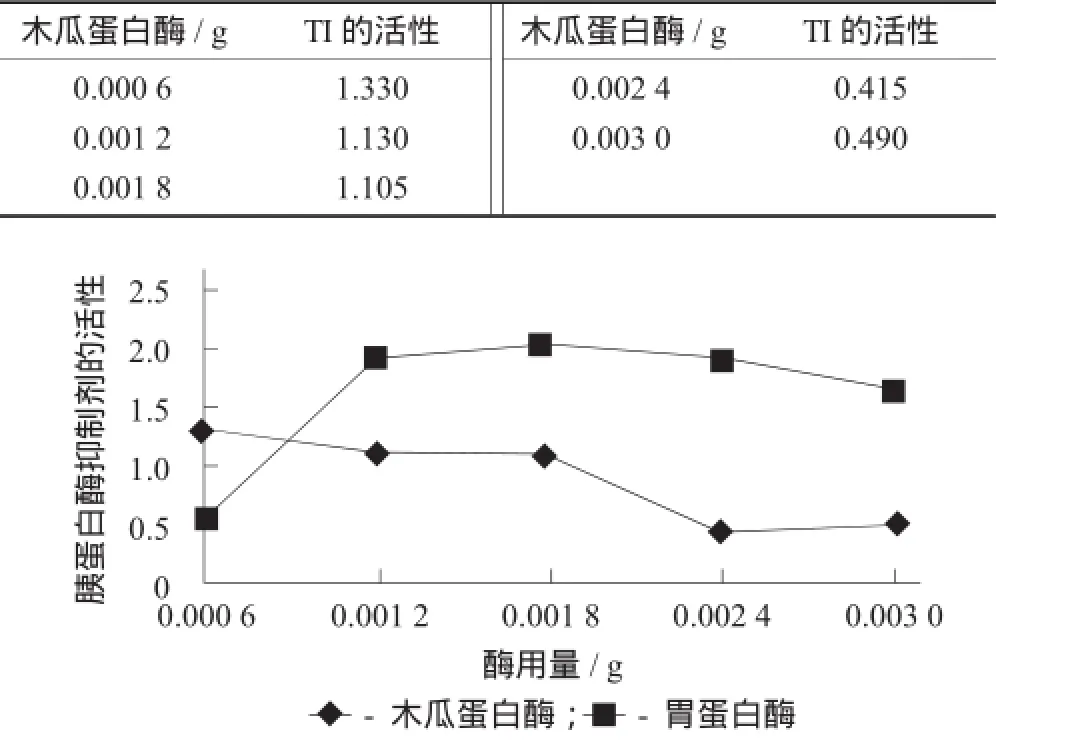
图4 木瓜蛋白酶与胃蛋白酶对比
由图4可知,胃蛋白酶在0.001 2~0.002 4 g/3 g时,活性最大,而木瓜蛋白酶在0.000 6~0.001 8 g/3 g的活性最大;但从总体上看,胃蛋白酶对胰蛋白酶抑制剂的影响要大于木瓜蛋白酶对胰蛋白酶抑制剂的影响。主要是因为胃蛋白酶是酸性蛋白酶,而木瓜蛋白酶是中性蛋白酶,酸性蛋白酶对胰蛋白酶的抑制要大于中性蛋白酶的抑制。
2.2L9(34)正交试验
正交试验结果与分析见表5,方差分析见表6,直观分析见图5。
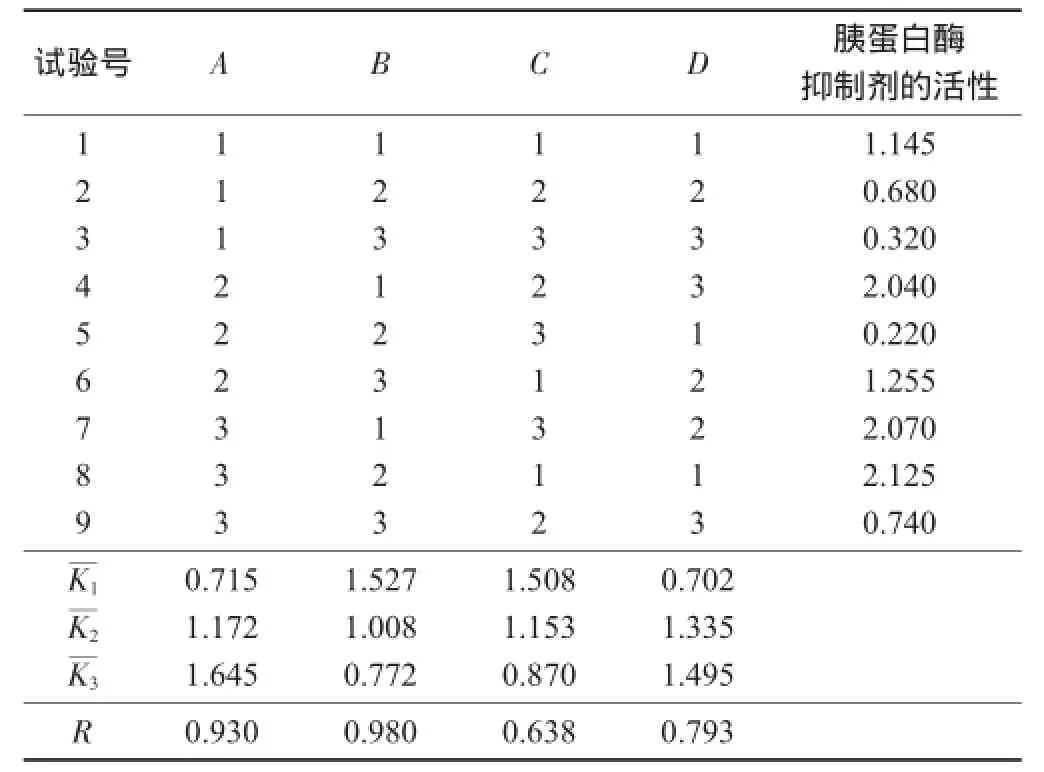
表5 正交试验结果与分析
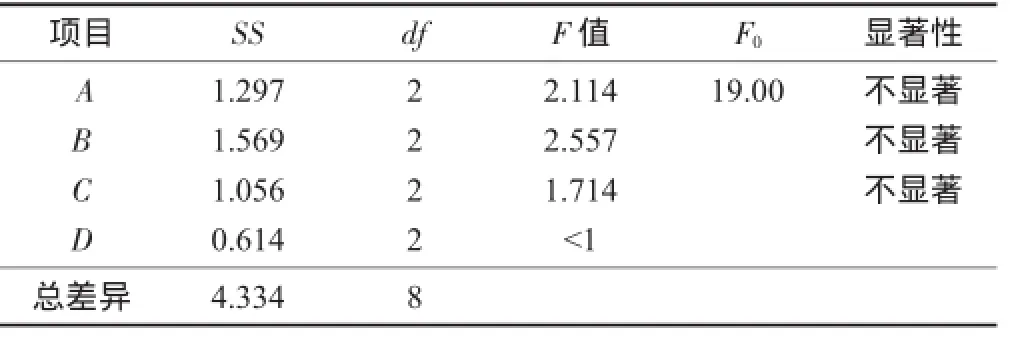
表6 方差分析
2.3验证试验
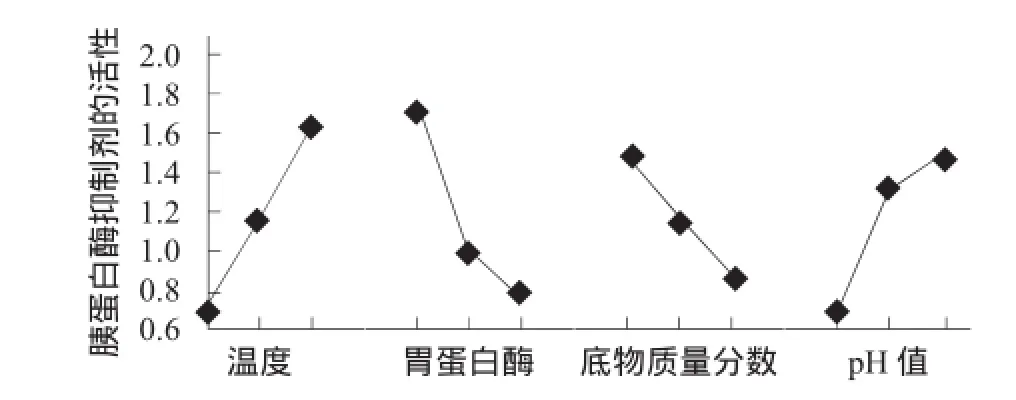
经过直观分析法可知温度为70℃,胃蛋白酶用量0.001 2 g/3 g,pH值为7,底物质量分数为9%进行验证试验。与第8组试验相比,经过3次试验,得到平均值2.130>2.125,由此可证实试验成功。
3 讨论与结论
本次试验利用综合处理的方法,应用多种因素对胰蛋白酶抑制剂进行影响。通过验证试验证明结论具有一定的可行性,可以有效地去除大豆中的胰蛋白酶抑制剂,为后续研究提供一定的依据。
从试验结果可以看出,胃蛋白酶对胰蛋白酶抑制剂影响最大,这体现酶的高效性;温度对胰蛋白酶抑制剂也比较显著,但长时间加热也会使蛋白质变性,有效赖氨酸数量因美拉德反应而降低。而且,鲍曼-贝尔克中含有多个二硫键高度重叠的分子结构,具有极高的耐热性。
胰蛋白酶抑制剂的性质及一些功能已经证实,但是要对其做全面的认识,特别是对其抗性机制的研究,必须做进一步的探索。应用物理、化学、微生物及酶制剂综合作用的研究方法去除大豆中的胰蛋白酶抑制剂,这样不仅可以去除其中胰蛋白酶抑制剂的活性,还可以减少蛋白质的大量变性,而且加快大豆加工生产工艺流程,同时节省能源,更好地增加豆制品的营养价值,提高其功能特性。
[1]石彦国,任丽.大豆制品工艺学 [M].北京:中国轻工出版社,1998:8.
[2]Kwok K C,Qin W H,Tsang J C.Heat in activation of the research advance in the inactivating methods of soybean trypsinhibitor[J].Journal of Food Science,1993,58(4):859-862.
[3]Espin N,Oslam M N.Stabilization of pa pain from papaya peels[J].FoodScienceandTechnologyinTernational,1998,4(3):179-181.
[4]霍贵成,杨丽杰.豆科植物中抗营养因子 [J].饲料博览,1996(8):5-7.
[5]万善霞,张淑平.胰蛋白酶抑制剂在不同领域的研究概况 [J].北京农学院学报,2002(10):20-23.
[6]Brzin J,Rogelj B,Popovic T,et al.A new type of cysteine proteinase inhibitor from fruit bodies of mushroom clitocybe nebularis[J].Journal of Biological Chemistry,2000,275(26):20 104-20 109.
[7]Iosif A V,Haram B Y.Prote olysis of kunitz soybean trypsin inhibitor,in fluenceon its activity[J].J Agric Food Chem,1995,43(4):862-866.
[8]曹龙奎.大豆加工过程中去除胰蛋白酶抑制因子的研究 [D].长春:吉林农业大学,1992.
[9]吴非,霍贵成.酶法顿化大豆胰蛋白酶抑制剂研究 [J].粮食与油脂,2002(6):9-10.
[10]王钦得,杨坚.食品实验设计与统计分析 [M].北京:中国农业大学出版社,2003:2-4.◇
Study on Soybean Trgpsin Inhibitor Inactivation
WANG Ruijun
(Heilongjiang Land Reclamation Vocational College of Techology,Harbin,Heilongjiang 150431,China)
There are four factors affect trypsin inhibitor:enzyme,temperature,acid and alkali degree,reactive volume,which are affect each other,and make trypsin inhibitor active fall.The experients results show that:gastric protein enzyme 0.001 2 g/3 g,temperature 70℃,pH 7,reactive volume 9%.The two factors which affect trypsin inhibitor very remarkable are enzyme volume and temperature.We have proved experiment and prove experiment result which is right.
trypsin inhibitor;soybean;inactivation
Q503
A
10.16693/j.cnki.1671-9646(X).2016.01.032
2015-11-20
王瑞军(1979— ),男,本科,工程师,研究方向为粮油加工。

