食品中黄曲霉毒素B1 ELISA试剂盒检测方法的建立及验证
谢体波 易重任 陈旭 等
摘要:建立了黄曲霉毒素B1酶联免疫试剂盒检测的方法,并通过对食用油、花生、谷物中黄曲霉毒素B1测定进行验证。结果表明,在25 ℃条件下加入50 μL标准品溶液、50 μL抗体工作液、50 μL酶标二抗反应30 min变异性最小;ELISA试剂盒检测灵敏度高,对食用油、谷物、花生样品中黄曲霉毒素B1最低检测限分别为88.82 ng/L和48.51、176.56 ng/kg;平均回收率和变异系数符合相关规定;与高效液相色谱法相比,检测结果一致。
关键词:黄曲霉毒素B1;ELISA试剂盒;食用油;花生;玉米
中图分类号:R155.5;TS201.6 文献标识码:A 文章编号:0439-8114(2016)04-1008-05
DOI:10.14088/j.cnki.issn0439-8114.2016.04.048
Establishment and Validation of Aflatoxin B1 ELISA Kit Test Method in Foods
XIE Ti-bo1,YI Zhong-ren1,CHEN Xu1,LIU Tian-lei1,ZHANG Lei1,WEI Li-li1,
LUO Gui-kun1,TAO Guang-can1,HE Fang-yang1,2
(1. Gui Zhou Kwinbon Food Safety Science-Technology Co., Ltd., Guiyang 550009,China;
2.Beijing Kwinbon Biotechnology Co., Ltd., Beijing 100012,China)
Abstract:This experiment has established the detection method of aflatoxin B1 whit ELISA kit,and based on the determination of aflatoxin B1 in cooking oil, peanuts,corn was validated,the results show that under the condition of 25 ℃,50 μL standard solution,50 μL antibody working liquid, 50 μL enzyme mark two antibody reacted 30min,variability was minimum;ELISA kit is high detection sensitivity,the aflatoxin B1 minimum detection limit in samples of cooking oil,corn,peanuts,were 88.82 ng/L,48.51 ng/kg,176.56 ng/kg;The average recovery and variation coefficient in accordance with relevant provisions and HPLC.
Key words: aflatoxin B1; ELISA kit; edible oil; peanut; maize
黄曲霉毒素(AFT)是由寄生曲霉和黄曲霉在生长的后期分泌产生的一类次生代谢物,是自然界中已发现的理化性质最稳定的一类霉菌毒素[1],具有极强毒性和致癌性。黄曲霉毒素在湿热地区饲料和食品中出现的几率较高,尤其是在谷物和粮油食品中出现的几率极高,导致榨出的油及饲料中也含有黄曲霉毒素,其中黄曲霉毒素B1在曲霉毒素群中的毒性最强,分布最广[2]。
目前对食品、农产品中黄曲霉毒素检测方法主要有高效液相色谱法(HPLC)[3]、色谱串联质谱(LC/MS/MS)[4]、薄层色谱法[5]、荧光光谱法(FS)[6]和酶联免疫吸附法(ELISA)[7]等。ELISA是测定黄曲霉毒素含量的常用方法,所涉及的仪器及试剂比较少,操作比较简单,被很多企事业单位所采用[8]。本试验建立了ELISA对黄曲霉毒素B1的检测方法,并通过对食用油、花生、谷物中黄曲霉毒素B1的检测验证了该方法的精密度、准确度、稳定性等,以期为黄曲霉毒素酶联免疫试剂盒的制备提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 样品与主要试剂 食用油、花生、谷物均为市售;黄曲霉毒素B1 ELISA检测试剂盒,北京勤邦生物技术有限公司;黄曲霉毒素B1标准品,纯度≥99%,美国Sigma公司;抗体工作液,酶标二抗,底物A液和B液,终止液,PBST洗液;乙腈、乙酸乙酯、正己烷、氢氧化钠、浓盐酸、十二水合磷酸氢二钠均为分析纯,北京化学试剂公司;去离子水(自制)。
1.1.2 主要仪器 8010S匀浆机,MK3酶标仪,DSY-Ⅲ氮吹仪,2000-SBL电子天平,KS-I1振荡器,Anke GL-20G-lI高速离心机,QL-901漩涡混合器,微量移液器(单道20~200 μL、100~1 000 μL,多道250 μL ):Anglent 1200高效液相色谱仪。
1.2 检测方法的建立
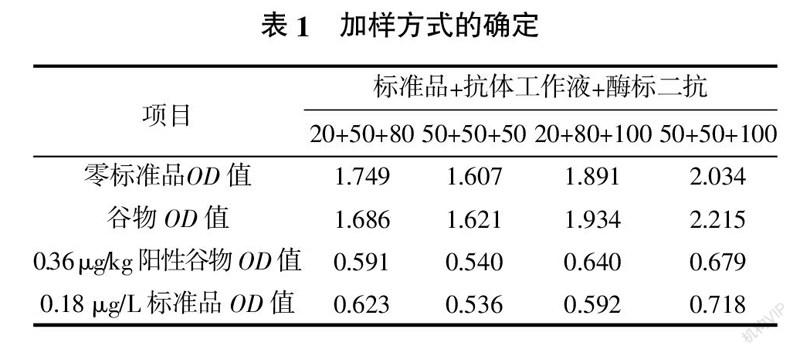
1.2.1 加样方式的确定
1)分别向板孔中加入标准品溶液、样品溶液,用常规抗体稀释液稀释1∶2×104的抗体和用常规酶标二抗稀释液稀释1∶2 000的酶标二抗,振荡混匀,25 ℃避光反应30 min,用PBST洗液洗板3次。
2)加入底物A液和B液各50 μL,25 ℃反应20 min,加入50 μL终止液终止反应。
3)分别测定零标准品OD值、谷物样本OD值、0.36 μg/kg谷物OD值、0.18 μg/L标准品OD值,以零标准OD值为1.5~2.0、谷物样本OD值与零标准品OD值偏差小、0.36 μg/kg阳性谷物样品的OD值与0.18 μg/L标准品OD值偏差小、0.18 μg/L标准品OD值相对较小为判定标准,确定较好的加样方式。
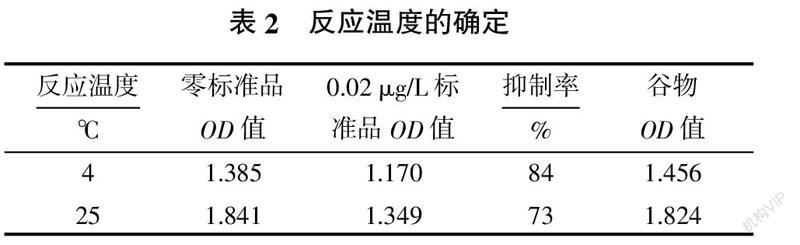
1.2.2 反应温度的确定
1)向板孔中加入标准品、样品溶液50 μL,用常规抗体稀释液稀释1∶2×104的抗体50 μL和用常规酶标二抗稀释液稀释1∶2 000的酶标二抗50 μL,振荡混匀,4、25 ℃下避光反应30 min,用PBST洗液洗板3次。
2)加入底物A液和B液各50 μL,25 ℃反应20 min,加入50 μL终止液终止反应。
3)分别测定零标准品OD值、0.02 μg/L标准品OD值、谷物样本OD值,计算抑制率,以零标准品OD值为1.5~2.0,谷物样本OD值接近零标准品OD值,抑制率在70%~80%为判定标准,选择较好的反应温度。
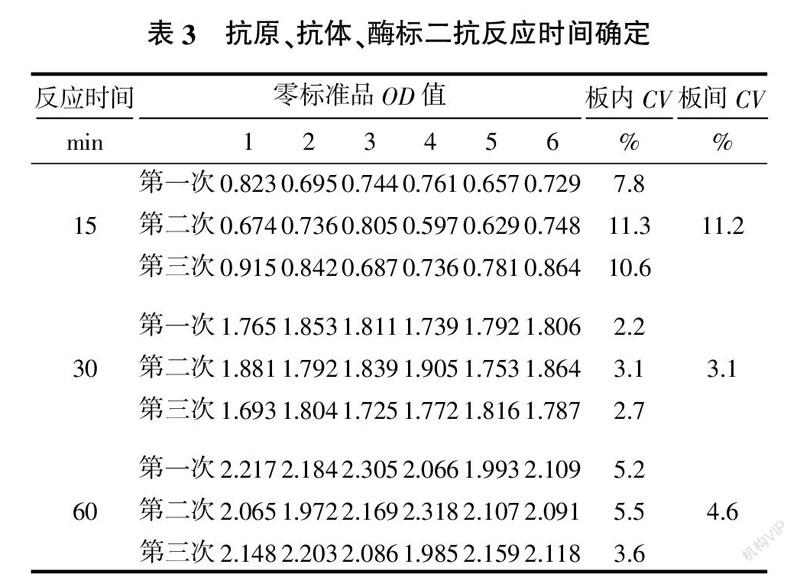
1.2.3 抗原、抗体、酶标二抗反应时间的确定
1)向板孔中加入标准品溶液50 μL、用常规抗体稀释液稀释1∶2×104的抗体50 μL和用常规酶标二抗稀释液稀释1∶2 000的酶标二抗50 μL,振荡混匀,25 ℃下避光反应15、30、60 min,用PBST洗液洗板3次。
2)加入底物A液和B液各50 μL,25 ℃反应20 min,加入50 μL终止液终止反应;
3)测定零标准品OD值,重复3次,每次做6个对照孔,计算不同反应时间测定值的变异度CV(%)。
1.2.4 标准曲线的绘制
1)根据上述选定的加样方式、反应温度、反应时间为分析条件,用0、0.02、0.06、0.18、0.54、1.62 μg/L浓度的标准溶液进行ELISA检测,测定OD值。
2)以黄曲霉毒素B1浓度为横坐标,各对应浓度的抑制率(%)为纵坐标,制作标准曲线,计算回归方程及相关系数,根据线性方程计算IC50。
以优化的ELISA条件,对所有浓度的标准溶液进行测定,每个浓度设置3次重复,根据测定结果制作标准曲线,测定零标准品OD值、IC50、变异系数、R2、0.02 μg/L标准品抑制率及对空白谷物样本添加0.36 μg/kg的回收率。
1.3 样本前处理
1.3.1 食用油样本 吸取200 μL样本至2 mL聚苯乙烯离心管中;加入1 mL复溶工作溶液,加入0.5 mL正己烷,振荡5 min,室温离心5 min;除去上层正己烷相,取下层50 μL用于分析。
1.3.2 谷物、花生样本 用均质器均质样本;称取(2.0±0.05) g样本至50 mL聚苯乙烯离心管中;加入3.0 mL乙腈,再加入3.0 mL去离子水,振荡5 min,室温离心5 min;移取3.0 mL上层清液至50 mL聚苯乙烯离心管中,加入4.5 mL三氯甲烷,振荡5 min,室温离心5 min;去除上层液体,取3 mL下层有机相至10 mL干净玻璃试管中,于50~60 ℃水浴氮气流下吹干;加入1 mL正己烷,涡动30 s溶解干燥残留物,加入1 mL复溶工作液,用涡旋仪涡动30 s,室温离心5 min;除去上层正己烷相,取下层水相50 μL用于分析。
1.4 ELISA检测试剂盒技术参数的确定
1.4.1 试剂盒灵敏度的确定 分别测定3个批次试剂盒标准曲线的IC50抑制浓度,确定该值浮动范围。检测限(LOD)计算公式如下:
LOD=X+3×■
式中,X为重复测定空白样品的平均值,n为样品数量。
1.4.2 试剂盒特异性的测定 选择与黄曲霉毒素B1类似结构的3种物质,将不同浓度的黄曲霉毒素B1类似物,替代黄曲霉毒素B1标准溶液,测定其标准曲线,并计算IC50抑制浓度,计算交叉反应率。
交叉反应率=
■×100%
1.4.3 试剂盒精密度和准确度的测定 取食用油样品分别添加100、200和400 ng/L黄曲霉毒素B1,取花生样品分别添加200、400和800 ng/kg黄曲霉毒素B1,取谷物样品分别添加50、100和200 ng/kg黄曲霉毒素B1,每种样品、每个浓度各6次重复,用试剂盒提供的操作方法提取测定。抽取3批试剂盒,每批试剂盒测定同一份样品2次,分别计算测定样品的回收率及批内、批间变异系数。
随机抽取花生、谷物样本各20份,分别用本试剂盒方法和仪器方法进行检测。仪器方法参考文献[9]中的第三法高效液相色谱法(对花生、谷物中黄曲霉毒素B1的检出限为0.5 μg/kg)。
将制备好的试剂盒保存于2~8 ℃环境下,分别在8个时间段(第0、1、2、3、6、9、12、15月)取出做保存试验,测定其IC50,添加100、200、400 ng/L食用油的回收率,添加200、400、800 ng/kg花生的回收率,添加50、100、200 ng/kg谷物的回收率;并将试剂盒保存于37 ℃和-20 ℃环境中,在4个时间段(第0、3、6、9天)取出做加速和冻融试验。
2 结果与分析
2.1 加样方式的确定
由表1可知,当加入50 μL标准品溶液、50 μL抗体工作液、50 μL酶标二抗进行反应时,零标准品OD值在1.5~2.0之间,谷物样本OD值与零标准品OD值偏差较小,0.36 μg/kg阳性谷物样品的OD值与0.18 μg/L标准品OD值偏差较小,故该方式为较好的加样方式。
2.2 反应温度的确定
由表2可知,加入50 μL标准品溶液、50 μL抗体工作液、50 μL酶标二抗于25 ℃下避光反应,测定的零标准品OD值在1.5~2.0之间,0.02 μg/L标准品的抑制率在70%~80%之间,谷物样品的OD值与零标准品OD值偏差较小,故选择反应温度为25 ℃。
2.3 反应时间的确定
由表3可知,加入标准品50 μL、抗体50 μL、酶标二抗50 μL,25 ℃反应30 min,零标准品OD值均在1.5~2.0,且变异相对较小,故反应时间确定为30 min。
2.4 标准曲线的绘制
以优化的ELISA条件,对所有浓度的标准溶液进行测定,每个浓度设置3次重复,试验结果见表4和图1。
2.5 试剂盒灵敏度的确定
由表5结果可知,黄曲霉毒素B1 ELISA检测试剂盒标准曲线IC50的波动范围为47.5~63.1 ng/L。
对阴性食用油、花生、谷物样品进行20次检测,测定结果的平均值加上3倍标准差即为试剂盒检测实际样品的最低检测限,结果见表6。由表6可以看出,本试剂盒对食用油的最低检测限为88.82 ng/L,对花生的最低检测限为176.56 ng/kg,对谷物的最低检测限为48.51 ng/kg。
2.6 试剂盒特异性的测定
试验测得与黄曲霉毒素B1结构相似的3种物质黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2的交叉反应率分别为81.3%、62%、22.3%。
2.7 试剂盒精密度和准确度的测定
对食用油样品分别添加100、200和400 ng/L 3个浓度的黄曲霉毒素B1,样品回收率为66.5%~93.2%;对花生样品分别添加200、400和800 ng/kg 3个浓度的黄曲霉毒素B1,样品回收率为66.6%~93.0%;对谷物样品分别添加50、100和200 ng/kg 3个浓度的黄曲霉毒素B1,样品回收率为65.8%~93.8%。批内和批间变异系数均小于15%。
2.8 与仪器方法的比较
以0.5 μg/kg为阳性判定线,低于阳性判定线的值,检测结果以“—”表示,高于或等于阳性判定线的值以实际检测结果表示(表7)。由表7可以看出,试剂盒检测结果与仪器检测结果相吻合。
2.9 试剂盒的稳定性
从表8中可看出,将试剂盒保存在2~8 ℃条件下,各样品的阳性回收率都较高,可以一直保存12个月;在37 ℃和-20 ℃条件下保存时间都较短。
3 结论
本研究制备了黄曲霉毒素B1 ELISA快速检测试剂盒,得出了制备该试剂盒的最佳条件,以食用油、谷物、花生为样本,验证了该检测试剂盒的检测效果,并将其检测结果与HPLC检测结果做了对照。结果表明,在25 ℃条件下加入50 μL标准品溶液、50 μL抗体工作液、50 μL酶标二抗反应30 min变异性最小;ELISA试剂盒检测灵敏度高,对食用油、谷物、花生样品中黄曲霉毒素B1最低检测限分别为88.82 ng/L和48.51、176.56 ng/kg;平均回收率和变异系数符合相关规定;与高效液相色谱法相比,检测结果一致。ELISA试剂盒耗时短,样品前处理方法简单、检测设备投资少、成本低,能够满足批量产品中黄曲霉毒素的快速检测。
参考文献:
[1] 刘 坚,余敦年,熊 宁,等,高效液相色谱法对稻谷及稻谷籽粒中黄曲霉毒素的测定研究[J].中国粮油学报,2011,26(4):107-110.
[2] 丁耀魁,邢陆军,程树维,等,高效液相色谱法测定谷物中黄曲霉毒素[J].粮油仓储科技通讯,2012(6):34-35.
[3] FU Z H,HUANG X X,MIN S G. Rapid determination of aflatoxins in corn and peanuts[J].J Chromatogr A,2008,1209(1-2):271-274.
[4] VENTURA M,G?魷ME A,ANAYA I,et al.Determination of aflatoxins B1,G1,B2 and G2 in medicinal herbs by liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A,2004,1048(1):25-29.
[5] ROCHA M E,FRANCISCO C O F,ICARO G P V,et al. Production of aflatoxins from aspergillus flavus in liquid medium[J].Journal of Life Sciences,2013,7(4):377-381.
[6] JAVAD H,GHOLAMREZA A K,NAADER A. Enhanced spectrofluorimetric determination of aflatoxin B1 in wheat by second-order standard addition method[J]. Talanta,2008,75(4):1075-1081.
[7] LEE N A,WANG S,ALLAN R D,et al. A papid aflation B1 ELISA:Development and validation withreduced matrix effects for peanuts,corn,pistachio and soybeans[J]. J Agric Food Chem,2004,52(10):2746-2755.
[8] 陈 玲.ELISA法检测黄曲霉毒素的关键控制点[J].广东饲料,2008,17(11):35-36.
[9] GB/T 5009.23-2006,食品中黄曲霉毒素B1,B2,G1,G2的测定[S].

