一株碱性果胶酶产生菌的筛选、鉴定及发酵条件优化
周熠 黄河 冯波 等

摘要:采用平板分离结合刚果红染色法从野生苎麻土壤中分离得到1株果胶酶产生菌Lys-5304。经形态观察和16S rDNA测序鉴定,该菌株鉴定为欧文氏菌(Erwinia amylovora)。通过单因素试验和响应面分析,该菌产果胶酶的最优条件为:葡萄糖3.0 g/100 mL,菜子粕0.2 g/100 mL,接种量1.5 mL,培养基起始pH 8.0,摇床转速180 r/min,发酵周期为72 h,培养温度为37 ℃。在此条件下,该菌的果胶酶活力达到1 021.33 U/mL,具有一定应用潜力。
关键词:果胶酶;欧文氏菌(Erwinia amylovora);发酵;响应面分析
中图分类号:Q93-33 文献标识码:A 文章编号:0439-8114(2016)04-0992-05
DOI:10.14088/j.cnki.issn0439-8114.2016.04.044
Screening,Identification of Alkaline Pectinase Producing Strain
and Optimization of Its Fermentation Conditions
ZHOU Yi,HUANG He,FENG Bo,LIN Yuan-shan
(College of Biological Science and Technology of Hunan Agricultural University, Changsha 410128,China)
Abstract:A pectinase producing strain LYS-5304 was screened from wild ramie soil by methods of plate isolation with Congo red staining.Strain LYS-5304 was identified as Erwinia carotovora according to morphological observation and 16S rDNA sequencing.Furthering studying,by means of single factor experiment and response surface analysis, showed that optimum conditions for pectinase production were as follows: Culture media containing glucose 3.0%,rapeseed meal 0.2%,inoculation volume 1.5%,initial pH of 8.0,at 37 ℃ shaking at 180 r/min for 72 h. The activity pectinase of LYS-5304 reached 1 021.33 U/mL under these conditions,and its indicated some potential applications.
Key words:pectinase;Erwinia amylovora; optimization of fermentation condition;response surface analysis
果胶酶(Pectinases)是指能分解果胶质的多种酶的总称,而不同来源的果胶酶有不同的特点,其中微生物来源的果胶酶主要有聚半乳糖醛酸酶(PG)、聚甲基半乳糖醛酸裂解酶(PMGL)和果胶酯酶(PE)[1]。果胶酶的用途十分广泛,涉及食品、药品、服装和饲料等多个领域[2,3]。国内对果胶酶的研究比较早,在菌种选育、生产工艺和应用等方面做了很多工作。田英华等[4]选育了一株高产果胶酶的黑曲酶突变株HYA4,在优化的发酵条件下酶活力达1 285 U/g。王建玲等[5]等通过基因工程菌(pWB980-pel521/WB600)发酵碱性果胶酶,酶活力达到约760 U/mL。目前,国内果胶酶发酵的酶活力总体偏低,而且商品化的果胶酶同时还具有一定的纤维素酶活性,这对果胶酶脱胶处理纺织品原材料带来一定的不利影响。本试验拟通过优化果胶酶发酵条件,为进一步选育无纤维素酶系果胶酶产生菌及实际应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 采样 湖南农业大学西田径场野生苎麻种植地,选取腐殖质下表3~5 cm土壤。
1.1.2 培养基 果胶酶产生菌分离培养基:果胶1.0%,蛋白胨0.3%,磷酸氢二钠0.2%,琼脂2.0%,水100 mL,pH自然。纤维素酶产生菌分离培养基:CMC-Na 1.0%,蛋白胨0.3%,磷酸氢二钠0.2%,琼脂2.0%,水100 mL,pH自然。果胶酶发酵基本培养基:葡萄糖1.0%,酵母膏0.5%,水100 mL,pH自然。斜面培养基:麸皮4.0%,葡萄糖1.0%,琼脂2.0%,水100 mL,pH自然。
1.1.3 试剂 果胶由SIGMA公司生产,琼脂、酵母膏及其他化学试剂为国产分析纯,麸皮购于本地市场,菜子粕由湖南农业大学中南烟草站提供。
1.2 方法
1.2.1 菌株的筛选 称取新鲜土样10 g,按10倍稀释法涂布0.1 mL于果胶酶产生菌分离培养基上,置于32 ℃培养箱中培养2~4 d。待菌落长出时,用无菌0.5%的刚果红溶液染色10 min,倾倒染色液,再用1 mol/L无菌NaCl溶液漂洗1~3次,直至呈现水解圈,将相应菌落转接斜面,编号,于冰箱中4 ℃保存。
1.2.2 菌株形态、培养和生理生化鉴定 菌株的形态、培养和生理生化特征的鉴定参照《常见细菌系统鉴定手册》[6]、《伯杰氏细菌鉴定手册》[7]进行。
1.2.3 菌株16S rDNA鉴定及分析 菌种委托北京三博远志生物科技公司进行测序,测序结果通过BLAST与GenBank中的序列进行比对,构建出系统发育树。
1.2.4 酶液的制备 吸取1.0 mL种子液接种到发酵培养基中,置于32 ℃摇床,180 r/min振荡培养3 d。用四层纱布过滤发酵液,滤液8 000 r/min离心10 min,上清液为粗酶液。
1.2.5 酶活测定 采用DNS法[8]在540 nm下对反应液吸光度进行测定。通过比对半乳糖醛酸标准曲线推算出还原的半乳糖醛酸含量。酶活力单位定义为:50 ℃,pH自然的条件下,1 mL酶液每分钟催化果胶还原产生1 μg半乳糖醛酸为1个酶活力单位。
1.2.6 发酵条件优化 采用单因素试验对影响果胶酶活力的碳源、氮源、发酵温度、发酵时间、pH、接种量进行研究,并结合响应曲面法进行合理分析,确定最佳发酵条件。
2 结果与分析
2.1 果胶酶产生菌初筛结果
筛菌过程中共获取122株水解圈明显的菌株。其中水解圈与菌落直径之比大于3的38株,大于4的13株,大于5的6株。图1-a是菌株Lys-5304在果胶酶初筛平板水解图,经刚果红染色以及氯化钠脱色后显示明显的水解圈,其中水解圈與菌落直径之比为5.36。该菌在平板中分泌果胶酶的能力强,但其液体条件下分泌果胶酶能力需要摇瓶发酵复筛进一步确定。
2.2 摇瓶发酵复筛结果
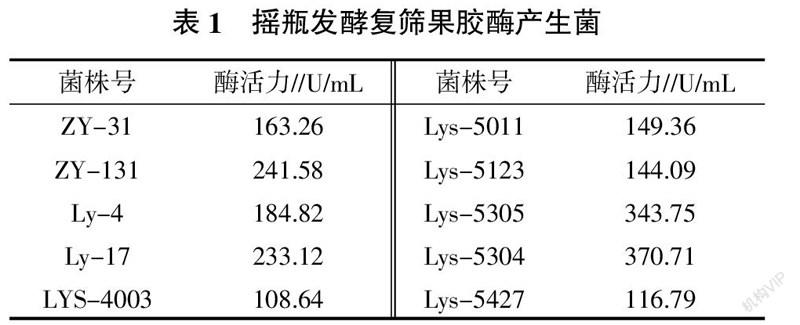
将初筛的122株菌株分别接种于100 mL液体发酵培养基中,在摇床转速200 r/min,32 ℃条件下培养3 d后测定其果胶酶活力,选取酶活力大于100 U/mL菌株列于表1。从表1可知, Lys-5304、Lys-5305不仅水解圈比较大,菌落长势较好,而且酶活力较高,分别达370.71、343.75 U/mL。
2.3 菌种鉴定结果
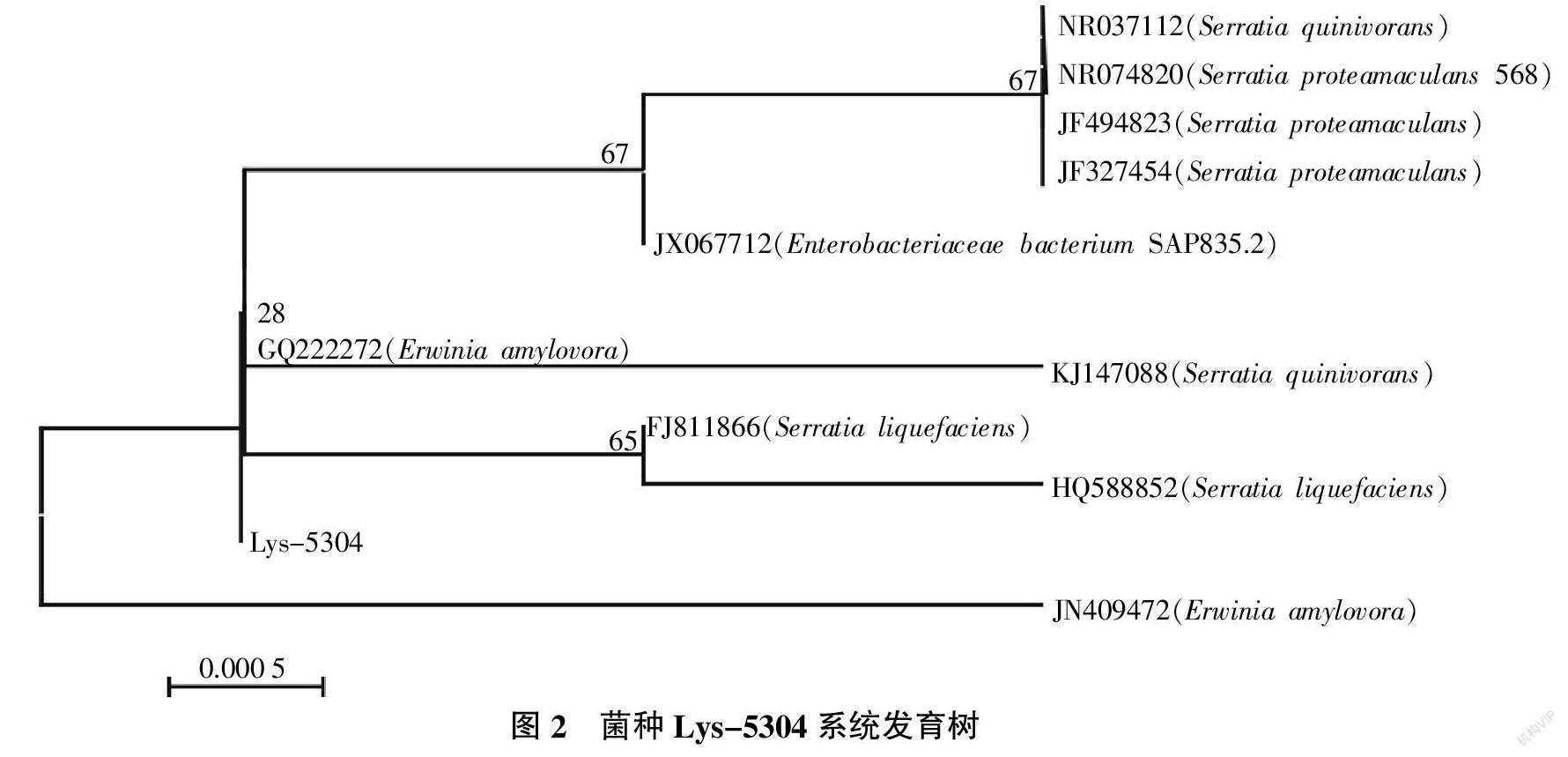
菌株Lys-5304经形态鉴定见图1-b,光学显微镜观察多为直杆状,少数异形,(0.5~1.0)μm×(1.0~2.5)μm,细胞多数单生,菌落光滑湿润有光泽,革兰氏染色阴性,菌株兼性厌氧,在NaCl浓度0%~4.0%、pH 5.0~9.0、温度10~45 ℃均能生长。菌株Lys-5304经北京三博远志生物技术有限责任公司通过引物27F、1492R进行16S rDNA 扩增序列测序。获得序列后在NCBI进行比对并利用MEGA 5.10构建进化树,结果见图2。通过GenBank BLAST发现Lys-5304与欧文氏菌(Erwinia amylovora)的相似度达99%以上。这与形态鉴定结果相符,因此菌株Lys-5304被鉴定为欧文氏菌。
2.4 菌株Lys-5304发酵条件的优化
由于菌株Lys-5304经平板初筛、摇瓶发酵复筛显示较高的果胶酶活力,因此,进一步对该菌株进行发酵条件单因子试验,再利用响应面法分析优化发酵条件。
2.4.1 培养温度对菌株Lys-5304产果胶酶的影响 菌株Lys-5304在基本发酵培养基(葡萄糖1.0%,酵母膏0.5%,下同)条件下,变换培养温度,发酵3 d后的果胶酶活力见图3。从图3可知,温度对菌株Lys-5304产果胶酶差异显著(P<0.05,下同),菌株Lys-5304在温度为30~37 ℃,随着温度升高,酶活力呈上升趋势;但温度继续升高时,酶活力有所降低,因此在37 ℃时最适合果胶酶发酵,此时酶活力达243.26 U/mL。
2.4.2 发酵时间对菌株Lys-5304产果胶酶的影响 菌株Lys-5304在基本发酵培养基32 ℃摇床转速180 r/min条件下,每12 h测定该菌果胶酶活力,果胶酶活力见图4。从图4可知,该菌株在12~24 h酶活力不强,之后酶活力持续升高,并于72 h达到峰值245.18 U/mL。之后酶活力开始下降,因此初步选择发酵时间为72 h。
2.4.3 起始pH对菌株Lys-5304产果胶酶的影响 菌株Lys-5304在32 ℃摇床转速180 r/min,变换基本发酵培养基的起始pH,发酵72 h后的果胶酶活力见图5。从图5可知,菌株在酸性环境与碱性环境产酶能力差异显著。在pH 2~4时,发酵液无果胶酶活力,随着pH上升果胶酶活力逐步提高, 当pH为8时达到峰值,为238.0 U/mL,之后略有下降,该菌的果胶酶可能为碱性果胶酶。
2.4.4 接种量对菌株Lys-5304产果胶酶的影响 菌株Lys-5304在32 ℃摇床转速180 r/min 100 mL基本发酵培养基中接种不同体积的种子液,发酵72 h后的果胶酶活力见图6。从图6可知,当接种量为1.2 mL时,酶活力达峰值219.31 U/mL。
2.4.5 碳源的选择对菌株Lys-5304产果胶酶的影响 不同种类的碳源对菌株Lys-5304菌株发酵果胶酶的影响结果见图7。从图7可知,在酵母膏1.0%(氮源)、温度32 ℃、发酵时间为72 h条件下,不同碳源对菌株Lys-5304产果胶酶差异显著,其中,葡萄糖作碳源,果胶酶活力最高达到290.70 U/mL。
2.4.6 氮源的选择对菌株Lys-5304产果胶酶的影响 不同种类的氮源对菌株Lys-5304菌株发酵果胶酶的影响结果见图8。从图8可知,在葡萄糖2.0%(碳源)、温度32 ℃、发酵时间为72 h条件下,不同氮源对菌株Lys-5304产果胶酶差异显著,有机氮源普遍比无机氮源的果胶酶活力高,如豆粕粉、菜子粕、玉米浆更好些。其中菜子粕作氮源最优,果胶酶活力达366.40 U/mL。
2.5 响应曲面法分析结果
选择对酶活力影响较大的3个因素碳源、氮源和接种量,设计Box-Behnken Design试验,并用Design-Expert软件对数据进行合理分析。Box-Behnken设计方案所得结果见表2,试验的方差分析见表3。从表3可知,方程的F值为9.38,F>f0.01(9,7)=6.71,说明用上述模型描述各因素与响应值之间的关系时,其因变量和全体自变量之间的影响关系显著, 即这种试验方法是可靠的。经回归模型预测15个组合,菌株Lys-5304产果胶酶的活力均大于850 U/mL。其中预测最佳条件为:葡萄糖3.0 g/100 mL,菜子粕0.2 g/100 mL,接种量为1.5 mL, 37 ℃,发酵周期72 h,酶活力达到最大值870.26 U/mL。
采用上述最优提取条件进行果胶酶发酵试验,考虑上述模型的失拟项误差显著性,以及便于实际操作,将最佳工艺条件修正为:葡萄糖3.0 g/100 mL,菜子粕0.2 g/100 mL,接种量1.5 mL,37 ℃,发酵周期72 h,在此条件下进行3次重复,测得酶活力达到最大值1 021.33 U/mL,数据大于预测值。经检测,该菌株在此条件下获得的粗酶液既无内切纤维素酶活性,也无木聚糖酶活性,可见该菌株具有应用苎麻脱胶的潜力,而不影响苎麻纤维的降解。
3 讨论
本试验采用果胶酶水解透明圈法分离果胶酶产生菌,获得果胶酶活力较高的菌株Lys-5304,该菌株鉴定为欧文氏菌,这与已有的菌株XJZ95-198和CXJZU-120报道基本吻合[9,10],说明该方法十分可靠。尽管菌株Lys-5304的酶活力低一些,但该菌为野生菌,生长快,可在pH 4.5~8.5生长,尤其是该菌株粗酶液无纤维素酶和木聚糖酶活性,说明该菌更适合苎麻脱胶,而不影响纤维素质量,这一点优于黑曲霉果胶酶的苎麻脱胶性能。该菌不仅能运用于苎麻脱胶,还能联合其他益生菌作用于果酒澄清与天然植物提取[11,12],并且菌株Lys-5304还有望通过诱变选育或者基因工程改良獲得活性更高的优势菌株。
参考文献:
[1] 王 樟.食品酶学[M].北京:轻工业出版社,1990.
[2] 田林茂.黑曲霉HG-1固态发酵苹果渣和棉粕生产果胶酶的工艺研究[D].兰州:甘肃农业大学,2008.
[3] 尤 华,陆兆新,冯红霞.微生物原果胶酶的研究进展[J].工业微生物,2002,32(1):50-53.
[4] 田英华,刘晓兰,邓永平.果胶酶高产菌Aspergillus niger HYA4的选育[J].齐齐哈尔大学学报,2005,21(1):12-14.
[5] 王建玲,刘逸寒,郝育杰.高产碱性果胶酶基因工程菌的发酵条件的优化[J].工业微生物,2011,41(3):21-26.
[6] 东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[7] R.E.布坎南,N.E.吉本斯,等.伯杰氏细菌鉴定手册[M].第八版.北京:科学出版社,1984.
[8] 郭 勇.酶工程[M].北京:中国轻工业出版社,1994.
[9] 张运雄.欧文氏杆菌CXJZ95-198非纤维素降解特性及manA基因的克隆研究[D].北京:中国农业科学院,2006.
[10] 郑 科,段盛文,刘正初,等.胡萝卜软腐欧文氏菌CXJZU-120的选育及其脱胶性能研究[J].中国农业科技导报,2011,13(6):72-77.
[11] 邱雁临,王金华.果胶酶对山楂酒澄清的研究[J].湖北农业科学,1996(6):67-70.
[12] 李勇慧,耿惠敏,杨振国.仙人掌中果胶的提取方法比较[J].湖北农业科学,2010,49(2):430-432.

