富硒链霉菌wh63的鉴定及富硒特性研究
昌青青 张园园 曹圆圆 等

摘要:富硒链霉菌wh63可在平板硒浓度为100 mg/L时生长良好。低浓度的硒元素可以促进菌株生长,高浓度则会抑制菌株的生长,硒添加量为0.5和1.0 mg/L的wh63菌株生物量比对照分别提高12%和8%。通过显微形态学观察,wh63菌株孢子丝卷曲,孢子表面光滑;在高氏1号培养基上,气生菌丝为白色,后期颜色会变深。结合16S rDNA序列分析鉴定,发现其与唐德链霉菌(Streptomyces tendae)的同源性最高,为99%,且生理生化特性一致,初步鉴定wh63菌株为链霉菌属(Streptomyces)。通过菌落形态观察,结合SEM(扫描电镜)和IR(红外光谱)分析,发现链霉菌wh63可以将无机硒转化为红色单质硒,红色单质硒附着在富硒链霉菌wh63菌体表面。
关键词:富硒链霉菌wh63;鉴定;转化
中图分类号:Q939.96 文献标识码:A 文章编号:0439-8114(2016)04-0867-05
DOI:10.14088/j.cnki.issn0439-8114.2016.04.013
Identification and Se-enriched Characteristics of A Strain Se-enriched Streptomyces wh63
CHANG Qing-qing, ZHANG Yuan-yuan, CAO Yuan-yuan, LU Cun-long, LU Peng, LIU Ai-min
(College of Life Sciences, Anhui Normal University/Provincial Key Laboratory of Biotic Environment and Ecological Safety in Anhui/Anhui Provincial Key Laboratory of the Conservation Exploitation of Biological Resources, Wuhu 241000, Anhui, China)
Abstract: A selenium(Se)-enriched Streptomyces was screened out from the soil in Anhui, numbered wh63, it could grow well in the plate medium of 100 mg/L selenium. The growth of strain wh63 could be promoted at low concentration of selenium, inhibited at high concentration of selenium. When 0.5 mg/L and 1.0 mg/L selenium were added into the media, the biomass of strain wh63 were increased by 12% and 8% than the control, respectively. Through microscopic morphology observation,the mycelium of strain wh63 was wave and curve, and the spore surface was smooth. The aerial mycelium was white on Gause No.1 plate medium, and the color was deep later. Strain wh63 was preliminary identified with Streptomyces by 16S rDNA sequences analysis,it had 99% homology with Streptomyces tendae, and resembling physiological and biochemical characteristics. Strain wh63 could transform inorganic Se into red elemental Se by colony morphology,combined with SEM (scanning electron microscope) and IR(infrared spectroscopy) observation. Red elemental Se was attached to the cell surface of Streptomyces wh63 strain.
Key words:selenium(Se)-enriched Streptomyces wh63;identification;transform
硒(Se)是维护人体正常生命活动必不可少的微量元素之一。硒结合蛋白形成的硒蛋白是重要的抗氧化酶,可防止自由基引起的细胞损伤,调节甲状腺功能,有助于免疫系统的正常运作[1-6]。硒以无机硒的形式广泛存在于自然界中,中国约有2/3的地区属国际上公认的缺硒地区,主要作物中含硒量低于0.05 μg/g[7],日常的饮食达不到硒的参考摄入量[8],因此富硒食品的需求量很大[9-11]。当前的富硒食品很多都是施加硒肥而来[12-15],但是过度施加硒肥会导致土壤中无机硒沉积,造成硒害。研究发现微生物可以将毒性大的无机硒转化为几乎无毒的生物硒[16-19]。放线菌广泛存在于自然生态环境中,许多放线菌既可以产生抗生素和具有生物活性的次生代谢物质,又可以用于生物处理废物过程,具有重要的商业价值[20],部分放线菌也具有很强的富硒能力[21]。崔彬[22]以放线菌为模板,以亚硒酸钠为硒源,在亚硒酸钠添加量为0.01 μg/mL时,成功得到直径100~200 nm的红色单质硒,并发现放线菌的耐硒能力比大肠杆菌和枯草芽孢杆菌强。本研究对象为从安徽芜湖土壤中筛选出的一株具有很强富硒能力的菌株wh63,对其形态、富硒特征及分类进行研究,为以后的富硒肥料研究奠定基础。
1 供试培养基及主要材料
菌株wh63由安徽师范大学生命科学学院微生物试验组提供[23]。
高氏1号液体培养基和PDA培养基[24]。
高氏1号固体培养基:在液体培养基基础上加琼脂20 g后灭菌即可。
硒母液:准确称取亚硒酸钠2.19 g溶解在去离子水中,定容至100 mL,使溶液硒浓度为10 mg/mL。
含硒筛选培养基:为了研究菌株的耐硒能力,在配置好的高氏1号固体培养基里加入亚硒酸钠母液,使其含硒量分别为10、50、100 mg/L,压力1.05 kg/cm2、温度121.3 ℃条件下灭菌20 min。
2 试验方法
2.1 菌株wh63的富硒特性
挑取已活化的放线菌wh63划线接种在含硒量为10、50、100 mg/L的高氏1号固体培养基上,28 ℃培养7 d后观察平板上的菌落变化,以及是否出现红色,以不含硒的培养基为对照。
用接种环挑取wh63菌株在高氏I号平板上划线接种,用镊子将灭菌的盖玻片以大约45°角扦入琼脂内(扦在接种线上),扦片数量可根据需要而定;将扦片平板倒置,28 ℃培养5 d,用镊子小心拔出盖玻片,擦去背面培养物,然后将有菌的一面朝上放在载玻片上,直接显微镜检[24]。根据《放线菌分类基础》[25]和《伯杰氏细菌鉴定手册》[26]及《链霉素鉴定手册》[27]进行菌株的初步鉴定。
2.2 不同浓度的硒对菌株wh63生长的影响
将长好的wh63菌液按5%的比例分别接入含硒量为0.5、1.0、2.0、4.0、7.0和9.0 mg/L的液体高氏1号培养基中,无硒为对照,28±1 ℃、180 r/min培养到144 h时,离心取菌体,55 ℃烘干,获得干粉,称量不同硒元素浓度下培养的菌株wh63生物量,探究硒对菌株wh63生长的影响。
2.3 菌株wh63的分子遗传学鉴定
将菌株wh63培养到对数生长期,混匀后取1 mL,15 000 r/min离心2 min,弃上清。加入240 mmoL、50 mM ET(pH=8.0)悬浮细胞,加入20 μg/μL溶菌酶60 μL,37 ℃温育60 min,15 000 r/min离心2 min,弃上清[28]。接着使用WizardTM DNA纯化试剂盒进行DNA提取。加入300 μL预冷的核裂解液,混匀,37 ℃温育18 h,室温冷却。加入100 μL蛋白质沉淀液,悬摇混匀,冰浴5 min,15 000 r/min离心3 min,移上清。上清转移至含有300 μL异丙醇的EP管中并加入8 μL的糖原,混匀。15 000 r/min离心2 min,弃上清,自然干燥。加入300 μL 70%的乙醇,混匀,15 000 r/min离心2 min,吸出乙醇,再重复一次后自然干燥40 min。DNA溶于35 μL 去离子水,4 ℃过夜后冷冻保存。根据文献[29]使用27F(5′-3′):AGAGTTTGATCCTGGCTCAG和1492R(5′- 3′):GGTTACCTTGTTACGACTT当做引物。反应体系25 μL:引物1 μL,模板1 μL,缓冲液2.5 μL, d NTP混合物4.0 μL,去离子水13.5 μL,Taq酶3.0 μL,将获得的放线菌基因组 DNA 作为模板进行16S rDNA 的扩增。PCR扩增条件为:95 ℃预变性2 min;94 ℃变性50 s,55 ℃复性50 s,72 ℃延伸1.5 min,35个循环;72 ℃延伸10 min。取8 μL PCR产物于0.8% 琼脂糖凝胶中电泳(80 V),260 nm紫外灯下观察并照相。检测出条带后进行切胶纯化,送上海生工生物工程有限公司进行测序。根据GenBank比对结果,构建系统发育树。
2.4 扫描电镜和红外光谱分析富硒wh63菌体
按“2.3”中方法获得的硒浓度为9 mg/L的培养基中和不含硒培养基中生长的wh63菌体干粉在S-4800-I扫描电镜下观察菌体表面状态;同时取上述样品1 mg,加入KBr 100 mg充分研磨,压片,放在日本岛津IRPrestige-21红外扫描分析仪上检测有机物基团的变化[30]。
3 结果与分析
3.1 菌株wh63的形态观察和富硒特性
由图1和图2可见,在高氏1号培养基上,放线菌wh63初期气生菌丝为白色,后期颜色会变深。插片培养观察孢子丝卷曲,孢子表面光滑,孢子呈长链,初步鉴定其为放线菌科链霉菌属。通过预试验发现该菌还具有促进植物侧根形成和芽的生长。
在培养基中添加一定量的亚硒酸钠,微生物细胞会出现红色颗粒沉积,这是由于微生物将亚硒酸钠还原成红色的生物硒[16],通过红色的深浅和培养基中的含硒量可以知道菌株的富硒能力。链霉菌wh63菌株可耐受的培养基硒浓度达到100 mg/L,由图3可知,富硒后的链霉菌wh63冷冻干燥菌粉呈现砖红色,而无硒培养条件下链霉菌wh63冷冻干燥菌粉为灰白色,说明其产生了红色的单质硒。由图4和图5可见,观察菌株wh63在硒浓度为10 mg/L平板上的形态,发现富硒wh63菌苔周围显现出砖红色。
3.2 不同浓度硒元素對菌株wh63生长的影响
由图6可知,在硒浓度为0.5和1.0 mg/L时链霉菌wh63生物量最高达到2.9和2.8 g/L,分别比对照要高12%和8%,超过1.0 mg/L的浓度后链霉菌wh63生物量呈现下降的趋势,这与杨启银等[31]、章西海等[32]的研究相符合。结果表明,低浓度硒元素能促进链霉菌wh63生长,高浓度则呈现抑制现象。
3.3 wh63菌株鉴定
取8 μL PCR产物在0.8%琼脂糖凝胶中进行电泳(80 V),电泳时间约30 min,电泳结束后,在260 nm紫外灯下观察,PCR产物在约1.5 kb处有一明显电泳带(图7)。
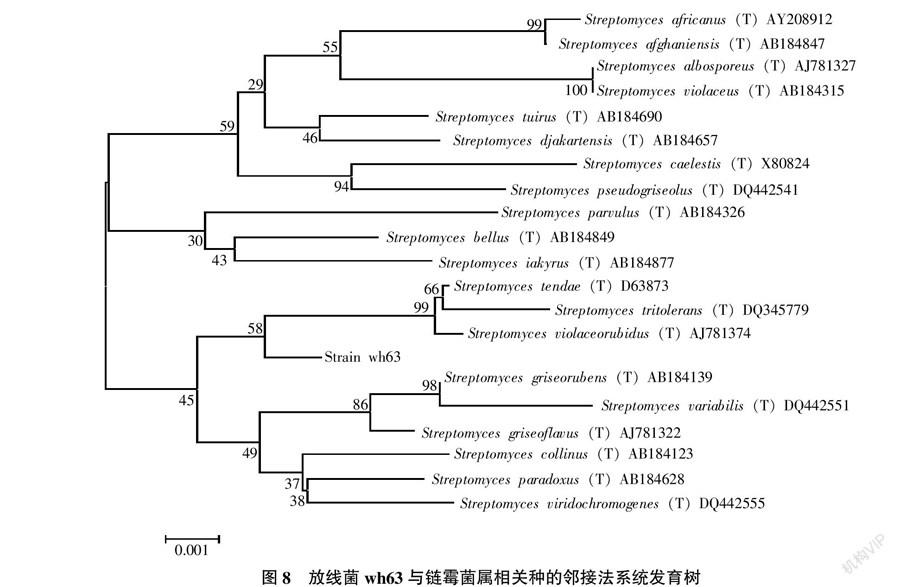
经过割胶纯化测序分析,得到16S rDNA区段长度为1 431 bp。将该序列与NCBI上登录序列进行比对,结果表明,放线菌wh63的16S rDNA区域基因序列与链霉菌属(Streptomyces)唐德链霉菌的同源性最高。运用生物软件MEGA4.1建立neighbor-joining(NJ)树,如图8所示。
由图8可见,wh63菌株与唐德链霉菌亲缘关系相近,鉴定为链霉菌属(Streptomyces),wh63的NCBI登录号为KM036214。
3.4 扫描电镜和红外光谱分析
进一步观察菌株wh63的SEM扫描电镜图(图9)可见,无硒培养下的链霉菌wh63表面光滑无其他物质附着,但是在硒浓度为9 mg/L的培养基中链霉菌wh63的SEM扫描电镜图(图10)中可发现其表面附着很多球形纳米粒子。通过观察可知链霉菌wh63可以利用亚硒酸钠,将其转化为单质硒,纳米颗粒表面光滑且多数附着在细胞的表面,这与崔彬[22]的研究不同,用放线菌富集硒元素后发现其大多数包含在细胞内,只有少量附着在细胞外。
观察链霉菌wh63红外图(图11)可发现,3 200~3 400 cm-1的震荡吸收峰是与-OH伸缩有关的吸收峰,2 980、1 650、980 cm-1的震荡吸收峰与 -CH3有关,2 925、2 850、1 470、725 cm-1等位置出现的吸收带与标准对照图谱中-C=O、-CH-、-CH2-的特征峰一致[30,33]。对比富硒前后的链霉菌wh63可知,链霉菌wh63富硒前后的红外光谱基本一致,富硒后没有特殊的基团和化学键出现,表明硒是游离存在的,并且没有含硒化合物的吸收峰出现,说明硒与菌体细胞之间无化学键联系,进一步证明富硒链霉菌wh63产生单质硒。
4 结论
富硒菌株wh63具有很好的耐硒能力,在硒含量为100 mg/L的情况下生长良好。通过对无硒培养条件下链霉菌wh63和硒浓度为9 mg/L条件下培养的链霉菌wh63的SEM和红外图谱分析比较,发现其富集产生红色单质硒,该单质硒为圆球状,光滑且附着在细胞表面。
参考文献:
[1] MEHDI Y, HOMICK J L, ISTASSE L, et al. Selenium in the environment, metabolism and involvement in body functions[J]. Molecules, 2013,18(3):3292-3311.
[2] AL-SALEH I,BILLEDO G,EL-DOUSH I,et al. Selenium and vitamin status in Saudi children[J]. Clinica Chimica Acta, 2006, 368(1-2):99-109.
[3] ELLIS D R,SALT D E. Plants,selenium and human health[J].Current Opinion in Plant Biology,2003,6(3):273-279.
[4] 王玉标.硒与人体健康[J].安徽教育学院学报,2003,21(3):43-45.
[5] ROTRUCK J T,POPE A L,GANTHER H E,et al. Selenium:Biochemical role as a component of glutathione peroxidase[J]. Science,1973,179:588-590.
[6] MARGARET P R. The importance of selenium to human heath[J]. Lancet,2000,356:233-241.
[7] 胡秋辉,陈晓红,安辛欣,等.富硒茶提高大鼠非特异性免疫功能的效应[J].食品科学,2000,21(11):56-58.
[8] 蒋士龙,汪志君.生命的微量元素硒[J].广东微量元素科学,2001,8(8):1-5.
[9] 陈历程,张 勇.微量元素硒的研究现状及其食品强化[J].食品科学,2002,23(10):134-137.
[10] 陈 瑾,杨加豹,邹成义.富硒动物产品的研究进展[J].饲料工业,2010,31(17):9-12.
[11] HEARD J W, STOCKDALE C R, WALKER G P, et al. Increasing selenium concentration in milk: Effects of amount of selenium from yeast and cereal grain supplements[J]. Journal of Dairy Science,2007,90(9):4117-4127.
[12] WANG D Y, WANG X, WONG S Y. Generation of selenium-enriched rice with enhanced grain yield, selenium content and bioavailability through fertilisation with selenite[J]. Food Chemistry,2013,141(3):2385-2393.
[13] THOSAIKHAM W, JITMANEE K, SITTIPOUT R, et al. Evaluation of selenium species in selenium-enriched pakchoi (Brassica chinensis Jusl var parachinensis(Bailey) Tsen & Lee) using mixed ion-pair reversed phase HPLC-ICP-MS[J]. Food Chemistry,2014,145:736-742.
[14] 唐玉霞,王慧敏,吕英华,等.硒肥浸种对小麦生长发育及产量和籽粒含硒量的影响[J].麦类作物学报,2010,30(4):731- 734.
[15] 王玉凤,徐 暄,孙其文.硒浸种对番茄种子萌发的影响[J].湖北农业科学,2009,48(10):2461-2463.
[16] GHARIEB M M, WILKINSON S C, GADD G M. Reduction of selenium oxyanions by unicellular, polymorphic and filamentous fungi:Cellular location of reduced selenium and implications for tolerance[J]. Indust Mierobiol,1995,14(3): 300-311.
[17] BIERLA K, SZPUNAR J, YIANNIKOURIS A, et al. Comprehensive speciation of selenium in selenium-rich yeast[J]. Trac Trends in Analytical Chemistry,2012,41(14):122-132.
[18] MASEKO T, CALLAHAN D L, DUNSHEA F R, et al. Chemical characterisation and speciation of organic selenium incultivated selenium-enriched Agaricus Bisporus[J]. Food Chemistry, 2013,141(4):3681-3687.
[19] 杨善岩,李海龙,狄志鸿.硒元素生理功能及微生物富硒发酵研究现状[J].食品工业,2013,34(6):167-169.
[20] OKAMI Y, HOTTA K. Search and discovery of new antibiotics[A]. GOODFELLOW M, WILLIAMS S T, MORDARSKI M.Actinomycetes in Biotechnology[M]. London:Aeademic Press,1988.
[21] 黄 峙,郑文杰,李乐农,等.纳米元素硒的生物合成及生物活性[J].中国生物工程杂志,2003,23(7):76-79.
[22] 崔 彬.原核微生物矿化纳米元素硒[D].长春:长春理工大学,2010.
[23] 蔡 欣.芜湖市区土壤放线菌的资源研究[D].安徽芜湖:安徽师范大学,2012.
[24] 刘爱民.微生物学实验[M].合肥:安徽人民出版社,2009.
[25] 阮继生.放线菌分类基础[M].北京:科学出版社,1977.
[26] 布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].第八版.北京:科学出版社,1984.
[27] 中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975.
[28] 骆耐香,陈森洲,袁桂峰,等.广西沿海地区红树林根系土壤中放线菌的分离与鉴定[J].基因组学与应用生物学,2010, 29(2):310-313.
[29] 周双清,黄小龙,黄东益,等.Chelex-100快速提取放线菌DNA作为PCR扩增模板[J].生物技术通报,2010(2):123-125.
[30] 翁诗甫.傅里叶变换红外光谱分析[M].第二版.北京:化学工业出版社,2010.
[31] 杨启银,刘淑超,贾秉晟,等.生物富硒对沼泽红假单胞菌G3菌株营养组分的影响[J].食品科学,2010,31(23):253-257.
[32] 章西海,丁 军,金 星,等.富硒沼泽红假单胞菌G3菌对金针菇营养组分和生物量的影响[J].食品科学,2013,34(19):153-157.
[33] KAMNEV A A, ANTONYUK L P, MATORA L Y, et al. Spectroscopic characterization of cell membranes and their constituents of the plant-associated soil bacterium Azospirillum brasilense[J]. Journal of Molecular Structure,1999,480-481:387-393.

