桦褐孔菌子实体多酚的分离及抗氧化性的研究
赵 伟,徐向群
(浙江理工大学理学院,杭州 310018)
桦褐孔菌子实体多酚的分离及抗氧化性的研究
赵 伟,徐向群
(浙江理工大学理学院,杭州 310018)
桦褐孔菌子实体中含有大量的活性多酚,为了对多酚进行有效分离,采用甲醇、乙醇和水作为提取溶剂,通过测定多酚含量和DPPH自由基清除率来比较不同溶剂的提取效率,并运用Sephadex LH-20柱色谱对多酚提取液进行分离。结果表明:在60℃条件下,以甲醇为溶剂并结合超声破碎得到的提取液中多酚含量和DPPH自由基清除率最高,同时Sephadex LH-20柱色谱对乙酸乙酯层和正丁醇层多酚实现了有效初步分离,并得出多酚的组成与抗氧化活性紧密关联。多酚的初步分离为进一步深入研究多酚组分提供了基础。
桦褐孔菌;多酚;分离;抗氧化活性
0 引 言
桦褐孔菌,也被称为“chaga”,是一种属于担子菌门绣革菌科的陆地多孔药用真菌,主要生长在北纬45°~50°的寒冷地区,包括北美、芬兰、波兰、俄罗斯的西伯利亚和堪察加半岛、中国黑龙江的大兴安岭和小兴安岭、吉林省的长白山以及日本的北海道等地区[1]。早在16世纪,桦褐孔菌作为一种有效且低毒性的民间药物,被广泛应用于治疗糖尿病、癌症和心血管等疾病[2]。桦褐孔菌的特殊药用价值主要是由于含有大量多糖、三萜、多酚等生物活性代谢产物,这些活性成分使其表现出了抗病毒、抗菌、免疫调节和抗氧化等活性[3-5]。桦褐孔菌多酚已被证明是一种天然的抗氧化剂,具有清除各种自由基的能力[6-8]。
目前对桦褐孔菌子实体的研究重点是多酚和多糖等物质的分离鉴定和生物活性,其中很多文献报道了多糖的提取和活性研究[9-10],但对于多酚类物质的研究较少,同时存在多酚的提取率低,分离鉴定困难等亟待解决的问题。从桦褐孔菌子实体中提取多酚的主要方法是溶剂提取法,比较常用的有热水、甲醇和乙醇等溶剂,而且不同的提取溶剂,得到的多酚含量和抗氧化活性不同[11-13]。超声破碎是用于提取生物细胞内物质的一种高效率的方法,它能够通过振动空化作用,破碎细胞壁。因此本文比较了几种常见溶剂的提取效率,并得出了运用溶剂提取与超声破碎相结合来提取桦褐孔菌子实体多酚是非常有效的方法[14]。本文在筛选出最佳提取条件的基础上,采用Sephadex LH-20柱色谱对多酚提取液进行初步分离分段,比较分段洗脱物中多酚的含量和抗氧化活性,为实现多酚的鉴定提供基础。
1 材料和方法
1.1 实验材料
1.1.1 实验原料
桦褐孔菌子实体,购于杭州胡庆余堂。
1.1.2 实验试剂
1,1-二苯基-2-三硝基苯肼(DPPH)、福林酚试剂等,分析纯,购于美国sigma公司;其它试剂均为分析纯,购于杭州高晶精细化工有限公司。
1.3 实验方法
1.3.1 桦褐孔菌子实体多酚的提取
桦褐孔菌子实体烘干至恒重后,研磨成粉末状,并将其倒入离心管中,分别加入10倍体积的提取溶剂(甲醇、乙醇和水)进行超声破碎,将破碎后的匀浆液提取6 h,提取3次,离心得含有大量多酚的上清液[15]。将所得的上清液脱水后溶于一定体积的蒸馏水,再加入1/4体积氯仿,萃取3次;然后在水层中加入1/4体积乙酸乙酯,萃取3次,将乙酸乙酯层萃取液真空干燥后,即得到桦褐孔菌子实体的乙酸乙酯层多酚;继续在萃取后的液体中加入1/4体积正丁醇,萃取3次,将正丁醇层萃取液真空干燥后,即可得到桦褐孔菌子实体的正丁醇层多酚。
1.3.2 桦褐孔菌多酚含量的测定
桦褐孔菌多酚的测定采用福林-酚法( Folin-Ciocalteu reagent method[16]),具体步骤如下:
a)多酚标准曲线的测定
分别100 mg/L的没食子酸标准溶液中准确吸取0、100、200、300、400、500、600、700、800 μL到干净的10 mL试管中,然后加入500 μL福林酚试剂,摇匀后放置3min,接着加入500 μL 20% Na2CO3,最后分别加入一定体积的蒸馏水使其体积均为5 mL,充分摇匀后放置在暗室里反应90 min。取出后,用紫外可见分光光度计测定吸光度A765值。分别以没食子酸标准溶液的浓度和吸光度为横纵坐标来绘制标准曲线[16]。
b)多酚含量的测定
将提取到的多酚定容到10 mL,按照与1.3.2 a)相同的方法进行测定并对照标准曲线计算多酚的含量。
1.3.3 桦褐孔菌多酚DPPH自由基清除率的测定
参考Zhu等[15]的方法测定桦褐孔菌多酚的 DPPH自由基清除率,具体方法为:将0.8 mL DPPH甲醇溶液(0.4 mM)加入到10 mL试管中,然后加入2.4 mL多酚样品,充分混合后,在暗室中室温保持 30 min,在波长为517 nm下,测得Ax值。对照组用蒸馏水代替多酚样品,在波长为517 nm下,测得A0值。用甲醇溶液代替 DPPH 甲醇溶液,多酚样品的加入量为2.4 mL,在波长为517nm下,测其Ax0值。计算公式如下:

(1)
1.3.4 桦褐孔菌多酚的分段分离鉴定
称取25 g Sephadex LH-20干粉于一定体积蒸馏水中,充分溶胀,将其填充在玻璃柱中(470 mm×15 mm),湿法上样后,以甲醇为流动相进行洗脱,流速为1.4 mL/min,结束后,继续用2~3倍柱体积的甲醇冲洗使柱子再生。
用紫外分光光度计在280 nm波长下,测定洗脱物的吸光度,根据色谱图中吸光度的变化,将得到的分段洗脱物合并成几个主要部分进行分析,并测定其中的多酚的含量及抗氧化性[17-18]。
1.3.5 数据分析
本文中的实验数据均为3组平行,运用 SPSS 19.0( USA)和 Origin 7.5软件进行处理。
2 结果与讨论
2.1 不同提取溶剂对桦褐孔菌多酚含量的影响
多酚主要分为酚酸、黄酮类和大分子多酚类物质,采用几种常见的溶剂提取桦褐孔菌子实体中的多酚,然后用乙酸乙酯萃取,可以使更多的小极性多酚进入乙酸乙酯层,极性较大的多酚则更容易被萃取到正丁醇层。每组实验平行3次,采用SPSS软件进行统计分析。
从图1可以看出,采用不同的溶剂提取,得到的乙酸乙酯和正丁醇萃取层多酚含量是不同的。通过对显著性差异的分析得出,乙酸乙酯层多酚含量由高到低为:甲醇*>甲醇>乙醇>水*>水,其中,甲醇*代表在60℃条件下以甲醇为提取溶剂,水*代表在100℃条件下以水为提取溶剂,其余均为室温条件;正丁醇层多酚含量由高到低:甲醇*>水*>水>乙醇>甲醇。以水为溶剂时,得到较多的强极性酚类物质,使得乙酸乙酯层多酚的含量最低,而正丁醇层多酚含量相对较高。通过比较分析得到,在60℃条件下,采用甲醇提取子实体中多酚的效果是最好的,提取液的乙酸乙酯层和正丁醇层多酚含量明显高于其他条件(P<0.05)。
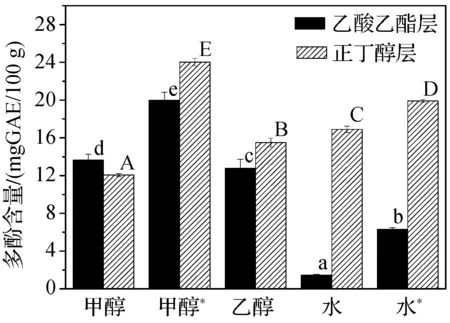
图1 不同提取溶剂对多酚萃取物中多酚含量的影响注:甲醇*:60 ℃条件,水*:100 ℃条件,其余均为室温条件。图中乙酸乙酯层和正丁醇层多酚含量的显著性差异分别用小写字母和大写字母表示,不同字母代表有显著性差异(P<0.05)。
2.2 不同提取溶剂对桦褐孔菌多酚抗氧化活性的影响
多酚的抗氧化活性研究非常重要,多酚DPPH自由基清除率经常被用来衡量抗氧化活性的高低。本实验在研究了多酚含量的基础上,比较不同提取溶剂的乙酸乙酯层和正丁醇层多酚萃取物在同一浓度下(100 mg GAE/L)的DPPH自由基清除率,同样每组实验平行3次,采用SPSS软件进行统计分析。
如图2所示,除水的乙酸乙酯层多酚以外,其余多酚的DPPH自由基清除率均在30%左右。相比较而言,在60℃条件下,甲醇提取液的乙酸乙酯层多酚和正丁醇层多酚的DPPH自由基清除率显著性地高于其它提取液(P<0.05),分别达到了40.01%和39.10%。综合考虑乙酸乙酯层和正丁醇层多酚的含量和DPPH自由基清除率,确定在60 ℃条件下,采用甲醇提取桦褐孔菌子实体中的多酚。
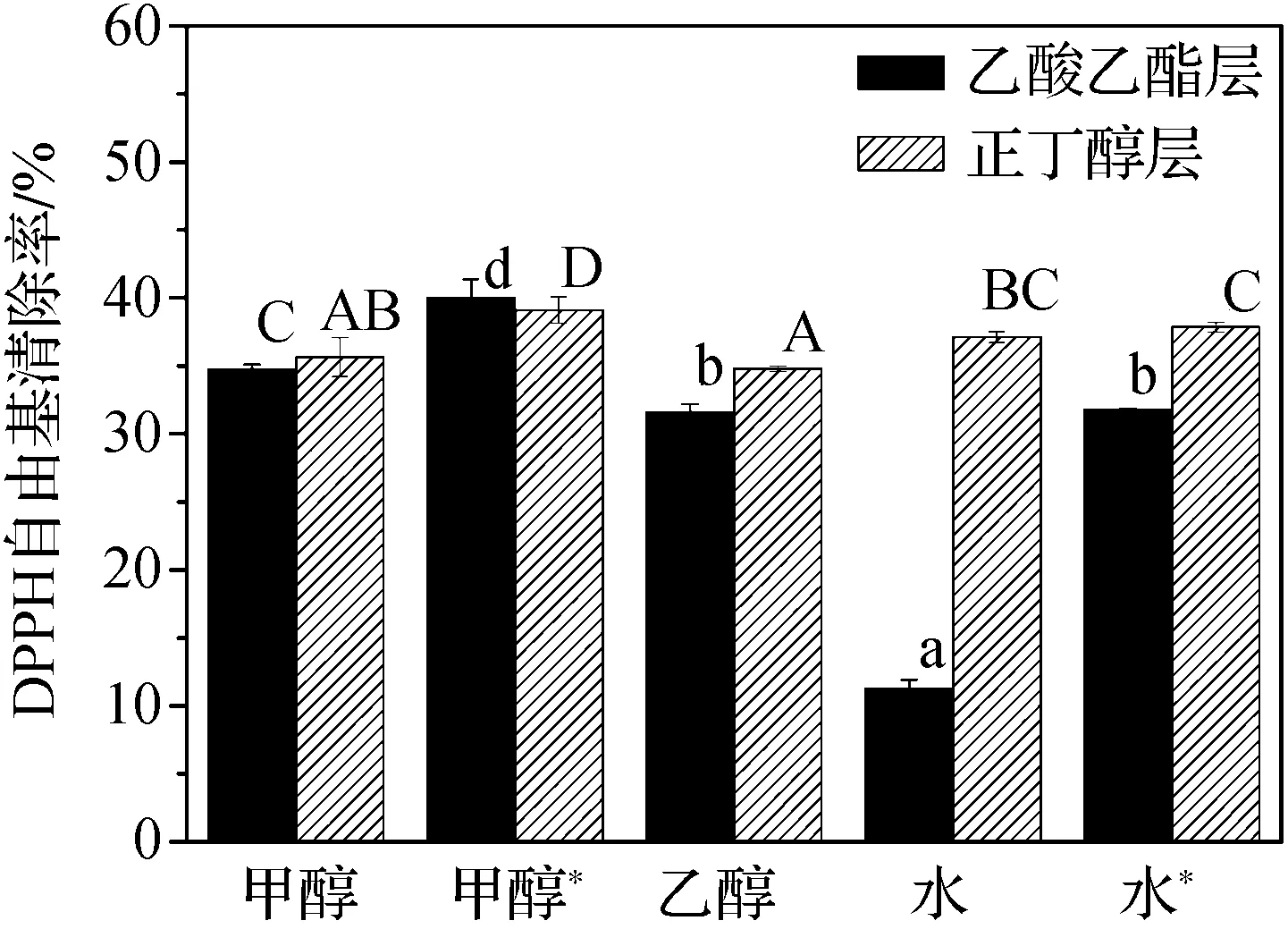
图2 不同提取溶剂对多酚萃取物的DPPH自由基清除率的影响注:甲醇*:60 ℃条件,水*:100 ℃条件,其余均为室温条件。图中乙酸乙酯层和正丁醇层多酚DPPH自由基清除率的显著性差异分别用小写字母和大写字母表示,不同字母代表有显著性差异(P<0.05)。
2.3 不同萃取层多酚Sephadex LH-20柱色谱流出曲线
在波长为280 nm下,测定每个试管中乙酸乙酯层和正丁醇层多酚柱色谱洗脱物的吸光度,制成色谱图,根据色谱图中吸光度的变化,将得到的洗脱物合并成几个主要部分进行分析,由于乙酸乙酯层和正丁醇层多酚的极性和组成的差异,其得到的柱色谱流出曲线不同,随着洗脱的进行,乙酸乙酯层多酚逐渐被洗脱出来,与乙酸乙酯层相比,正丁醇层多酚较易被洗脱出来,F2中洗脱液的吸光度最高,含有较多的多酚,具体结果如图3所示。

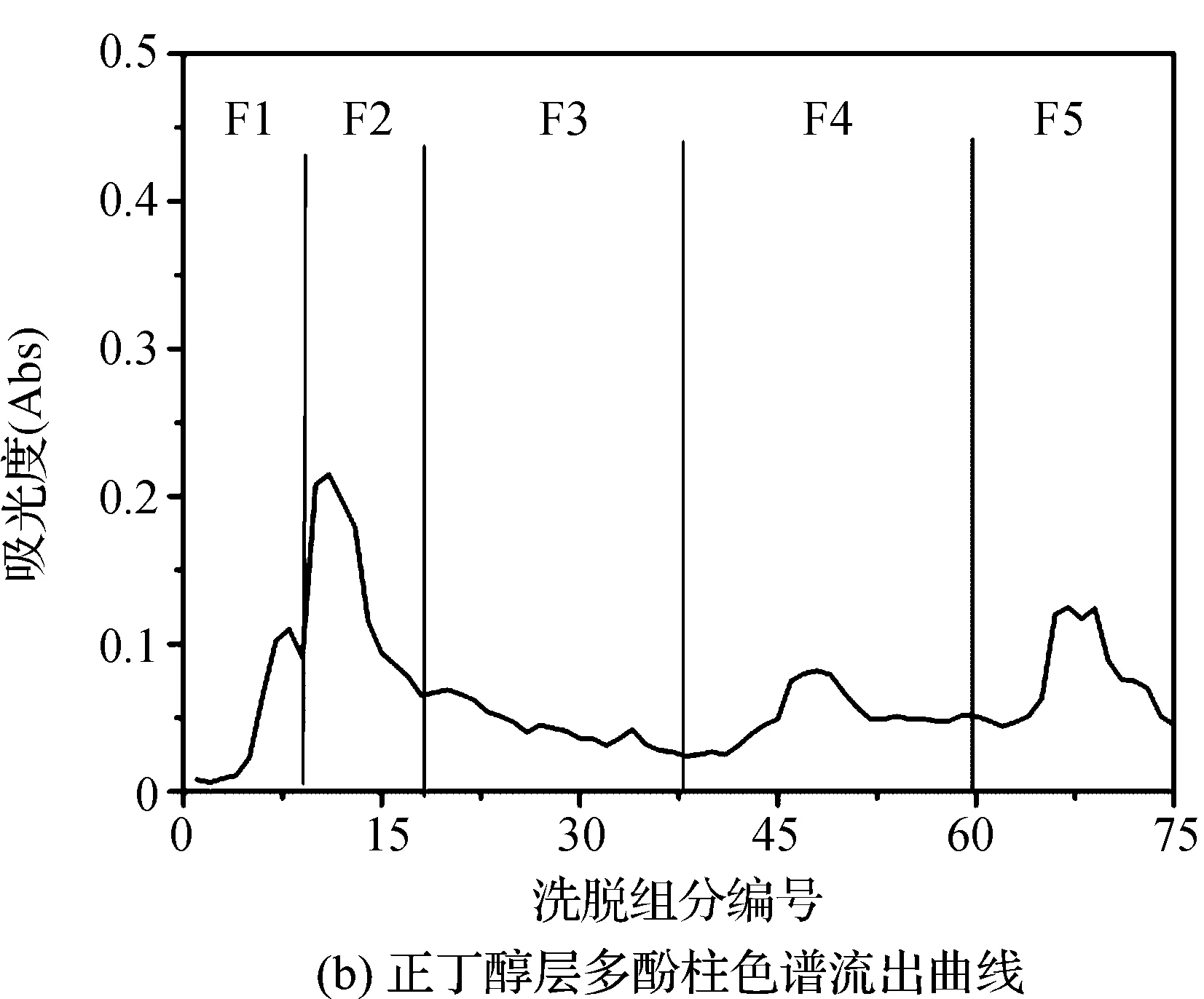
图3 桦褐孔菌子实体多酚柱色谱流出曲线
2.4 不同萃取层多酚分段分离的多酚含量
将得到的洗脱物进行根据流出曲线进行合并后,测定了各个部分的多酚含量。从图4(a)中可以


图4 桦褐孔菌子实体多酚分段分离多酚含量注:图中多酚含量的显著性差异用小写字母表示,不同字母表示有显著性差异(P<0.05)。
看出乙酸乙酯层分段洗脱物中多酚含量由高到低为:Ⅱ>Ⅲ>Ⅳ>Ⅰ>Ⅴ,第Ⅱ部分的多酚含量明显高于其他组分(P<0.05),第Ⅴ部分的多酚含量最低;如图4(b),对于正丁醇层分段洗脱物,同样是第Ⅱ部分的多酚含量最高,其余部分均要远远低于第Ⅱ部分,第Ⅱ和Ⅴ部分没有显著性差异(P<0.05)。由于正丁醇极性大于乙酸乙酯,在正丁醇层中含有更多的强极性多酚。
2.5 不同萃取层多酚分段分离的多酚抗氧化活性
抗氧化活性是多酚的一个重要生物学活性,因此比较分段多酚的抗氧化活性的不同是十分重要的。如图5(a),乙酸乙酯层分段洗脱物的DPPH清除率由高到低为:Ⅱ>Ⅲ>Ⅳ>Ⅴ>Ⅰ,其中第Ⅱ部分中不仅含有最多的多酚,其对应的DPPH清除率也是最高的,达到了65.61%;第Ⅳ和Ⅴ部分的多酚含量虽然较低,但其DPPH自由基清除率较高,分别达到了54.80%和51.50%,这说明该部分含有更多的高活性多酚;正丁醇层分段洗脱物中,除第Ⅰ部分以外,其余部分的DPPH自由基清除率均在40%

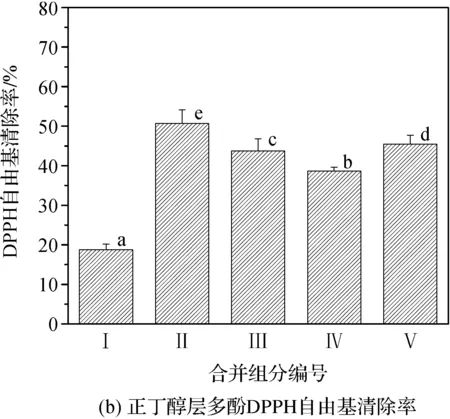
图5 桦褐孔菌子实体多酚分段分离多酚DPPH自由基清除率注:图中多酚DPPH自由基清除率的显著性差异用小写字母表示,不同字母表示有显著性差异(P<0.05)。
以上,第Ⅱ部分的抗氧化活性最高,达到了50.70%,说明这几部分中含有的多酚活性较高(P<0.05),具体结果如图5(b)。同时通过比较发现,乙酸乙酯层多酚的DPPH自由基清除率总体上高于正丁醇层,具有较高的抗氧化活性(P<0.05)。
3 结 论
桦褐孔菌作为一种天然药用真菌,其子实体中含有大量的生物活性成分,其中多酚类物质在抗氧化活性方面发挥着重要的作用。通过对几种溶剂提取液中多酚含量和抗氧化活性的研究发现:a)在60 ℃条件下,采用甲醇溶剂对桦褐孔菌子实体中多酚的提取效果是最有效的;b)Sephadex LH-20柱色谱可以对不同萃取层多酚初步进行有效分离,对多酚含量和抗氧化活性的比较后,从而得出抗氧化活性不仅与多酚含量有关,更重要的是受多酚组成的影响。该实验结果为后续多酚的进一步分离鉴定提供了前提,可以尝试在此基础上选择活性较高的部分进行组分研究。
[1] XU X, QUAN L, SHEN M. Effect of chemicals on production, composition and antioxidant activity of polysaccharides ofInonotusobliquus[J]. International Journal of Biological Macromolecules,2015,77:143-150.
[2] ZHENG W, ZHANG M, ZHAO Y, et al. Accumulation of antioxidant phenolic constituents in submerged cultures ofInonotusobliquus[J]. Bioresource Technology,2009,100(3):1327-1335.
[3] SONG Y, HUI J, KOU W, et al. Identification ofInonotusobliquusand analysis of antioxidation and antitumor activities of polysaccharides[J]. Current Microbiology,2008,57(5):454-462.
[4] XU X, SHEN M, QUAN L. Stimulatory agents simultaneously improving the production and antioxidant activity of polyphenols fromInonotusobliquusby submerged fermentation[J]. Applied Biochemistry and Biotechnology,2015,176:1237-1250.
[5] ZHENG W, MIAO K, LIU Y, et al. Chemical diversity of biologically active metabolites in the sclerotia ofInonotusobliquusand submerged culture strategies for up-regulating their production[J]. Applied Microbiology and Biotechnology,2010,87(4):1237-1254.
[6] YANG Z, TU Y, XIA H, et al. Suppression of free-radicals and protection against H2O2-induced oxidative damage in HPF-1 cell by oxidized phenolic compounds present in black tea[J]. Food Chemistry,2007,105(4):1349-1356.
[7] PALACIOS I, LOZANO M, MORO C, et al. Antioxidant properties of phenolic compounds occurring in edible mushrooms[J]. Food Chemistry,2011,128(3):674-678.
[8] WONG J Y, CHYE F Y. Antioxidant properties of selected tropical wild edible mushrooms[J]. Journal of Food Composition and Analysis,2009,22(4):269-277.
[9] XU X Q, WU Y D, CHEN H. Comparative antioxidative characteristics of polysaccharide-enriched extracts from natural sclerotia and cultured mycelia in submerged fermentation of Inonotus obliquus [J]. Food Chemistry,2011,127(1),74-79.
[10] XU X Q, LI J, HU Y. Polysaccharides fromInonotusobliquussclerotia and cultured mycelia stimulate cytokine production of human peripheral blood mononuclear cells in vitro and their chemical characterization [J]. International Immunopharmacology,2014,21(2),269-278.
[11] CUI Y, KIM D S, PARK K C. Antioxidant effect ofInonotusobliquus[J]. Journal of Ethnopharmacology,2005,96(1):79-85.
[12] ZHENG W, ZHANG M, ZHAO Y, et al. Analysis of antioxidant metabolites by solvent extraction from sclerotia ofInonotusobliquus(Chaga)[J]. Phytochemical Analysis,2011,22(2):95-102.
[13] NAKAJIMA Y, SATO Y, KONISHI T. Antioxidant small phenolic ingredients inInonotusobliquus(persoon) Pilat(Chaga)[J]. Chemical and Pharmaceutical Bulletin,2007,55(8):1222-1226.
[14] ZHAO Y X, MIAO K J, ZHI-WEN ZHANG M M, et al. Effects of nitric oxide on production of antioxidant phenolic compounds in Phaeoporus obliquus[J]. Mycosystema,2009,28(5):750-754.
[15] ZHU L, XU X. Stimulatory effect of different lignocellulosic materials for phenolic compound production and antioxidant activity fromInonotusobliquusin submerged fermentation[J]. Applied Biochemistry and Biotechnology,2013,169(7):2138-2152.
[16] SINGLETON V L, ROSSI J A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal of Enology and Viticulture,1965,16(3):144-158.
[18] BOULEKBACHE-MAKHLOUF L, MEUDEC E, CHIBANE M, et al. Analysis by high-performance liquid chromatography diode array detection mass spectrometry of phenolic compounds in fruit of Eucalyptus globulus cultivated in Algeria[J]. Journal of Agricultural and Food Chemistry, 2010, 58(24): 12615-12624.
(责任编辑: 许惠儿)
Study on Separation of Polyphenol from Fruit Body ofInonotusobliquusand Its Antioxidant Activity
ZHAOWei,XUXiangqun
(School of Sciences, Zhejiang Sci-Tech University, Hangzhou 310018, China)
The fruit body ofInonotusobliquuscontains abundant active polyphenols. In order to separate the polyphenols, methanol, ethanol and water were used as the extraction solvents, and the extraction efficiency of different solvents was compared through determining content and DPPH radical scavenging activity of polyphenol. Meanwhile, Sephadex LH-20 column chromatography was applied to separate the polyphenol extract. The study results show that under the condition of 60 ℃ , the content and DPPH radical scavenging activity of polyphenol in extract reach the maximum when methanol as the solvent is combined with ultrasonication. Besides, good preliminary separation of polyphenol at ethyl acetate layer and n-butyl alcohol layer is achieved by using Sephadex LH-20 column chromatography. The result indicates that polyphenol composition is closely related to antioxidant activity. Preliminary separation of polyphenol lays a foudnaiton for further study of polyphenol components.
Inonotusobliquus; polyphenol; separation; antioxidant activity
10.3969/j.issn.1673-3851.2016.11.022
2016-03-12
浙江省自然科学基金项目(LY16B020013)
赵 伟(1990-),女,山东青岛人,硕士研究生,主要从事生物化学和生物分析化学方面研究。
徐向群,E-mail:xuxiangqun@zstu.edu.cn
Q936
A
1673- 3851 (2016) 06- 0928- 05 引用页码: 110706

