无溶剂体系丙三醇改性硅烷凝胶及应用于固定化脂肪酶
钱俊青, 唐弋奥, 李尚谦
无溶剂体系丙三醇改性硅烷凝胶及应用于固定化脂肪酶
钱俊青, 唐弋奥, 李尚谦
(浙江工业大学药学院, 浙江杭州310014)
为了获得适用于食品工业且固定化酶性能优异的固定化材料,规避在固定化材料制备过程中使用影响食品安全性的试剂,在无溶剂体系中以丙三醇改性四乙氧基硅烷(TEOS)获得改性硅烷凝胶。经过试验研究,获得的优化改性工艺条件为原料摩尔比四乙氧基硅烷(TEOS):丙三醇= 1:0.25,固体酸催化剂3 g×(50 mL)-1TEOS,反应温度50℃,反应时间72 h。优化工艺获得的改性四乙氧基硅烷亲水性明显增强,在水中的溶解量可达0.58 g×mL-1。使用改性四乙氧基硅烷固定化假丝酵母脂肪酶,酶的催化活性得到良好保留,酶分子的结构刚性得到增强,和游离酶在相同条件下催化-抗坏血酸棕榈酸酯的合成,改性硅烷凝胶固定化酶表现出比游离酶更好的催化活性。经改性后的硅烷凝胶是食品安全性良好的酶固定化材料。
丙三醇改性;硅烷凝胶;无溶剂体系;固定化;脂肪酶
1 前 言
固定化酶在食品工业中的应用十分广泛,常被用于油脂加工[1]、乳品制造[2]、食品添加剂合成[3]等多个领域。硅烷凝胶是固定化酶的良好材料[4],在使用硅烷凝胶固定化酶时,具有材料可调控性好[5]、适用范围广[6]、能保持酶分子较佳空间构象[7]等优点。但硅烷凝胶也具有水溶性差[8]、材料较脆[9]等缺点,因而常通过对硅烷凝胶进行改性来解决上述缺点,目前以丙三醇改性硅烷凝胶前体——四乙氧基硅烷(TEOS)为较理想的改性方法,但在获得改性四乙氧基硅烷时,要采用乙腈为反应介质[10,11],而乙腈具有较强的毒性,这严重限制了改性硅烷凝胶固定化酶在食品工业中的应用[12],而其他的改性方法又存在各种不足[13,14],因此,寻找一种安全性高,适合于食品工业的硅烷凝胶改性方法十分必要。
在无溶剂体系中使用丙三醇改性四乙氧基硅烷这一方法在国内外均少有报道,本研究采用这种方法对硅烷凝胶前体进行改性,获得了与使用乙腈作为反应介质时性能相当的改性四乙氧基硅烷。并利用该改性四乙氧基硅烷固定化脂肪酶,以催化食品抗氧化剂L-抗坏血酸棕榈酸酯合成为催化活性的考察依据,考察固定化脂肪酶的催化活力,以期获得适用于食品工业的且具有优秀固定化性能的酶固定化材料。
2 材料和方法
2.1 材料
2.1.1 药品与试剂
四乙氧基硅烷(TEOS),阿拉丁T110593;丙三醇,杭州化学试剂有限公司;固体酸催化剂(732型强酸性阳离子交换树脂),杭州争光树脂有限公司;假丝酵母脂肪酶(Candida rugose lipase, CRL),10000 U,北京凯泰新世纪生物技术有限公司;其他有机试剂,国药集团化学试剂有限公司。
2.1.2 仪器
恒温水浴振荡器,金坛市江南仪器厂;pH计,上海精科仪器公司;傅里叶变换红外光谱仪,美国伯乐仪器公司;旋转蒸发仪,东京理化;电热恒温鼓风干燥箱,上海新苗医疗器械有限公司。
2.2 方法
2.2.1 丙三醇改性四乙氧基硅烷的合成
于250 mL锥形瓶中,加入732型强酸性阳离子交换树脂做固体酸催化剂,然后加入50 mL四乙氧基硅烷,在含有机溶剂和无溶剂体系中振荡反应,振荡转速为180 r×min-1,滴加丙三醇,待反应结束后过滤除去固体酸催化剂,将滤液于25℃下减压蒸馏8 h(真空度低于30 kPa),得到透明状固体凝胶。水溶性是衡量改性四乙氧基硅烷性能的重要指标,溶解性越好其性能越好[15],因此使用水溶性作为改性四乙氧基硅烷性能好坏的评定依据。
2.2.2 改性四乙氧基硅烷溶解性测定
取3个4.5 mL的离心管,分别量取2.0 mL蒸馏水,向离心管中逐渐加入改性凝胶前体,振荡混匀,直至加入的改性凝胶前体不能继续溶解于蒸馏水中,移取1 mL饱和溶液上清液至已干燥并称重的培养皿中,于恒温烘箱中干燥至恒重,每组测定3次,得到改性前体饱和溶液中溶质的质量,溶解性以改性四乙氧基硅烷在水中溶解的质量浓度计算(g×mL-1)。
2.2.3 改性四乙氧基硅烷的结构表征
采用红外光谱、13C-NMR和1H-NMR对丙三醇改性后的硅烷凝胶前体进行结构表征。
2.2.4 假丝酵母脂肪酶的固定化
取0.6 g改性四乙氧基硅烷,加入蒸馏水2.0 mL,加入致孔剂PEG600 80 mg,超声得到透明均匀的溶液,后用NaOH溶液调节pH至7.0,然后加入含假丝酵母脂肪酶200 mg 的磷酸盐缓冲液4 mL (0.1 mol×L-1,pH7.8),最后加入硅烷偶联剂3-氨基丙基三乙氧基硅烷(APTES),之后放入4℃ 冰箱中,老化72 h,最后冷冻干燥12 h,即可制得改性硅烷凝胶固定化假丝酵母脂肪酶。
2.2.5-抗坏血酸棕榈酸酯的合成
本研究选用-抗坏血酸和棕榈酸甲酯合成-抗坏血酸棕榈酸甲酯作为检测改性硅烷凝胶固定化脂肪酶催化活力的反应。取50 mL具塞三角瓶,加入20 mL叔戊醇作为反应溶剂(使用前分子筛除水),加入1.36 mmol (0.24 g)-抗坏血酸,1.11 g棕榈酸甲酯,改性硅烷凝胶固定化脂肪酶0.4 g(含100 mg脂肪酶)或100 mg游离脂肪酶,于50℃,200 r×min-1反应24 h。
2.2.6-抗坏血酸棕榈酸酯的测定
根据中国人民共和国国家标准(GB16314-1996)中-抗坏血酸棕榈酸酯的检测方法,采用碘量法对其进行含量的测定[16]。
3 结果与分析
3.1 无溶剂体系改性四乙氧基硅烷的制备和改性工艺优化
在未选出优化改性工艺条件之前,使用的改性工艺条件为原料摩尔比TEOS:丙三醇= 1:0.5,固体酸催化剂2 g,反应温度40℃,反应时间72 h。
选用乙腈(ACN)、丙酮、二氯甲烷(DCM)作为反应介质以及在无溶剂体系中进行丙三醇改性四乙氧基硅烷的制备,结果见图1。
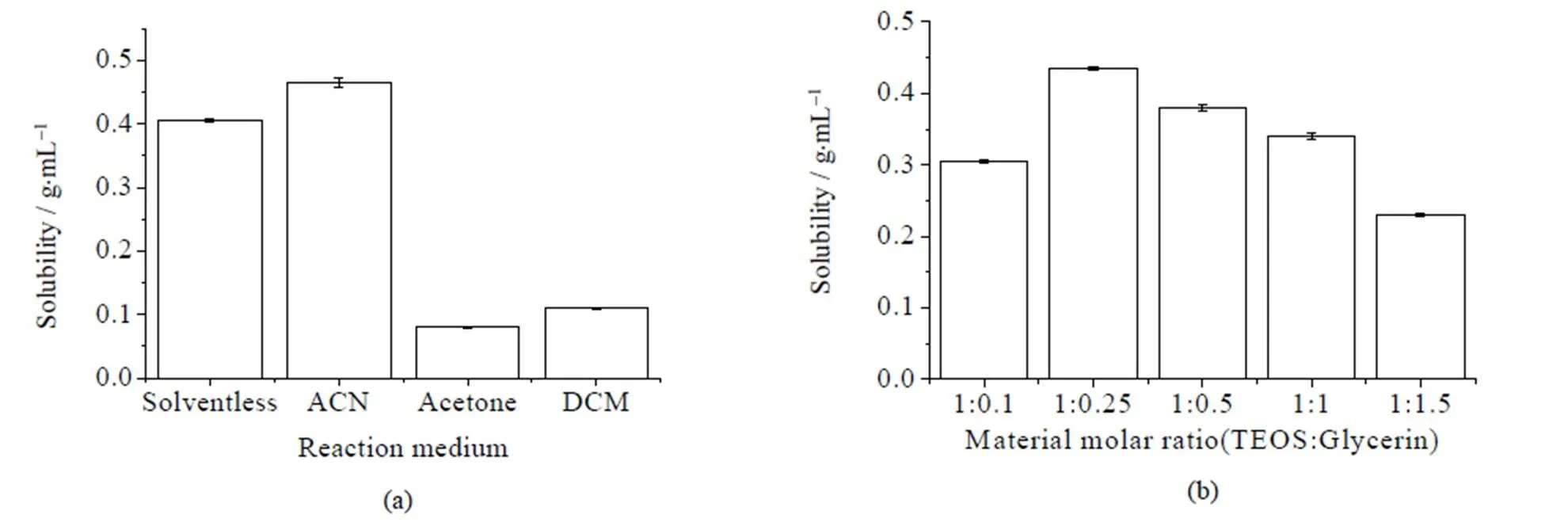
图1 反应介质(a) 和底物摩尔比(b) 对改性四乙氧基硅烷的影响
由图1(a)可知,当使用无溶剂体系改性四乙氧基硅烷时,所得改性四乙氧基硅烷的水溶性已经与使用乙腈作为反应介质所得的改性四乙氧基硅烷相当,并且远大于二氯甲烷以及丙酮作反应介质时的产物溶解性。说明使用无溶剂体系改性的四乙氧基硅烷其性能可以达到用于固定化酶的要求,因此,选用无溶剂体系作为改性四乙氧基硅烷的反应体系,来进行后续改性工艺条件的优化。
原料摩尔比对反应进行的方向和程度有重要影响,本研究探讨了不同原料摩尔比对改性四乙氧基硅烷反应的影响,由图1(b)可知,原料中TEOS:丙三醇= 1:0.25时,改性凝胶前体溶解性最大,改性效果较好。当原料中丙三醇含量继续增大时,其改性后产物溶解性下降,可能是由于空间位阻的原因,导致丙三醇难以较多取代硅原子上面的乙氧基基团。
反应温度影响反应进行的速率和平衡状态,本研究探讨了反应温度对改性四乙氧基硅烷反应的影响,结果见图2。
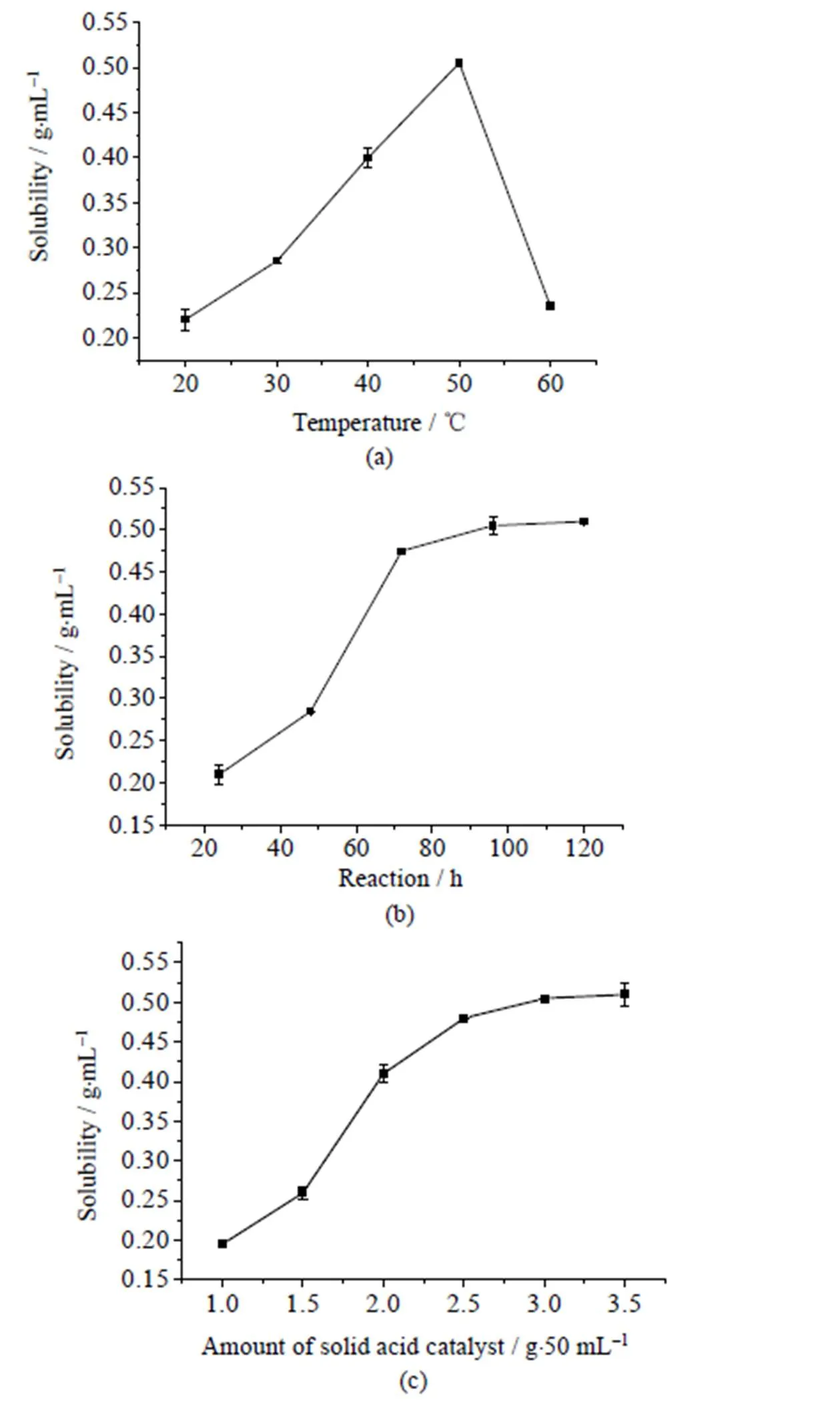
图2 反应温度(a) 、反应时间(b) 和固体酸催化剂用量(c) 对改性四乙氧基硅烷的影响
由图2(a)可知,反应温度对合成的前体的水溶性影响较大。随反应温度的升高,改性四乙氧基硅烷溶解性逐渐增加;但是当反应温度大于50℃ 时,溶解效果变差,因此反应温度选择为50℃,另外从反应速度的角度出发,反应温度为50℃也十分合适。
恰当的反应时间可以保证反应得到充分进行并且获得较好的实验效率,本研究探讨了反应时间对改性四乙氧基硅烷反应的影响,由图2(b)可知,当反应时间超过72 h后,丙三醇取代硅烷乙氧基的反应速率变慢,并在80 h后,反应基本达到平衡状态,综合考虑实验效率和改性效果,选择最适反应时间为72 h。
催化剂用量会影响反应速率甚至影响反应结果,本研究探讨了固体酸催化剂用量对对改性四乙氧基硅烷反应的影响,由图2(c)可知,当固体酸催化剂的用量超过2.5 g时,丙三醇改性后硅烷凝胶前体溶解性提高缓慢,说明此时丙三醇与TEOS反应较为完全,效果较好。综合选择催化剂的用量为3.0 g。
3.2 改性四乙氧基硅烷的结构表征
3.2.1 红外表征
采用红外光谱对改性前后及具有不同溶解性的改性四乙氧基硅烷进行表征,结果见图3,图3(b)中A为溶解性稍差(0.12 g×mL-1)的改性四乙氧基硅烷,B溶解性能适中(0.36 g×mL-1)的硅烷凝胶前体,C溶解性能较好(0.58 g×mL-1)硅烷凝胶前体。
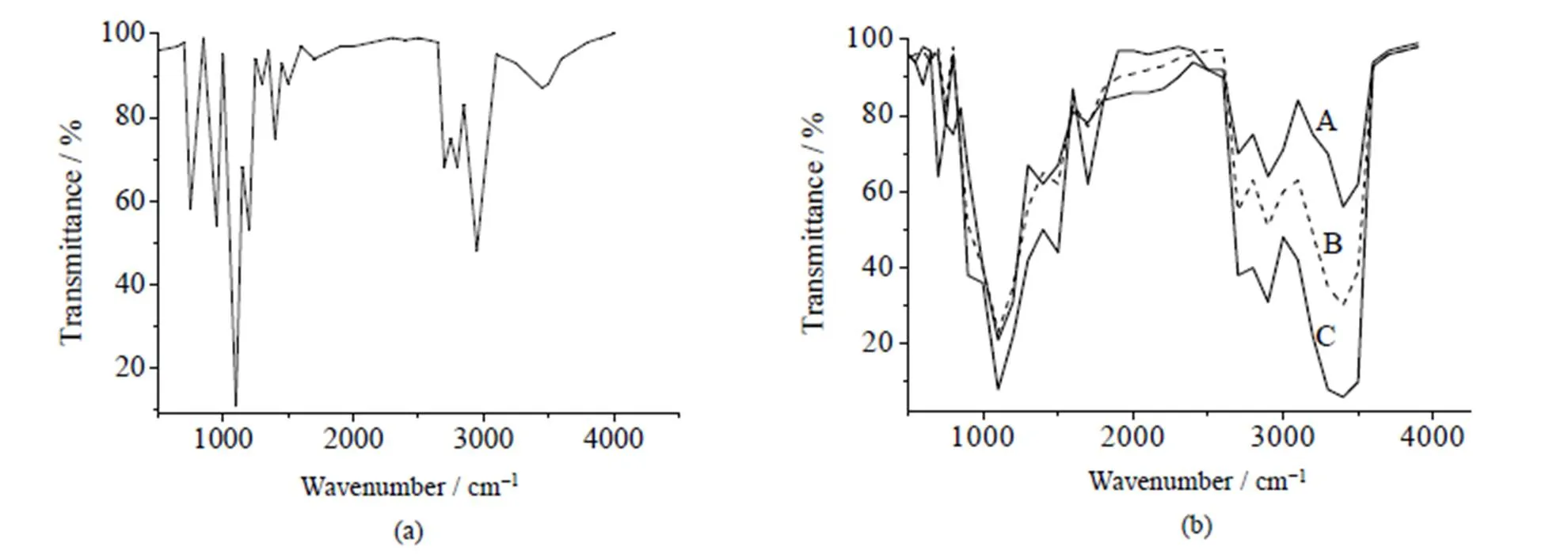
图3 TEOS (a) 和不同溶解性的改性四乙氧基硅烷(b) 的红外光谱图
从图3(a)与(b)的对比中,可发现图3(b)中3600~3300 cm-1处有强吸收,这是由于产物中具有较多的羟基的原因,说明TEOS上的乙氧基被丙三醇所取代,因而具备有较多的羟基。图3(b)中,不同溶解性的改性四乙氧基硅烷呈现不同的红外光谱图,溶解性能较好的改性四乙氧基硅烷在3600~3300 cm-1处有较强吸收,基本可以表明丙三醇与TEOS发生较为完全的反应,改性效果较好;溶解性能较差的硅烷凝胶前体在此处吸收较弱,表明丙三醇与TEOS反应并不完全,改性效果较差。
3.2.2 核磁表征
采用13C-NMR和1H-NMR对丙三醇改性后的硅烷凝胶前体进行表征,结果见图4.
根据图4(a)的1H-NMR中可以看出,谱图中除了有TEOS的1.2 ppm和3.85 ppm左右的乙氧基峰、(3.5~3.6) ppm丙三醇吸收峰外,(3.6~3.8) ppm有很多新的峰出现,这些新增的峰是与氧相连的碳上的氢原子的特征峰,由此看出是丙三醇取代了TEOS上的乙氧基基团。
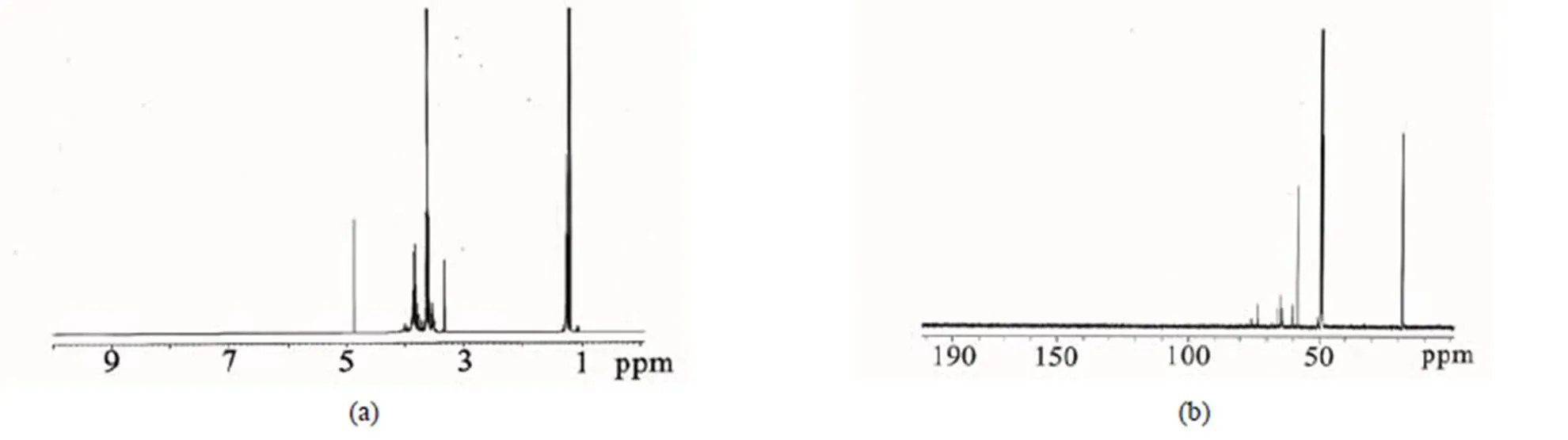
图4 改性四乙氧基硅烷的1H-NMR (a)和C-NMR 谱(b) (CH3OD,400M)
根据图4(b)的13C-NMR中可以看出,除了有TEOS的18.4 ppm和59 ppm的乙氧基碳峰、丙三醇的63 ppm和74 ppm位的碳峰外,在60 ppm和73 ppm处都有新的峰出现,是丙三醇取代乙氧基后所表现出来的峰值。
3.3 改性硅烷凝胶固定化酶
使用制得的改性四乙氧基硅烷按2.2.4节方法对假丝酵母脂肪酶进行固定化,得到改性硅烷凝胶固定化酶。在固定化酶的过程中,硅烷偶联剂3-氨基丙基三乙氧基硅烷(APTES)的使用量会对凝胶形成有重要影响,改性四乙氧基硅烷与APTES的反应示意图见图5,本研究探讨了APTES使用量对固定化酶活性的影响。
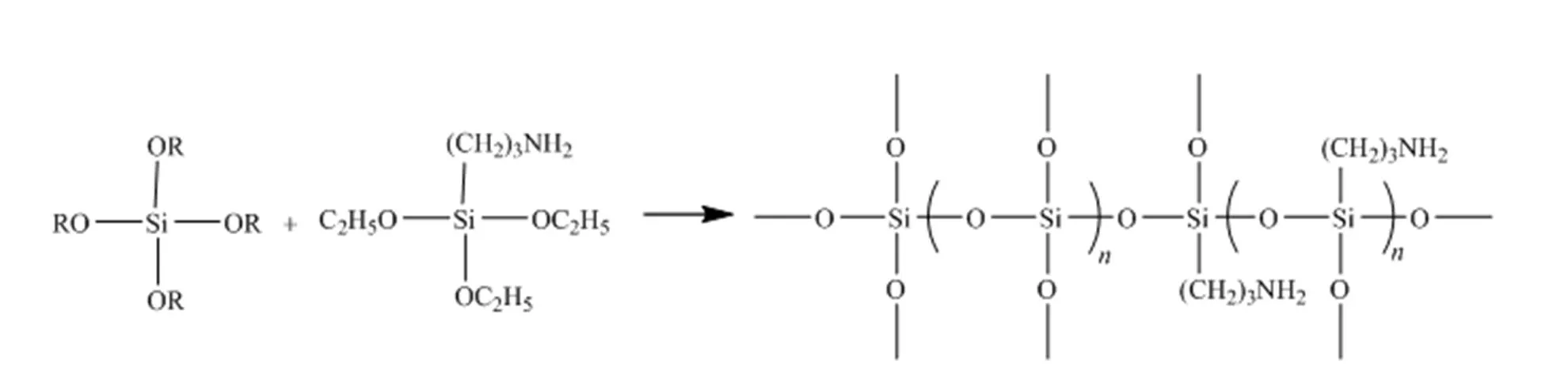
图5 改性四乙氧基硅烷与APTES 的反应示意图
3.3.1 APTES使用量对固定化酶活性的影响
APTES使用量对固定化酶活性的影响,结果见图6。
由图6(a)可知,固定化过程中添加硅烷偶联剂APTES,能够使前体迅速发生聚合反应生成凝胶,完成凝胶对酶的包埋,硅烷偶联剂APTES的添加量对凝胶的形成及酶的活性有着重要的影响,适量增加硅烷偶联剂APTES的使用能够提高固定化酶的催化酯化活性,其中硅烷偶联剂APTES的使用量选择为250 uL时较为适宜。
3.3.2 固定化酶与游离酶催化活性的比较
3.3.2.1 不同pH缓冲液处理后固定化酶和游离酶催化活性的比较
使用不同pH缓冲液溶解游离酶并用于固定化,在相同条件下处理游离酶后冷干,之后做催化活性的比较,由图6(b)可知,固定化酶始终比游离酶具有更好的催化活性,可能的原因是固定化材料增强了酶蛋白分子结构的刚性,在与外界环境接触的过程中,其分子结构更加不易受到破坏。当pH为7.8时,固定化酶每mg酶能催化合成0.0012 g产物;pH为7.6时,游离酶每mg酶能催化合成0.0009 g产物。经固定化后,固定化脂肪酶的最适pH为7.8,而游离酶最适pH为7.6。
3.3.2.2 不同温度下固定化酶和游离酶催化活性的比较
不同温度下固定化酶和游离酶催化活性的比较,由图6(c)可知,改性硅烷凝胶固定化酶较游离酶具有更好的热稳定性,在较高温度下仍然具有很强的催化活性,且固定化酶的最适温度为50℃,比游离酶的最适温度要高。固定化酶相较游离酶展现出了更好的催化活性,在各自最适催化条件下催化-抗坏血酸棕榈酸甲酯的合成,固定化酶每mg酶能催化合成0.0013 g产物,游离酶每mg酶能催化合成0.0009 g产物,得到的产物浓度是游离酶催化相同反应的1.42倍。

图6 APTES用量对固定化酶活性的影响(a) 以及不同pH 缓冲液处理后(b) 和不同温度下(c) 固定化酶和游离酶的酶活比较
4 结 论
使用无溶剂体系改性得到的硅烷凝胶前体,是良好的固定化材料,具有好的食品安全性和生物相容性。改性硅烷凝胶固定化脂肪酶,较好地保存了酶分子的结构,且酶蛋白分子获得了更好的结构刚性,使其热稳定性等性能得到提高,相较游离酶,在催化-抗坏血酸棕榈酸甲酯的合成时,固定化酶的催化活性更高。同时,在此研究基础上,还应对固定化凝胶的结构、固定化酶的泄漏情况、固定化酶的重复使用次数等参数做进一步探讨。综上所述,无溶剂体系改性四乙氧基硅烷是良好的硅烷凝胶改性方法,改性过程规避了乙腈,保证了该固定化材料在食品工业中的应用。
参考文献:
[1] ChangM K, Abraham G, JohnV T,. Production of cocoa butter-like fat from interesterfication of vegetable oils [J]. Journal of the American Oil Chemists¢Society, 1990, 67(11): 832-834.
[2] LIU Jing (刘晶), HAN Qing-bo (韩清波), ZHANG Yao-guang (张耀广). Creamy enzyme and its influence on quality of dairy products(乳脂酶及其对乳制品品质的影响) [J]. Science and Technology of Food Industry(食品工业科技), 2006, 27(4): 194 -1961.
[3] TANG Lu-hong (汤鲁宏), ZHANG Hao (张浩). Selection of suitable reaction media and lipase:synthesize of l-ascorbyl palmitate catalyzed by lipase (催化合成L-抗坏血酸棕榈酸酯的反应媒体和脂肪酶) [J]. Journal of Wuxi University of Light Industry (无锡轻工大学学报), 2000, 19(2): 157-1591.
[4] Lisa C K. Sol-gel optics: processing and applications [M]. Berlin: Springer Science& Business Media, 1994.
[5] Hsu A F, Foglia T A, Shen S. Immobilization of Pseudomonas cepacia lipase in a phyllosilicate sol–gel matrix: effectiveness as a biocatalyst [J]. Biotechnology and Applied Biochemistry, 2000, 31(3): 179-183.
[6] Kadnikova E N, Kostić N M. Sol–gel glass is not necessarily an inert matrix for enzyme encapsulation. Catalysis of sulfoxidation by silica [J]. Journal of Non-Crystalline Solids, 2001, 283(1): 63-68.
[7] HUANG Shu-fang (黄淑芳), JIANG Zhong-yi (姜忠义), WU Hong (吴洪). Problems and solutions of enzyme encapsulation through sol-gel process (溶胶-凝胶法固定化酶的问题与解决途径) [J]. Polymer Bulletin (高分子通报), 2003, 5: 28-35.
[8] Avnir D, Braun S, Lev O,. Enzymes and other proteins entrapped in sol-gel materials [J]. Chemistry of Materials, 1994, 6(10): 1605-1614.
[9] Lin J, Brown C W. Sol-gel glass as a matrix for chemical and biochemical sensing [J]. TrAC Trends in Analytical Chemistry, 1997, 16(4): 200-211.
[10] Gill I. Bio-doped nanocomposite polymers: sol-gel bioencapsulates [J]. Chemistry of Materials, 2001, 13(10): 3404-3421.
[11] Lu S, Jiang S, Chen G. Synthesis and biocompatible properties of a new glycerylsilane [J]. Asian Journal of Chemistry, 2012, 24(11): 4883-4886.
[12] Gill I, Ballesteros A. Encapsulation of biologicals within silicate, siloxane, and hybrid sol-gel polymers: an efficient and generic approach [J]. Journal of the American Chemistry Society, 1998, 120(34): 8587-8598.
[13] Bhatia R B, Brinker C J, Gupta A K,. Aqueous sol-gel process for protein encapsulation [J]. Chemistry of Materials, 2000, 12(8): 2434-2441.
[14] Hodgson R J, Brook M A, Brennan J D. Capillary-scale monolithic immunoaffinity columns for immunoextraction with in-line laser-induced fluorescence detection [J]. Analytical Chemistry, 2005, 77(14): 4404-4412.
[15] Goring G L G, Brennan J D. Fluorescence and physical characterization of sol–gel-derived nanocomposite films suitable for the entrapment of biomolecules [J]. Journal of Materials Chemistry, 2002, 12(12): 3400-3406.
[16] General Administration of Quality Supervison, Inspection and Quanrantine of the People’s Republic of China (中华人民共和国国家技术监督局). Standards of food additives the determination of-ascorbic palmitate (食品添加剂使用卫生标准-抗坏血酸棕榈酸酯的测定): GB16314-1996 [S]. Beijing (北京): China Standard Publishing House (中国标准出版社), 1996.
Solvent-Free Glycerin Modified TetraethoxysilaneSol-Gel and its Application in Lipase Immobilization
QIAN Jun-qing, TANG Yi-ao, LI Shang-qian
(College of Pharmacy, Zhejiang University of Technology Hangzhou 310014, China)
Solvent-free glycerin modified tetraethoxysilane (TEOS) sol-gel was prepared to obtain enzyme immobilization materials without toxic reagents and suitable for food industry. The material prepared has good food safety and high biocompatibility, and the optimum modification conditions is TEOS: glycerin molar ratio = 1:0.25, solid acid catalyst 3 g×(50 mL)-1TEOS, temperature 50℃ for 72 h. The hydrophilicity of the modified TEOS is significantly increased with water solubility of 0.58 g×mL-1. The lipase immobilized shows high catalytic activity and strong structural rigidity.-ascorbyl palmitate synthesis catalyzed by immobilized and free enzymes is studied under same conditions, and the immobilized enzyme shows better performance.
glycerin modifying; sol-gel; solvent-free system; immobilization; lipase
1003-9015(2016)05-1134-06
Q814.2
A
10.3969/j.issn.1003-9015.2016.05.021
2015-11-25;
2016-02-24。
钱俊青(1964-),男,浙江绍兴人,浙江工业大学教授,博士。通讯联系人:钱俊青,E-mail: qjq@zjut.edu.cn

