五味子醇提物的提取工艺优化及其体外抗氧化作用评价Δ
田 双,严铭铭,邵 帅,刘 畅,尉忠贤,杨 洋(长春中医药大学中医药与生物工程研发中心,长春 130117)
五味子醇提物的提取工艺优化及其体外抗氧化作用评价Δ
田双*,严铭铭#,邵帅,刘畅,尉忠贤,杨洋(长春中医药大学中医药与生物工程研发中心,长春130117)
目的:优化五味子醇提物的提取工艺,并评价提取物及其纯化物的抗氧化作用。方法:以总酚酸、总黄酮含量及对1,1-二苯基-2-三硝基苯肼(DPPH)自由基消除率的综合评分为评价指标,设计单因素和正交试验优化五味子提取工艺中的提取次数、溶剂乙醇的体积分数、提取时间和溶剂倍量,并进行验证;对最优提取工艺所得提取物进行纯化,测定其对DPPH自由基的消除率和还原能力以评价纯化物的体外抗氧化作用(以维生素C为阳性对照)。结果:五味子的最优提取工艺条件为以8倍量70%乙醇加热回流提取3次,每次1.0 h;验证试验中各指标的RSD≤0.53%(n=3);提取物的30%乙醇洗脱部位抗氧化作用最强,其对DPPH自由基消除率和还原能力与维生素C相当。结论:优化后的提取工艺稳定、可行,所得提取物及纯化物具有较好的体外抗氧化作用。
五味子;总酚酸;总黄酮;提取工艺;正交试验;抗氧化作用
五味子[Schisandra Chinensis(Turcz.)Baill.]为木兰科植物,因皮肉甘酸,核中辛苦,且具咸味,故称五味子。《中国药典》中记载五味子具有收敛固涩、益气生津、补肾宁心等功效[1]。五味子中富含多种化学成分[2],但目前的研究主要集中在木脂素和多糖类化合物[3-4],而对总黄酮及总酚酸类化合物研究较少。大量研究表明,植物总黄酮及总酚酸类化合物具有很强的生物活性和药理活性,如降血脂、降血糖、抗氧化、抗炎等药理作用,尤其具有明显的抗氧化活性[5-6]。因此,本文对五味子中的抗氧化活性物进行研究,旨在为五味子资源开发利用提供更多的理论依据。
1 材料
1.1仪器
UV-1700紫外分光光度计(上海澳瑞德精密仪器有限公司);OSB-2100旋转蒸发仪(日本东京理化公司);JD60-4万分之一电子分析天平[德国赛多利斯科学仪器(北京)有限公司];CP225D电子分析天平(上海精密科学仪器有限公司);HH-6数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司)。
1.2药材、药品与试剂
五味子的干燥成熟果实(采于吉林省白山市抚松县种植地,于9-10月采摘,经长春中医药大学姜大成教授鉴定为真品);芦丁对照品(批号:0721-200010,纯度:92.5%)、咖啡酸对照品(批号:110831-200302,纯度:>98%)均来源于吉林省药品检验所;1,1-二苯基-2-三硝基苯肼(DPPH)、维生素C对照品(批号:20010217,纯度:99.0%)均来源于美国Sigma公司;试验所用试剂均为分析纯。
2 方法与结果
2.1五味子抗氧化活性物提取及纯化制备工艺流程
五味子干燥果实→粉碎→脱脂(5倍量石油醚冷浸脱脂)→与溶剂混合→沸水浴加热回流提取→过滤→滤液→减压浓缩→干燥→得抗氧化活性物粗提物→聚酰胺法纯化→得抗氧化活性物纯化物。
2.2含量测定
2.2.1对照品溶液的制备精密称取芦丁对照品25 mg、咖啡酸对照品1.5 mg,置于50 ml量瓶中,分别加甲醇和乙醇适量,超声溶解,放冷,定容至刻度,摇匀,即得。
2.2.2供试品溶液的制备精密称取五味子抗氧化活性物纯化物0.01 g,置于50 ml量瓶中,加乙醇适量,超声30 min溶解,取出,放冷,定容至刻度,滤过,即得。
2.2.3总黄酮含量测定[1]精密量取“2.2.1”项芦丁对照品溶液1、2、3、4、5、6 ml,分别置于25 ml量瓶中,各加水至6 ml,加入5%亚硝酸钠溶液1 ml,振荡摇匀,静置6 min;再加入10%硝酸铝溶液1 ml,振荡摇匀,静置6 min;加入氢氧化钠溶液10 ml,加水定容至刻度,摇匀,放置15 min。以相应的试剂为空白,于500 nm波长处测定吸光度。以质量浓度为横坐标(x),以吸光度(y)为纵坐标,建立标准曲线,得回归方程为y=9.54x+0.109 6(r=0.995 0),表明芦丁检测质量浓度线性范围为0.02~0.12 mg/ml。精密度试验的RSD为0.89%(n=6),准确度试验中平均回收率为97.28%(RSD=1.41%,n=6),表明本方法准确、可靠。
2.2.4总酚酸含量测定[1]精密量取“2.2.1”项咖啡酸对照品溶液0.25、0.5、1、1.5、2、2.5、3、4 ml,分别置于25 ml量瓶中,加无水乙醇至5.0 ml,加0.3%十二烷基硫酸钠2.0 ml及0.6%三氯化铁-0.9%铁氰化钾(1∶0.9)混合溶液1.0 ml,摇匀,于暗处放置5 min;加0.1 mol/L盐酸至刻度,摇匀,暗处放置20 min。以相应的试剂为空白,于700 nm波长处测定吸光度。以质量浓度为横坐标(x),以吸光度(y)为纵坐标,建立标准曲线,得回归方程为y=11.255x+0.063(r=0.998 0),表明咖啡酸检测质量浓度线性范围为0.3~4.8 μg/ml。精密度试验的RSD为1.39%(n=6),准确度试验中平均回收率为99.02%(RSD=1.67%,n=6),表明本方法准确、可靠。
2.2.5样品中总黄酮及总酚酸含量测定分别精密量取样品液2 ml(测总黄酮)、1 ml(测总酚酸),各置于10 ml量瓶中,按“2.2.3”“2.2.4”项下操作显色,测定吸光度,按各项下的回归方程计算样品液中总黄酮及总酚酸的含量。
2.3DPPH自由基消除试验[7]
取干燥洁净的具塞试管,依次编号,量取样品液2 ml置于具塞试管中,分别在各试管中加入2 ml 0.04 mg/ml DPPH溶液,涡旋混匀,于暗室反应30 min。在517 nm波长处测定吸光度(A1)。以2 ml甲醇代替DPPH溶液为阴性对照组,同法测定吸光度(A2)。以2 ml甲醇代替样品液为空白对照组,同法测定吸光度(A0)。以蒸馏水作空白调零,平行测定3次,取平均值。计算DPPH自由基的消除率[(A0-A1+A2)/A0×100%]。
2.4提取工艺优化
2.4.1单因素试验 (1)提取溶剂考察。取6份五味子粉末各100 g,分别加入1 500 ml不同提取溶剂(水,10%、30%、50%、70%、90%乙醇),加热回流提取3次,每次提取0.5 h。(2)提取次数考察。取4份五味子粉末各100 g,分别提取1、2、3、4次,提取溶剂为70%乙醇,料液比为1∶15,提取时间为0.5 h。(3)提取时间考察。取5份五味子粉末各100 g,分别提取0.5、1.0、1.5、2.0、3.0 h,提取3次,提取溶剂为70%乙醇,料液比为1∶15。(4)料液比考察。取5份五味子粉末各100 g,分别以料液比为1∶6、1∶8、1∶9、1∶10、1∶12加入70%乙醇,提取3次,每次提取2.0h。
取上述各提取液过滤,50条件下减压浓缩干燥,分别取适量并用甲醇溶解、定容,得样品液。按“2.3”项下方法进行DPPH自由基消除试验(平行测定3次,取平均值),结果见图1。
由图1A可知,当提取溶剂为70%乙醇时,DPPH自由基的消除率最大。由图1B可知,随着提取次数的增加,DPPH自由基的消除率逐渐增加;当提取次数为3、4次时,DPPH自由基的消除率无显著变化,因此提取3次即可。由图1C可知,在提取时间为0.5~2.0 h时,DPPH自由基的消除率随着时间延长而增大;当提取时间达到2.0、3.0 h时,DPPH自由基消除率无显著变化,因此提取时间选2.0 h较适宜。由图1D可知,随着料液比的增大,DPPH自由基消除率增大;当料液比为1∶10、1∶12时,DPPH自由基消除率无显著变化,因此料液比以1∶10较适宜。
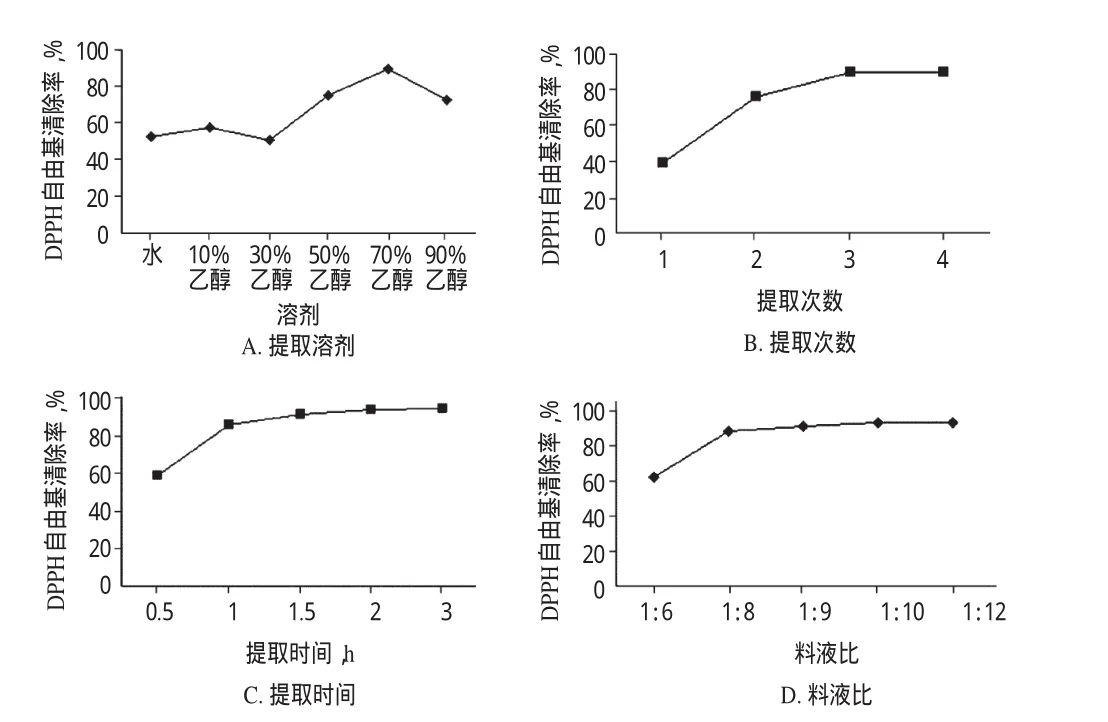
图1 各因素对DPPH自由基清除率的影响Fig 1 Effects of each factor on the clearance rate of DPPH free radical
2.4.2正交试验在单因素试验结果基础上,选择提取次数(A)、乙醇体积分数(B,%)、提取时间(C,h)、溶剂倍量(D)为考察因素,以总酚酸含量(X1)、总黄酮含量(X2)及DPPH自由基消除率(X3)的综合评分[以各指标的最大值为参照将数据进行归一化,设定总酚酸含量、总黄酮含量、DPPH自由基消除率的权重系数分别为0.25、0.25、0.5,综合评分(Y)=0.25X1×100/ X1max+0.25X2×100/X2max+0.5X3×100/X3max]。取五味子药材干燥粉末200 g,设计4因素3水平的正交试验进行加热回流提取(平行测定3次,取平均值)。因素与水平见表1;正交试验设计与结果见表2;方差分析结果见表3。

表1 因素与水平Tab 1 Factors and levels
由直观分析可得各因素最优组合为A3B3C3D3;由方差分析结果可知,以最小方差值D因素为误差项,A、B因素结果具有显著影响。经综合考察,为节省能源,提取时间选择1.0 h,溶剂倍量选择8倍量。最终确定最优提取工艺为A3B3C1D1,即采用70%的乙醇提取3次,每次1.0h,加溶剂乙醇量为药材量的8倍。
2.5验证试验
称取3批五味子药材,按最优提取工艺进行验证试验。结果总酚酸含量分别为24.89%、24.77%、24.96%(RSD=0.39%,n=3);总黄酮含量分别为11.41%、11.49%、11.53%(RSD=0.53%,n=3);DPPH自由基消除率分别为92.47%、92.41%、92.58%(RSD=0.09%,n=3)。这表明优化工艺稳定可行,且所制五味子醇提物具有较强的DPPH自由基消除作用。
2.6抗氧化作用试验
2.6.1纯化物制备[8]取上述按最优工艺提取的五味子提取物适量,加甲醇溶解,放至已装好的聚酰胺柱中,分别用水和10%、30%、50%、70%、95%乙醇以3倍柱体积(BV)的量进行梯度洗脱,收集各梯度洗脱液,50条件下减压回收溶剂,真空干燥得6种纯化物样品(编号为a~f)。
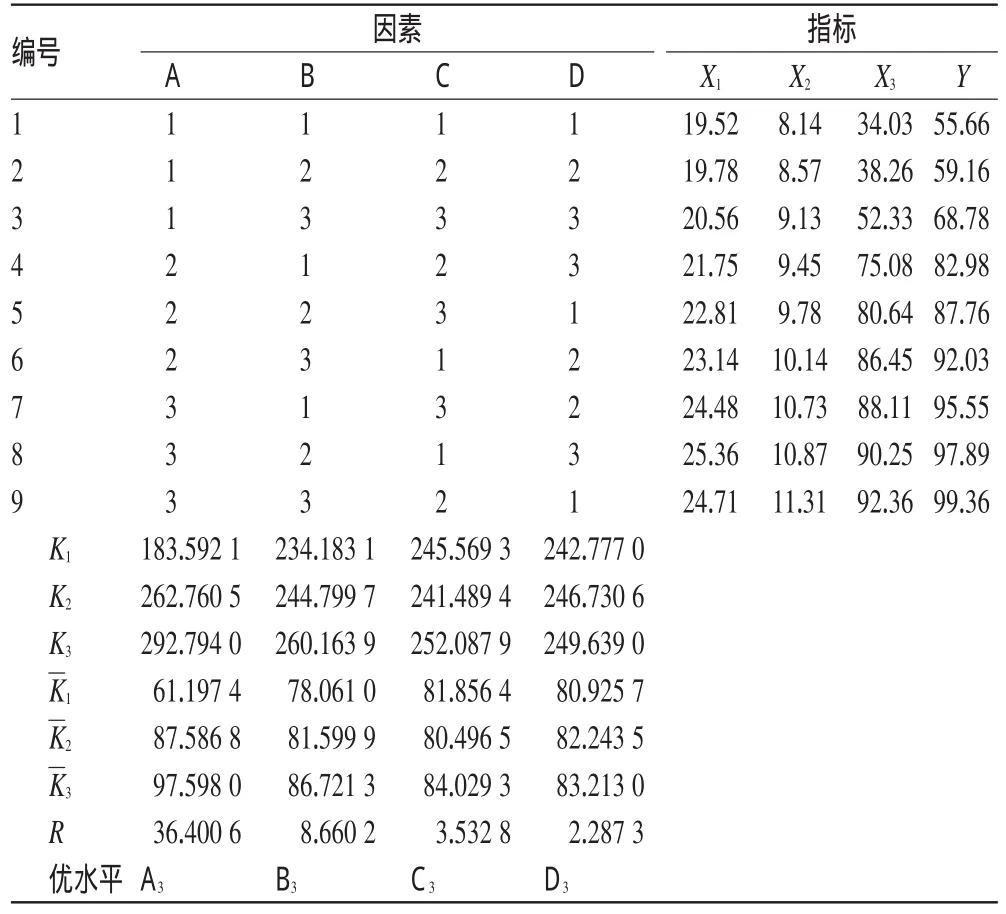
表2 正交试验设计与结果(n=3)Tab 2 Arrangement and results of the orthogonal tests(n=3)

表3 方差分析结果Tab 3 Results of variance analysis
2.6.26种纯化物的DPPH自由基消除率测定分别精密称取上述6种纯化物样品各2 mg,置于10 ml量瓶中,加甲醇溶解并定容至刻度,摇匀,即得质量浓度均为0.2 mg/ml的样品液。将上述样品液分别进行DPPH自由基消除试验(平行测定3次,取平均值),筛选抗氧化活性作用最强的纯化物。结果a~f的清除率分别为10.22%、27.69%、96.84%、68.22%、65.99%、66.54%,即当洗脱液为30%乙醇时所得纯化物(以下简称为30%乙醇纯化物)的DPPH自由基消除率最高,抗氧化活性最强。
2.6.330%乙醇纯化物的DPPH自由基消除率试验取30%乙醇纯化物样品适量,加甲醇超声溶解,制备成不同质量浓度(0.05、0.10、0.15、0.20、0.25 mg/ml)的样品液,以维生素C为阳性对照按“2.3”项下方法进行DPPH自由基消除试验(平行测定3次,取平均值),结果见图2。

图2 2种样品对DPPH自由基的消除作用比较Fig 2 The clearance of DPPH free radical by 2samples
由图2可见,纯化物的DPPH自由基的消除作用与其质量浓度呈正比;当质量浓度为0.25 mg/ml时,对DPPH自由基的消除率最大,为95.57%,且与维生素C活性相当(t检验,P> 0.05)。
2.6.430%乙醇纯化物的还原能力试验[9]取30%乙醇纯化物样品适量,加甲醇超声溶解,分别制备成质量浓度为0.2、0.4、0.6、0.8、1.0 mg/ml的样品溶液。各量取2.5 ml至具塞试管中,分别加pH 6.6的0.2 mol/L磷酸盐缓冲液(PBS)2.5 ml、1%铁氰化钾溶液2.5 ml,混匀,于50水浴中保温20 min,取出后迅速冷却;再加入10%三氯乙酸(TCA)2.5 ml,混匀,离心(3 000 r/min,离心半径15 cm)5 min。取上清液2.5 ml置于试管中,加蒸馏水2.5 ml、0.1%FeCl3溶液0.5 ml,摇匀,静止放置10 min。于700 nm波长处测定吸光度(a1)。以2.5 ml水代替样品液为阴性对照,同法测定吸光度(a2);以水为空白。以维生素C为阳性对照,计算还原能力a=a1-a2,每管平行3次。a越大,则还原能力越强,结果见图3。
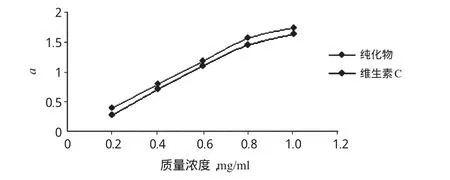
图3 30%%乙醇纯化物的还原能力Fig 3 The reducibility of the purified extracts obtained with 30%%ethanol
由图3可见,30%乙醇纯化物的还原能力与其质量浓度呈正比,且略高于维生素C,但无统计学意义(t检验,P>0.05)。
3 讨论
本试验通过优化五味子醇提物的提取工艺,筛选出具有抗氧化活性的粗提物,再通过聚酰胺法进一步对粗提物富集纯化,并得出其30%乙醇洗脱部位为抗氧化活性最强的纯化物,由此建立了一种具有较强抗氧化活性的五味子纯化物的制备工艺。此方法操作简易,生产成本低,易于投入工业化生产。
近年来,对五味子药材中的化合物相关研究越来越多,研制的相关药品和食品也越来越多。由于五味子药材来源广泛,因此对五味子提取物进行抗氧化活性的系统研究,具有重要的意义,可为五味子药材的充分开发利用提供理论基础。
[1] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2010:32、66-67、116.
[2]官艳丽,曹沛,郁开北,等.北五味子化学成分的研究[J].中草药,2006,37(2):185.
[3]张兰杰,张维华,赵珊红.北五味子果实中多糖的提取与纯化研究[J].鞍山师范学院学报,2002,4(1):58.
[4]杜国成.五味子化学成分及药理研究进展[J].中国医药科学,2011,1(20):32.
[5]翟清波,李诚,王静,等.植物多酚降血糖和降血脂作用研究进展[J].中国药房,2012,23(3):279.
[6] 吴夏.五味子鲜果多酚提取鉴定及其对受损HepG2细胞保护作用的研究[D].北京:中国农业大学,2014.
[7] 张志国,陈锦屏,邵秀芝.红枣核类黄酮清除DPPH自由基活性研究[J].食品科学,2007,28(2):67.
[8]苗建武,陈绍民,王超,等.聚酰胺树脂分离纯化丹参总酚酸的研究[J].中国实验方剂学杂志,2011,17(3):28.
[9]周向军,高义霞,袁毅军,等.乌龙茶茶褐素提取工艺的优化及抗氧化研究[J].中国实验方剂学杂志,2011,17(4):36.
(编辑:刘萍)
Optimization of Extraction Technology of Ethanol Extracts from Schisandra chinensis and Their Antioxidation Evaluation in vitro
TIAN Shuang,YAN Mingming,SHAO Shuai,LIU Chang,YU Zhongxian,YANG Yang(Chinese Medicine and Biological Engineering Research and Development Center,Changchun University of Chinese Medicine,Changchun 130117,China)
OBJECTIVE:To optimize the extraction technology of ethanol extracts from Schisandra chinensis and evaluate the antioxidation of the extracts and purified extracts.METHODS:With the comprehensive score of the contents of total phenolic acids and total flavonoids as well as the clearance rate of 1,1-diphenyl-2-picrylhydrazyl(DPPH)free radical as the evaluated index,single factor and orthogonal tests were designed to optimize the extraction times,the volume fraction of the solvent ethanol,extraction duration and solvent volume in the extraction technology of S.chinensis,and verification tests were conducted.After purification of the extracts obtained by the optimal extraction technology,the rates of clearance of DPPH free radical by the purified extracts and the reducibility of the purified extracts were determined to evaluate their antioxidation in vitro(vitamin C as positive control).RESULTS:The optimal extraction technology of S.chinensis was as follows as heating reflux extraction with 70%ethanol 8 times as much as the extracts,3 extraction times and extraction duration of 1.0 h each time;the RSD of all indexes in the verification tests was lower than or equal to 0.53%(n=3).30%ethanol elution parts of the extracts had the strongest antioxidation,with a clearance rate of DPPH free radical and reducibility comparable to those of vitamin C.CONCLUSIONS:The optimized extraction technology is stable and feasible;the extracts and purified extracts obtained by such technology have rather good antioxidation in vitro.
Schisandra chinensis;Total phenolic acids;Total flavonoids;Extraction technology;Orthogonal test;Antioxidation
R284.2;R285
A
1001-0408(2016)28-3976-03
10.6039/j.issn.1001-0408.2016.28.27
吉林省重点科技攻关项目(No.20140204070YY)
*硕士研究生。研究方向:中药化学。E-mail:1446316766@qq. com
教授,博士。研究方向:药物化学、中药化学及新药开发。E-mail:yanmm595@yahoo.com.cn
(2016-01-07
2016-03-15)

