杂色蛤蛤肉和蒸煮液中粗多糖的单糖组成分析
韩 青,李 帅,李智博,赵前程,李 萌(大连海洋大学食品科学与工程学院,辽宁省水产品加工及综合利用重点实验室,辽宁大连 116023)
杂色蛤蛤肉和蒸煮液中粗多糖的单糖组成分析
韩 青,李 帅,*李智博,赵前程,李 萌
(大连海洋大学食品科学与工程学院,辽宁省水产品加工及综合利用重点实验室,辽宁大连 116023)
以杂色蛤蛤肉及其加工蒸煮液为研究对象,采用醇沉的方式获得2种粗多糖,用色谱柱进行分离纯化,并通过高效液相色谱分析比较二者的单糖组成。结果显示,2种粗多糖经过分离后都得到2个洗脱峰N1和N2;二者的N1峰主要成分均为葡萄糖,蒸煮液多糖的N1峰还检测到少量的岩藻糖;蛤肉多糖的N2峰主要成分是葡萄糖醛酸,还含有少量的葡萄糖,蒸煮液多糖的N2峰主要成分是葡萄糖,还检测到少量的葡萄糖醛酸、岩藻糖、甘露糖和半乳糖。
杂色蛤;蒸煮液;粗多糖;离子交换层析;单糖组成
0 引言
杂色蛤,学名为菲律宾蛤仔(Ruditapes philippinarum),是一种隶属于帘蛤科的贝壳类海产品,南方通常叫做花蛤,辽宁俗称蚬子[1]。杂色蛤在我国产量较高,而且其具有肉质细嫩、口味鲜美、营养含量丰富的特点[2]。目前,杂色蛤除了鲜活产品以外,多是冻煮加工产品,附加值较低,加工过程中会产生大量的蒸煮废弃液,其中含有大量的生物活性成分,直接排放会造成资源的浪费和环境的污染[3]。因此,本文通过研究杂色蛤蛤肉多糖和加工蒸煮液多糖的单糖组成分析,为杂色蛤多糖产品的开发利用提供理论根据。
本文以杂色蛤蛤肉以及杂色蛤加工蒸煮液为研究对象,分别采用酶解醇沉和直接醇沉的方式获得蛤肉粗多糖和蒸煮液粗多糖,采用阴离子交换柱层析对2种粗多糖进行分离纯化,对于分离得到的纯化多糖进行PMP衍生化,通过高效液相色谱分析比较单糖组成。
1 材料与方法
1.1 主要试剂与材料
主要试剂:三(羟甲基)氨基甲烷Tris,国药集团化学试剂有限公司提供;1-苯基-3-甲基-5-吡唑啉酮PMP,分析纯,天津市大茂化学试剂厂提供;乙腈,色谱纯,美国Spectrum提供;单糖标准品(D-葡萄糖(Glc)、D-甘露糖(Man)、D-半乳糖(Gal)、D-(+)-半乳糖醛酸(GalUA)、L-岩藻糖(Fuc)、D-葡萄糖醛酸(GlcUA),美国Sigma提供。
原料:新鲜杂色蛤,购自黑石礁新玛特超市。
1.2 仪器
冷冻真空干燥机,北京博医康实验仪器有限公司产品;721型可见分光光度计、电热恒温鼓风干燥箱,上海光谱仪器有限公司产品;全能台式高速冷冻离心机,北京昊诺斯科技有限公司产品;SBS-160型数控计滴自动部份收集器,上海沪西分析仪器有限公司产品;L-2000型液相、La Chorm C18型柱,日本日立公司产品;透析袋(截留分子量7 000 Da),Solarbio公司产品。
1.3 试验方法
1.3.1 杂色蛤粗多糖的提取方法
将新鲜的杂色蛤去壳称质量,取肉,加入一定量的蒸馏水匀浆3 min,随后加酸调节pH值,加入胃蛋白酶,在水浴锅中酶解,酶解完成后灭酶10 min,待冷却至室温后以转速9 000 r/min离心15 min后,取上清液加入等体积的95%乙醇在冷藏条件下醇沉过夜。取得的沉淀以转速9 000 r/min离心15 min。将提取到的粗多糖放入瓶底,在水浴锅上方挥发乙醇24 h,继续用氮吹除去剩余乙醇,将样品冻干、称质量,计算粗多糖回收率。
1.3.2 杂色蛤蒸煮液粗多糖的提取方法
取一定量的杂色蛤蒸煮液(其中可溶性固形物的含量为1.40%),加入等体积的95%乙醇冷藏条件下醇沉过夜,取得的沉淀以转速9 000 r/min离心15 min,将样品冻干、称质量,计算粗多糖回收率。
1.3.3 DEAE Sepharose Fast Flow阴离子层析柱[4-5]
杂色蛤蛤肉和杂色蛤蒸煮液粗多糖都用pH值8.5的Tris-HCl溶液作为缓冲溶液,取样20 mg用2 mL左右的缓冲溶液溶解。层析柱的体积为166 mL,用0~1.5 mol/L的NaCl盐溶液进行梯度洗脱,流速为1.0 mL/min,每管收集6 mL左右,共收集130管。
1.3.4 总糖含量的测定
总糖含量的测定选用苯酚-硫酸法[6],先用葡萄糖标准溶液绘制标准曲线Y=0.006 4X+0.004 5,R2=0.995 1,吸取样液用苯酚-硫酸显色后,于波长490 nm处测量吸光度,通过标准曲线来计算出样品的总糖含量。
1.3.5 衍生物的制备
(1)单糖标准品衍生物的制备。按照尹利昂[7]的方法,将6种单糖标准品配置成2 mmol/L溶液,分别吸取50 μL加入消解管中,然后加入450 μL的PMP衍生试剂和等体积0.3 mol/L的NaOH溶液,70℃水浴反应30 min,取出冷却至室温后,用450 μL 0.3 mol/L的HCl中和,加入1 mL氯仿萃取,充分震荡,小心洗掉下层并弃掉,重复3次。过膜,取上层20 μL进样。
(2)多糖样品衍生物的制备。按照盛文静[8]的方法,精确称取蒸煮液纯化样品2.0 mg,放入消解管中,不要黏在壁上,加入1 mL的2 mol/L TFA,充氮气1 min封管,110℃水解8 h。冷却至室温,使用氮吹于水浴锅上55℃将TFA挥干,后以NaOH溶液调至中性,取400 μL与400 μL的PMP,400 μL的NaOH,加入5 mL PE管里进行衍生,而后加400 μL 0.3 mol/L的HCl中和,其他步骤同上。
1.3.6 色谱条件的设定
色谱仪为日立高效液相色谱,色谱柱为C18分离柱,紫外检测器波长为250nm。系统流速为1.0mL/min,设定柱温为25℃。
流动相:溶剂A为80%乙腈溶液;溶剂B为 15%乙腈、85%0.05 mol/L磷酸盐缓冲溶液(KH2PO4-NaOH,pH值6.9);溶剂C为40%乙腈、60%0.05 mol/L磷酸盐缓冲溶液(KH2PO4-NaOH,pH值6.9);溶剂D为5%乙腈、95%超纯水。
梯度模式:时间梯度为0-15-60 min;浓度梯度为B 92%-65%-65%,C 8%-35%-35%。
进样体积:20 μL。
1.3.7 液相色谱分离检测
(1) 分离条件优化和保留时间的确定。吸取2 mg/mL每种单糖标准品溶液100 μL加入超纯水1 900 μL稀释到100 mg/mL,按照1.3.5(1)的方法进行衍生处理,取20 μL进样,进行HPLC分析,确定每种单糖标准品的保留时间。
(2)各单糖标准曲线制作。按表1稀释混合标准品溶液,配制成质量浓度为25,50,100,150,200,250 μg/mL的溶液分别编号1~6,吸取50 μL的2 mg/mL岩藻糖标准品溶液加入150 μL超纯水,配制成浓度为500 μL/mL的溶液编号为7,按照1.3.6(1)的方法进行衍生处理,取20 μL进样,进行HPLC分析,每个质量浓度进样3次,以平均值计算。以质量浓度对峰面积进行线性回归,计算其线性范围。
单糖标准品梯度溶液配制方法见表1。
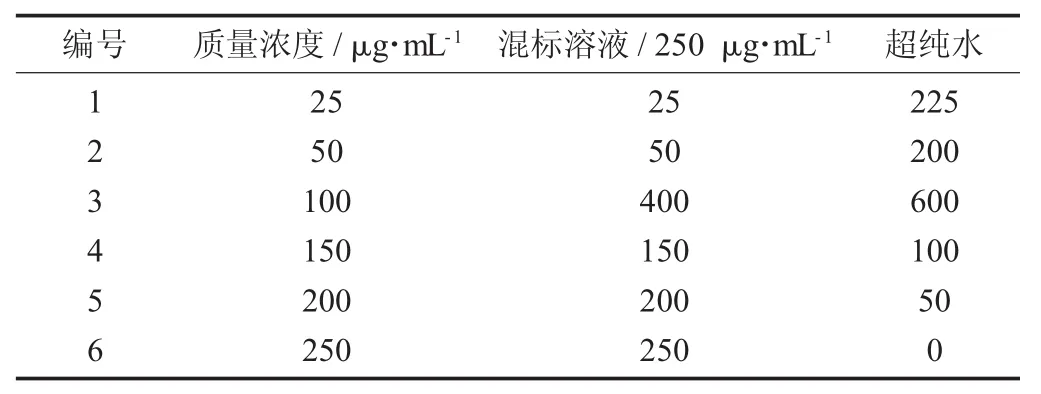
表1 单糖标准品梯度溶液配制方法
(3)重复性。做5组标准品平行样,用同样仪器和试剂于当天进行PMP衍生化,并进行高效液相色谱分析,来检测重复性[9-11]。
(4)检测限和定量限。适当稀释1号混合标准溶液,进行衍生处理,取20 μL进样,进行HPLC分析,确定各个单糖的检测限(S/N=3) 和定量限(S/N=10)。
(5)精密度。对3号混合标准品溶液用同样的仪器和试剂当日进行PMP衍生,连续进样3次,进行HPLC分析,得到各单糖峰面积的日内精密度。
2 结果与分析
2.1 杂色蛤蛤肉和蒸煮液的粗多糖提取率
新鲜杂色蛤蛤肉200 g,采用酶解醇沉法得到粗多糖的质量为8.64 g,其中总糖含量约为56.07%。经计算得出,蛤肉粗多糖的提取率为8.26%。
杂色蛤蒸煮液900 mL,其中多糖占可溶性固形物的46%,采用直接醇沉法得到粗多糖6.75 g,经计算得出蒸煮液的多糖提取率为52.80%。
2.2 蛤肉多糖和蒸煮液多糖经DEAE Sepharose Fast Flow阴离子层析柱分离结果
取杂色蛤蛤肉粗多糖和蒸煮液粗多糖溶于2 mL pH值8.5的缓冲溶液,上样后进行离子交换层析,以0~1.5 mol/L NaCl浓度在第30管开始连续梯度洗脱,收集到的样品用苯酚-硫酸法比色法测定总糖含量,以管数为横坐标、吸光度为纵坐标做洗脱曲线。
DEAE Sepharose Fast Flow阳离子交换层析分离杂色蛤蛤肉粗多糖见图1,DEAE Sepharose Fast Flow阳离子交换层析分离杂色蛤蒸煮液粗多糖见图2。

图1 DEAE Sepharose Fast Flow阴离子交换层析分离杂色蛤蛤肉粗多糖
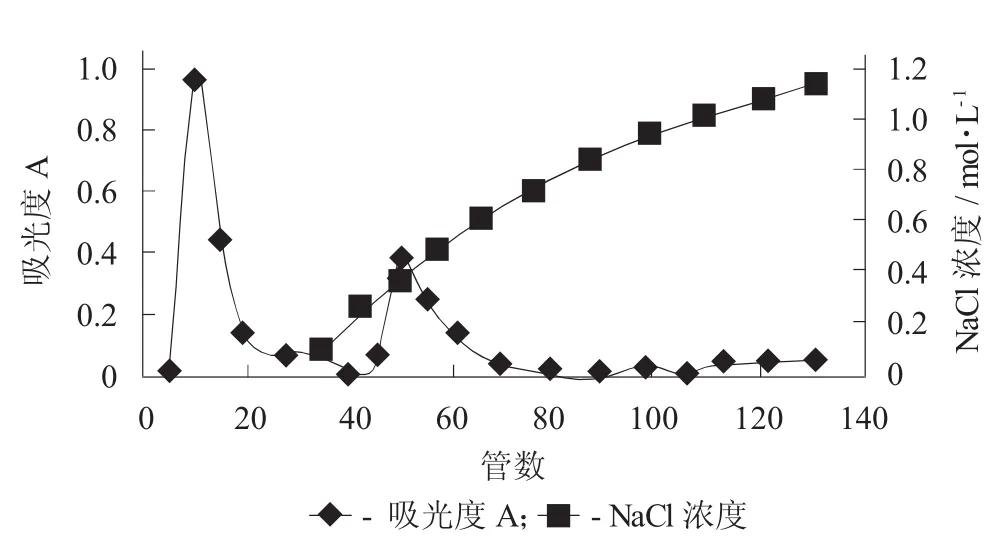
图2 DEAE Sepharose Fast Flow阴离子交换层析分离杂色蛤蒸煮液粗多糖
由图1和图2可知,杂色蛤蛤肉粗多糖和蒸煮液粗多糖经过DEAE Sepharose Fast Flow阴离子交换层析分离都得到2个洗脱峰N1和N2,说明2种粗多糖的性质比较相近。
2.3 高效液相色谱检测结果
2.3.1 单糖标准品的分离
Man,GlcUA,GalUA,Glc,Gal,Fuc 6种标准品按照方法所述步骤进行PMP衍生化,产物进行高效液相色谱分析,各个单糖衍生物分离效果比较好,并且比较峰型对称。根据保留时间确定的标准糖分别为Man,GlcUA,GalUA,Glc,Gal,Fuc。
单糖标准品PMP衍生物液相洗脱见图3。
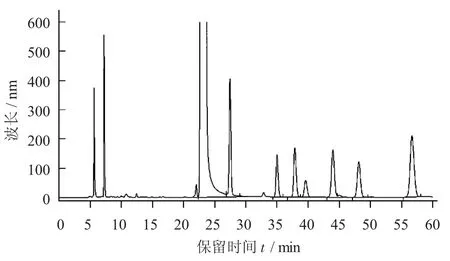
图3 单糖标准品PMP衍生物液相洗脱
2.3.2 各单糖标准曲线制作
6种不同单糖的线性回归方程见表2。

表2 6种不同单糖的线性回归方程
2.3.3 重复性
所有标准品衍生物的标准偏差均小于10%,表明该方法对于所有标准品衍生物来说检测重复性良好。
6种不同单糖的重复性见表3。

表3 6种不同单糖的重复性
2.3.4 检测限和定量限
6种不同单糖的定量限和检测限见表4。
2.3.5 精密度
6种单糖的RSD在2.65%~7.32%,说明仪器精密性良好,方法精密度符合要求。

表4 6种不同单糖的定量限和检测限
6种不同单糖的日内精密度见表5。

表5 6种不同单糖的日内精密度
2.3.6 杂色蛤蛤肉以及杂色蛤蒸煮液多糖的单糖组成比较
通过高效液相色谱的检测分析,根据单糖标准品和多糖样品的保留时间与色谱法面积,计算杂色蛤蛤肉多糖和蒸煮液多糖各洗脱峰的单糖组成。
杂色蛤蛤肉和蒸煮液粗多糖的单糖组成数据见表6。
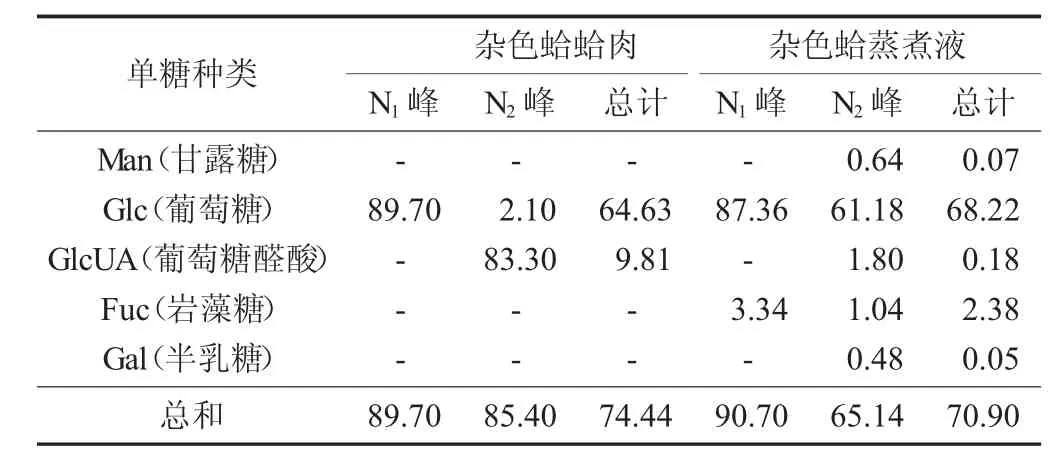
表6 杂色蛤蛤肉和蒸煮液粗多糖的单糖组成数据
由表6可知,杂色蛤蛤肉多糖和蒸煮液多糖的N1与N2洗脱峰中都检测到了葡萄糖,且蒸煮液多糖中的含量略高。
蛤肉多糖和蒸煮液多糖N1峰中的主要成分均为葡萄糖,蒸煮液多糖的N1峰中还检测到少量的岩藻糖。蛤肉多糖的N2峰主要成分是葡萄糖醛酸,还含有少量的葡萄糖,未检测出岩藻糖、甘露糖和半乳糖;蒸煮液多糖的N2峰主要成分是葡萄糖,还检测到少量的葡萄糖醛酸、岩藻糖、甘露糖和半乳糖。
有文献报道,杨荣华等人[12]利用Sepharose 4B凝胶层析柱对贻贝蒸煮液粗多糖进行了分离纯化,得到MJPs-1和MJPs-2两个组分,经检验均为均一多糖,主要为葡萄糖,这与本研究的结论较为接近,贝类蒸煮液中主要是由葡萄糖连接组成的水溶性多糖。乔德亮[13]采用DEAE-纤维素与葡聚糖G-100层析法对三角帆蚌多糖进行分离纯化,得到HCPS-1,HCPS-2,HCPS-3三个均一多糖组分,其中HCPS-1由阿拉伯糖、葡萄糖2种单糖组成,HCPS-2仅由1种单糖葡萄糖组成,HCPS-3由5种单糖组成(鼠李糖、岩藻糖、甘露糖、葡萄糖和半乳糖);将厚壳贻贝多糖粗品经DEAE-纤维素阴离子交换层析、Sephacryl S-200凝胶过滤层析分离纯化得到粗多糖组分SVP-12,由鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、半乳糖和葡萄糖7种单糖组成[14],可见贝肉多糖由水溶性的和非水溶性的组成,其单糖组成较为复杂。
糖醛酸是指糖中的伯羟基被氧化成羧基后形成的化合物及其衍生物,天然存在的有D-葡萄糖醛酸、D-半乳糖醛酸等,D-葡萄糖醛酸在动物体内具有与毒物结合后排出的作用,也是构成肝素、硫酸软骨素、透明质酸等高活性物质的成分;岩藻糖是六碳糖的一种,它在神经传导、免疫调节、抑制癌症的生长转移和呼吸道感染的预防与治疗等方面有重要作用[15-20]。由此看来,对杂色蛤蛤肉以及杂色蛤蒸煮液单糖组成的研究能够为杂色蛤多糖产品的开发利用提供良好的理论基础。
3 结论
新鲜杂色蛤蛤肉粗多糖的提取率为8.26%,总糖含量约为56.07%;杂色蛤蒸煮液中多糖占可溶性固形物的46%,经计算得出蒸煮液的多糖回收率为52.80%。杂色蛤蛤肉粗多糖和蒸煮液粗多糖经DEAE Sepharose Fast Flow阴离子交换层析分离均得到2个峰(N1和N2)。通过高效液相色谱分析二者单糖组成发现,蛤肉多糖和蒸煮液多糖N1峰的主要成分均为葡萄糖,蒸煮液多糖N1峰中还检测到少量的岩藻糖;蛤肉多糖N2峰主要成分是葡萄糖醛酸,还含有少量的葡萄糖,蒸煮液多糖N2峰主要成分是葡萄糖,还检测到少量的葡萄糖醛酸、岩藻糖、甘露糖和半乳糖。
[1] 沈建,林蔚,郁蔚文,等.我国贝类加工现状与发展前景 [J].中国水产,2008(3):73-75.
[2] 张谢令,姜仕臣,丛裕泉,等.山东蓬莱菲律宾蛤仔资源调查研究 [J].海洋湖沼通报,2007(4):151-156.
[3] 高雨,查越,林丽娟,等.低值贝类浓缩汤料制备工艺与抗氧化活性的研究 [J].农产品加工(上),2015(4):30-32.
[4] 殷涌光,韩玉珠,丁宏伟,等.动物多糖的研究进展[J].食品科学,2006,27(3):256-262.
[5]Yi Liu,Qian Cheng Zhao,Zhi Bo Li,et al.Extraction,Purification and Characterization of Polysaccharides from Clam(Ruditapes philippinarum)[J].Advanced Materials Research,2013(3):1 236-1 240.
[6]Mourao P A S,Bastos I G.Highly acidic glycans from seacucumbers:isolation and fractionation of fucoserich sulfated polysaccharides from the body waU of Ludwigothurea grisea[J].Eur J Biochem,1987,18(3):639-645.
[7] 尹利昂.不同海参多糖的分离纯化及生化性质分析 [D].青岛:中国海洋大学,2009.
[8] 盛文静.不同海参多糖的提取分离及化学组成分析比较 [D].青岛:中国海洋大学,2007.
[9] 杨兴斌,赵燕,王海芳,等.柱前衍生化高效液相色谱法分析当归多糖的单糖组成 [J].分析化学,2005,33(9):1 287-1 290.
[10]林雪,贾敬芬,黄琳娟,等.RP-HPLC用于芦荟多糖的单糖组成研究 [J].食品科学,2006,27(4):192-195.
[11]井泽良,刘兴华,关文强.真菌寡聚糖单糖组成(HPLC)分析及诱导抗病活性初步研究 [J].食品研究与开发,2006,27(1):53-56.
[12]杨荣华,陈静波,戴志远.贻贝蒸煮液多糖的提取及其生物活性研究 [J].中国食品学报,2009(1):84-88.
[13]乔德亮.三角帆蚌多糖提取、纯化、生物活性及其结构 [D].南京:南京农业大学,2009.
[14]闫雪,杨静峰,周大勇,等.虾夷扇贝内脏多糖SVP-12的分离纯化及性质研究 [J].食品与发酵工业,2009(2):172-175.
[15]阎欲晓,粟桂娇,莫柏立,等.文蛤蛋白酶解液的制备及自由基清除活性的研究 [J].食品科技,2006(7):97-99.
[16]钦传光,黄开勋,徐辉碧.泥鳅多糖对实验性糖尿病小鼠血糖血脂的影响 [J].中国药理学与毒理学杂志,2002,16(2):124-127.
[17]张莉,刘万顺,韩宝芹,等.菲律宾蛤仔(Ruditapes philippinarum)蛋白聚糖的分离提取及其抗肿瘤活性的初步研究 [J].海洋与湖沼,2007,38(1):62-68.
[18]穆娇娇.蛤类蛋白酶解物的制备及其抗氧化活性的分析 [D].大连:大连海洋大学,2011.
[19]谢红旗,周春山,杜邵龙,等.酶法提取、超滤分离香菇多糖新工艺研究 [J].食品科学,2007,28(4):217-219.
[20]侯清娥,董建伟,王录军.糖蛋白的研究概述 [J].农产品加工(下),2016(1):69-71.◇
The Monosaccharide Composition Analysis of Polysaccharide in Ruditapes Philippinarum and the Clam Cooking Liquid
HAN Qing,LI Shuai,*LI Zhibo,ZHAO Qiancheng,LI Meng
(Key Laboratory of Aquatic Product Processing and Utilization of Liaoning Province,College of Food Science and Engineering,Dalian Ocean University,Dalian,Liaoning 116023,China)
In this paper,based on Ruditapes philippinarum and processing meat cooking liquor as the research object,adopt the way of alcohol sink for two kinds of coarse polysaccharide,using chromatography column purification,and by high performance liquid chromatography(HPLC)analysis and comparison the monosaccharide composition.After separation,according to the results of two kinds of coarse polysaccharide are two N1,N2,elution peak;N1peaks of the two main ingredients are glucose,cooking liquor polysaccharide N1peak is detected by a small amount of fucose;clam polysaccharide of N2peak is mostly glucuronic acid,also contains a small amount of glucose,polysaccharide cooking liquid N2peak of main component is glucose,and also detect a small amount of glucuronic acid,fucose,mannose and galactose.
Ruditapes philippinarum;cooking liquor;crude polysaccharide;ion exchange chromatography;monosaccharide composition
TQ281
A
10.16693/j.cnki.1671-9646(X).2016.10.009
1671-9646(2016)10a-0029-04
2016-07-23
国家海洋公益性行业科研专项(201505030-6);辽宁省海洋与渔业厅科研项目(201511)。
韩 青(1992— )女,在读硕士,研究方向为食品生物技术。
*通讯作者:李智博(1979— ),女,博士,副教授,研究方向为食品生物技术。

