髂骨来源的“双相”BMG结合软骨细胞修复兔关节软骨缺损的实验研究
白亦光,陈巧玲,肖东琴,刘康,冯刚
(川北医学院第二临床医学院·南充市中心医院,1.骨科;2.肿瘤科;3.组织工程与干细胞研究所,四川 南充 637000)
髂骨来源的“双相”BMG结合软骨细胞修复兔关节软骨缺损的实验研究
白亦光1,陈巧玲2,肖东琴3,刘康3,冯刚3
(川北医学院第二临床医学院·南充市中心医院,1.骨科;2.肿瘤科;3.组织工程与干细胞研究所,四川 南充637000)
目的:探讨应用髂骨来源的“双相”骨基质明胶(bone matrix gelatin,BMG)结合软骨细胞移植修复兔关节软骨缺损的有效性和可行性。方法:使用酶消化法体外分离培养并扩增兔肋软骨细胞;使用自体来源髂骨构建“双相”BMG支架材料;将软骨细胞种植与BMG支架材料上构建成为细胞-BMG复合物;将制作好的27只软骨缺损动物模型随机分为3组。将细胞-BMG复合物移植于软骨缺损模型进行修复治疗作为实验组。将BMG支架移植入软骨缺损模型作为材料组;空白对照组不做处理。分别在术后4周、8周和12周通过大体形态学(依据国际软骨修复协会评分量表)、病理组织学染色及免疫组织化学染色方法对各组修复效果进行评价。结果:番红O染色,甲苯胺蓝染色和Collagen II 免疫组化染色分别提示术后12周时实验组的修复组织非常类似于正常关节软骨,组织表面与正常软骨组织平面几乎持平,材料组软骨缺损处得到了部分修复,而缺损组的修复效果较差。按照ICRS量表,大体形态学和病理组织学评分结果提示:术后12周实验组的修复效果与其他两组相比有明显统计学差异(P<0.05)。结论:自体髂骨来源的“双相”BMG结合软骨细胞在体内可形成具有一定结构功能的软骨组织,能够应用于再生修复软骨的缺损。
软骨细胞;BMG支架材料;软骨修复;组织工程
关节软骨是一个具有弹性光滑表面,提供结构支撑和执行关节承载与活动功能的无血管组织,在关节运动中具有降低磨损和缓冲震荡的作用[1]。 膝关节骨性关节炎是一类具有高发病率疾病,是引起中老年人膝关节疼痛的最主要病因,随着年龄的增长,其自我修复能力逐渐减弱。目前临床上对骨性关节炎的治疗主要分为非手术保守治疗(药物和物理治疗)和外科手术治疗(膝关节置换术等)[2-3]。保守治疗措施主要有使用非甾体抗炎药、营养软骨药和关节腔注射玻璃酸钠注射液,其目的主要是缓解临床症状,却不能逆转已经发生退行性变的关节软骨和细胞的生物学功能,且只在关节软骨发生退行性变的早期有效;同样现有的外科手术治疗手段主要有置换人工金属材质关节,以达到缓解症状和维持关节运动功能和稳定性的效果,数年以后仍需要进行关节返修等手术等[4]。因此,继续深入研究关节退行性变疾病的有效治疗手段具有十分重要的意义。
组织工程软骨构建主要涉及种子细胞及具有软骨细胞生存的三维结构微环境能力的材料支架构成。选择一种合适的生物支架材料显得尤为重要。本实验拟采用自体髂骨来源的“双相”骨基质明胶(bone matrix gelatin,BMG)三维支架作为组织工程材料并结合软骨细胞对兔膝关节软骨缺损模型进行修复,以期取得良好的修复效果。
1 材料与方法
1.1实验动物及实验方法
1.2.1软骨细胞的培养与增殖将5月龄新西兰兔肋软骨无菌分离,剪成1 mm3大小碎片,使用等体积0.1%Ⅱ型胶原酶消化后,放于37 ℃恒温水浴8 h(4 h后替换一次胶原酶)。取10% FBS的DMEM培养基加入离心管稀释,离心,弃上清,最后将沉淀移入T75细胞瓶中,加20% FBS的DMEM培养基10 mL于瓶内,静置于5% CO2,37 ℃培养箱培养。将软骨细胞原代培养并增殖到所需的数量级[5]。
1.2.2“双相”BMG材料的制备将新西兰兔耳缘静脉3%戊巴比妥钠l mL/kg麻醉后俯卧位固定于手术台,骼骨处预先脱毛,常规碘伏消毒铺巾,切开皮肤约3 cm,显露骼骨;用骨刀及外科剪剪取骼骨以保持松质骨与皮质骨的“双相”结构。将骼骨标本4 ℃下浸泡于0.9% NH4CL中24 h;水洗后使用氯仿及甲醇按体积比1∶1比例混合浸泡骼骨标本1.5 h(脱脂);4 ℃下浸泡于0.6 mol/L HCL下7 h进行脱钙,至骼骨标本变软且具有弹性;蒸馏水清洗5次;再次使用体积比1∶1氯仿甲醇混合液脱脂过夜;依次使用2 mol/L氯化钙浸泡1 h、0.5 mol/L乙二氨四乙酸浸泡1 h、4 mol/L氯化锂浸泡1 h; 55 ℃蒸馏水水浴24 h;37 ℃下DMEM培养液浸泡1 h;得到BMG材料。将得到的BMG修剪成高3 mm×3 mm×5 mm的圆柱状,注意保持BMG材料的“双相”性,即一侧为松质骨,一侧为皮质骨,风干后电镜下观察孔隙率,环氧乙烷灭菌后-80 ℃保存[6]。
1.2.3BMG-软骨细胞复合物的制备将BMG材料复温,放入96孔板,将软骨细胞浓度调整为1×107/mL,去1 mL滴加在BMG材料上,静置于5% CO2,37 ℃培养箱培养,使用时直接移植即可。
1.2.4 动物体内试验取10月龄新西兰白兔27只(川北医学院实验动物中心提供),雌雄不限,体重2.5~3.0 kg。10月龄兔随机分为3组,分别命名为缺损组、材料组和BMG-软骨细胞组。耳缘静脉注射麻醉后,常规备皮、消毒、铺巾;取双膝外侧切口,切口长度1 cm;逐层打开皮肤、滑膜层、关节囊;推开髌骨及髌骨旁脂肪垫;屈曲膝关节;于髌骨沟处用电钻开 3 mm×3 mm大小的软骨缺损,深度保持在5 mm左右。其中缺损组直接复位髌骨,逐层缝合切口。材料组仅移植BMG材料,注意确保松质骨面向上,皮质骨面向下,逐层缝合切口。BMG-软骨细胞组将培养箱中的BMG-软骨细胞复合物完整植入,逐层缝合切口。术后3 d使用青霉素肌肉注射预防感染。
1.2检测指标
1.2.1大体观察术后4、8、12 周时段处死动物,游离股骨远端肉眼观察关节修复组织色泽、修复组织面积、厚度及其与周围组织有无粘连等情况。根据以往国际软骨修复协会(ICRS)量表进行评分[7]。
1.2.2番红O染色10%多聚甲醛固定标本,脱钙两周,矢状位切开远端股骨标本,石蜡包埋,切片(厚5 μm),二甲苯酒精脱蜡至水;苏木素染10 min;0.2%亮绿染色10 min;0.1%番红O染色10 min;1%醋酸酒精分化液3 s,树脂封片后镜下观察[8]。
1.2.3甲苯胺蓝染将切片60 ℃烘烤过夜;蒸馏水水洗3次,每次5 min;二甲苯酒精脱蜡至水;1%甲苯胺蓝染色4 h(保持室温25 ℃,必要时可使用酒精灯烘烤),蒸馏水水洗3次后封片,镜下观察[8]。
1.2.4Ⅱ型胶原免疫组化染色将切片60 ℃烘烤过夜;二甲苯酒精脱蜡至水;2%牛透明质酸酶封闭30 min;3%过氧化氢封闭10 min(避光);Ⅱ型胶原一抗(鼠抗兔)封闭4 ℃过夜; Ⅱ型胶原二抗(羊抗鼠)封闭1 h(保持室温25 ℃);DAB显色;树脂封片后倒置显微镜下观察并采集图像[8]。
1.3统计学分析
实验数据应用SPSS 13.0统计学软件处理。数据以均数±标准差表示, 组间比较采用方差分析,P<0.05为有统计学意义。
2 结果
2.1软骨细胞体外分离培养及形态学观察
组织培养7 d后可见少量细胞爬出,贴壁后的细胞外观呈多角形、圆形或椭圆形,胞质丰富。14 d后在培养瓶中呈现典型铺路石样表现,如图1所示。
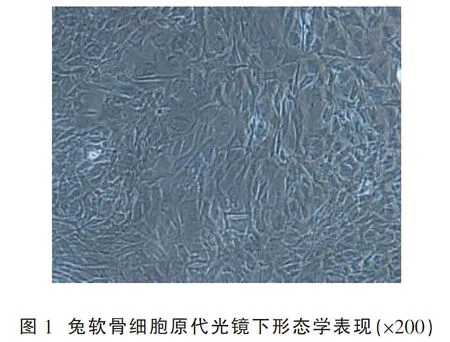
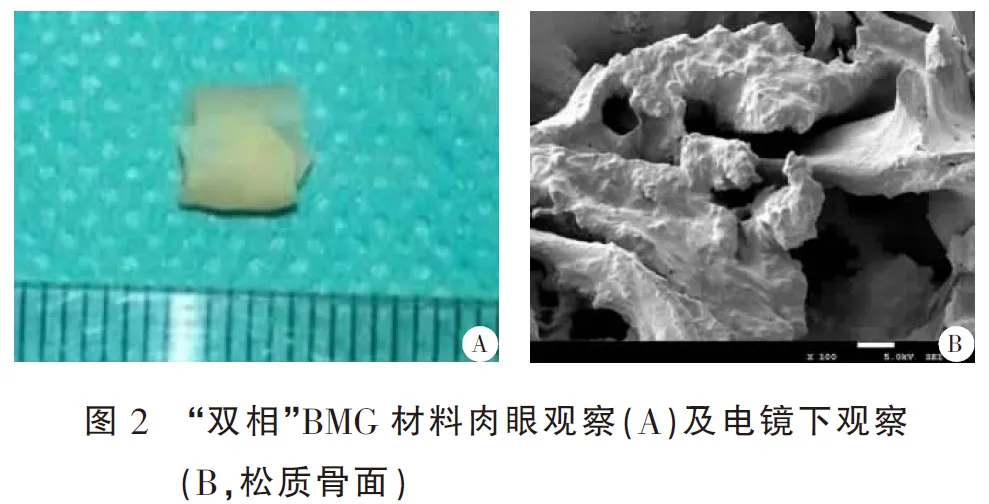
2.2“双相”BMG材料肉眼及电镜下观察
BMG材料修剪为3 mm×3 mm×5 mm大小圆柱状,肉眼观察如图2A所示;电镜下观察BMG材料松质骨一侧表面显示布满孔穴、内部多孔隙,为种子细胞的生长提供了良好的外部环境,松质骨面孔隙大小100~800 μm,如图2所示。
2.3关节软骨缺损修复效果组织学评价
番红O染色提示:在术后12 周,3组正常软骨层均显示大量红染,表明正常软骨组织表面含有大量蛋白多糖,其中缺损组的修复情况较差,缺损部位平面明显低于正常软骨组织,基底部杂乱无章,可见少量骨组织及纤维软骨组织增生,未见明显的软骨层及软骨陷凹形成;材料组修复部位平面明显低于正常软骨组织,BMG材料表面红染,可见材料支架未被明显降解吸收,但表面未见明显软骨层形成;实验组可见修复的组织表面与正常软骨组织平面几乎持平,表面含有大量蛋白多糖,红染明显。形成明显软骨层,软骨层下可见明显软骨陷凹,修复效果明显(如图3所示)。
甲苯胺蓝染色提示:在术后12 周,3组正常软骨层均显示大量蓝染,缺损组缺损部位组织甲苯胺蓝染色不明显,内部呈现骨性或纤维性组织修复;材料组修复部位可见基质甲苯胺蓝染色较淡,呈现条索状支架,细胞外基质淡染,修复效果不佳;实验组术后修复部位明显填充,细胞外基质蓝染明显,形成完整的软骨表面,与正常软骨层几乎看不到明显差别,修复效果明显(如图3所示)。
Collagen II 免疫组化染色提示:在术后12 周,三组正常软骨层均显示大量黄染,缺损组术后缺损部位CollagenII 免疫组化染色不明显,基底部未见明显Collagen II分泌;材料组术后修复组织中黄染较淡,细胞外基质淡染,说明CollagenII 少量分泌,修复组织内部多为纤维性组织修复。实验组术后修复组织内细胞外基质为阳性, 新生组织分泌大量 Collagen II,与正常软骨层表面相似,修复效果明显(如图3所示)。

2.4ICRS量表评分
按照ICRS量表,术后将股骨远端游离后肉眼观察修复效果进行评分,各时间点各组间比较如图4所示,术后12周缺损组得分5.2±0.5;材料组得分5.9±1.2;实验组得分9.5±1.5,与其他两组相比有明显统计学意义。将病理组织学观察修复效果进行评分,各时间点各组间比较如图5所示,术后12周缺损组得分17.2±1.5;材料组得分9.8±0.5;实验组得分9.7±1.2,与其他两组相比有明显统计学意义。
由此可见,实验组在术后12周,修复效果明显强缺损组和材料组。
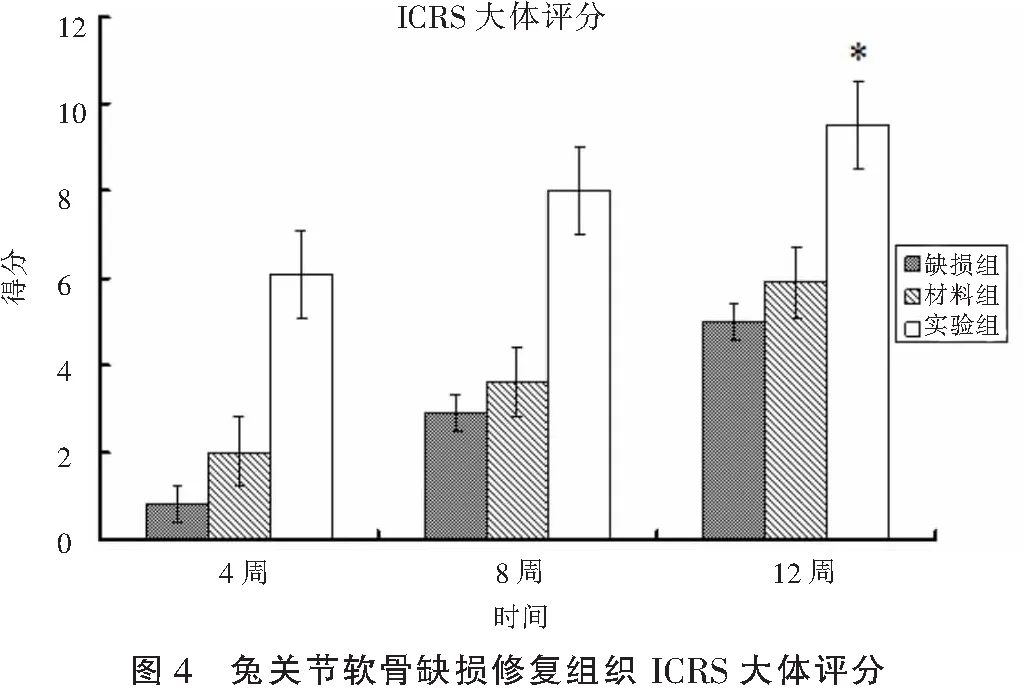
*P<0.05,与对照组和材料组相比。
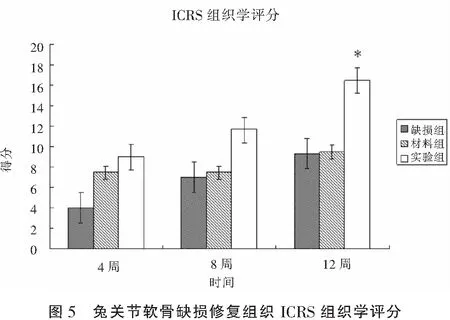
*P<0.05,与对照组和材料组相比。
3 讨论
各种针对软骨损伤修复的治疗方法正在积极的探索研究当中。目前治疗方法有很多,主要包括:自体软骨细胞移植,骨膜及软骨移植或者微骨折外科手术等。自体软骨细胞移植据报道临床软骨修复效果较满意,但软骨细胞来源非常有限,并且体外培养增殖能力差,细胞容易衰老或纤维样分化,在进行移植过程中,细胞悬液无法在缺损处良好固定,常常发生渗漏导致种子细胞的浪费以及周围软组织的骨化;骨膜及软骨移植治疗软骨损伤存在匹配困难、移植物易退变等缺陷,微骨折外科手术可在短期内缓解关节的疼痛症状,但其破坏了关节软骨的微环境,从而导致软骨纤维化修复,远期效果差,甚至导致严重的并发症[9]。
本实验从组织工程角度为关节软骨缺损修复提供了另一个方法,其原理主要是将种子细胞与生物材料之间综合应用,在体外构建有生物活力的组织工程软骨体,然后植入修复组织缺损处,达到组织或器官功能的恢复。这种组织工程软骨体与自体软骨移植的区别在于种子细胞可以在体内良好的增殖并分泌新的有效的Ⅱ型胶原和蛋白多糖等软骨细胞外基质,而自体软骨移植后,其内分化成熟的软骨细胞无法分泌新的有效的软骨细胞外基质,而软骨组织又是一种缺乏血供的组织,无法进行自我修复,故而移植后易发生退变。 对软骨修复结果的病理评价方法,采用大体观察以及组织病理学观察两种方式,并分别采用ICRS公认的量表法进行评分,组织病理学观察采用番红O染色、甲苯胺蓝染色及Collagen II 免疫组化染色来检测,其中番红O和甲苯胺蓝对软骨组织内的糖胺聚糖十分敏感,相互之间形成佐证。Collagen II是软骨组织重要的细胞外基质,对其表达量的检测也十分重要。
本实验中,术后12周实验组的软骨缺损修复效果较其他两组十分满意,表明BMG作为支架材料是非常合适的,由于“双相”支架材料BMG的另一面为骨皮质,在与缺损处基底部的骨质相融合生长的过程中,可以弥补其他材料在修复表面的机械强度不够这一缺点,但具体强度指标未得到进一步的证实,这将是下一步实验需要完善的方向。
种子细胞是组织工程中的重要一个环节,实验所使用的种子细胞是成熟的类软骨细胞,有学者在使用骨髓间充质干细胞及脂肪干细胞对软骨缺损进行移植也取得了良好的修复效果[10],在今后的实验中,我们可以将使用上述干细胞与分化成熟的软骨细胞进行修复效果的比较,试图寻求一种更为有效的种子细胞选择。
软骨组织工程研究仍处于动物体内及体外实验阶段,距离临床安全有效的应用尚有一段距离。但是随着对组织工程软骨在种子细胞来源,支架的特性及细胞与支架的构建等一系列问题研究的不断深入,组织工程软骨的临床应用前景必将受到了更加广泛的关注。本实验使用BMG材料构建组织工程软骨对缺损的关节软骨进行了结构和功能上的修复,为今后组织工程软骨的临床应用提供了实验基础。
[1]Roach HI,Aigner T,Soder S,etal.Pathobiology of osteoarthritis:pathomechanisms and potential therapeutic targets[J].Curr Drug Targets,2007,8(2):271-282.
[2]Richter W.Mesenchymal stem cells and cartilage in situ regeneration[J].J Intern Med,2009,266(4):390-405.
[3]Feng G,Wan Y,Balian G,etal.Adenovirus-mediated expression of growth and differentiation factor-5 promotes chondrogenesis of adipose stem cells[J].Growth Factors,2008,26(3):132-142.
[4]Jung SN,Rhie JW,Kwon H,etal.In vivo cartilage formation using chondrogenic-differentiated human adipose-derived mesenchymal stem cells mixed with fibrin glue[J].J Craniofac Surg,2010,21(2):468-472.
[5]赵明,陈竹,张旭乾,等.关节软骨细胞体外培养及生物学特性的实验研究[J].川北医学院学报,2013,28(2):95-98.
[6]Wan YQ,Feng G,Shen FH,etal.Novel biodegradable poly(1,8-octanediolmalate) for annulus fibrosus regeneration[J].Macromol Biosci,2007,7(11):1217-1224.
[7]赵明. 利用新型组织工程软骨修复兔关节软骨缺损的实验研究[D].南充:川北医学院,2013.
[8]刘康,白亦光,陈竹,等.兔骨髓间充质干细胞的分离培养及鉴定[J].川北医学院学报,2013,28(2):103-106.
[9]Jakobsen RB,Shahdadfar A,Reinholt FP,etal.Chondrogenesis in a hyaluronic acid scaffold:comparison between chondrocytes and MSC from bone marrow and adipose tissue[J].Knee Surg Sports Traumatol Arthrosc,2010,18(10):1407-1416.
[10]Bai X,Li G,Zhao C,etal.BMP7 induces the differentiation of bone marrow-derived mesenchymal cells into chondrocytes[J].Med Biol Eng Comput,2011,49(6):687-692.
(学术编辑:冯刚)
本刊网址:http://www.nsmc.edu.cn作者投稿系统:http://noth.cbpt.cnki.net邮箱:xuebao@nsmc.edu.cn
Experimental study on the repairment for articular cartilage defects of rabbit with “bipolar” bone matrix gelatin combined with chondrocytes
BAI Yi-guang1,CHEN Qiao-ling2,XIAO Dong-qin3,LIU Kang3,FENG Gang3
(NanchongCentralHospital,TheSecondClinicalCollegeofNorthSichuanMedicalCollege,1.OrthopaedicDepartment;2.OncologyDepartment;3.ResearchInstituteofTissueEngineeringandStemCell,Nanchong637000,Sichuan,China)
Objective:To study the effectiveness and feasibility of the “bipolar” BMG which come from ilium combined with chondrocytes transplanted to repair articular cartilage defects.Methods:Culture the primary rabbit cartilage cells with the enzyme digestion method in vitro. Construct “bipolar” BMG scaffold material with the autogenous iliac.Construct cells-BMG composites with the cartilage cells and BMG scaffold material.The 27 cartilage defect animal models were randomly divided into three groups.The cells-BMG composite was transplanted to repair cartilage defect model as experimental group.The BMG scaffold material transplanted to repair cartilage defect model as materials control group.The defect model was without any treatment as blank control group.The repair effect was evaluated by gross morphology (according to the ICRS rating scale),pathological histology staining and immunohistochemical staining method at 4 weeks,8 weeks and 12 weeks respectively.Results:Safranin O,toluidine blue and collagen II immunohistochemical staining demonstrate that regenerate tissue of experimental group was similar with normal cartilage,and the surface of regenerate tissue and normal cartilage tissue were almost flat at 12 weeks after surgery. However,the defects in materials control group had been repaired partly and the repair effect of blank control group was very poor.According to the ICRS rating scale,the repair effect scores of gross morphology and pathologic histology showed that the scores of experimental group were significant higher than the other two groups at 12 weeks after surgery (P<0.05).Conclusion:“Bipolar” BMG combined with cartilage cells can form cartilage tissue in vivo which possess a certain structure function.The tissue engineering cartilage can be used in regenerative repair of cartilage defects.
Cartilage cells;BMG scaffold material;Cartilage repair;Tissue engineering
10.3969/j.issn.1005-3697.2016.05.08
国家自然科学基金(81171472、81071270、30872614);四川省教育厅资助项目(15ZA0216、15ZB0201);南充市科技局科技支撑项目(14A0017、14A0022);川北医学院科研发展计划(CBY14-A-ZD02);四川省卫计委科研项目(16PJ202)
2015-10-26
白亦光(1986-),男,硕士,住院医师。E-mail:baiyiguang@163.com
冯刚,E-mail:lssmd18@gmail.com
时间:2016-10-2511∶31
http://www.cnki.net/kcms/detail/51.1254.R.20161014.1716.016.html
1005-3697(2016)05-0652-04
R684.3
A

