PSP对STZ诱导的糖尿病大鼠眼保护作用的临床动态观察
王 艺,彭国庆,陈 迪,韩 超,苗春润,苏 超,卢保金,冯善龙
·实验论著·
PSP对STZ诱导的糖尿病大鼠眼保护作用的临床动态观察
王 艺1,彭国庆2,陈 迪1,韩 超1,苗春润3,苏 超4,卢保金3,冯善龙4
1DepartmentofOphthalmology;3DepartmentofEmergency;4Department of General Surgery,Affiliated Hospital of Taishan MedicalUniversity,Tai'an271000,ShandongProvince,China;2Department of Orthopedics,Tai'an City Central Hospital,Tai'an 271000,Shandong Province,China
Correspondence to:Yi Wang.Department of Ophthalmology,Affiliated Hospital of Taishan Medical University,Tai'an 271000,Shandong Province,China.346048368@qq.com
·AIM:Toapplydifferentdosesofpolygonapolysaccharose(PSP)todiabeticratsmodelby gastrogavagethatwereinducedbystreptozotocin(STZ),then check the rats about anterior segment,FVEP,ERG,fundus fluorescein angiography(FFA)and measurefastingbloodglucose(glucoseoxidase method)by inner canthus vein blood to observe the eye disease process at different time points and to discuss the protective effect of PSP on ocular lesions in DM rats and the treatment effect,to provide the experimental basis and theoretical basis for PSP treating diabetic ocular disease.
·METHODS:One hundred male SD rats were randomly divided into 2 groups:diabetic model group(80 rats induced by STZ)and blank control group(20 rats). Then the diabetic model group was randomly divided into 4 subgroups.The group DM(diabetic group)had 20 rats with normal diet and 2mL physiological saline for dailygavage.PSPgavagedgroupsincludedthree subgroups and with 20 rats in each group,group L(low dose ofPSPgavagegroup,200mg/kg),groupM(medium dose of PSP gavage group,400mg/kg),group H(high dose of PSP gavage group,800mg/kg).Every group was gavaged with 2mL PSP.Twenty rats in group BC(blank control group),and they were gavaged saline of equal dose as control.After the success of modeling,5 groups were under the same conditions of feeding,and gavaged every day.At 2,4,6,8,10 and 12wk,anterior segment examination and FFA were given.At 4,8 and 12wk,F-VEP and ERG were given.Fasting blood glucose(by glucose oxidase method)was measured through inner canthus vein blood.
·RESULTS:Compared to BC group,fasting blood glucose levels were significantly higher in group DM,L,M and H(P<0.05).Compared to DM group,fasting blood glucose level decreased in L,M,H group(P<0.05).The fasting blood glucose levels of L,M and H groups showed a time and dose dependent relationship. After anterior segment examination,there were 6 rates in DM group,3 in L group,1 in M group with different degrees ofcataractsymptomswhichbecamemore serious with time.The BC group was not found any abnormal in the anterior segment.Examined by F-VEP,the rats in group DM showed extension of the P100 peak latency.Compared to the group DM,PSP gavaged group showed a shortened of the extension of the P100 peak latency,while the group BC had no obvious change.In the ERG examination,the rats in group DM showed that amplitude of Max-R a,b wave decreased by 51.2%,59.8%and amplitude of Cone-R a,b wave decreased by 31.4%,41.2%.The Ops OS value and amplitude of 30Hz FlickerN1-P1decreased,therewasasignificant difference compared to group BC.PSP gavaged group was better than group DM.In the FFA examination,in group DM,we could find the typical manifestations of diabeticretinopathybackgroundfluorescence enhancement,distortion of the blood vessels and blood capillary dilate,retinal vascular leakage of fluorescein and intraretinal hemmorhages compared with the group BC.PSP gavaged group was better than group DM.
·CONCLUSION:PSP can effectively reduce the blood glucose levels of diabetic rats,and also can delay the process of ocular complications in diabetic rats,which have an obvious therapeutic effect on ocular lesions.The mechanism islikelytoimprovethemetabolismof glucose and lipid metabolism,increase the amount of glucose tolerance,and play a protective role in diabetic lens metabolism and retinal microvascular disease.
目的:应用不同剂量黄精多糖(polygona-polysaccharose,PSP)灌胃由链脲佐菌素(streptozotocin,STZ)诱导的糖尿病大鼠模型,在不同时间点对大鼠行前节检查、F-VEP、ERG、眼底荧光血管造影检查(FFA)观察眼部病变过程,眼内眦静脉采血葡萄糖氧化酶法(强生血糖仪)测空腹血糖值。探讨PSP对DM大鼠眼部病变的保护作用机制与治疗效果,为黄精多糖治疗糖尿病眼部病变提供实验依据及理论基础。
方法:雄性SD大鼠100只随机被分为两组:糖尿病模型组80只(由STZ诱导造模)和空白对照组20只。再将糖尿病模型组随机分为4组,其中DM组(糖尿病对照组)20只,正常饲养,每日灌胃2mL生理盐水。PSP灌胃组三组,每组各20只,包括L组(低剂量PSP灌胃组,200mg/kg)、M组(中剂量PSP灌胃组,400mg/kg)、H组(高剂量PSP灌胃组,800mg/kg),每次灌胃剂量2mL;BC组(空白对照组)20只,灌胃等剂量生理盐水作为对照。造模成功后5组在相同条件下饲养,每天灌胃,并在第2、4、6、8、10、12wk行前节照相、眼底荧光血管造影检查(FFA),4、8、12wk行F-VEP、ERG检查。眼内眦静脉采血葡萄糖氧化酶法(强生血糖仪)测空腹血糖值。
结果:DM、L、M、H组与BC组相比:空腹血糖水平明显增高(P<0.05)。L、M、H组与DM组相比:空腹血糖水平增高(P<0.05)。L、M、H三组之间呈时间与剂量依赖关系。眼前节检查可观察到有6只DM组、3只L组、1只M组大鼠出现了不同程度的白内障症状,并随着时间推移愈发加重,而BC组眼前节照相并未发现异常。DM组大鼠在F-VEP检查表现为P100峰潜时延长,PSP灌胃组与DM组相比P100峰潜时延长时间缩短,BC组无明显改变。在ERG中表现为DM组大鼠Max-R a和b波振幅下降51.2%和59.8%,Cone-R a和b波振幅下降31.4%和41.2%,Ops-OS值、30Hz Flicker N1-P1振幅下降,与BC组比较有显著统计学差异,PSP灌胃组情况好于DM组。在FFA检查中可发现DM组眼底与BC组相比出现背景荧光增强、大血管扭曲和毛细血管扩张、视网膜血管荧光素渗漏、视网膜内出血等典型糖尿病视网膜病变的表现,PSP灌胃组情况好于DM组。
结论:PSP既能有效降低糖尿病大鼠的血糖水平,又能延缓糖尿病大鼠眼部并发症的进程,减缓白内障和糖尿病视网膜病变的发生发展,可以对眼部病变起到明显的治疗作用。其机制有可能为通过抑制糖基化终产物,改善糖脂质代谢,提高糖耐量,而对糖尿病晶状体代谢和视网膜微小血管病变发挥保护作用。
黄精多糖:链脲佐菌素:糖尿病大鼠:糖尿病视网膜病变:眼
0 引言
糖尿病是一组以高血糖为特征的代谢性疾病,其特点为并发症多,且呈进行性加重。由于人类生活水平的显著提高,现在糖尿病已经成为全世界最为常见的全身代谢性疾病之一。糖尿病由于胰岛素分泌不足或其生物活性低下可导致全身各器官和组织血管代谢紊乱,据文献报道,糖尿病人群中几近半数合并糖尿病眼部病变,其中1/4有明显视力障碍,糖尿病性白内障首当其冲,其次糖尿病视网膜病变(diabetic retinopathy,DR)作为糖尿病的严重并发症之一,已然成为世界公认的中老年人致盲眼病,直接影响了患者及患者家庭的生活品质。糖尿病病程5a以下者DR的发病率约为38%~39%,病程5~10a者约为50%~56.7%,病程10a以上者则高达69%~90%。其致盲率为8%~12%[1]。在发现DR改变之前或出现DR改变早期,有效地控制血糖和改善视网膜微循环可以防止DR的发生或减慢其进展的速度[2]。目前糖尿病的治疗多依赖于西药,但西药治疗效果还远没达到理想水平,且药物治疗仅为辅助治疗。西药存在低血糖、胃肠道反应等缺点,中药具有药物作用缓和、持久、毒副作用小,可以从整体水平上治疗和防治慢性进展性疾病。所以,开发高效低毒的抗糖尿病中药将是一个具有发展前景的研究领域。
中药黄精为百合科植物,其中泰山黄精味甘性平,具有补气养阴、健脾润肺益肾之功效。黄精主要含有多糖、甾体皂苷、蒽醌类化合物、生物碱、强心苷、木质素、维生素和多种氨基酸等化合物,其中黄精多糖是其主要药效活性物质。研究黄精多糖对实验性糖尿病大鼠眼部病变的影响可以进一步探索黄精多糖对糖尿病并发症的治疗作用,并发现治疗糖尿病的新途径。
1 材料和方法
1.1材料 雄性SD(清洁级)大鼠100只,两月龄,体质量200±20g,购于斯贝福(北京)实验动物科技有限公司,生产许可证号:SCXK(京)2011-0004。药品、试剂和仪器:黄精多糖粉剂:泰安市中荟植物生化有限公司,含量≥90%;链脲佐菌素:Sigma公司(批号:WXBB2432V);复方托吡卡胺滴眼液:参天制药株式会社(批号: M412271);血糖测定试剂盒:上海桥杜生物科技有限公司;荧光素钠注射液:广州白云山明兴制药有限公司(批号:LotIM1314A2015-03);7%水合氯醛:泰山医学院附属医院制(批号:20140715)。灌胃针(规格:16号,8cm,北京中昊万通科技有限公司)。pH值测定仪(Thermo奥立龙ORION3-STARPH/ORP测量仪)。美国强生稳豪倍优型血糖仪(One Touch UltraVue)及配套血糖试纸。目测尿糖试纸:广州市花都高尔宝生物技术有限公司,产品编号:YY/T0478。眼前节照相仪:上海新眼光医疗器械有限公司;裂隙灯检查仪:上海新眼光医疗器械有限公司;眼电生理诊断系统:德国罗兰,产品型号:RETI-Port 21 Compact;同步共焦激光眼底荧光造影仪:德国海德堡,产品型号:SPECTRALIS HRA+OCT。
1.2方法
1.2.1大鼠的分组及造模 大鼠100只分为两组:(1)糖尿病组:大鼠自由饮水但禁食12h后,30min内快速腹腔注射STZ(60mg/kg,用2%柠檬酸钠缓冲液溶解,pH= 4.44)造模,80只。造模3d后用葡萄糖氧化酶法测空腹血糖(FBG)≥11.1mmol/L、尿糖试纸检测≥(+++)者视为成功糖尿病大鼠,<11.1mmol/L的大鼠淘汰出糖尿病组,造模成功68只;(2)正常对照组(BC):腹腔注射等剂量的2%柠檬酸钠缓冲溶液,20只(造模成功后每天上午8∶00~10∶00灌胃生理盐水2mL)。糖尿病组68只大鼠采用随机配伍方法分为4组(每组17只,造模后3d开始每天上午8∶00~10∶00灌胃):(1)糖尿病模型组(DM):正常饲养,灌胃2mL生理盐水。(2)低剂量PSP灌胃组(L):灌胃2mL PSP(200mg/kg,无菌生理盐水溶解)。(3)中剂量PSP灌胃组(M):灌胃2mL PSP(400mg/kg,无菌生理盐水溶解)。(4)高剂量PSP灌胃组(H):灌胃2mL PSP(800mg/kg,无菌生理盐水溶解)。
1.2.2空腹血糖检测 造模前3d及造模后3d应用葡萄糖氧化酶法(强生稳豪倍优型血糖仪配备配套血糖试纸)测量空腹血糖(FBG)值以确定造模成功率,以后每2wk测量1次。
1.2.3相关眼科临床检查方法 造模成功后在第2、4、6、8、10、12wk行前节照相、眼底荧光血管造影(FFA)检查,4、8、12wk行F-VEP和ERG检查。(1)眼前节照相:将大鼠用复方托吡卡胺滴眼液散瞳,然后以7%水合氯醛溶液腹腔注射麻醉(0.5mL/100g),麻醉效果满意后一人手持大鼠放于裂隙灯显微镜物镜前方,用拇指示指分开大鼠右眼睑使眼球充分暴露,并使大鼠右眼瞳孔正对裂隙灯显微镜物镜镜头。另一人操作裂隙灯显微镜以弥散光照明法进行检查,出现最佳清晰图像后按下相机快门拍照3~5张保存备用。左眼同法检查。(2)视网膜电图(ERG):将大鼠用复方托吡卡胺滴眼液散瞳后置于暗室中暗适应30min,然后在暗室环境下用7%水合氯醛溶液腹腔注射麻醉,麻醉效果满意后将大鼠置于特制的固定架上,将固定架放于Ganzfeld全视野刺激器窗口边缘行ERG检查。弱红光下安置电极,参考电极夹置双耳,地电极夹置后囟处(此两处使用导电糊提高电极接触率及导电性能),作用电极悬挂于双眼下睑,并确认其与角巩膜缘密切接触。微调各电极接触部位,待操作显示器上电阻数值显示≤10kohm后启动检查程序。记录程序参考2008年国际临床视觉电生理学会建议的新标准六项[3]。(3)闪光视觉诱发电位(F-VEP):本操作顺延ERG检查,调整支架使大鼠右眼正对Ganzfeld全视野刺激器窗口,左眼遮盖。作用电极夹置后囟处,参考电极夹置两眼连线中点处;接地电极夹置在右耳(此三处使用导电糊提高电极接触率及导电性能)。微调各电极接触部位,待操作显示器上电阻数值显示≤10kohm后启动检查程序。记录:1.4Hz下N1-3、P1-3的峰时及N1-P1、N2-P2、N3-P3的振幅;11Hz下 N1、P1的峰值及N1-P1的振幅。左眼同法检查。(4)眼底荧光血管造影(FFA):本操作顺延F-VEP检查,白内障大鼠放弃此检查。F-VEP检查完成后一人手持大鼠将其右眼放于同步共焦激光眼底荧光造影仪镜头前方,用拇指示指分开大鼠右眼眼睑确保瞳孔充分暴露。另一人操作同步共焦激光眼底荧光造影仪,微调操纵杆调整镜头方位直至看到眼底调整焦距使眼底组织结构清晰显示,按下相机快门拍3~5张眼底像保存备用。同法检查左眼。拍完眼底像后将大鼠平放于操作台经尾静脉注射100g/L的荧光素钠注射液(注射剂量0.05mL/100g),即刻转换FFA模式行FFA检查,方法同前所述。
统计学分析:实验数据采用SPSS 20.0统计学软件进行分析,各组计量数据均以±s表示,多组间样本均数的比较采用重复测量的双因素方差分析,组间进一步两两比较采用LSD-t法,以P≤0.05为差异有统计学意义。
表1 不同时间点各组大鼠空腹血糖值的比较(±s,mmol/L)
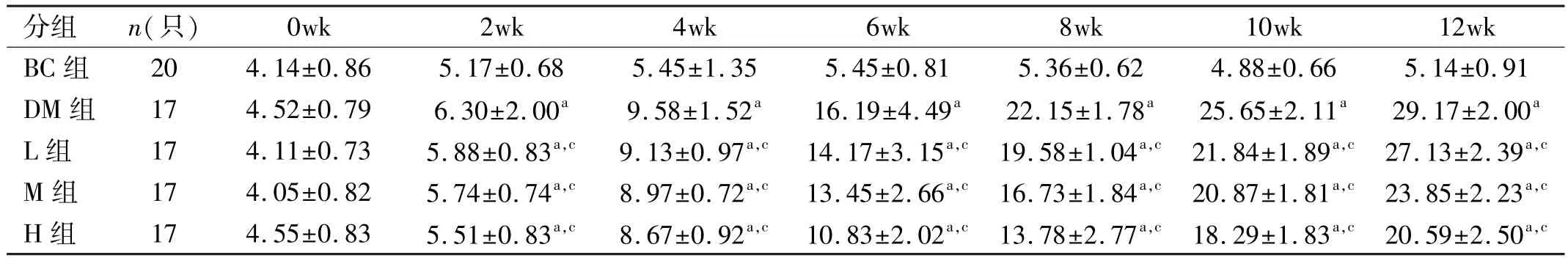
表1 不同时间点各组大鼠空腹血糖值的比较(±s,mmol/L)
注:aP<0.05 vs同时间BC组;cP<0.05 vs同时间DM组。
分组n(只)0wk2wk4wk6wk8wk10wk12wk BC组204.14±0.865.17±0.685.45±1.355.45±0.815.36±0.624.88±0.665.14±0.91 DM组174.52±0.796.30±2.00a9.58±1.52a16.19±4.49a22.15±1.78a25.65±2.11a29.17±2.00aL组174.11±0.735.88±0.83a,c9.13±0.97a,c14.17±3.15a,c19.58±1.04a,c21.84±1.89a,c27.13±2.39a,cM组174.05±0.825.74±0.74a,c8.97±0.72a,c13.45±2.66a,c16.73±1.84a,c20.87±1.81a,c23.85±2.23a,cH组174.55±0.835.51±0.83a,c8.67±0.92a,c10.83±2.02a,c13.78±2.77a,c18.29±1.83a,c20.59±2.50a,c
2 结果
2.1一般情况观察 BC组大鼠活泼好动,反应敏捷,形体匀称,毛发健康有光泽,角膜透明,屈光质清晰无异常。DM组大鼠造模成功3d后可见典型的多食、多饮、多尿和体重减轻的“三多一少”症状;随着高血糖状态的持续稳定,DM组大鼠消瘦症状逐渐明显,并且毛色渐枯、发黄、精神萎靡。
2.2各组大鼠血糖变化 造模后随着时间延长,BC组血糖稳定,DM组、L组、M组与H组血糖呈上升趋势,但随着用药剂量的加大,L组、M组和H组与DM组相比血糖上升趋势逐渐减缓(表1)。双因素分析结果显示:不同处理组之间比较F=5.764,P=0.001,不同时间比较F= 156.792,P=0.000。不同时间及不同处理组间FBG值的差异有统计学意义(P<0.05)。
2.3各组大鼠眼前节检查情况 造模成功后第2、4、6、8、10、12wk行眼前节照相检查可发现:BC组大鼠未出现白内障。DM组大鼠第6wk出现1只大鼠双眼白内障;第8wk新发2只大鼠双眼白内障,第10~12wk新发2只大鼠双眼白内障。L组大鼠第8wk出现2只大鼠单眼白内障,第8~12wk出现1只大鼠双眼白内障。M组大鼠第10wk出现1只大鼠双眼白内障。H组大鼠第12wk出现2只大鼠单眼白内障。根据发病时间点及发病率分析,DM组最先出现并发性白内障,且发病率最高,随着用药剂量的增加,发病时间及发病率呈现延后及降低趋势。混浊弥散于核及皮质,由部分混浊发展为完全混浊,开始时在前后囊下出现典型的白点状或雪片状混浊,迅速扩展为完全性白内障,以后囊下极部多见(图1)。
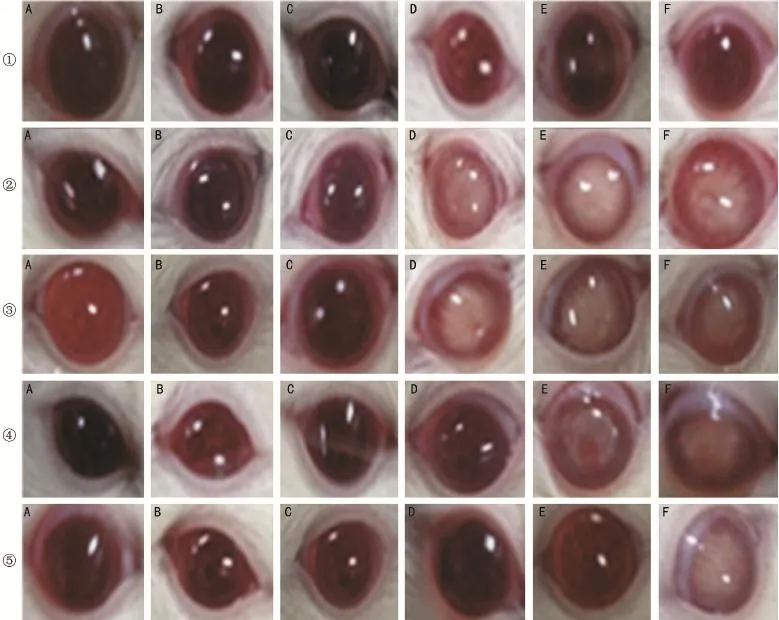
图1 不同组大鼠前节照相检查结果 ①:BC组;②:DM组;③:L组;④:M组;⑤:H组;A:2wk;B:4wk;C:6wk;D:8wk;E:10wk;F:12wk。
2.4各组大鼠视网膜电图检查结果 五组间a波波幅差异无统计学意义(P>0.05),而DM组b波波幅显著降低,与BC组比较差异有统计学意义(P<0.05),H组与BC组比较无统计学差异(P>0.05),而与DM组比较有统计学差异(P<0.05);M组和L组情况介于DM组与H组之间。DM组a波、b波潜时明显延长,与BC组比较有统计学差异(P<0.05),H组a波、b波潜时略有延长,与BC组比较无统计学差异(P>0.05),而与DM组比较有统计学差异(P<0.05);M组和L组情况介于DM组与H组之间(表2)。
b值双因素分析结果显示:不同处理组之间比较F= 1.734,P=0.158,不同时间比较F=6.719,P=0.004。不同时间b值的差异有统计学意义。b-w值双因素分析结果显示:不同处理组之间比较F=5.518,P=0.001,不同时间比较F=3.359,P=0.040,不同处理组和不同时间b-w值的差异均有统计学意义。P2值双因素分析结果显示:不同处理组之间比较F=0.617,P=0.653,不同时间比较F=0.033,P=0.967,不同处理组和不同时间P2值的差异均无统计学意义。OS2值双因素分析结果显示:不同处理组之间比较F=3.042,P=0.025,不同时间比较F=14. 782,P=0.000。不同处理组和不同时间OS2值的差异均有统计学意义(P<0.05)。
2.5各组大鼠视觉诱发电位检查情况 DM组VEP峰值期为134.80±7.54ms,与BC组VEP峰值期(105.70± 20.40ms)比较明显延长(P<0.05)。H组VEP峰值期为120.80±16.31ms,与BC组VEP峰值期(105.70± 20.40ms)比较差异无统计学意义(P>0.05),M、L组情况介于DM组与H组之间。DM组波幅为3.22±0.51μV,与BC组(4.01±0.96μV)比较明显降低(P<0.05)。H组波幅为3.66±1.26μV,与BC组(4.01±0.96μV)比较差异无统计学意义(P>0.05),M、L组情况介于DM组与H组之间(表3)。
P2双因素分析结果显示:不同处理组之间比较F= 5.918,P=0.001,不同时间比较F=11.647,P=0.000,不同处理组和不同时间P2值的差异均有统计学意义。双因素分析结果显示:N2-P2不同处理组之间比较F=3.185,P=0.024,不同时间比较F=1.370,P=0.258,不同处理组间N2-P2值的差异有统计学意义。
2.6各组大鼠眼底荧光血管造影检查情况 BC组大鼠彩色眼底像显示,视盘位于眼球后部中央,沿着视盘发出6~8只细且直的动脉,伴行6~8只较粗的视网膜静脉,未见黄斑样结构,无渗出和出血。经尾静脉注射荧光素钠后可见视网膜中央动脉,稀疏的小动脉分支形成的浅层毛细血管网,小静脉汇集成的视网膜静脉,与动脉相间排列,视网膜小血管最小到4级血管均可显像。DM组大鼠检查结果显示,弥散性毛细血管纡曲扩张,荧光渗漏,视网膜血管1~3级病变表现均存在。L、M、H组大鼠检查结果与DM组相似,但病变程度逐渐减轻(图2)。
表2 各组大鼠全视野闪光ERG b波的峰时及振幅和OPs2峰时及振幅变化±s
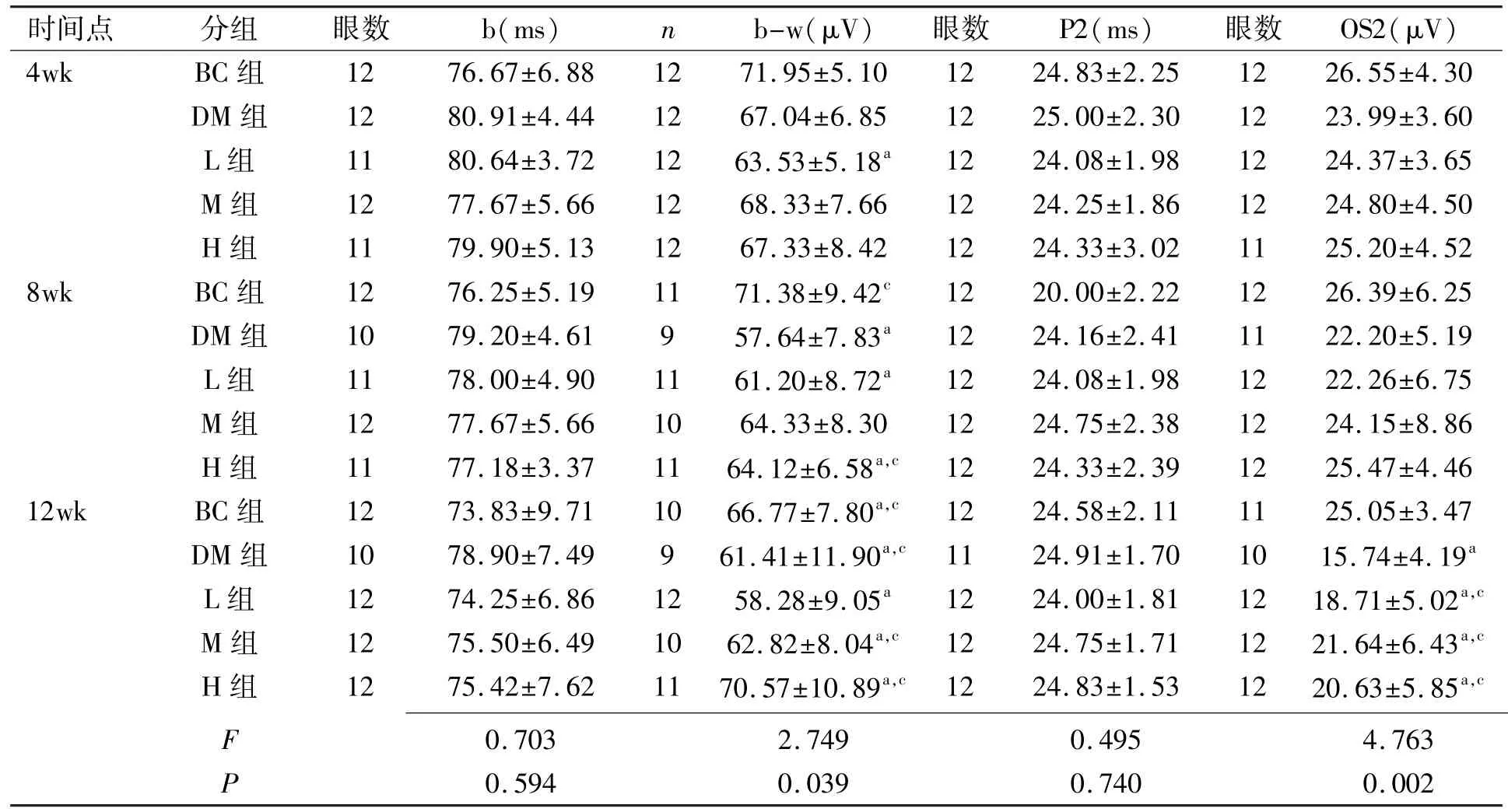
表2 各组大鼠全视野闪光ERG b波的峰时及振幅和OPs2峰时及振幅变化±s
注:aP<0.05 vs同时间BC组;cP<0.05 vs同时间DM组。
时间点分组眼数b(ms)nb-w(μV)眼数P2(ms)眼数OS2(μV)4wkBC组1276.67±6.881271.95±5.101224.83±2.251226.55±4.30 DM组1280.91±4.441267.04±6.851225.00±2.301223.99±3.60 L组1180.64±3.721263.53±5.18a1224.08±1.981224.37±3.65 M组1277.67±5.661268.33±7.661224.25±1.861224.80±4.50 H组1179.90±5.131267.33±8.421224.33±3.021125.20±4.52 8wkBC组1276.25±5.191171.38±9.42c1220.00±2.221226.39±6.25 DM组1079.20±4.61957.64±7.83a1224.16±2.411122.20±5.19 L组1178.00±4.901161.20±8.72a1224.08±1.981222.26±6.75 M组1277.67±5.661064.33±8.301224.75±2.381224.15±8.86 H组1177.18±3.371164.12±6.58a,c1224.33±2.391225.47±4.46 12wkBC组1273.83±9.711066.77±7.80a,c1224.58±2.111125.05±3.47 DM组1078.90±7.49961.41±11.90a,c1124.91±1.701015.74±4.19aL组1274.25±6.861258.28±9.05a1224.00±1.811218.71±5.02a,cM组1275.50±6.491062.82±8.04a,c1224.75±1.711221.64±6.43a,cH组1275.42±7.621170.57±10.89a,c1224.83±1.531220.63±5.85a,cF 0.5940.0390.7400.002 0.7032.7490.4954.763 P
表3 各组大鼠闪光VEP P2波的峰时及振幅变化±s
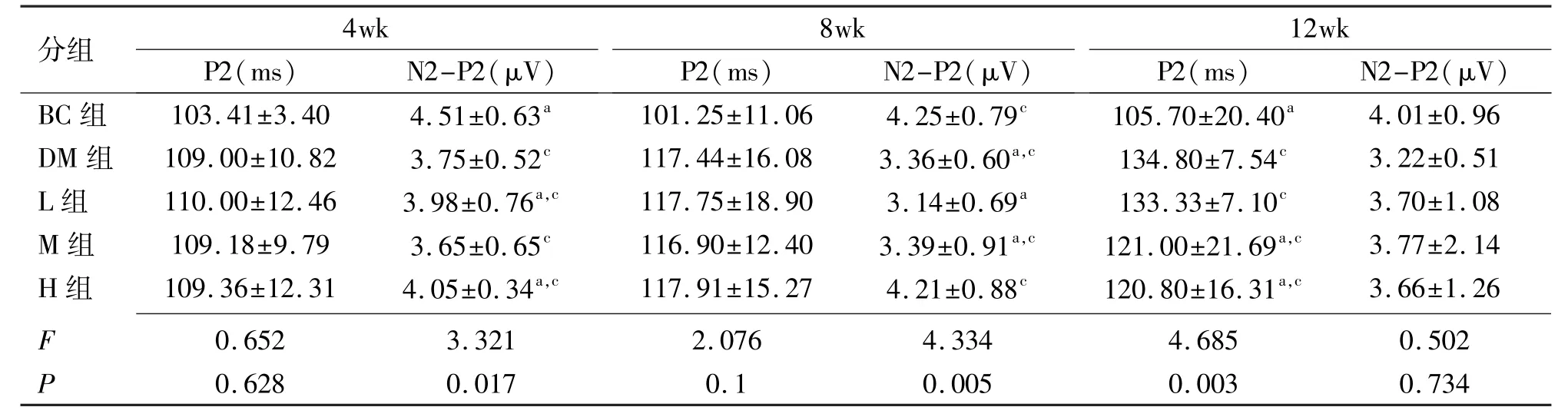
表3 各组大鼠闪光VEP P2波的峰时及振幅变化±s
aP<0.05 vs同时间BC组比较;cP<0.05 vs同时间DM组。
分组4wk P2(ms)N2-P2(μV)8wk P2(ms)N2-P2(μV)12wk P2(ms)N2-P2(μV)BC组103.41±3.404.51±0.63a101.25±11.064.25±0.79c105.70±20.40a4.01±0.96 DM组109.00±10.823.75±0.52c117.44±16.083.36±0.60a,c134.80±7.54c3.22±0.51 L组110.00±12.463.98±0.76a,c117.75±18.903.14±0.69a133.33±7.10c3.70±1.08 M组109.18±9.793.65±0.65c116.90±12.403.39±0.91a,c121.00±21.69a,c3.77±2.14 H组109.36±12.314.05±0.34a,c117.91±15.274.21±0.88c120.80±16.31a,c3.66±1.26 F P 0.6280.0170.10.0050.0030.734 0.6523.3212.0764.3344.6850.502
3 讨论
糖尿病病情控制不好甚至完全失控时会引起微血管(失明、肾部病变和神经病变)和大血管(心血管病变和中风)的并发症[4]。由白内障引起的失明是糖尿病的一种重要的长期并发症。白内障,以云状或混浊的晶状体为特征,是糖尿病的一个早期并发症,并且是全世界首要的致盲原因,而且在发展中国家更是如此[5],其多为双眼发病,而且发展迅速,可于数月、数周甚至数天内发展为完全混浊。
糖尿病性视网膜病变也是糖尿病最重要的致盲的并发症之一,临床上根据是否出现视网膜新生血管为标志,将没有视网膜新生血管形成的糖尿病性视网膜病变称为非增殖性糖尿病性视网膜病变(NPDR),而将有视网膜新生血管形成的糖尿病性视网膜病变称为增殖性糖尿病性视网膜病变[6]。据文献报道,DR发病的危险因素包括遗传因素、高血压因素、高血脂因素、眼部因素,且和糖尿病病程长短有着密切的关系[7],关于DR的发病机制的研究有多元醇通路、炎症-免疫机制、基因多态性、氧化应激和蛋白激酶C的活化等,目前认为该病很有可能是多种因素交叉反应的结果[8]。而在DR的治疗研究当中,中医中药疗法是一个重要的发展方向。中药黄精多糖性温、价格便宜、药效显著、不良反应少,具有较大潜在应用市场。黄精多糖具有多种药理作用,可降脂、降血糖、抗病毒、抗感染、增强记忆力和免疫力等[9];另外还具有抗氧化、抗自由基损伤的作用。有研究证实PSP可以提高血C肽和胰岛素水平,改善SOD和MDA水平,通过调节糖代谢并且抑制微血管新生而达到保护作用[10]。
在本实验中,通过一次性注射STZ建立糖尿病大鼠模型,并灌胃给予不同剂量的PSP,以期判定药物降糖和眼保护作用疗效分析。观察糖尿病眼部病变需进行眼部检查,主要包括裂隙灯前节检查、荧光素眼底血管造影、视网膜电图及视觉诱发电位等项目,以便及时了解糖尿病视网膜病变的严重程度及视网膜功能。ERG电生理信号的解剖学基础:a波主要针对光感受器,b波代表双极细胞和Müller细胞的功能[11];Ops波代表无长突细胞。通常采用a波和b波变化用于评定视网膜功能。DR的微循环改变往往较早影响到此层,因而有学者报道当F-ERG a、b波尚正常时已有OPs的缺失或明显降低[12]。Ops可观察视网膜供血状况[13],OPs总振幅是目前判断早期DR最敏感的指标,它不仅能早期发现病变,还能反映视网膜的进行性损害[14]。Ops总波振幅越低,DR病情越重[15]。其子波OPs2、OPs3的波幅与DR的严重程度有着明显相关性,即振幅越小,DR越重。本次实验以OPs2振幅作为检测指标进行分析,我们发现BC组与DM、L组组间有显著统计学意义,DM组与M、H组组间有统计学意义。这与报道的其他相关研究结果相吻合[16]。VEP主要用于判断视神经功能状态和视觉传导通路功能变化,波幅常反应参加反应细胞多少。如果某一水平发生病变或功能障碍时,诱发电位的相应部分就会出现潜伏期、波幅及波形的改变,FVEP异常提示视网膜至视皮层之间的病变,异常程度与视功能障碍程度相一致[17]。FFA评定眼底病的病理状态和治疗效果直接而客观[18]。目前国内针对大鼠FFA检查多使用Heidelberg眼底血管造影设备,并通过大鼠尾静脉注射造影剂达到实质性效果[19]。我们的实验结果能够清晰地观察到各组大鼠眼底血管改变。
在实验中我们通过控制动物麻醉深度、固定电极放置、调节室内温度、环境照度等一系列措施,使实验中的各种客观因素的影响降到最小,而使电生理指标最大限度地反映动物视神经系统的机能状态。虽然经证实将这四种检查方法用于大鼠检查是可行的,但实际操作过程中并不容易,需要注意的细节非常多,很多关键环节比如电极片的安放、麻醉时间和程度的把握等都需要控制到比较理想的状态操作才能顺利进行。如何找到可行的办法将其用于实验动物并得出可信的结果,是我们这次实验的主要目的。
综上所述,PSP既能有效降低糖尿病大鼠的血糖水平,又能延缓糖尿病大鼠眼部并发症的进程,可以对眼部病变起到明显的治疗作用。其机制有可能为通过抑制糖基化终产物,改善糖脂质代谢,提高糖耐量而对糖尿病视网膜病变发挥保护作用。
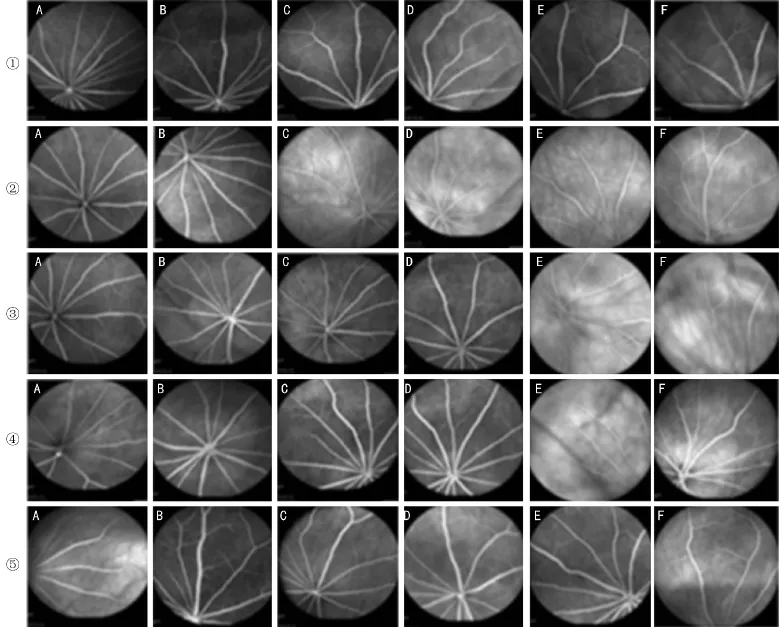
图2 各组大鼠FFA检查结果 ①:BC组;②:DM组;③:L组;④:M组;⑤:H组;A:2wk;B:4wk;C:6wk;D:8wk;E:10wk;F:12wk。
1 Santiago JG,Walia S,Sun JK,et al.Influence of diabetes and diabetes type on anatomic and visual outcomes following central rein vein occlusion.Eye(Lond)2014;28(3):259-268
2 Bamashmus MA,Gunaid AA,Khandekar RB.Diabetic retinopathy,visual impairment and ocular status among patients with diabetes mellitus in Yemen:a hospital-based study.Indian J Ophthalmol 2009;57(4): 293-298
3 Hood DC,Bach M,Brigell M,et al.ISCEV guidelines for clinical multifocal electroretinography(2007 edition).Doc Ophthalmol 2008;116(1):1-11
4 Michael J,Fowler MD.Microvascular and macrovascular complications of diabetes.Clin Diabetes 2008;26(3):77-82
5 Thangaraju P,Chakrabarti A,Banerjee D,et al.Dual blockade of Renin Angiotensin system in reducing the early changes of diabetic retinopathy and nephropathy in a diabetic rat model.N Am J Med Sci 2014;6(12):625-632
6 Shao Q,Heussen FM,Ouyang Y,et al.Retinal vessel diameter changes in different severities of diabetic retinopathy by SD-OCT.Eur J Ophthalmol 2015[Epub ahead of print]
7 Frozza RL,Bernardi A,Hoppe JB,et al.Neuroprotective effects of resveratrol against Aβ administration in rats are improved by lipid-core nanocapsules.Mol Neurobiol 2013;47(3):1066-1080
8 Zhong S,Ma S,Hong Z,et al.Antiinflammation effect of danggui shaoyao san on Alzheimer's diseases.China Journal of Chinese Materia Medica 2011;36(22):3155-3160
9 Yi Y,Wu S,Ye M,et al.Effect of Aβ1-42 injection on hippocampus cells in rats and protective role of polygona-polysaccharosefor Alzheimer's disease.Zhong Nan Da Xue Xue Bao Yi Xue Ban 2014;39(4):344-348
10 Gong H,Li W,Yin Y,et al.Hypoglycemic activity and mechanism of Polygona-polysaccharide on diabetic rat model.Zhongguo Zhong Yao Za Zhi 2009;34(9):1149-1154
11 Ilmarinen T,Hiidenmaa H,Kööbi P,et al.Ultrathin Polyimide Membrane as Cell Carrier for Subretinal Transplantation of Human Embryonic Stem Cell Derived Retinal Pigment Epithelium.PLoS One 2015;10(1):e0143669
12 Park YG,Kang S,Brinkmann R,et al.A Comparative Study of Retinal Function in Rabbits after Panretinal Selective Retina Therapy versus Conventional Panretinal Photocoagulation.J Ophthalmol 2015;2015(2):247-259
13 Porciatti V.Electrophysiological assessment of retinal ganglion cell function.Porciatti V.Exp Eye Res 2015;141(3):164-170
14 Carozzo S,Ball SL,Narici L,et al.Interaction of(12)C ions with the mouse retinal response to light.Neurosci Lett 2015;598(3):36-40
15 Post M,Goslawski W,Modrzejewska M,et al.Electrophysiological function of the retina and optic nerve in patients with atrial fibrillation. Doc Ophthalmol 2015;131(1):53-62
16 Pardue MT,Barnes CS,Kim MK,et al.Rodent Hyperglycemia-Induced Inner Retinal Deficits are Mirrored in Human Diabetes.Transl Vis Sci Technol 2014;3(3):6
17 Méndez-Balbuena I,Huidobro N,Silva M,et al.Effect of mechanical tactile noise on amplitude of visual evoked potentials: multisensory stochastic resonance.J Neurophysiol 2015;114(4):2132-2143
18 Soltanipour A,Sadri S,Rabbani H,et al.Analysis of Fundus Fluorescein Angiogram Based on the Hessian Matrix of Directional Curvelet Sub-bands and Distance Regularized Level Set Evolution.J Med Signals Sens 2015;5(3):141-155
19 Wigg JP,Zhang H,Yang D.A Quantitative and Standardized Method for the Evaluation of Choroidal Neovascularization Using Micron III Fluorescein Angiograms in Rats.PLoS One 2015;10(5):e0128418
Observation on the protective effect of polygonatum polysaccharide for eyes in streptozotocin induced diabetic rats
Yi Wang1,Guo-Qing Peng2,Di Chen1,Chao Han1,Chun-Run Miao3,Chao Su4,Bao-Jin Lu3,Shan-Long Feng4
Science and Technology Development Plan Project of Tai'an(No.2015NS1119)
2015-11-28 Accepted:2016-02-24
polygona-polysaccharose;streptozotocin;diabetes rat;diabetic retinopathy;ocular
泰安市科技发展计划项目(No.2015NS1119)
(271000)中国山东省泰安市,泰山医学院附属医院1眼科;3急诊科;4普外科;2(271000)中国山东省泰安市,泰安市中心医院骨科
王艺,男,在读博士研究生,主治医师,讲师,研究方向:糖尿病视网膜病变。
王艺.346048368@qq.com
2015-11-28
2016-02-24
Wang Y,Peng GQ,Chen D,et al.Observation on the protectiveeffectofpolygonatumpolysaccharideforeyesin streptozotocin induced diabetic rats.Guoji Yanke Zazhi(Int Eye Sci)2016;16(3):428-434
10.3980/j.issn.1672-5123.2016.3.06引用:王艺,彭国庆,陈迪,等.PSP对STZ诱导的糖尿病大鼠眼保护作用的临床动态观察.国际眼科杂志2016;16(3):428-434

