氨基硅烷化磁纳米颗粒固定化果胶酶改善烟草浸膏品质
颜克亮,陈虹,王文峰,胡巍耀,凌军,陈微,余洪波
1云南中烟工业有限责任公司,技术中心,云南昆明红锦路367号 650231;2华中科技大学,生命科学与技术学院,湖北武汉洪山区珞瑜路1037号 430074
氨基硅烷化磁纳米颗粒固定化果胶酶改善烟草浸膏品质
颜克亮1,陈虹2,王文峰2,胡巍耀1,凌军1,陈微1,余洪波2
1云南中烟工业有限责任公司,技术中心,云南昆明红锦路367号 650231;2华中科技大学,生命科学与技术学院,湖北武汉洪山区珞瑜路1037号 430074
为降低烟草浸膏中的不利成分,首次利用氨基硅烷化磁纳米颗粒固定化果胶酶制剂处理烟草浸膏,研究了酶处理条件对浸膏中果胶和蛋白含量的影响,并对处理后的烟草浸膏在再造烟叶中的应用效果进行感官评价。结果显示:①固定化果胶酶蛋白及酶活回收率分别为44.44%和40.86%;②固定化酶处理的最佳条件为:温度50 ℃、pH 3.5、酶浓度4.44 U/mL、反应时间24 h;③利用固定化酶处理叶膏和梗膏,果胶水解率分别达到84.04%和39.26%,浸膏中的酶蛋白可通过磁性分离完全去除;④将处理后的烟草浸膏用于再造烟叶制备,吸味明显改善。该方法可有效降低烟草浸膏中果胶含量,并除去残留酶蛋白,可改善烟草浸膏品质。
烟草浸膏;氨基硅烷化磁纳米颗粒;固定化果胶酶;还原糖;果胶水解
从废次烟叶和烟梗中提取出来的叶膏、梗膏等烟草浸膏具有丰富烟香、体现烟草本香的作用,用于再造烟叶的制造[1]。然而,浸膏中的果胶、蛋白等成分,会使再造烟叶存在吸味品质差、杂气重等缺陷,影响了再造烟叶在卷烟产品中的应用[2]。酶处理法常用于改善浸膏品质、降低果胶等不利成分含量,李琳等利用果胶酶、纤维素酶、淀粉酶和中性蛋白酶处理废次烟末制备烟草浸膏,可有效提高再造烟叶品质[3]。酶本身是一种蛋白质,处理后的酶蛋白残留会对浸膏品质产生负面影响,且残余酶灭活不充分也会影响再造烟叶质量,因而限制了酶处理法在生产中的应用。近年来,具有稳定性高、易分离、无毒等特点的磁纳米颗粒作为一种固定化酶的载体,受到了广泛的关注[4]。利用磁纳米载体固定酶的方法与包埋方式的酶固定方法相比,其具有比表面积大,分散性好等特点,可以提高固定化酶的酶解效率[5]。本研究以磁纳米颗粒为载体固定果胶酶,可在外加磁场作用下实现从反应体系中分离回收,因而有望解决酶处理法蛋白残留的难题[6]。目前利用磁纳米颗粒固定果胶酶的研究还未见报道,而固定化酶技术在烟草领域的应用也鲜有报道。本研究以(3-氨丙基)三乙氧基硅烷((3-aminopropyl) triethoxysilane, APTES)修饰的氨基硅烷化磁纳米颗粒为载体固定果胶酶,利用固定化酶制剂处理叶膏和梗膏,旨在为改善烟草浸膏品质提供一个新的技术思路。
1 材料与方法
1.1 材料和仪器
1.1.1 材料
(3-氨丙基)三乙氧基硅烷(AR,阿拉丁试剂公司);六水合氯化铁(FeCl3•6H2O)、四水合氯化亚铁(FeCl2•4H2O)、浓氨水(NH3•H2O),聚乙二醇(PEG, Mn=4000),25%的戊二醛溶液,无水乙醇(AR,国药集团化学试剂有限公司);果胶酶(BR,上海瑞永生物科技有限公司,最适温度50 ℃,最适pH 3.5);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);烟草浸膏:叶膏、梗膏(红云红河集团)。
1.1.2 仪器
X射线衍射仪(荷兰帕纳科公司);电动搅拌器(武汉科尔仪器设备有限公司);数显恒温水浴锅(金坛市富华仪器有限公司);钕铁硼磁铁;紫外-可见分光光度计(上海舜宇恒平科学仪器有限公司);傅里叶变换红外光谱仪(德国Bruker公司)。
1.2 方法
1.2.1 固定化果胶酶制备
(1)氨基硅烷化磁纳米颗粒制备。采用化学共沉淀的方法制备Fe3O4磁纳米颗粒[7],并加入聚乙二醇对磁纳米颗粒进行包裹,能够有效改善磁纳米颗粒的聚集,提高其稳定性[8]。利用APTES制备的氨基硅烷化磁纳米颗粒[9],具体操作步骤如下:
①磁纳米颗粒制备。称取10.321 g FeCl3•6H2O和4.355 g FeCl2•4H2O(保持Fe3+/Fe2+=1.75:1)和5 g PEG,加入1000 mL圆底烧瓶中,再向烧瓶中加入200 mL蒸馏水并通入N2,在600 r/min高速搅拌下加热至80 ℃。加入一定量的浓氨水使反应体系pH维持在10~11,反应30 min。在外加磁场的作用下,收集反应得到的磁纳米颗粒,用热蒸馏水和无水乙醇反复洗涤后分散在无水乙醇中。
②氨基硅烷化修饰。在磁性纳米颗粒的乙醇分散液中通入N2并加入一定量的APTES,使Fe3O4和APTES的摩尔比约为4:1。在200 r/min、40 ℃反应条件下反应36 h,无水乙醇反复洗涤,置于4 ℃冰箱中保存待用。
(2)果胶酶的固定。参考阮贵华等人固定胰蛋白酶的方法[10]以戊二醛作为交联剂将果胶酶固定在氨基硅烷化磁纳米颗粒上,具体步骤如下:
①氨基硅烷化磁纳米颗粒活化。取一定量氨基硅烷化磁纳米颗粒,加入4%戊二醛溶液(磁纳米颗粒(mg):4%戊二醛溶液(mL)=10:1),在30 ℃、200 r/min恒温摇床上活化3 h。外加磁场下大量蒸馏水反复洗涤去除未反应完的戊二醛得到带有醛基活性基团的磁纳米颗粒。
②果胶酶的固定。取一定量的果胶酶溶液(5mg/mL, pH=3.5)加入到带醛基活性基团的磁纳米颗粒中,酶液与磁纳米颗粒比例为1(mL):10(mg)。将上述混合物置于30 ℃、200 r/min恒温摇床上活化3 h,反应完后外加磁场下蒸馏水洗涤去除未固定化的蛋白质,取与固定化前果胶酶等体积的蒸馏水将固定化酶分散,计算固定化酶磁纳米颗粒载体浓度以及蛋白回收率和酶活回收率。蛋白回收率和酶活回收率计算分别按照以下公式计算:

式(1)中,R1(%)是蛋白回收率,S0(mg/mL)是加入酶蛋白总量,S1(mg/mL)是上清液残余蛋白量。式(2)中,R2(%)是酶活回收率,A1(U)是固定化酶的酶活,A0(U)—固定化酶等量的游离酶酶活。
其中,果胶酶酶活定义为:当果胶酶浓度一定时,1 mL果胶酶在50 ℃,pH=3.5条件下水解果胶,1 min产生1 μM半乳糖醛酸为一个酶活单位(U)。蛋白含量测定利用BCA蛋白浓度测定试剂盒。
1.2.2 磁纳米颗粒结构表征
分别利用X射线衍射和傅里叶红外光谱技术表征氨基硅烷化修饰前后的磁纳米颗粒结构[11]。
(1)X射线衍射分析。测试条件:Cu靶(Kα,λ=0.15406 nm),工作电压40 kV,工作电流200 mA,扫描速度0.02°/s,扫描范围为20-80°。得到两者的X射线衍射图谱并与JCPDS标准卡片进行比较。利用德拜—谢乐公式d=Kλ/ (βcosθ) 计算磁纳米晶体粒径,其中:d为晶粒平均粒径,单位为nm;K为常数为0.8980;λ为X射线波长为0.15406 nm;β为最强峰的半峰宽;θ为对应峰的衍射角。
(2)傅里叶红外光谱技术。将磁纳米颗粒样品与KBr混匀,压片供测试用。测试条件为:谱区400~4000 cm-1,分辨率0.4 cm-1,采样速率80张谱/秒。
1.2.3 叶膏和梗膏的制备
利用再造烟叶在线生产过程中获得叶膏和梗膏进行实验。选取烟叶碎片按照特定比例进行混合后萃取,过滤后的萃取液浓缩得到叶膏,其常规成分为:总糖23.82%、还原糖21.18%、钾离子6.02%、总植物碱4.74%、氯离子2.2%和总氮3.2%;将烟梗按照特定比例混合后萃取,过滤后的萃取液浓缩得到梗膏,其常规成分为:总糖38.84%、还原糖33.49%、钾离子9.7%、总植物碱1.07%、氯离子4.39%和总氮2.6%。
1.2.4 酶解条件对固定化果胶酶处理效率的影响
分别探究不同酶浓度、pH值、温度和反应时间对固定化果胶酶处理烟草叶膏、梗膏效率的影响。具体实验步骤如下:
(1)酶浓度。分别在1.11、2.22、4.44或13.32 U/mL酶浓度, pH 3.5、50 ℃条件下处理叶膏或梗膏8 h。同时利用未固定化酶的氨基硅烷化磁纳米颗粒载体在相同载体浓度条件下处理叶膏或梗膏8 h为对照。
(2)pH值。分别在pH 2.4、3、3.6、5、7、8,4.44 U/mL酶浓度、50 ℃下处理叶膏或梗膏8 h。
(3)温度。在酶浓度为4.44 U/mL、pH 3.5条件下,分别置于28、40、48、70 ℃水浴锅中处理叶膏或梗膏8 h。
(4)时间。在酶浓度为4.44U/mL、pH 3.5、50 ℃条件下,分别处理叶膏或梗膏2、4、8、12、24 h。
反应后将样品置于100 ℃水浴锅中灭活10 min,利用DNS(3,5-二硝基水杨酸)比色法测定样品中还原糖含量[12]。利用还原糖增加率评价果胶酶酶解效率,还原糖增加率越高酶解效率越高,还原糖增加率按以下公式计算:

式(3)中,R3是还原糖增加率;C1是酶解后样品中还原糖含量;C0是酶解前样品中还原糖含量,公式中所有还原糖含量均换算成半乳糖醛酸含量。
1.2.5 游离酶与固定化酶处理浸膏的比较研究
在最适温度、酶浓度、pH条件下,分别向100 mL烟草叶膏、梗膏中加入固定化果胶酶和游离果胶酶,处理24 h。反应完成后,将一块强磁铁(磁铁材质为钕铁硼,长10 cm,宽6 cm,厚9 mm,整块磁铁由长2 cm,宽1 cm,厚3 mm的小块磁铁拼接而成)置于含有固定化酶的反应容器下部吸引固定化果胶酶,固定化果胶酶在外加磁场作用下会逐渐聚集在反应容器底部,吸引15min后收集固定化果胶酶处理后的烟草浸膏,将收集的浸膏重复上述步骤直至用强磁铁吸引时再无磁纳米颗粒被吸引下来;同时测定去除固定化果胶酶后样品中果胶酶酶活以确认固定化果胶酶是否去除干净。测定处理前后浸膏中的蛋白质、果胶和还原糖含量,计算果胶水解率,并以同等酶浓度下的游离果胶酶为对照。果胶水解率计算方法参考刘耀飞等[13]的方法,具体计算公式如下:

式(4)中,R4是果胶水解率;C1是酶解后样品中还原糖含量;C0是酶解前样品中还原糖含量;P是酶解前果胶含量,公式中所有还原糖含量均换算成半乳糖醛酸含量。
果胶含量参考中华人民共和国农牧渔业标准(NY82.11—1998),采用咔唑比色法测量[14];蛋白质含量用凯氏定氮法测定[15-16]。
1.2.6 固定化果胶酶处理样品感官评价及应用验证
(1)应用验证
进一步开展500kg的中试应用验证:将采用固定化酶处理后的梗膏及叶膏替换生产中的梗膏和叶膏,以常规片基为基础,进行再造烟叶的制备;并将制备的再造烟叶按照8%~10%的比例添加到云烟(ZY)配方中,进行配方验证实验。
(2)感官评价
将片烟或再造烟叶切丝混匀后卷制成烟支,置恒温恒湿箱中,在标准空气湿度条件下(温度22℃±1℃,空气湿度60%±1%)平衡48 h,后送集团评吸组进行评吸,再造烟叶感官评价参考YC/T 498-2014(再造烟叶(造纸法)感官评价方法)进行,卷烟感官评价参考GB5606.4-2005进行评价,分别对不同样品进行评吸。
2 结果与讨论
2.1 磁纳米颗粒固定化果胶酶制备
2.1.1 氨基硅烷化磁纳米颗粒的表征
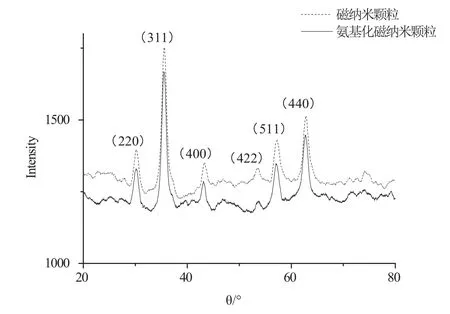
图1 氨基硅烷化修饰前后磁纳米颗粒的X衍射图Fig.1 X ray diffraction patterns of magnetic nanoparticles before and after amino–silane modi fi cation
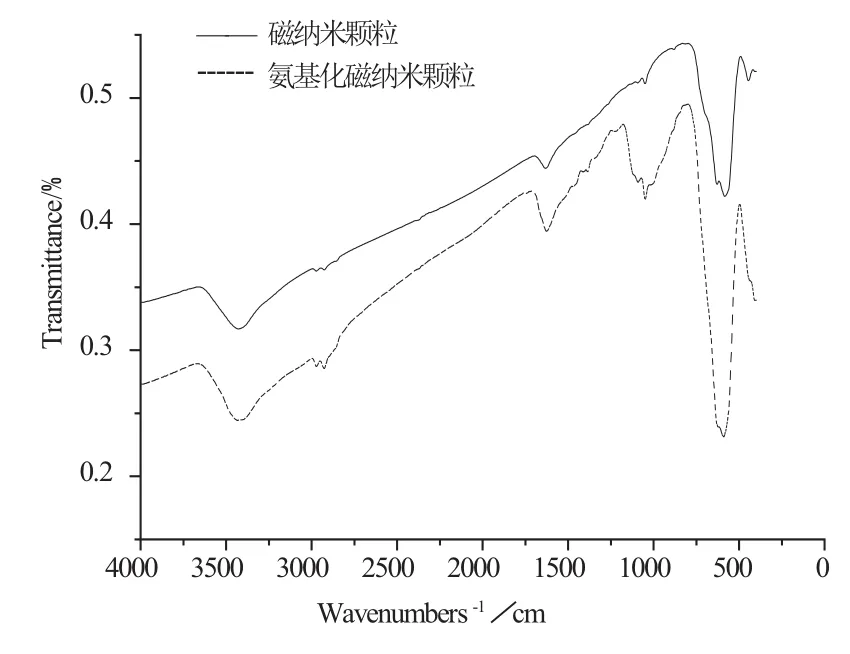
图2 氨基硅烷化修饰前后磁纳米颗粒的红外图谱Fig.2 Infrared spectrums of magnetic nanoparticles before and after amino–silane modi fi cation
分别利用X射线衍射法和傅里叶红外光谱法表征氨基硅烷化修饰前后磁纳米颗粒。图1显示了修饰前后磁纳米颗粒的X射线衍射图谱。结果表明,当2θ的范围为20-80°,磁纳米颗粒和氨基化磁纳米颗粒出现相同的强峰,说明氨基硅烷化修饰后磁纳米颗粒的晶体结构没有发生改变。将两者的X衍射图与JCPDS标准卡片对比,发现两者的主要吸收峰与标准的Fe3O4的特征峰(220)、(311)、(400)、(422)、(511)、(440)相吻合,说明两者均为不含杂质的反立方尖晶石型。利用德拜—谢乐公式对磁纳米颗粒直径进行计算,修饰前磁纳米颗粒直径约为15.6 nm。
在氨基硅烷化修饰反应过程中,APTES与Fe3O4粒子上吸附的羟基发生硅烷化反应而将氨基功能基团包覆在磁纳米颗粒的表面,因此可以通过傅里叶红外检测APTES是否成功包覆在Fe3O4粒子上。图2显示,两种磁纳米颗粒均在580 cm-1处出现-Fe-O特征吸收峰,但修饰后的磁纳米颗粒在1080 cm-1和2900 cm-1处出现-Si-O和-CH2特征吸收峰。由于-NH2与-OH特征吸收峰位置较为一致,因此3400 cm-1处的吸收峰可能是由于-NH2与-OH振动而产生。以上表征结果说明,APTES对磁纳米颗粒进行了包裹,氨基功能化修饰是成功的。
2.1.2 果胶酶固定化评价
由表1可知,固定化果胶酶蛋白回收率为40.86%,酶活回收率为44.44%,说明果胶酶通过此方法确实能够被磁纳米载体有效地固定,并且能够保留水解果胶的能力,证实该方法固定果胶酶是可行的。
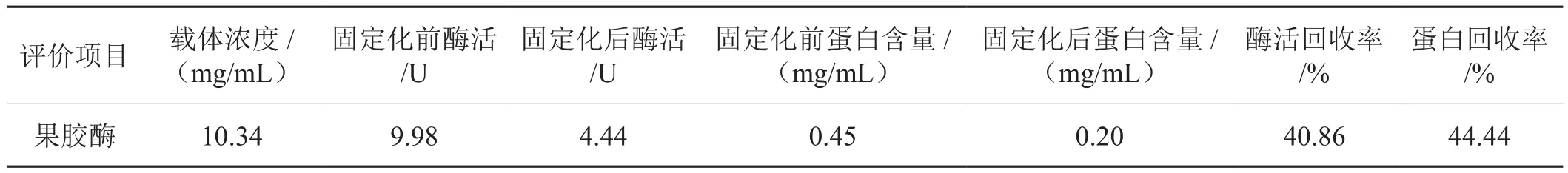
表1 果胶酶固定化效果评价Tab. 1 Evaluation of the immobilization effect of immobilized pectinase
传统的固定化酶技术是通过范德华力、静电引力和疏水作用力等将酶吸附在载体上,但由于吸附作用较弱,酶蛋白易从载体上脱落。如上所述,脱落下来的酶蛋白会对浸膏品质产生负面影响,因此需要用更牢固的方法将酶结合在载体上。本研究利用磁纳米颗粒表面羟基与APTES反应,实现纳米颗粒表面的氨基硅烷化修饰,纳米颗粒表面的氨基可通过戊二醛与酶蛋白氨基共价交联,使酶蛋白共价结合在载体上,较传统吸附法的稳定性显著增强[17-18]。此外,表面修饰也有助于解决磁纳米颗粒在制备、分离、后处理及存放过程中的粒子团聚、粒径变大等问题,增强磁纳米颗粒的稳定性[19]。
2.2 固定化果胶酶酶解条件研究
不同酶浓度、pH值、温度以及处理时间对固定化果胶酶处理烟草叶膏和梗膏的影响分别如图3~6所示。

图3 酶浓度对固定化果胶酶处理的影响Fig. 3 Effect of enzyme concentration on hydrolysis ef fi ciency of immobilized pectinase
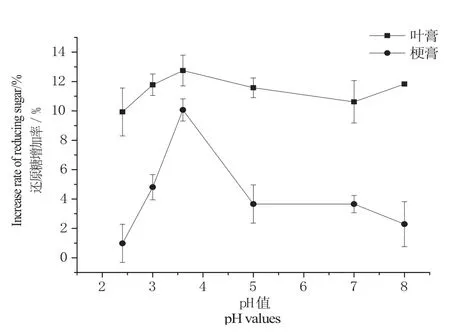
图4 pH对固定化果胶酶处理的影响Fig. 4 Effect of pH on hydrolysis ef fi ciency of immobilized pectinase
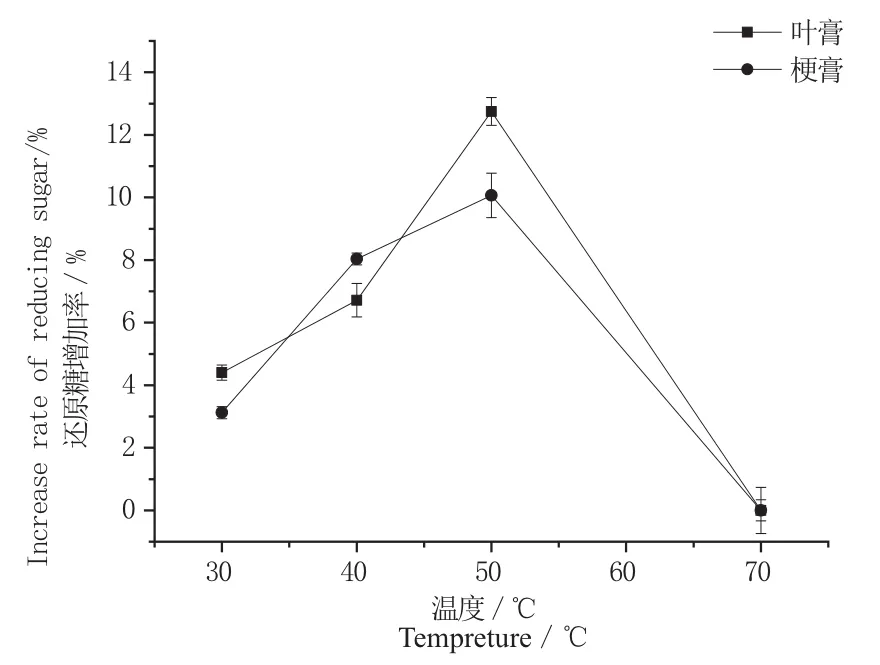
图5 温度对固定化果胶酶处理的影响Fig. 5 Effect of tempreture on hydrolysis ef fi ciency of immobilized pectinase

图6 处理时间对固定化果胶酶处理的影响Fig. 6 Effect of processing time on hydrolysis ef fi ciency of immobilized pectinase
由 图3可知,叶膏和梗膏的还原糖增加率均随着固定化酶浓度的升高而升高,当酶浓度达到4.44 U/mL时处理效率最高,但是当浓度继续增加时,处理效率反而下降。其原因可能与磁纳米颗粒载体的吸附作用有关[20],当载体浓度超过一定量时对酶解体系中糖的吸附量要大于酶解产生的糖量,导致测得的还原糖含量降低。对照组实验结果表明当载体浓度为4.44 U/mL或低于此浓度时,相同处理条件下未固定果胶酶的氨基硅烷化磁纳米颗粒载体对烟草浸膏中还原糖含量没有吸附,但当载体浓度达到13.32 U/mL时,相同处理条件下叶膏中还原糖含量降低了19.68%,梗膏中还原糖含量降低了15.17%,该结果与实验组结果一致。这种物理吸附作用可能也会对果胶的去除有一定的帮助。
图4和图5分别显示了酶解pH值和酶解温度对叶膏和梗膏酶处理效率的影响。结果表明,当温度为50 ℃、pH为3.5时,叶膏和梗膏的还原糖增加率达到最高,说明在该pH和温度条件下固定化酶处理效率最佳。商品果胶酶的最适温度为50 ℃、最适pH为3.5,这说明固定化并没有改变果胶酶的基本催化性质,仍与游离果胶酶保持一致。
图6显示在最适pH、温度和酶浓度下酶解时间对酶解效率的影响。结果表明,随着酶解还原糖增加率逐渐提高,表明时间的延长有助于果胶水解率的增加,当酶解时间为24 h时,叶膏和梗膏中的还原糖增加率不再继续增加,酶解效率达到最高。综合以上结果,确定最终固定化果胶酶处理叶膏、梗膏酶解最佳条件为:酶浓度为4.44 U/mL,酶解pH值为3.5,温度50 ℃,酶解24 h。
2.3 游离酶与固定化酶处理浸膏的比较研究
根据上述确定的最佳酶解条件(4.44 U/mL酶浓度、pH 3.5、50 ℃、酶解24 h),利用固定化果胶酶和同等酶浓度的游离果胶酶分别处理烟草叶膏、梗膏后,果胶含量变化结果如表2所示,蛋白含量变化如表3所示。

表2 游离酶与固定化酶处理后浸膏中果胶含量变化Tab.2 Changes of pectin content of tobacco extracts after being treated with free pectinase and immobilized pectinase
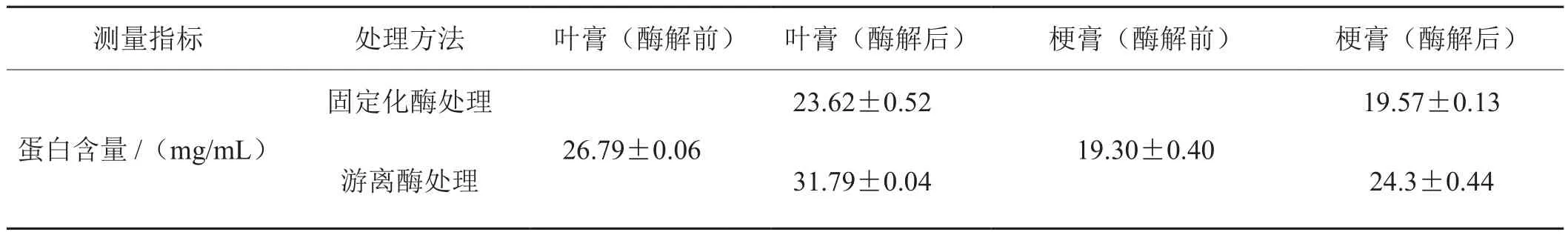
表3 游离酶与固定化酶处理后浸膏中蛋白含量变化Tab.3 Changes of protein content of tobacco extracts after being treated with free pectinase and immobilized pectinase
结果表明,固定化酶处理后叶膏和梗膏中的果胶均分别由处理前的20.86 mg/mL和25.76 mg/mL降至3.33 mg/mL以下和15.65 mg/mL,显著减小了对浸膏品质的不利影响。固定化酶对于叶膏的处理效率高,处理后残余果胶含量极低。与游离酶相比,固定化酶处理叶膏的果胶水解率变化不大,但处理梗膏的水解率均所下降,这可能是因为固定化酶纳米颗粒容易吸附在梗膏中的悬浮颗粒上,从而影响了酶解效率的缘故。
尽管与游离果胶酶相比,固定化果胶酶处理梗膏的酶解效率有所降低,但由于酶蛋白的加入,游离酶处理的烟草浸膏中蛋白含量均显著提升,叶膏和梗膏蛋白含量分别较处理前增加18.67%和25.91%,这些酶蛋白不仅会对吸味产生负面影响,而且处理后无法保证酶的完全灭活,残存的酶解作用会严重影响再造烟叶的品质。而固定化酶处理后,固定在磁纳米颗粒上的酶蛋白在强磁场作用下随着磁纳米颗粒的吸出而被去除,经过反复吸引,浸膏中不再有磁纳米颗粒吸出,同时对浸膏中果胶酶活的检测表明浸膏中已无果胶酶存在,说明酶蛋白已完全被去除。因此,浸膏中的蛋白含量不仅没有增加,而且叶膏中的蛋白含量还下降了11.83%,这可能是磁纳米载体对蛋白的少量吸附导致的结果。因此,利用氨基硅烷化修饰的磁纳米颗粒固定化果胶酶,可以快速便捷地将酶蛋白从处理样品中完全分离,从而解决酶处理法的酶蛋白残留问题。
2.4 固定化果胶酶处理样品感官评价及应用验证
将氨基硅烷化磁纳米颗粒固定化果胶酶处理的叶膏和梗膏替代再造烟叶制备过程中的叶膏和梗膏,按照现有工艺制备再造烟叶样品。测定其常规成分变化情况,并对其感官进行评价。所得结果分别如表4和表5所示。通过表中化学成分的变化可以看出,其总糖略有减少,还原糖含量有明显增加,其他指标变化不明显。从感官评价来看,在香气、杂气、刺激、余味等方面均有改善,烟香变得柔和细腻,刺激降低,尤其是杂气有所减轻、余味改善明显。
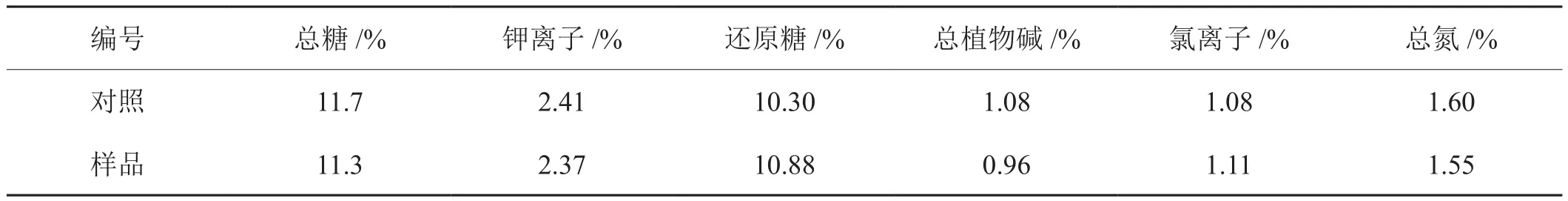
表4 再造烟叶化学指标变化情况Tab.4 Change of chemical parameters of reconstituted tobacco
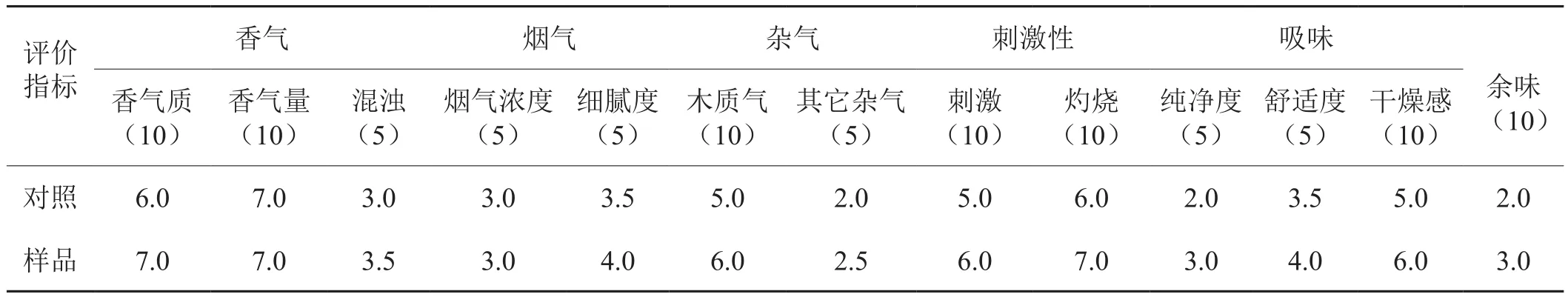
表5 再造烟叶感官特性变化情况*Tab.5 Change of sensory properties of reconstituted tobacco
将制备的再造烟叶分别按照8%和10%的比例添加到云烟(ZY)配方中,进行配方验证实验,所制备样品与对照(8%的对照再造烟叶)相比,其感官特性差异如表6所示。同比例添加,与对照相比,烟香更为厚实、清晰、流畅,余味生津回甜;增加2%添加后,烟香仍保持较好,杂气小,余味干净舒适。
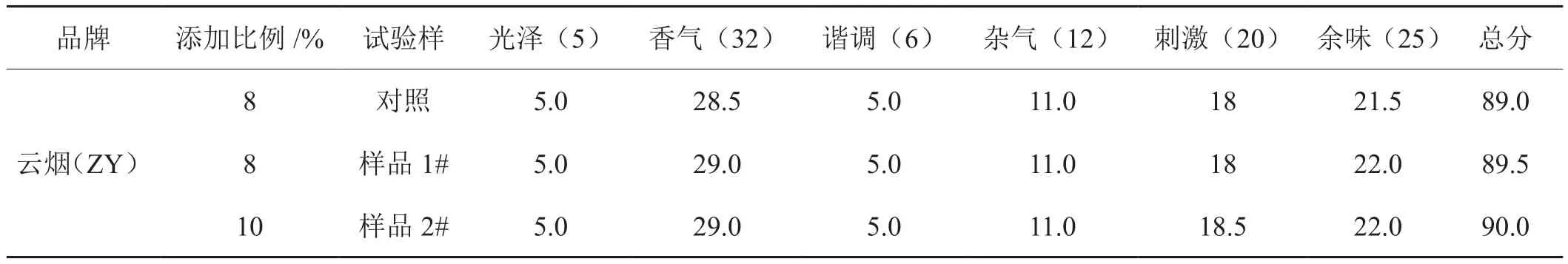
表6 云烟(ZY)配方感官特性变化情况Tab.6 Change of sensory properties of different Yunyan(ZY)formula
3 结论
氨基硅烷化磁纳米颗粒固定化果胶酶处理烟草浸膏的研究表明:①固定化果胶酶能够有效地对烟草浸膏中果胶进行降解,处理后浸膏中的酶蛋白可通过磁性分离完全去除;②将固定化果胶酶处理后的烟草浸膏用于再造烟叶制备,吸味改善明显。因此,将氨基硅烷化磁纳米颗粒固定化果胶酶用于烟草浸膏中果胶水解,能为酶解法处理改善烟草浸膏品质提供一条新技术途径。
[1] 庞登红,李丹,熊国玺,等. 酶法处理烟叶碎片制备烟草浸膏[J]. 江南大学学报(自然科学版),2009,8(5):607-612.Pang Denghong, Li Dan, Xiong Guoxi, et al. Tobacco Extract Made from Tobacco Fragments with Enzyme [J].Joural of Jiangnan University (Natural Science Edition),2009, 8 (5): 607-612. (in Chinese)
[2] 吴亦集,沈光林,陶红,等. 造纸法再造烟叶原料的加酶萃取[J]. 烟草科技,2011,(7): 33-36.Wu Yiji, Shen Guanglin, Tao Hong, et al. Extraction of Tobacco Materials for Paper-making Process Reconstituted Tobacco in Presence of Enzyme Mixture [J]. Tobacco Science & Technology, 2011, (7): 33-36. (in Chinese)
[3] 李琳,韦杰,王豹祥,等. 复合酶处理废次烟末制备烟草浸膏[J]. 湖北农业科学,2012,51(9):1803-1807.Li Lin, Wei Jie, Wang Baoxiang, et al. Preparation of Tobacco Wastes Extracts with Complex Enzymes [J].Hubei Agricultural Sciences, 2012, 51 (9): 1803-1807. (in Chinese)
[4] 隋颖,张立平. 功能化磁性纳米颗粒固定化脂肪酶研究[J]. 应用化工,2013,42(11):1978-1980.Sui Ying, Zhang Liping. Study on Lipase Immobilization on Functional Magnetic Nanoparticles [J]. Applied chemical industry, 2013, 42 (11): 1978-1980. (in Chinese)
[5] 丁文武,孙铭珍,曹汝毅,等. 纳米磁性微粒固定化脂肪氧合酶的制备及其酶活研究[J]. 粮油食品科技,2015,23(2):79-82.Ding Wenwu, Sun Mingzhen, Cao Ruyi, et al. Preparation of Magnetic Nanoparticles Immobilized Lipoxygenase and its Activity [J]. Science and Technology of Cereals; Oils and Foods, 2015, 23 (2): 79-82. (in Chinese)
[6] 陈陶声,居乃琥,陈石根,等. 固定化酶理论与应用[M].北京:轻工业出版社,1987:98-102.Chen Taosheng, Ju Naihu, Chen Shigen, et al. Theory and Application of Immobilized Enzyme [M]. Bei Jing: China Light Industry Press, 1987: 98-102. (in Chinese)
[7] 陈明洁,张汉昌,关志荣. 化学共沉淀法制备Fe3O4纳米颗粒的结构和磁性能研究[J]. 材料导报:纳米与新材料专辑,2008(3):94-96.Chen Mingjie, Zhang Hanchang, Guan Zhirong. Research on Structural and Magnetic Features of Fe3O4Nanoparticles Synthesized by Chemical Co-precipitation Method [J].Materials Review: Nano and New Materials, 2008 (3): 94-96. (in Chinese)
[8] Xu L, Kim M J, Kim K D, et al. Surface modified Fe3O4nanoparticles as a protein delivery vehicle [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2009, 350 (1) : 8-12.
[9] 胡玮,娄兆文. 四氧化三铁磁性纳米微粒表面的氨基化修饰[J]. 化学研究,2013(2):144-148.Hu Wei, Lou Zhaowen. Amination Surface-Modification of Ferriferous Oxide Magnetic Nanoparticles [J]. Chemical Research, 2013 (2): 144-148. (in Chinese)
[10] 阮贵华,刘玉花,陈正毅,等. Fe3O4磁性纳米粒子固定化胰蛋白酶[J]. 桂林理工大学学报,2013,35(4):569-574.Ruan Guihua, Liu Yuhua, Chen Zhengyi, et al. Tryptase immobilized by Fe3O4magnetic nanoparticles [J]. Journal of Guilin University of Technology, 2013, 35 (4): 569-574.(in Chinese)
[11] 安丽娟,李兆强,徐娓,等. 超顺磁性高分子微球的制备与表征[J]. 高等学校化学学报,2005,26(2):366-369.An Lijuan, Li Zhaoqiang, Xu Wei, et al. Preparation and Characterization of Superparamagnetism Polymer Microsphere [J]. Chemical Journal of Chinese Universities,2005, 26 (2): 366-369. (in Chinese)
[12] 周正红,贾宗剑. 利用 DNS 定糖法快速测定烟草中水溶性总糖的研究[J]. 烟草科技,1998,(1):26-29.Zhou Zhenghong, Jia Zongjian. Study on Rapid Mesuring Soluble Sugar by DNS Method [J]. Tobacco Science &Technology, 1998, (1): 26-29. (in Chinese)
[13] 刘耀飞,常纪恒,于川芳. 烟梗中果胶的酶法降解[J].烟草科技,2013,(8):40-44.Liu Yaofei, Chang Jiheng, Yu Chuanfang. Enzymatic Degradation of Pectin in Tobacco Stem [J]. Tobacco Science& Technology, 2013, (8): 40-44. (in Chinese)
[14] NY 82.11—1988,果汁测定方法果胶的测定[s].NY 82.11—1988, The determination of pectin in fruit juice[s]. (in Chinese)
[15] 史玮,孙莹,徐振斌. 凯氏定氮法测定粮食蛋白质含量方法研究[J]. 粮食科技与经济,2013,38(5):31-32.Shi Wei, Sun Ying, Xu Zhenbin. Study of Protein Content Detection of Grain Using Kjeldahl Determination Method[J]. Grain Science and Technology and Economy, 2013, 38(5): 31-32. (in Chinese)
[16] 章平泉,金殿明,杜秀敏,等. 自动凯氏定氮仪测定烟草及其制品中的总氮[J]. 烟草科技,2011,(3):43-45.Zhang Pingquan, Jin Dianming, Du Xiumin, et al.Determination of Total Nitrogen in Tobacco Products by Automatic Kjekdahl Nitrogen Analyzer [J]. Tobacco Science & Technology, 2011, (3): 43-45. (in Chinese)
[17] 冯斌,任志强,屈晶苗,等. 3-氨丙基三乙氧基硅烷表面修饰的磁性 Fe3O4纳米粒子合成与表征[J]. 化工新型材料,2009,36(12):26-29.Feng Bin, Ren Zhiqiang, Qu Jingmiao, et al. Preparation and Characterization of (3-Aminapropyl) Triethoxysilane Coated Magnetite Nanoparticles [J]. New Chemical Materials, 2009, 36 (12): 26-29. (in Chinese)
[18] 李杨,江连洲,李丹丹,等. 氨基硅烷修饰的磁纳米粒子固定化碱性蛋白酶[J]. 食品科学,2012,33(9):202-205.Li Yang, Jiang Lianzhou, Li Dandan, et al. Immobilization of Alkaline Protease with Magnetic Nanoparticles Modi fi ed by Amino-Silane [J]. Food Science, 2012, 33 (9): 202-205.(in Chinese)
[19] 杨可可,杨婉身,王显祥,等. 硅烷化氨基磁性粒子的制备及其固定化木瓜蛋白酶的研究[J]. 四川农业大学学报,2008,26(2):135-140.Yang Keke, Yang Wanshen, Wang Xianxiang, et al.Preparation of Amino Group Coated Magnetic Microspheres by Silanization and its Study on Immobilizing Papain [J].Journal of Sichuan Agricultural University, 2008, 26 (2):135-140. (in Chinese)
[20] 沈昊宇,赵永纲,胡美琴,等. 高分子聚羧酸-纳米Fe3O4磁性复合颗粒的制备及其对水中对羟基苯甲酸酯类化合物的吸附作用[J]. 复合材料学报,2009,26(4):68-73.Shen Haoyu, Zhao Yonggang, Hu Meiqin, et al. Preparation and Adsorption Properties of Polycarboxylate Nano-Fe3O4Magnetic Composite Particles [J]. Acta Materiae Compositae Sinica, 2009, 26 (4): 68-73. (in Chinese)
Pectinase immobilized by aminosilanized magnetic nanoparticles for improving quality of tobacco extract
YAN Keliang1, CHEN Hong2, WANG Wenfeng2, HU Weiyao1, LING Jun1, CHEN Wei1, YU Hongbo2
1 Technology Center, China Tobacco Yunnan Industrial Co., Ltd, Kunming 650231, China;2 College of Life Science and Technology, Huazhong University of Science and Technology, Wuhan 430074, China
Immobilized pectinase was used for the fi rst time to deal with tobacco extract so as to reduce adverse constituents in tobacco extract. Di ff erent conditions that can a ff ect concentration of pectin and protein in tobacco extract have been studied. Application veri fi cation of tobacco extracts which have been treated with immobilized pectinase has been done. Results showed that immobilized pectinase had a protein recovery rate of 44.44 % and a catalytic activity recovery rate of 40.86 %. The optimized condition for immobilized pectinase was as below: temperature 50 ℃, the pH 3.5, enzyme activity 4.44 U/mL and enzymolysis time 24 h. After treated by immobilized pectinase,the pectin hydrolysis rate of tobacco extract was 84.04 % (leaf) and 39.26 % (stem), and the immobilized pectinase could be removed from tobacco extract under the power of magnetic force. Reconstituted tobacco made by tobacco extract which had been treated by immobilized pectinase had better taste than reconstituted tobacco made by tobacco extract which had no treatment. Pectin concentration of tobacco extract can be obviously reduced after being treated by pectinase immobilized by amino-silanized magnetic nanoparticles. Immobilized pectinase can be removed, thus improving and the quality of tobacco extract.
tobacco extract; amino-silanized magnetic nanoparticles; immobilized pectinase; reducing sugars; hydrolysis of pectin
颜克亮,陈虹,王文峰,等. 氨基硅烷化磁纳米颗粒固定化果胶酶改善烟草浸膏品质[J]. 中国烟草学报,2016,22(2)
云南中烟科技项目(No. 2013FL04)
颜克亮(1981—),博士,工程师,主要从事烟草相关技术及产品研发工作,Email:unclelia@163.com
余洪波(1977—), Email:yuhongbo@hust.edu.cn
2015-07-21
: YAN Keliang, CHEN Hong, WANG Wenfeng, et al. Pectinase immobilized by aminosilanized magnetic nanoparticles for improving quality of tobacco extract [J]. Acta Tabacaria Sinica, 2016, 22(2)

