沙丁胺醇免疫层析试纸条的应用研究
刘冰,王玲玲,童贝,冯久慧,生威,张燕,王硕
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
沙丁胺醇免疫层析试纸条的应用研究
刘冰,王玲玲,童贝,冯久慧,生威,张燕,王硕*
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
用胶体金和纳米金-聚苯胺-纳米金微球(GPG)分别标记制备的沙丁胺醇多克隆抗体,喷涂在玻璃纤维垫上,将包被抗原和羊抗兔二抗分别固定到硝酸纤维素膜上作为检测线(T-Line)和质控线(C-Line),干燥后组装试纸条,建立免疫层析分析方法。考查检测试纸条的灵敏度和稳定性,并应用于动物源性食品(猪肉、牛肉、羊肉和猪肝)中沙丁胺醇残留的可视化检测。实验结果可以看出,沙丁胺醇胶体金标记免疫层析分析方法的样品检出限为5μg/L,沙丁胺醇GPG标记免疫层析分析方法的样品检出限为10μg/L。
沙丁胺醇;胶体金;纳米金-聚苯胺-纳米金微球;免疫层析试纸条
沙丁胺醇(Salbutamol,SAL),又名咳喘宁、舒喘宁、索布胺等,是β-肾上腺素受体激动剂的一种,临床上最初被用于治疗和预防呼吸系统疾病和支气管哮喘[1-2]。将沙丁胺醇作为生长促进剂饲喂动物,会导致部分药物残留在动物体内。沙丁胺醇对于患有心脑血管疾病的人危害较大,对于糖尿病患者,容易导致乳酸中毒。研究表明,沙丁胺醇会损害母猪的生殖系统[3-4]。我国禁止将沙丁胺醇及其盐、酯应用于所有食用动物中[5]。欧盟(European Union)禁止沙丁胺醇等β-兴奋剂的所有用途[6]。
目前关于动物组织中沙丁胺醇的检测方法比较多,胶体金免疫层析技术在沙丁胺醇残留快速检测方面得到了广泛应用[7-9]。曾红惠等[7]建立了HPLC法同时检测肉制品中的沙丁胺醇、克伦特罗和莱克多巴胺。Degroodt JM等[8]建立了免疫亲和层析(IAC)-高效液相色谱法检测肝脏中的沙丁胺醇残留。试验采用0.01mol/L的盐酸提取样品,经IAC法对提取液进行净化。得到SAL的定量限为1μg/kg,建立的标注曲线在0.2 ng/mL~10 ng/mL范围内线性良好,回收率为67%~80%。Ventura R等[9]建立了超高效液相色谱/串联质谱法对尿液中的沙丁胺醇进行直接定量检测。吴巧丽等[10]采用GICA方法检测动物组织和饲料中的沙丁胺醇残留。采用金增强技术,金颗粒聚集的越多,检测信号就越强。在酸性介质中,采用氯金酸水溶液氧化苯胺,使苯胺单体发生氧化聚合,氯金酸被还原成胶体金,包埋在聚苯胺中,形成纳米金-聚苯胺复合物。再向聚合物中添加粒径为20 nm左右的胶体金溶液,通过物理吸附形成纳米金-聚苯胺-纳米金微球(GPG)。该材料被Cui YL等[11]应用于电化学免疫传感器中检测促甲状腺激素。材料具有良好的电化学性能和较大的表面积,能结合更多的HRP标记二抗,从而提高信号强度。对促甲状腺激素的检出限为0.005μIU/mL。试验以沙丁胺醇作为目标物,比较胶体金和GPG标记材料所建立的免疫层析分析方法。
1 材料与方法
1.1材料与仪器
沙丁胺醇抗血清:天津科技大学食品营养与安全重点实验室自制;沙丁胺醇(SAL)玛雅试剂;羊抗兔二抗、氯金酸、柠檬酸三钠、牛血清白蛋白(OVA)、盐酸克伦特罗(CL)、异丙肾上腺素(ISOP)、莱克多巴胺(RAC)、特布他林(TER)均购自美国Sigma公司;硝酸纤维素膜(135NC膜)购自美国Millipore公司;样品垫、结合垫、吸水纸以及PVC底板均购自上海金标科技有限公司;猪肉、牛肉、羊肉、猪肝均购自天津某超市。
蛋白纯化仪:美国BIO-RAD公司;紫外分光光度计:美国Varian公司;透射电子显微镜:日本电子光学公司;真空干燥箱:天津三水仪器有限公司;双维往复划膜仪、全自动斩切机:上海金标生物科技有限公司。
1.2方法
1.2.1沙丁胺醇包被抗原的制备
1.2.1.1沙丁胺醇半抗原的制备
准确称取沙丁胺醇200mg(0.836mmol),置于100mL圆底烧瓶中,加入12mL无水乙醇(使用前经过脱水处理)超声处理使其完全溶解。称取200mg(2.00mmol)丁二酸酐,在磁力搅拌条件下加入到上述溶液中,室温反应3 h~4 h,反应结束后,将反应液旋干,将附着于烧杯内壁上的固体刮下,用无水乙醇洗涤3次,过滤收集固体,真空干燥除去溶剂,盛装于棕色瓶中,4℃冰箱保存备用[12]。
1.2.1.2沙丁胺醇包被抗原的制备
采用碳二亚胺法(EDC法)制备包被原。准确称取沙丁胺醇丁二酸衍生物5mg(0.015mmol),1-(3-二甲氨基丙基)-3-乙基碳二亚胺(0.022mmol)4.2mg,用0.5mL 130mmol/L碳酸氢钠缓冲液溶解,室温下搅拌活化30min,此反应液命名为A液。准确称取10mg卵清蛋白(OVA),用2mL碳酸氢钠缓冲液(130mmol/L)溶解,在缓慢搅拌条件下,吸取A液300μL加入到蛋白溶液中(每2min加5μL,冰浴降温),置于4℃冰箱中搅拌过夜。将反应所得的偶联物装入透析袋中,4℃条件下用磷酸缓冲液(PB)透析3 d,取出分装,每1mL加入5μL 10%叠氮钠,4℃冰箱保存备用。
1.2.2沙丁胺醇多克隆抗体的纯化
采用ProteinA-sephoarse 4B亲合层析柱对沙丁胺醇抗血清进行纯化处理,在4℃条件下采用PB缓冲液透析3 d,可以得到接近分析纯的抗体。
1.2.3标记材料的制备
1.2.3.1胶体金的制备
采用柠檬酸三钠还原法制备胶体金。向制备胶体金的锥形瓶中加入足量的双蒸水,于恒温加热磁力搅拌器上加热至沸腾,约1min后,倒掉沸水。量取100mL双蒸水倒入锥形瓶,用记号笔标记水位,去除1mL水,加入1mL 1%的氯金酸溶液,混匀后加热至沸腾。在搅拌条件下迅速向溶液中加入2.25mL 1%的柠檬酸三钠溶液。计时约2min内,溶液颜色发生变化,最终呈现稳定的酒红色。继续煮沸15min,冷却至室温,加入双蒸水定容至100mL,转移到蓝盖瓶中,于4℃避光保存[15]。观察所制备的胶体金溶液的颜色、透明度、分散状态、有无沉淀等,以初步判定胶体金的质量。利用透射电镜对胶体金颗粒的超微结构进行扫描,观察胶体金的粒径大小、粒径分布是否均匀等[13-14]。
1.2.3.2GPG的制备及质量鉴定
配制含有0.01mol/L和0.1mol/L苯胺的盐酸溶液。比较苯胺的含量对反应的影响。分别取10mL含0.01mol/L和0.1mol/L苯胺的HCl溶液于25mL圆底烧瓶中,在磁力搅拌条件下加入3mL,1mmol/LHAuCl4水溶液,室温条件下反应40min(充入N2保护,避光反应)。将反应液离心,收集沉淀(15 000 r/min,30min),加入3mL水复溶,沉淀洗涤3次。最终将沉淀重悬于1mL水中。将溶液移至小玻璃瓶内,逐滴加入3mL胶体金溶液,室温下轻轻振摇过夜(冲入N2保护,避光反应)。离心收集GPG(15000 r/min,30min),用1mL水重悬,于4℃冰箱内保存备用。直接观察所制备的纳米金-聚苯胺-纳米金微球(GPG)的颜色、透明度和分散状态,以初步判定GPG的质量。利用透射电子显微镜对GPG颗粒的结构进行扫描,观察颗粒的粒径大小以及分布状态等[15]。
1.2.4标记抗体方法的确定
1.2.4.1胶体金标记抗体
取1mL胶体金于离心管中,用K2CO3调节pH值为9,加入20μL抗体,混匀后,于4℃静置1 h。每管加入20μL20%的BSA溶液和10μL20%的PEG-20000溶液,室温静置20min。将静置后的溶液于4℃,2000 r/min条件下离心15min,保留上清液,除去标记过程中形成的聚合物。接下来将上清液于4℃,10 000 r/min条件下离心30min,保留沉淀,未标记的抗体及金粒子存在于上清中。将沉淀用金标工作液稀释适当倍数,4℃冰箱保存[16]。
1.2.4.2GPG标记抗体
取1mLGPG溶液,冰浴超声5min,用0.2mol/L的K2CO3溶液调节pH为8,混匀后加入20μLSAL抗体,快速混匀,置于4℃冰箱内静置过夜(14 h~16 h)。每毫升加入20μL 20%的BSA溶液和10μL 20%的PEG-20000溶液,混匀后室温静置20min。在11 063 r/min,4℃条件下离心20min,保留沉淀,弃去上清。沉淀用金标抗体稀释液稀释。
用标品稀释液配制一系列浓度的沙丁胺醇标准品溶液:1、2、5、10μg/L,取100μL标准品溶液用于试纸条上样,观察试纸条显色情况,以检测线颜色与空白对照检测线颜色有明显差别时的最低标准品浓度作为试纸条检出限。
1.2.6试纸条特异性的确定
本试验选取与沙丁胺醇结构类似的五种β-兴奋剂类兽药:盐酸克伦特罗(CLB)、异丙肾上腺素(ISOP)、特布他林(TER)、莱克多巴胺(RAC)和多巴酚丁胺(DOB),用建立的胶体金标记免疫层析试纸条方法进行检测,以确定所建立的试纸条检测方法的特异性。
1.2.7试纸条实际样品的检测
1.2.7.1样品基质处理方法
本实验选取市售的猪肉、牛肉、羊肉和猪肝作为实际样品,具体基质处理方法如下:取1 g均质后的样品于50mL离心管中,加入1mL 0.1mol/L的盐酸溶液,超声15min,再加入4mLPBS缓冲液,高速混旋3min,于6 137 r/min,10℃条件下离心10min,吸取上清液,用1mol/L氢氧化钠溶液将pH值调至中性(若有沉淀,在6 861 r/min,10℃条件下离心10min),取上清液直接用于试纸条检测。
1.2.7.2样品添加回收试验
661 Prevalence of skin diseases among marine-training soldiers stationed in east coastal area and its influencing factors
样品猪肉、牛肉、羊肉、猪肝经试剂盒验证沙丁胺醇含量低于试剂盒检出限,作为空白基质进行添加回收实验。猪肉、牛肉、羊肉、猪肝4种阴性样品中分别添加0、5、10、50μg/kg的沙丁胺醇标准品,按照上述基质处理方法处理后进行实验,观察回收结果。
2 结果与讨论
2.1标记材料的质量鉴定
制备出的胶体金溶液为酒红色,肉眼可见溶液澄清透明,状态稳定,表面无悬浮杂质,溶液底部无聚沉颗粒,初步说明制备的胶体金质量良好。利用透射电子显微镜对胶体金颗粒的超微结构进行扫描,结果见图1。
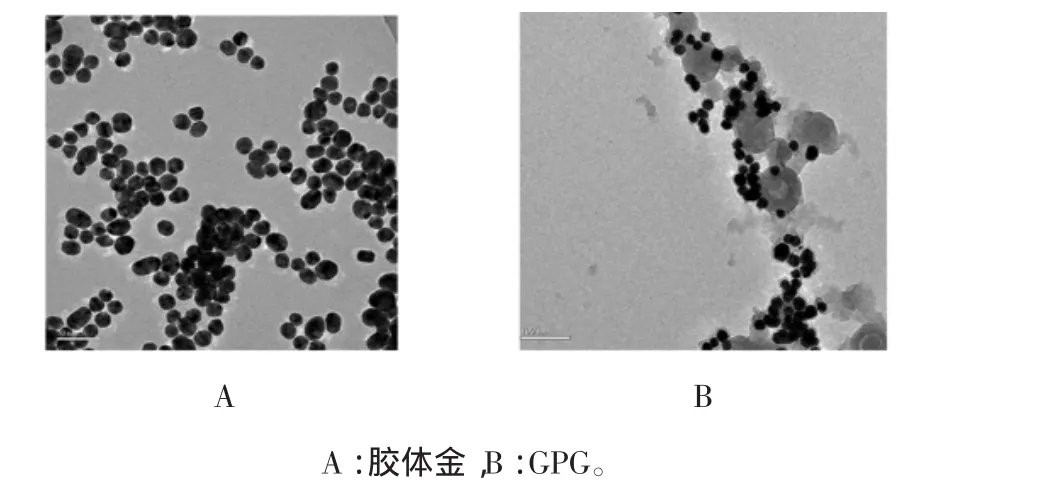
图1 标记材料的透射电镜扫描图Fig.1 Transm ission electronm icroscopy(TEM)of labelled materials
从图中可以看出,胶体金粒径平均粒径在18 nm左右,与理论值相符。胶体金颗粒呈现球形,粒径均一。目视该GPG材料为黑色溶液,状态较为均一,静置一周后出现沉淀,但是摇匀后仍呈现均一状态,不影响使用。从其透射电镜扫描图可见胶体金颗粒吸附在聚苯胺表面。
2.2试纸条检出限的确定
配制一系列浓度的沙丁胺醇标准品溶液,采用优化出的最佳条件组装试纸条,随着标准品浓度的升高,试纸条检测线颜色逐渐变浅直至消线。标准品浓度依次是0、1、2、5、10μg/L,胶体金标记抗体的试纸条结果如图2所示。

图2 沙丁胺醇胶体金试纸条检出限的确定Fig.2 The detection lim itof colloidalgold strips for SAL
当标准品中沙丁胺醇的浓度为2μg/L时,胶体金试纸条检测线明显比阴性对照浅,当标准品中沙丁胺醇的浓度达到10μg/L时,试纸条检测线消失。经过多次重复实验,定义采用铺垫组装方式建立的胶体金标记免疫层析试纸条的目视检出限为2μg/L。标准品浓度依次是0、2、5、10、20μg/L,胶体金及GPG标记抗体的试纸条结果如图3所示。

图3 沙丁胺醇GPG试纸条检出限的确定Fig.3 The detection lim itof GPG strips for SAL
当沙丁胺醇标准品浓度为5μg/L时,GPG试纸条检测线与空白对照检测线颜色有明显差别,当沙丁胺醇标准品浓度为10μg/L时,试纸条检测线消线。经过多次重复试验,定义GPG标记免疫层析试纸条的目视检出限为5μg/L。
2.3试纸条特异性的确定
选择了5种与沙丁胺醇结构类似的β-兴奋剂类兽药(克伦特罗、特布他林、异丙肾上腺素、莱克多巴胺、多巴酚丁胺)进行交叉反应实验。当克伦特罗的浓度为10μg/L时,试纸条检测线消失,说明该抗体与克伦特罗交叉反应明显,可同时用于克伦特罗的检测。当特布他林的浓度为200μg/L时,试纸条检测线消失,说明该抗体与特布他林存在交叉反应。对于其他三种β-兴奋剂和八种常见兽药,当其浓度达到1000μg/L时,试纸条的检测线与质控线颜色依然一致,说明该抗体与其他3种β-兴奋剂类兽药和八种常见兽药基本无交叉反应。
2.4试纸条实际样品的检测
向猪肉、牛肉、羊肉、猪肝4种阴性样品中分别添加沙丁胺醇标准品,用HCl/PBST进行提取和稀释即可消除基质影响。对于胶体金标记的试纸条,标准品添加浓度依次是0、5、10、50μg/L,4种样品的试纸条结果如图4所示。


图4 4种样品的添加回收试验结果Fig.4 The recovery experiments resultof four spiked samples
样品当添加浓度为5μg/L时,试纸条检测线颜色与空白对照检测线颜色有明显差别,检测线颜色随着沙丁胺醇添加浓度的增大而逐渐变浅,说明样品提取方法有效。经过多次重复实验,最终确定所建立的胶体金标记免疫层析试纸条方法在实际样品中的检出限为5μg/L。对于GPG标记的试纸条,标准品添加浓度依次是0、10、25、50μg/L,4种样品的试纸条结果如图5所示。

图5 4种样品的添加回收试验结果Fig.5 The recovery experiments resultof four spiked sam ples
经过多次试验,GPG标记免疫层析试纸条方法在实际样品中的检出限为10μg/L。
3 结论
总而言之,论文选取胶体金和GPG两种材料进行抗体标记,优化建立免疫层析试纸条方法,并用于动物源性食品中沙丁胺醇残留的检测。实验数据得出,胶体金标记免疫层析试纸条方法检出限为2.0μg/L,样品检出限为5μg/L,检测时间为5min;GPG标记免疫层析分析方法检出限为5.0μg/L,样品检出限为10μg/L,检测时间为5min。通过比较发现:传统的胶体金在实验体系中灵敏度较高。GPG标记抗体方法和用量与胶体金一样,但最后GPG标记抗体最佳稀释倍数是6倍稀释,胶体金是4倍稀释,相比较而言,GPG标记比胶体金节约抗体。目前免疫胶体金技术发展很快,也相当成熟,实验结果采用胶体金作为标记物灵敏度略高,而GPG纳米材料,批间差异小,稳定性优于胶体金。在今后的研究中,可以尝试将胶体金与GPG复配使用,标记不同的抗体。胶体金在硝酸纤维素膜上呈现红色条带,GPG在硝酸纤维素膜上呈现黑色条带,用于多残留检测时,由于检测线颜色不同,可以更加直观清晰地观察到检测结果,实现多元化检测。
[1]刘宣兵,庞玉芳,侯玉泽,等.沙丁胺醇的毒副作用及其残留检测[J].上海畜牧兽医通讯,2008,26(4):83-85
[2]Zhang GP,Wang XN,Yang JF,et al.Development of an immunochromatographic lateral flow test strip for detection of beta-adrenergic agonistClenbuterol residues[J].Journal of Immunological Methods,2006,312(1/2):27-33
[3]邱阳生,杨根海,何方洋.β-兴奋剂沙丁胺醇及其检测技术研究进展[J].动物医学进展,2002,23(4):50-52
[4]中华人民共和国农业部.农业部第235号公告.动物性食品中兽药最高残留限量[S].北京:中国标准出版社,2002:27
[5]Council Directive 96/22/EC.Concerning the prohibition on the use in stockfarming of certain substances having a hormonal or thyreostatic action and of beta-agonists and repealing Directives 81/602/ EEC,88/146/EECand 88/299/EEC[S].Off JEuropean Communities,1996,L125,3-9
[6]Sheu SY,Lei YC,Tai YT,et al.Screening of salbutamol residues in swinemeat and animal feed by an enzyme immunoassay in Taiwan[J].Analytica Chimica Acta,2009,654(2):148-153
[7]曾红惠,黎少映,冯耀基,等.HPLC法同时测定肉制品中沙丁胺醇、莱克多巴胺和克仑特罗[J].医学动物防制,2009,25(12):940-944
[8]Degroodt JM,Wyhowskide BB,Srebrnik S.Immunoaffinity-chromatography purication of salbutamol in liverand HPLC-fluorometric detection at trace residue level[J].Zeitschrift fur Lebensmittel-Untersuchungund-Forschung,1992,195(6):566-568
[9]Ventura R,Ramirez R,Monfort N,etal.Ultraperformance liquid chromatography tandem mass spectrometric method for direct quantification ofsalbutamol in urine samples in doping control[J].Journal of Pharmaceuticaland BiomedicalAnalysis,2009,50(5):886-890
[10]吴巧丽,叶春生.胶体金免疫层析技术快速检测沙丁胺醇残留[J].现代食品科技,2012,28(11):1595-1599
[11]Cui YL,Chen HF,Hou L,et al.Nanogold-polyaniline-nanogold microspheres-functionalizedmolecular tags for sensitive electrochemicalimmunoassayofthyroid-stimulatinghormone[J].Analytica Chimica Acta,2012,738(1):76-84
[12]Thobhani S,Attree S,Boyd R,et al.Bioconjugation and characterisation of gold colloid-labelled proteins[J].Journal of Immunological Methods,2010,356(1/2):60-69
[13]Frens G.Controlled nucleation for the regulation of the particle size inmonodispersegold suspensions[J].Nature(Physical Science),1973,241(105):20-22
[14]Shi CG,Zhao SQ,Zhang K,et al.Preparation of colloidal gold immunochromatography strip for detection ofmethamidophos residue[J].Journal of Environmental Sciences-China,2008,20(11):1392-1397
[15]徐浩,延卫,冯江涛.聚苯胺的合成与聚合机理研究进展[J].化工进展,2008,27(10):1561-1568
[16]Thobhani S,Attree S,Boyd R,et al.Bioconjugation and characterisation of gold colloid-labelled proteins[J].Journal of Immunological Methods,2010,356(1/2):60-69
Study on the Application of Immunochromatographic Test Strip for the Determ ination of Salbutamol
LIU Bing,WANG Ling-ling,TONG Bei,FENG Jiu-hui,SHENG Wei,ZHANG Yan,WANG Shuo*
(Key Laboratory of Food Nurtrition and Safety Ministry of Education ofChina,The Schoolof Food Engineering and Biotechnology of Tianjin University ofScience and Technology,Tianjin 300457,China)
Colloidal gold and nanogold-polyaniline-nanogold microspheres(GPGs)were labeled purified salbutamolpolyclonalantibodies,respectively.And then theywere spraide on glass fibermat,the coating antigen and goatanti-rabbits econdary antibody were fixed to nitrocellulose membrane as test line and control line respectively.After drying assembled teststrip,the immunochromatographic strip for the determination ofsalbutamol were deceloped.The sensitivity and stability of the test strip were studied and it was applied in the visual detection of salbutamol residued in animal food(pork,beef,lamb and liver).Itwas found that the detection limitof colloidalgold immunochromatographic teststripwere 5μg/L in samples,while the detection limitof immunochromatographic rapid teststrip labeled by GPGwere10μg/L.
salbutamol;colloidalgold;GPG;immunochromatographic teststrip
10.3969/j.issn.1005-6521.2016.18.028
质检公益性行业科研专项(201310146)
刘冰(1979—),女(汉),副教授,博士,研究方向:食品安全检测。
王硕(1969—),男,教授,研究方向:食品安全检测。
2015-11-04

