Bif-1在肝癌中的表达并缩短其生存期相关性研究
范仁根 查文章 周勇 秦呈林 单湘湘 周建平 万心强
Bif-1在肝癌中的表达并缩短其生存期相关性研究
范仁根1查文章1周勇1秦呈林1单湘湘2周建平2万心强3
目的 探讨Bif-1在肝癌组织的表达及其对于临床预后的相关性。方法 用免疫组化法研究206例肝细胞肝癌中Bif-1的表达情况。半定量测定细胞质的免疫反应。并与其他多个临床病理参数结合分析,其中包括患者的生存情况。运用χ2检验和K-M生存分析进行研究。结果 Bif-1在肝癌细胞中的表达水平高于癌旁组织。Bif-1在肝癌中表达水平的增高与组织低分化和短生存期显著相关。Bif-1的表达水平与患者的年龄、性别、肿瘤大小、包膜侵犯、HBs-Ag的表达以及门静脉侵犯无显著相关性。结论 Bif-1在肝癌中过表达。Bif-1的过表达是一个新的独立预后标志,与肿瘤的不良分化与总生存期缩短相关。
Bif-1;Beclin1;肝癌;生存期
在世界范围内,肝细胞肝癌发病率第五,在肿瘤相关死亡率中位列第三,是肝移植的主要指征[1]。因此,肝癌是人类健康的一大重要问题,预计在不久的将来与其相关的问题还会增加。尽管诊断水平和外科治疗方法近年来取得巨大进展,患者的预后仍不尽如人意,因为在切除术后或其他局部区域治疗法后,复发率较高。然而,肝癌的发展机制至今仍不明确。
Bif-1是一种保守的胞浆蛋白,包含一个羧基SH3结构域,最初是被作为Bax结合蛋白发现的[2]。Bif-1与Bcl-2家族蛋白没有显著的同源性。这一家族的蛋白与Bax蛋白相互作用,影响细胞的生存和死亡。近来,Bif-1表达的临床病理作用被认为与多种肿瘤的发展与预后相关[3]。然而,Bif-1与肝癌的临床病理关联仍不清楚。本研究的目的是用免疫组化的方法检测Bif-1在肝癌中的表达情况并探索其与预后的相关性。
1 材料与方法
1.1一般资料
选取2012年6月~2013年6月笔者所在医院收治的206例肝癌患者的临床资料,男134例,女72例,年龄50~83岁,平均(52.34±2.09)岁。所有患者均符合肝癌疾病判断标准。排除标准:严重感染者、合并严重疾病者等。
1.2方法
通过鼠抗人Bif-1单克隆抗体(CA,USA;1∶500稀释)进行免疫组化染色,切片,脱蜡用二甲苯和乙醇,3%过氧化氢溶液阻断内源性过氧化物酶(微波加热柠檬酸缓冲液为40分钟),一抗暴露于48℃过夜并用抗过氧化物酶染色试剂盒染色,标记抗原用3,3'-二氨基联苯胺盐酸盐,其后用苏木精复染。免疫组化染色为Bif-1评价经临床三个未知患者预后的病理学专家,结果得到一致共识。根据Bif-1阳性细胞百分率强度进行评估。Bif-1阳性细胞百分率强度分级如下,0级0~39%;1级:40~69%;2级>70%。免疫染色强度得分为:0,负;1,弱;2,强。此外,免疫反应评分为阳性染色细胞百分率及染色强度评分(0~4)相加得出。免疫阳性的肿瘤评分0~1被指定为“低”,肿瘤评分2~4免疫反应评分被指定为“高”。
1.3统计分析
采用SPSS 15统计软件进行统计分析,采用χ2检验确定组间变量之间的差异,采用K-M生存分析法研究分类组与生存期的相关性。P<0.05表明差异有统计学意义。
2 结果
通过免疫组化检测206例肝癌患者及其相应的癌旁组织Bif-1的表达情况。在正常肝组织和癌组织中,可以观察到Bif-1在癌细胞的细胞质染色,而细胞核不染色。免疫组化结果如图1所示。106例肿瘤组织为Bif-1高表达组(51.5%),其余100个肿瘤组织为Bif-1低表达组(48.5%)。Bif-1在癌组织和癌旁组织的表达率分别为51.5%和33.0%,差异有统计学意义(P<0.01)。

图1 Bif-1 在肝癌及癌旁组织的表达
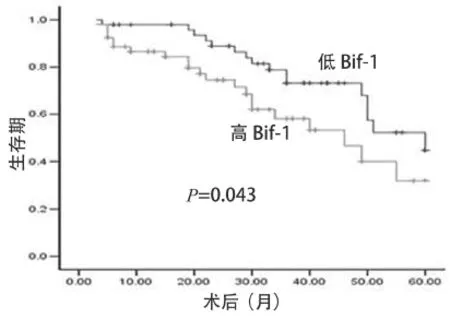
图2 Bif-1在肝癌术后组织中的表达与总体生存率的相关性
结果提示患者Bif-1的表达情况与患者的细胞病理分级及预后有一定相关性,而与患者性别、年龄,肿瘤大小、内膜损伤、乙肝表面抗原的表达、门静脉浸润无关。
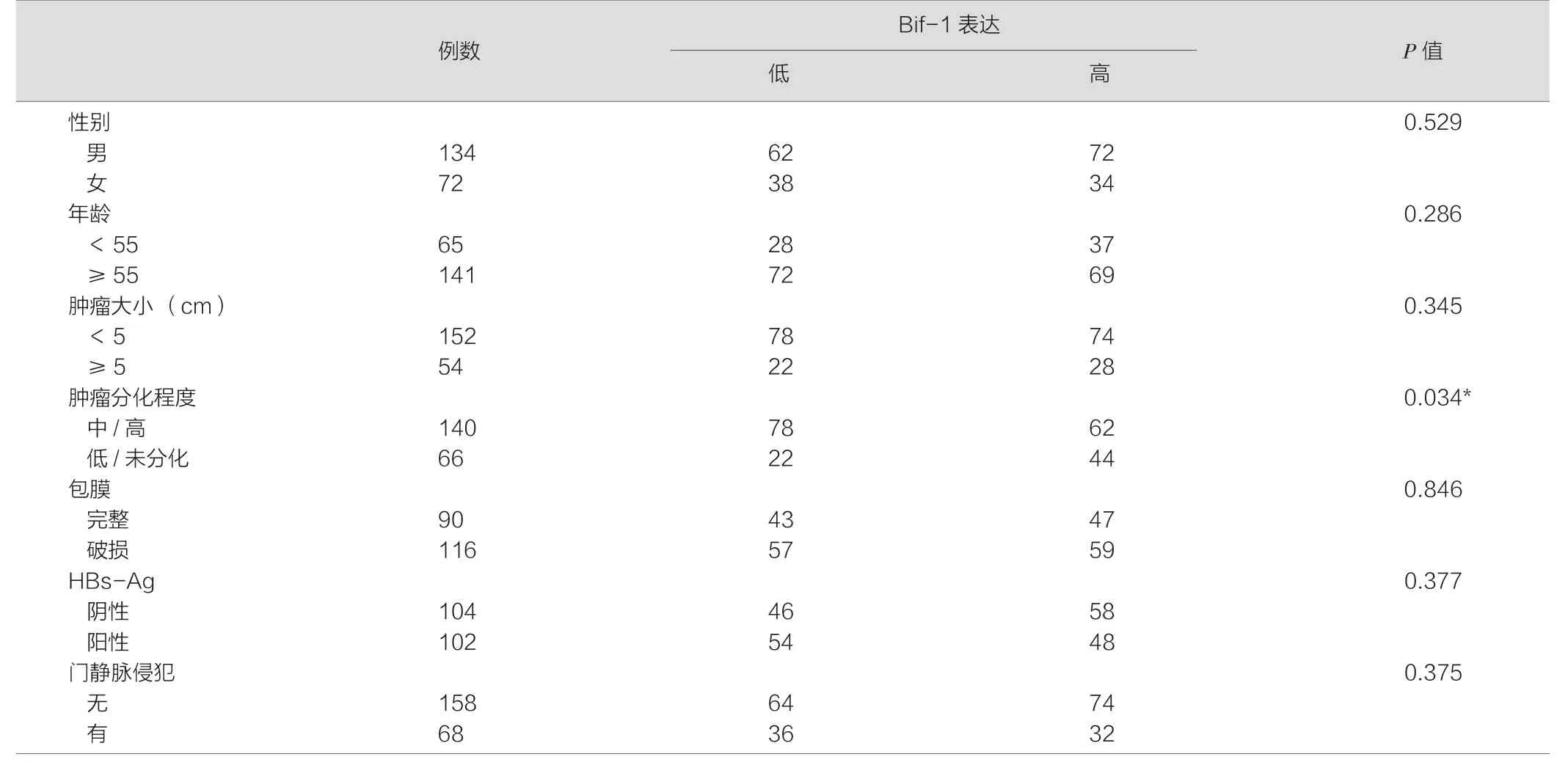
表1 Bif-1在肝癌组织中的表达与临床病理参数之间的相关性
实验中,我们研究了Bif-1在肝癌组织中的表达与生存周期的相关性,单因素分析结果提示Bif-1与肝癌的预后密切相关,Bif-1阳性高表达的患者与低表达的患者生存周期明显不同,差异有统计学意义(对数秩检验值=4.096,P=0.043;图2)。高表达组的平均生存期为(40.0±2.5)个月,而低表达组为(49.0±3.5)个月。这表明,Bif-1表达水平是肝癌患者总体生存率的独立预后因素。
3 讨论
本研究中,我们用免疫组化法检测了Bif-1在肝癌中的表达情况,与癌旁组织相比,Bif-1在肝癌组织细胞中高表达。Bif-1可通过UVRAG与Bec lin1作用来调节PI3KC3的活性以及在哺乳动物细胞中的自我吞噬效应。既往研究表明,Bif-1表达下调明显抑制PI3KC3的活性以及自噬小体在人宫颈癌细胞和老鼠成纤维细胞的形成[4]。另外,研究发现Bif-1 与Atg9阳性囊泡可共同局部化[5]。这些囊泡的形成与转运是吞噬过程中自噬小体膜起源和膨胀的必要条件。自我吞噬是一种进化上高度保守的代谢途径,可降解细胞大分子和器官细胞[6]。自我吞噬与细胞程序性死亡密切相关,已经受到了众多学者的关注。
自噬死亡消除了机体损坏的有害细胞,包括受化疗药物作用的肿瘤细胞。增生的肿瘤细胞的生长需要营养,然而肿瘤周围环境中含氧量和营养都显著减少。在正常乳腺组织氧气和葡萄糖中位水平分别是10 kPa与5 mmol/l,而在乳腺癌组织中则分别为4 kPa与1.5 mmol/l[7]。这一差异说明肿瘤细胞除了高糖酵解,也需要通过自我吞噬来增加能量供给。随着肿瘤的生长,癌细胞可能需要自我吞噬以在营养缺乏和低氧的环境下生存,表现为有限的血管化。自噬小体被认为存在于血管化不足和低代谢区域。另外,凋亡肿瘤组织中对自我吞噬的抑制亦可导致细胞坏死。因此,自我吞噬被认为是一个必要的生理反应,在营养缺乏的的条件下维持肿瘤细胞的活力。
实验表明,相比于高分化的肝癌组织,低分化的肝癌组织中Bif-1的表达水平更高。Bif-1表达水平增高与肝癌分级之间的关联目前尚不明确。Ogier-Denis等[8]人的研究已经证实,相比于分化良好的结肠癌细胞,未分化的克隆细胞株HT29高潜能的自噬蛋白降解明显减少,从而导致自噬活性增高。因此,我们认为低/未分化的癌细胞表现出更大的自噬活力,通过蛋白降解使得肿瘤细胞在营养受限条件下得以存活。
我们的实验结果表明,Bif-1在肝癌中是一个致癌基因而不是抑癌基因。然而,之前有研究[9]表明Bif-1在胰腺导管腺癌、大肠癌、前列腺癌、膀胱癌、胆囊癌以及胃癌中表达水平下降。这与我们在肝癌中的研究结果相悖,这一差异有待进一步研究。我们认为自我吞噬在肿瘤发生发展中发挥着种种病理生理学作用,其作用可能随着肿瘤细胞类型和肿瘤组织环境差异而发生改变[10]。
总之,本研究表明Bif-1蛋白的表达可成为肝癌预后的一个新型标志物。Bif-1过表达的肝癌患者肿瘤分级更差,生存时间更短。Bif-1的生物学作用还需要更多的研究阐明,以便于评估其在肝癌诊断与治疗中的潜在价值。
[1]朱朋飞,秦建民. 细胞自噬在原发性肝癌发生与防治中的生物学作用[J]. 中国医药科学,2015,5(4):24-28.
[2]王小刚,徐仁芳,徐海燕,等. Bif-1在肾透明细胞癌中的表达及其临床意义[J]. 临床泌尿外科杂志,2015,30(1):11-13.
[3]王铸,何霞,冯发深,等. Bif-1对前列腺癌LNCap细胞生物学行为的影响[J]. 热带医学杂志,2012,12(7):781-784.
[4]Takahashi Y,Coppo la D,M atsushita N, et al. Bif-1 interacts with Beclin 1 through UVRAG and regulates autophagy and tum origenesis[J]. Nat Cell Bio l.,2007,9(10): 1142-1151.
[5]Takahashi Y,Meyerkord CL,W ang HG. BAR gaining membranes for autophagosome formation: Regu lation of autophagy and tumorigenesis by Bif-1/Endophilin B1[J]. Autophagy,2008,4(1): 121-124.
[6]王宠,张萍,朱卫国. 细胞自噬与肿瘤发生的关系[J]. 中国生物化学与分子生物学报,2010,26(11):988-997.
[7]李丁,张鹏. 细胞自噬在肿瘤发生发展中作用的研究进展[J]. 山东医药,2015,55(45):106-108.
[8]Ogier-Denis E,Blais A,Houri JJ,et al. The emergence of a basolateral 1-deoxymannojirimycin-sensitive mannose carrier is a function of intestinal epithelial cell differentiation. Evidence for a new inhibitory effect of 1-deoxymannojirimycin on facilitative mannose transport[J]. The Journal of biological chemistry,1994,269(6):4285-4290.
[9]Florin Burada,Elena Raluca N icoli,M arius Eugen Ciurea,et al. Autophagy in colorectal cancer:An important switch from physiology to pathology[J]. W orld Journal of Gastrointestinal Oncology,2015,36(11): 271-284.
[10]李国东,吴德全,李本义. 细胞自噬在肿瘤中作用的研究进展[J].癌症,2009,28(4):445-448.
The Correlation Studies of Bif-1 Overexpressed in Hepatocellular Carcinoma and Correlates With Shortened Patient Survival Time
FAN Rengen1ZHA Wenzhang1ZHOU Yong1QIN Cheng lin1SHAN Xiangxiang2ZHOU Jianping2WAN Xinqiang31 Genera l Surgery Department, First People's Hospital of Yancheng, Yancheng Jiangsu 224000, China, 2 Department of Geriatric Medicine, First People's Hospital of Yancheng, Yancheng Jiangsu 224000, China, 3 The Department of Clinical Medicine, Nantong University Medical School, Nantong Jiangsu 226019, China
Ob jective Bif-1 and Beclin1 interact with each other andaf ect the structure of autophagy bodies in the process of autophagy. The purpose of this study is to investigate the prognostic signif cance of Bif-1 expression and its correlation with prognostic parameters in other clinical and pathological parameters. Methods Immunohistochem ical method was used to study the expression of Bif-1 in 206 cases of hepatocellular carcinoma. Sem i quantitative determ ination of the immune response in the cy top lasm. And com bined with other clinical patho logical parameters, including the patient's survival. Chi square test and K-M survival analysis were used. Resu lts The expression level of Bif-1 in hepatocellular carcinoma cells w as significantly higher than that in adjacent tissues. The higher expression level of Bif-1 in liver cancer was signif cantly associated with low dif erentiation and short survival time. The expression level of Bif-1 was not signif cantly correlated with patient's age, gender, tumor size, capsule invasion, HBs-Ag expression and portal vein invasion. Conclusion The study indicates that Bif-1 is overexpressed in hepatocellular carcinoma. Over expression of Bif-1 is a new independent prognostic marker, and tumor dif erentiation was associated with a shorter overall survival.
Beclin1, Bif-1, Liver cancer, Survival time
R 735.7
A
1674-9308(2016)29-0037-04
10.3969/j.issn.1674-9308.2016.29.021
1 江苏省盐城市第一人民医院普外科,江苏 盐城 224000;2 江苏省盐城市第一人民医院老年医学科,江苏 盐城 224000;3.南通大学医学院临床医学系,江苏 南通 226019

