鸡小肠上皮细胞分离培养及NLRP3在该细胞中的表达
陶志云,朱春红,徐文娟,姬改革,李慧芳
(江苏省家禽科学研究所,江苏 扬州 225125)
鸡小肠上皮细胞分离培养及NLRP3在该细胞中的表达
陶志云,朱春红,徐文娟,姬改革,李慧芳
(江苏省家禽科学研究所,江苏 扬州 225125)
为了探明NLRP3在鸡小肠上皮细胞中表达情况,为鸡的NLRP3基因在小肠细胞中的功能研究奠定基础。采用18胚龄的鸡胚,分离培养鸡的小肠上皮细胞(intestinal epithelial cells,IEC);采用免疫细胞化学(immunocytochemistry,ICC)和反转录PCR(RT-PCR)方法,检测NLRP3基因在鸡小肠上皮细胞中的表达。结果表明:分离培养出活性较强的IEC;ICC检测显示获得的小肠上皮细胞表面NLRP3抗原阳性,RT-PCR法可扩增出520 bp的目的片段。表明成功分离培养出鸡小肠上皮细胞,并证明鸡NLRP3在鸡小肠上皮细胞中表达。
鸡;小肠上皮细胞;NLRP3
NLRP3是近年发现的胞质型模式识别受体—NOD样受体家族的一员,研究表明,其能识别多种微生物,在机体固有免疫反应和疾病发生中具有重要作用。NLRP3炎性小体与多种感染性和免疫性疾病相关。近年研究表明,NLRP3在炎症性肠病(IBD)的发生过程中也发挥重要作用[1-3]。但这些研究对象都是哺乳动物,未见在禽类中的研究报道。鸡NLRP3基因能否识别鸡肠道微生物,发挥抗病作用尚不知晓。研究表明,NLRP3在嗜中性粒细胞、单核细胞、淋巴细胞、树突状细胞、成骨细胞、上皮细胞中均有表达[4]。但是否在鸡小肠上皮细胞中表达尚不清楚。因此,本文分离培养了鸡小肠上皮细胞,并鉴定NLRP3在小肠细胞中的表达情况,为NLRP3在禽类的研究奠定基础。
1 材料与方法
1.1试验材料试验选择18胚龄的鸡胚,鸡胚来源于国家级地方鸡种基因库(江苏)。
1.2主要试剂和仪器DMEM(Coning),DMEM/ F12(Hyclone),胰蛋白酶(Amresco),I型胶原酶(Solarbio),胎牛血清(Hyclone),CK18兔多克隆抗体(BBI),NLRP3兔多克隆抗体(BBI),猴抗兔二抗(BBI),TRNzol-A+总RNA提取试剂(Tiangen)、SYBR Green SuperReal PreMix(Tiangen)、Quant cDNA第一链合成试剂盒(Tiangen)。
二氧化碳培养箱(Memmert),生物安全柜(苏净安泰);荧光倒置显微镜(Nikon);酶标仪(Rayto),PCR仪(Eppendorf);凝胶成像系统(Tanon);高速冷冻离心机(Eppendorf)。
1.3试验方法
1.3.1鸡小肠上皮细胞的分离培养孵化至18胚龄的鸡胚去壳,用无菌镊子挑出胚胎,置于加入青、链霉素的PBS的烧杯中。在生物安全柜中,于无菌培养皿中小心剥离小肠,去除肠系膜,用PBS将小肠内腔冲洗干净,剪碎成1 mm3碎片,用DMEM重悬,按1∶1的比例加入适量0.1%Ⅰ型胶原酶消化30~40 min,加入适量FBS终止消化,反复吹打多次,然后将消化液先用50目尼龙滤膜过滤,收集滤液去除未消化完全的组织,再用300目的尼龙膜过滤去除单细胞,收集尼龙膜上的小肠隐窝细胞团于15 mL离心管中,1 000 r/min离心5 min,将细胞沉淀悬浮于培养液中,调整适当密度接种于6孔培养板或96孔板中,37℃、5%CO2培养箱内培养。
1.3.2鸡小肠上皮细胞形态学检查在倒置显微镜下观察细胞的生长状态和形态特征。
1.3.3细胞生长曲线绘制采用MTT法测定细胞的活性和生长。将小肠隐窝细胞团按1×105个/mL的密度接种于96孔细胞培养板中,分别在培养的1 d到10 d用酶联免疫测定仪测定细胞在492 nm处的光吸收值(OD)值,每天设10个复孔。
1.3.4免疫细胞化学法鉴定小肠上皮细胞和检测NLRP3的表达本试验针对上皮组织的特异性抗原成分即细胞角蛋白(CK18)进行小肠上皮细胞的鉴定。在细胞培养至6 d时,PBS洗2~3遍;用4%多聚甲醛室温下固定30 min;0.5%Triton-X100通透处理15 min,PBS洗2~3次;5%BSA封闭20 min;添加适当1抗(1∶50),室温1~2 h,PBS洗 2~3次;阴性对照添加等量PBS;加入生物素化猴抗兔IgG,室温1 h,PBS洗2~3次;荧光显微镜下观察。NLRP3在小肠上皮细胞中的表达检测方法同CK18鉴定小肠上皮细胞。
1.3.5RT-PCR法检测NLRP3的表达取小肠上皮细胞的总RNA,反逆转录成cDNA。根据Gen-Bank中的鸡NLRP3序列(KJ470775.1),采用Primer Premier 5.0软件设计引物,上游引物序列为5′-CGGCATCTGGAAGCACAAGG-3′;下游引物序列为5′-GAAACTGCCCAACACGCTCT-3′。目的片段长度520 bp,PCR反应体系总体积为20 μL,退火温度60℃,72℃延伸10 min,35个循环。扩增产物经2%琼脂糖凝胶电泳检测。
2 结果与分析
2.1鸡小肠上皮细胞的分离培养及生长情况
由图1不同时间的小肠上皮细胞图1和图2的细胞生长曲线图可见,两者结果一致,即分离培养的小肠隐窝细胞团在24 h开始生长,即贴壁并在周围辐射出少量的小肠上皮细胞,为多角形或蝌蚪形,在4~6 d,细胞快速增殖,分裂旺盛,分布均匀,数量显著增多,形成集落,呈单层“铺路石”状生长,培养7~8 d,细胞分裂开始减少,表现为细胞数量相对稳定。培养9 d以后,细胞体积发生膨大,细胞量出现减少。
2.2免疫细胞化学法鉴定鸡小肠上皮细胞本文采用上皮组织的特异性抗原成分细胞角蛋白CK18的特异性抗体-兔CK18多克隆抗体,对小肠上皮细胞进行免疫细胞化学染色,再用FITC标记的抗兔二抗与之结合,阳性细胞在荧光显微镜下可见明显绿色荧光(图3,A2)。对照组未加CK18抗体,因此荧光显微镜下未见荧光(图3,A1)。

图1 培养不同时间的小肠上皮细胞
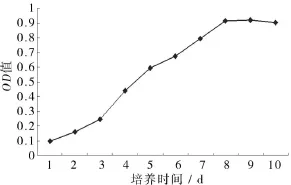
图2 鸡小肠上皮细胞生长曲线
2.3鸡小肠上皮细胞中NLRP3的表达鉴定采用兔的NLRP3多克隆一抗和带FITC荧光标记的二抗对鸡小肠上皮细胞进行免疫组化染色后,可见明显的绿色荧光(图4A),阴性对照组无绿色荧光(图4B)。采用反转录PCR法检测NLRP3基因在鸡小肠上皮细胞中的表达情况,获得条带单一、明亮的目的片段,经测序为520 bp,阴性对照管未加cDNA模板,未见目的条带(图5)。

图3 CK18鸡小肠上皮细胞鉴定
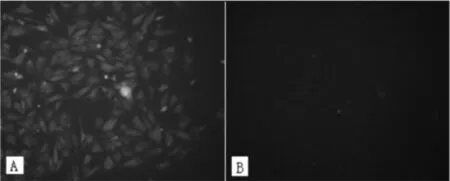
图4 NLRP3在小肠上皮细胞中的免疫细胞化学鉴定

图5 鸡NLRP3基因的部分cDNA片段凝胶电泳
3 讨论
3.1鸡小肠上皮细胞的分离培养不同的消化液对小肠上皮细胞分离效果不同,已有研究表明,采用胶原酶I消化可获得大量细胞团[5-6]。本试验采用18日龄的鸡胚,0.1%I型胶原酶消化30~40 min,在消化过程中用吸管轻轻的反复吹打组织块以利于细胞分离,也获得了大量肠隐窝细胞团,分离效果较好。酶消化后的细胞悬液中混有大量的单个细胞,需要进一步进行纯化处理。小肠隐窝细胞团的纯化方法很多,包括机械刮除法、相差消化-相差贴壁法等[7]。这两种方法均可以获得较纯的小肠上皮细胞,但比较费时和费力。Grossmann等(2003)报道了一种快速纯化IEC的方法[8]。本文在此方法的基础上进行了改进,经鉴定获得了纯度较高的小肠上皮细胞。对分离、纯化的细胞进行培养后的形态观察和细胞生长曲线绘制,结果表明,细胞在1~2 d为贴壁和缓慢生长期,3 d后生长加速并进入快速生长期,8 d后由于细胞密度较高彼此挤压生长受到抑制,增殖下降。
3.2NLRP3在小肠上皮细胞中的表达研究表明,小肠上皮细胞感染肠炎耶尔森病原体过程中,NLRP3炎性小体激活[9],表明NLRP3在识别病原菌过程中具有重要作用。我们之前的研究报道了NLRP3基因在鸡不同组织中的表达情况[10],表明NLRP3在小肠中有表达,但其在肠道识别病原菌和肠道疾病的发生发展过程中的作用尚不清楚。因此,体外分离培养小肠上皮细胞并研究NLRP3在小肠上皮细胞中的功能具有重要意义。本试验在蛋白水平和转录水平鉴定了NLRP3在小肠上皮细胞中表达,这为以后NLRP3在鸡小肠上皮细胞中的功能研究奠定了基础。
[1]Schouhz I,Verma D,Halfvarsson J,et al.Combined polymorphisms in genes encoding the inflammasome components NALP3 and CARD8 confer susceptibility to Crohn’s disease in Swedish men[J].Am J Gastroentero1,2009,104(5):1180-1188.
[2]Hirota S A,Ng J,Lueng A,et al.NLRP3 inflammasome plays a key role in the regulation of intestinal homeostasis[J].Inflamm Bowel Dis,2011,17(6):1359-1372.
[3]De la Fuente M,Franchi L,Araya D,et al.Escherichia coli isolates from inflammatory bowel diseases patients survive in macrophages and activate NLRP3 inflammasome[J].Int J Med Microbiol,2014,304(3-4):384-392.
[4]冯静静.NLRP3炎性小体在炎症性肠病中的研究进展[J].胃肠病学,2011,16(6):370-372.
[5]马玉龙,许梓荣,郭彤,等.鸡肠上皮细胞的分离及原代培养方法[J].中国兽医学报,2007,2(1):74-80.
[6]洪智敏,贾永杰,瞿明仁,等.鸡胚小肠上皮细胞的分离及原代培养研究[J].江西农业大学学报,2011,33(6):1164-1170
[7]李艳,彭春燕,梁榕旺,等.鸡小肠上皮细胞的分离培养与鉴定[J].中国畜牧兽医,2011,38(2):68-72.
[8]Grossmann J,Walther K,Attinger M,et al.Progression on isolation and short-term ex-vivo culture of highly purified non-apoptotic human intestinal epithelial cells(IEC)[J].KJCB,2003,82:262-270.
[9]Thinwa J,Segovia J A,Bose S,et al.Integrin-mediated first signal for inflammasome activation in intestinal epithelial cells[J].J Immunol,2014,193(3):1373-1382.
[10]陶志云,施祖灏,朱春红,等.清远麻鸡NLRP3基因部分cDNA序列克隆及组织表达差异研究[J].江苏农业学报,2014,30(1):140-143.
Isolation and cultureof chicken intestinal epithelial cells and theexpression of NLRP3 in thesecells
TAO Zhi-yun,ZHU Chun-hong,XU Wen-juan,JI Gai-ge,LI Hui-fang
(Jiangsu Institute of Poultry Sciences,Yangzhou 225125,China)
The aim of this study is to ascertain the expression of NLRP3 in intestinal epithelial cells(IECs)of chicken,and lay the foundation for the functional studies of chicken NLRP3 gene in IECs.Intestinal epithelial cells were isolated and cultured from chicken embryo at 18 days.The expression of chicken NLRP3 was detected by immunocytochemistry(ICC)and reverse transcription PCR(RT-PCR)method.The results showed that chicken IEC grew very well.The surface antigen of NLRP3 was positive by ICC,and the 520 bp fragments of NLRP3 gene was obtained by RT-PCR length.Chicken IECs were isolated and cultured successfully.These results indicate that chicken NLRP3 gene exists in chicken IECs.
chicken;intestinal epithelial cells;NLRP3
LI Hui-fang
S858.31
A
0529-6005(2016)04-0022-03
2014-10-14
国家自然科学基金青年基金项目(31101795,3110 1833);现代农业技术领域863计划(2011AA100301);现代农业产业技术体系(CARS-42-G03)
陶志云(1979-),女,助理研究员,博士生,主要从事动物免疫学及动物遗传育种方面的研究,E-mail:zhiyun2@126. com
李慧芳,E-mail:lhfxf-002@aliyun.com.cn

