紫草素对子宫内膜癌Ishikawa细胞雌激素信号通路表达的影响
黄彩梅 夏亦冬 胡国华
(1 上海中医药大学附属市中医医院,上海,200071; 2 上海市长宁区妇幼保健院,上海,200051)
紫草素对子宫内膜癌Ishikawa细胞雌激素信号通路表达的影响
黄彩梅1,2夏亦冬1胡国华1
(1 上海中医药大学附属市中医医院,上海,200071; 2 上海市长宁区妇幼保健院,上海,200051)
目的:观察紫草素对子宫内膜癌Ishikawa细胞雌激素信号通路表达的影响。方法:Ishikawa细胞体外培养,经1、3、5M紫草素及相应浓度紫草素中分别加入雌激素10 nM,处理细胞后,用MTT法分别检测治疗24 h、48 h、72 h后Ishikawa细胞生长抑制率;Western-blot及RT-PCR法检测雌激素信号通路ERα、CyclinD1、c-myc蛋白表达情况及ERα基因的表达情况。结果:显示随着紫草素作用浓度的增加及干预时间的延长,Ishikawa细胞抑制率明显上升;紫草素作用于子宫内膜癌Ishikawa细胞24 h后,ERα、CyclinD1、c-myc蛋白表达下降,与空白对照组比较差异有统计学意义(P<0.05),但是ERαmRNA表达无统计学意义,与空白对照组比较(P>0.05)。结论:紫草素随着浓度的增加及作用时间的延长,能够显著抑制Ishikawa细胞的增殖;紫草素通过抑制雌激素信号通路中ERα、CyclinD1、c-myc蛋白表达,起到抑制子宫内膜癌Ishikawa细胞增殖的作用。
紫草素;子宫内膜癌;雌激素信号通路;Ishikawa细胞
子宫内膜癌(Endometrial Cancer,EC)是女性常见的恶性肿瘤,其发病率呈逐年上升趋势,在发达国家,该病目前已接近新发妇科恶性肿瘤的50%[1]。根据EC的病因、病理及生物学行为,临床常将EC分为Ⅰ和Ⅱ 2种类型。其中70%~80%的散发EC属于Ⅰ型癌,为雌激素依赖型EC[2]。孕激素治疗是主要的内分泌治疗措施。但调查显示,超过30%的早期患者对孕激素不敏感或在孕激素治疗过程中产生孕激素抵抗,为子宫内膜癌患者的激素治疗带来困难[3]。紫草素是从天然紫草中提取的萘醌类化合物,有研究表明新疆紫草素能诱导生殖系肿瘤细胞凋亡,从而抑制其体外增殖[4]。另有研究表明紫草素具有抑制雌激素受体阳性乳腺癌中雌激素依赖性基因翻译的作用[5]。先前的研究表明紫草素具有通过PI3K/AKT信号通路诱导子宫内膜癌Ishikawa细胞凋亡的作用[6]。本研究进一步探索紫草素对子宫内膜癌雌激素受体阳性Ishikawa细胞增殖及雌激素信号通路的影响。
1 材料与方法
1.1细胞株雌激素受体阳性子宫内膜癌细胞株:Ishikawa细胞(丰有吉教授赠予)。
1.2试剂与试药紫草素(干燥粉末,纯度>98%,中国药品生物制品检定所),用5%二甲基亚砜(DMSO)帮助溶解,配制成浓度为1 mg/mL溶液,-20 ℃保存备用,实验时将紫草素溶液稀释到需要的浓度。DMEM培养基(GIBCO公司);胎牛血清、胰酶(Sigma公司);Cyclin D1、c-myc(cst公司);ERa(abcam公司);羊抗兔HRP标记二抗、羊抗鼠HRP标记二抗(碧云天生物有限公司);引物由英俊生物科技有限公司合成。
1.3实验仪器酶标仪(美国BIOTEK公司);倒置显微镜(Olympus公司);细胞培养箱(德国Heraeus);Western blot电泳系统、化学发光仪(Bio-Rad公司);电转仪(大连竞迈科技有限公司);实时荧光定量PCR仪(美国ABI7500型号);高速低温离心机(德国EPPENDORF公司)。
1.4实验方法
1.4.1细胞培养Ishikawa细胞株生长于含10%胎牛血清的DMEM培养基中,放置于37 ℃、5%CO2的培养箱中传代培养。
1.4.2实验分组紫草素浓度参照前期实验结果[6],将实验分为空白组(只含细胞培养液);治疗组5组:紫草素的浓度分别为(1、3、5 μM紫草素);对照组4组分别为雌二醇+紫草素(雌激素10 nM、紫草素1 μM+雌激素10 nM、紫草素3 μM+雌激素10 nM、紫草素5 μM+雌激素10 nM)。
1.4.3MTT法以每孔约5×103每孔接种到96孔培养板孔内,每组设5个平行孔,培养24 h后,细胞贴壁,细胞接近80%融合,吸弃培养液,用含0.2%小牛血清的RPMI1640培养液静止24 h,依据实验要求加药。加药后,继续分别培养24 h、48 h、72 h后每孔加入20 μL的5 mg/mL MTT溶液继续培养4 h。每孔加入二甲亚枫150 μL,轻轻震荡,10 min后在490 nm波长处用酶标仪测OD值,并计算增殖率,增殖率=(A实验-A对照)/A对照。每个浓度设5个重复孔。
1.4.4Western blot检测Ishikawa细胞株接种于培养皿中,各组加入相应终浓度紫草素或雌二醇,作用细胞24 h后,提取总蛋白。BCA蛋白定量法检测蛋白浓度,取PBS、各样品10 μL,加DW990 μL,灌胶上样,电泳分离,转PVDF膜,5%BSA封闭,一抗4 ℃孵育过夜,选择合适的二抗室温孵育60 min,显色,混合等体积化学发光剂AB液,与PVDF膜共孵育1 min;放射自显影:放入Bio-Rad化学发光仪检测结果。
1.4.5RT-PCR检测取对数生长期的Ishikawa细胞株接种于10 cm的培养皿中,加入含终浓度为0、1、3、5 μM的紫草素,作用细胞24 h后,提取总RNA。逆转录合成cDNA,进行PCR扩增,PCR反应条件为95 ℃ 30 s、95 ℃ 5 s、60 ℃ 34 s,共40个循环。GAPDH上游引物:5′-ATGGGGAAGGTGAAGGTCG-3′;下游引物:5′-GGGGTCATTGATGGCAACAATA-3′。

2 结果
2.1紫草素对Ishikawa细胞增殖的影响MTT结果显示,不同浓度的紫草素对Ishikawa细胞的增殖均有抑制作用,随着药物浓度的增加和作用时间的延长,抑制增殖的作用越明显。雌激素对Ishikawa细胞有促进增殖作用,但在含有雌激素的培养液中逐渐增加紫草素,抑制增殖的作用显著。见表1。

表1 紫草素不同浓度及作用时间对子宫内膜癌Ishikawa细胞株生长抑制作用
注:△与空白组比较P<0.05;☆与SK3UM组比较P<0.05;□与SK3UM+E10组比较P<0.05◆与24 h比较<0.01。
2.2Western blot检测雌激素信号通路相关蛋白的表达
2.2.1ERα、cyclinD1蛋白的表达分别用紫草素(1,3,5 μM)浓度组作用Ishikawa细胞,结果随着紫草素浓度的增加,ERα蛋白的表达呈下降趋势,与空白组比较,差异有统计学意义(P<0.05);与紫草素低浓度组比较有统计学意义(P<0.05);CyclinD1蛋白的表达随紫草素浓度的上升呈下降趋势,与空白组比较,差异有统计学意义(P<0.05),与紫草素低浓度组比较有统计学意义(P<0.05)。见图1、表2。
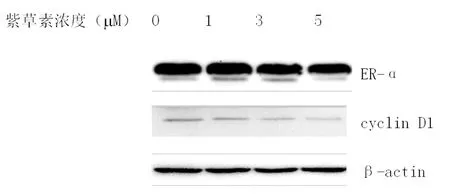
图1 不同浓度紫草素作用Ishikawa细胞24 h后,ERα及cyclinD1表达情况

组别ERαcyclinD1空白对照组1537±01423108±0577紫草素浓度组1μM1218±0710■1760±0364■3μM0960±0090■▲0750±0582■▲5μM0584±0057■▲0529±0330■▲
注:■与空白组比较P<0.05;▲与紫草素Ⅰ组比较P<0.05。
2.2.2紫草素对cyclinD1、 c-myc蛋白表达的影响Ishikawa细胞分别进行空白对照组、Ⅰ组:雌激素10 nM、Ⅱ组:SK3 μM、Ⅲ组:雌激素10 nM+SK3 μM作用后用Western blot法检测cyclinD1蛋白表达:雌激素组与空白对照组比较无差异,无统计学意义(P>0.05),单纯紫草素组及紫草素与雌激素混合组与空白组比较有统计学意义(P<0.05),单纯雌激素组与单纯紫草素组比较有统计学意义(P<0.05);单纯雌激素组与紫草素、雌激素混合组比较有统计学意义(P<0.05);雌激素对Ishikawa细胞c-myc蛋白的表达无影响,与空白对照组比较,无统计学意义(P>0.05),紫草素促进Ishikawa细胞c-myc蛋白的表达下降,与空白组比较,有统计学意义(P<0.05),雌激素加紫草素混合培养Ishikawa细胞c-myc蛋白的表达也下降,与空白对照组比较,有统计学意义(P<0.05);但与单纯紫草素组比较无统计学意义(P>0.05);与单纯雌激素组比较c-myc蛋白的表达下降有统计学意义(P<0.05)。见图2、表3。

图2 Ishikawa细胞经紫草素、雌激素或联合作用24 h后cmyc及cyclinD1表达情况

组别cmycCyclinD1空白对照组1023±02741857±0527Ⅰ组0775±01401750±0608Ⅱ组0609±0944★0881±0198★●Ⅲ组0510±0109★●0703±0138★●
注:★与空白组比较P<0.05;●与Ⅰ组比较P<0.05。
2.3RT-PCR检测紫草素对Ishikawa细胞中ERαmRNA的表达情况本实验将紫草素(1,3,5 μM)分别干预Ishikawa细胞24 h后,用RT-PCR检测发现Ishikawa细胞中ERα mRNA表达与空白对照组比较,差异无统计学意义(P>0.05)。见图3。

图3 经紫草素治疗24 h后Ishikawa细胞ERα mRNA表达情况
3 讨论
EC占女性生殖道恶性肿瘤20%~30%,其中近80%为与雌激素依赖密切相关的子宫内膜样腺癌,为Ⅰ型EC[7]。经典通路认为雌激素主要通过与细胞内雌激素受体(Estrogen Receptor,ER)结合调节子宫内膜癌发生的作用[8]。ER、PR的缺失与细胞恶性程度上升、侵袭性增加有关[9]。对于Ⅰ型EC的发生与ERα的表达密切相关[10]。有研究表明子宫内膜的慢性炎性反应,引起巨噬细胞增多,巨噬细胞分泌的炎性反应因子通过上调ERα的表达,增加雌二醇对子宫内膜癌的增殖作用[11]。
《神农本草经》记载,紫草,味苦、性寒,入心、肝经,具有清热凉血、活血、解毒透疹之功。其有效成分紫草素可通过抑制类固醇硫酸酯酶减少雌激素合成,从而抑制MCF-7细胞的生长[12]。前期研究表明紫草素有抑制子宫内膜癌生长的作用[6],紫草素诱导子宫内膜癌Ishikawa细胞凋亡,其凋亡机制可能与促进Bax表达,抑制Bcl2表达相关[13]。本研究进一步探索紫草素抑制雌激素受体阳性子宫内膜癌Ishikawa细胞的作用机制。用MMT法检测发现紫草素对Ishikawa细胞的抑制作用显著。
内、外源性雌激素对子宫内膜的长期刺激是子宫内膜癌发生的重要诱因,雌激素特定的受体ER在子宫内膜癌的发生发展中起着至关重要的作用[14]。有研究发现从正常子宫内膜到癌变的子宫内膜,随着病理分级、临床分期的增高,ER、PR含量逐渐递减,ER、PR的缺乏是子宫内膜癌恶性程度增高的表现[15]。而本研究发现随着紫草素作用时间的延长及浓度的增加,Western Blot检测显示ERα的蛋白表达下降,但是RT-PCR检测显示对ERαmRNA表达无显著差异。本研究结果与Yuan等研究紫草素具有抑制雌激素受体阳性乳腺癌ERα蛋白翻译的实验结果相一致[5]。说明紫草素通过对雌激素受体ERα的靶向作用可能抑制EC的生长,其原因有待进一步研究探索。
CyclinD1与肿瘤发生有着密切的关系,是雌激素基因组应答途径的效应蛋白之一[16]。有研究显示子宫内膜癌患者的内膜组织中CyclinD1蛋白表达明显高于正常对照组,提示CyclinD1蛋白可能成为子宫内膜癌侵袭的筛查指标[17]。本研究表明随着浓度的增加,紫草素对子宫内膜癌Ishikawa细胞CyclinD1蛋白表达有明显抑制作用,雌激素对子宫内膜癌Ishikawa细胞CyclinD1蛋白表达没有抑制作用。
作为雌激素受体靶基因之一c-Myc,是通过过表达、基因高度扩增或重排参与肿瘤的形成过程[18]。Cheng等[19]认为 c-Myc在雌激素介导的雌激素受体转录中起重要作用。有研究表明c-Myc蛋白引起的细胞周期调控异常在EC发病中为重要的分子事件[20]。雌激素对子宫内膜癌Ishikawa细胞c-Myc蛋白表达无影响,紫草素能抑制子宫内膜癌Ishikawa细胞c-Myc蛋白的表达。
综上所述,紫草素通过抑制ERα、CyclinD1、c-Myc蛋白表达,起到抑制子宫内膜癌Ishikawa细胞增殖的作用。为紫草素成为防治子宫内膜癌的基因靶向治疗药物提供实验依据。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics[J].CA Cancer J Clin,2015,65(1):5-29.
[2]张慧明,梁元姣.雌激素受体与子宫内膜癌的关系[J].江苏医药,2010,36(3):331.
[3]Hahn HS,Yoon SG,Hong JS,et al.Conservative treatment with progestin and pregnancy outcomes in endometrial cancer[J].Int J Gynecol Cancer,2009,19(6):1068-1073.
[4]王英丽,张阳,刘力华.紫草素诱导生殖系肿瘤细胞凋亡的研究[J].中国妇幼保健,2007,22(25):3585-3587.
[5]Yuan Y,Zhou Q.A novel antiestrogen agent Shikonin inhibits estrogen-dependent gene transcription in human breast cancer cells[J].Breast Cancer Research and Treatment,2010,121(1):233-240.
[6]余思云,黄彩梅,胡国华.紫草素通过PI3K/Akt信号通路诱导子宫内膜癌Ishikawa细胞凋亡[J].世界中西医结合杂志,2014,9(12):1303-1306.
[7]黄彩梅,夏亦冬,胡国华.中药治疗子宫内膜癌作用机制研究进展[J].吉林中医药,2015,35(9):971.
[8]华腾,吴婷婷,汪宏波.雌激素受体及其变异体与子宫内膜癌的关系[J].国际妇产科学杂志,2014,41(6):599.
[9]田志华,郝钢华,于艳丽,等.雌激素受体、孕激素受体、表皮生长因子受体2及增殖细胞核抗原在子宫内膜癌组织中的表达及意义[J].医学综述,2015,21(9):1697-1699.
[10]Jarzabek K1,Koda M,Walentowicz-Sadlecka M,et al.Altered expression of ERs,aromatase,and COX2 connected to estrogen action in type 1 endometrial cancer bology[J].Tumor Biology,2013,34(6):4007-4016.
[11]Ning C,Xie B,Zhang L,et al.Infiltrating macrophages induce ERα expression through an IL-17A-mediated epigenetic mechanism to sensitize endometrial cancer cells to estrogen[J].Cancer Research,2016,76(1):1354-1366.
[12]徐佳,伍春莲.紫草素药理作用研究进展[J].药物生物技术,2015,22(1):87-90.
[13]余思云,李运延,胡国华.紫草素诱导子宫内膜癌 Ishikawa 细胞凋亡及其机制的研究[J].辽宁中医杂志,2013,40(9):1931.
[14]张慧明,梁元姣,郝群,等.雌激素受体相关受体α与雌激素受体在子宫内膜癌组织中的表达[J].医学研究生学报,2010,23(2):171-174.
[15]娄雪玲,周梅玲,张占薪,等.雌激素受体、孕激素受体、C-erbB-2和Ki-67在 子宫内膜癌中的表达及其与临床病理相关性[J].中国实用妇科与产科杂志,2014,30(7):559.
[16] Li ZL,Shao SH,Jiao F,et al.Cyclin D1 regulates lung cancer invasion and metastasis[J].Sheng Li Xue Bao,2012,64(1):55-61.
[17]覃睿,梁科庆,温伟,等.VEGF和pRb2/p130、CyclinD1在子宫内膜癌中的表达及意义[J].现代肿瘤医学,2015,23(11):1578.[18]何迎春,柳景红,曹建雄,等.壮骨镇痛胶囊对乳腺癌细胞nm23-H1和c-myc基因表达的影响[J].临床肿瘤学杂志,2010,15(9):774-778.
[19]Cheng PC,Chang HK,Chen SH.Quantitative nanoproteomics for protein complexes(QNanoPX)related to estrogen transcriptional action[J].Mol Cell Proteomics,2010,9(2):209-224.
[20]莫秋荣,梁科庆,农勤高,等.子宫内膜癌中 c-Myc和 cyclin E的表达及临床意义[J].临床肿瘤学杂志,2013,18(11):989.
(2015-11-12收稿责任编辑:张文婷)
Effect of Shikonin on Endometrial Cancer Ishikawa Cells Expression of Estrogen Signal Pathway
Huang Caimei1,2,Xia Yidong1,Hu Guohua1
(1 Shanghai Municipal Hospital of Traditional Chinese Medicine,Shanghai 200071,China;2 ShanghaiChangningMaternity&InfantHealthHospital,Shanghai200051,China)
Objective:To observe the effect of shikonin on endometrial cancer Ishikawa cells expression of estrogen signal pathway.Methods:Ishikawa cells cultured in vitro,after 1,3,5 μM Shikonin and the corresponding concentrations of shikonin were added 10 nm estrogen,MTT method were used to detect Ishikawa cells growth inhibition rate after 24,48,72 hours of treatment; Western blot and RT PCR method were applied to detect estrogen signaling pathway in ER alpha,cyclin D1,c-myc protein expression and ER alpha gene expression.Results:As shikonin concentration increased and intervention time extended,Ishikawa cell inhibition rate increased significantly; After 24 hours of shikonin intervention on Ishikawa endometrial cancer cells,ER alpha,CyclinD1,c-myc protein expression decreased,and the difference between the groups had statistical significance(P<0.05).But ER mRNA expression had no statistical difference,compared with the control group(P>0.05).Conclusion:As the concentration increased and time extended,shikonin significantly inhibited the proliferation of Ishikawa cells; through inhibiting the expression of ER alpha,cyclinD1 and c-myc protein expression,it prevented the endometrial carcinoma Ishikawa cell proliferation.
Shikonin; Endometrial cancer; Estrogen signaling pathway; Ishikawa cell
上海市卫计委科研基金课题(编号:20134118);上海市卫生局进一步加快中医药事业发展三年行动计划项目“海派朱氏妇科流派传承研究”(编号:ZY3-CCCX-1-1013);上海市中医药事业发展三年行动计划项目“胡国华上海市名老中医学术经验研究工作室”(编号:ZYSNXD-CC-MZY050);上海市长宁区科委基金项目(编号:CNKW2015Y14)
黄彩梅(1981.01—),女,博士,主治医师,医师,研究方向:主攻妇科内分泌疾病中医调理,E-mail:amycmhuang@aliyun.com
胡国华(1952.12—),男,硕士,主任医师,博士研究生导师,教授,研究方向:主攻中医不孕症治疗,E-mail:hgh0083@163.com
R285.5
A doi:10.3969/j.issn.1673-7202.2016.09.051

