基于GC-MS技术的蹄叶炎奶牛血浆代谢谱分析
李亚娟,王东升,张世栋,严作廷,杨志强,杜玉兰,董书伟,何宝祥
基于GC-MS技术的蹄叶炎奶牛血浆代谢谱分析
李亚娟1,2,王东升1,张世栋1,严作廷1,杨志强1,杜玉兰2,董书伟1,何宝祥2
(1中国农业科学院兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室/甘肃省新兽药工程重点实验,兰州 730050;2广西大学动物科技学院,南宁 530005)
【目的】利用气相色谱/质谱联用技术(gas chromatograph tandem mass spectrometer technology, GC-MS)对奶牛血浆进行代谢组学分析,以明确奶牛发生蹄叶炎时血浆中代谢物的变化,进一步揭示其发病机制。【方法】根据蹄叶炎奶牛的临床症状和活动量情况,选取蹄叶炎患病组S和健康对照组C奶牛各10头,采集血浆样品,经衍生化处理后,利用GC-MS方法对两组奶牛的血浆进行全部代谢物检测。用SIMCA-P 11.5软件进行主成分分析(principal component analysis, PCA)和偏最小二乘法分析(supervised partial least squares-discriminant analysis,PLS-DA),对蹄叶炎组奶牛和健康组奶牛检测数据进行模式识别分析,筛选差异代谢物,并利用生物信息学方法进行代谢通路富集分析。为进一步验证代谢组学的试验结果,检测了与差异代谢通路相关的脂质代谢指标和抗氧化能力指标。【结果】利用GC-MS方法,在奶牛血浆中共检测到242种代谢物,通过多元统计分析结合t-检验筛选出37种差异代谢物(VIP>1,<0.05),其中在蹄叶炎奶牛血浆中3种物质含量上调(FC>1),分别是氨基氧乙酸、油酸、乳糖,34种物质含量下调(FC<1),包括脂肪酸、氨基酸等。经代谢通路富集分析,发现变化显著(<0.05)的代谢通路包括脂肪酸生物合成通路,甘氨酸/丝氨酸/苏氨酸代谢通路,不饱和脂肪酸生物合成通路,嘌呤代谢通路,甲烷代谢通路,苯丙氨酸代谢通路和氰基氨基酸代谢通路。在验证试验中,发现两组奶牛血浆中脂质代谢相关指标差异显著,且蹄叶炎患病牛血浆抗氧化能力显著低于健康牛,与代谢组学结果一致。【结论】利用GC-MS技术分析了蹄叶炎患病牛与健康奶牛血浆代谢谱的变化,发现两组间代谢物存在显著差异,并筛选出了37种差异代谢物,而这些差异分子可能成为奶牛蹄叶炎早期诊断或群体监测的潜在生物标记物。本结果全面揭示了奶牛蹄叶炎发生后血浆代谢物的代谢规律,为进一步阐明其发病机制提供理论依据。
代谢组学;蹄叶炎;气相色谱质谱联用技术;奶牛
0 引言
【研究意义】随着奶牛养殖业的发展,奶牛蹄病已成为继乳房炎和繁殖疾病之后危害奶牛健康的重要疾病,而蹄叶炎是最为常见的一种蹄病[1]。蹄叶炎是蹄壁真皮的乳头层和血管层发生的弥漫性、浆液性和无菌性炎症[2],可导致蹄变形、蹄底溃疡病及白线病等多种蹄病,引起奶牛疼痛不安,严重影响了动物福利,造成奶牛生产性能明显下降,带来了巨大的经济损失,制约了奶业的健康发展。因此,开展对奶牛蹄叶炎病因、发病机理、诊断和防治等方面的研究,对防治奶牛蹄叶炎、提高奶牛生产性能具有重要的实用价值和现实意义。【前人研究进展】有人认为奶牛蹄叶炎是机体全身代谢紊乱的局部表现,也与营养、遗传和管理等综合因素有关,还可继发于瘤胃酸中毒、乳房炎、胎衣不下、酮病和子宫内膜炎等[3-4]。如当奶牛摄入过多精料,发生瘤胃酸中毒时,瘤胃内微生物异常发酵,释放出内毒素、组胺等有害物质,随血液循环作用于蹄部,引发蹄叶炎,而乳酸、内毒素和组织胺正是引发该病的主要因素[5]。THOEFNER等[6]利用过量饲喂低聚果糖建立了奶牛急性蹄叶炎的病理模型,齐长明等[7]通过给奶牛皮下注射二磷酸组织胺后,牛蹄部出现了蹄叶炎的临床症状。因此,奶牛发生蹄叶炎时,机体的碳水化合物代谢[8]和脂质代谢[9]发生了紊乱,但其他物质的代谢是否发生了变化?这些变化在蹄叶炎的发生发展过程中是什么角色,尚无人知晓。因此,对奶牛蹄叶炎发病时体内整体代谢变化的全面了解,将有助于揭示其发病机制。【本研究切入点】代谢组学是研究生物在内外因素影响下,机体代谢轮廓变化规律的学科[10],通过代谢组学的方法,对患病和健康动物进行代谢物的全谱检测,对比分析代谢轮廓的改变,有助于认识疾病过程中体内物质代谢途径的改变[11]。因此,代谢组学已被广泛地应用于疾病的诊断[12]和生物标记物的筛选[13-14]。目前,代谢组学常用的技术平台包括核磁共振波谱法(NMR),高效液相色谱-质谱法(HPLC-MS),傅里叶变换红外光谱法(FT-IR)和气相色谱-质谱法(GC-MS)[15],其中由于GC-MS具有较高的分辨度和灵敏度以及良好的重现性而被广泛使用[16-17]。但是,关于奶牛蹄叶炎的代谢谱研究还尚未见报道。因此,对奶牛蹄叶炎发病时体内代谢变化的全面了解,将有助于了解其发病机制。【拟解决的关键问题】拟采用GC-MS技术,结合多元统计分析方法,分析健康和患蹄叶炎病牛的血浆代谢谱,旨在找出疾病过程中变化显著的内源性代谢物和代谢通路,为进一步阐明该病的发病机理提供理论依据,为早期诊断与防治蹄叶炎提供新的思路。
1 材料与方法
1.1 试验时间、地点
本试验于2014年9月至2015年5月执行,其中实验动物筛选和血样采集在甘肃省奶牛繁育中心完成,,GC-MS检测由上海博苑生物科技有限公司完成,样品处理、保存和后期的验证实验在中国农业科学院兰州畜牧与兽药研究所完成。
1.2 试剂与仪器
安捷伦7890B GC/5977A MS联用仪(Agilent,USA),配有非极性的DB-5毛细管柱(30 m×250 μm I.D.,J&W Scientific,Folsom,CA);高速低温离心机;快速离心浓缩仪;涡旋混合器。
甲氧胺盐酸吡啶溶液,N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA),三甲基氯硅烷(TMCS)均为Sigma色谱纯。冷甲醇,L-2-氯-苯丙氨酸和正己烷等试剂均为国产分析纯。牛组织胺(Histamine,His)ELISA试剂盒,购自上海桥杜生物技术公司,内毒素检测使用鲎试剂的终点显色法(Chromogenic End- point Tachypleus Amebocyte Lysate,CETAL),购自厦门市鲎试剂实验厂有限公司。血浆生化指标的测定[9]使用全自动生化分析仪(深圳迈瑞公司BS-420),抗氧化指标测定所使用的试剂盒购自南京建成生物研究所。
1.3 动物选择和分组
在甘肃省某奶牛场选择健康对照组C和蹄叶炎患病组S奶牛各10头,蹄叶炎奶牛选取标准是通过活动量检测发现近两天内活动量有显著降低的奶牛,再根据有跛行、弓背、蹄部触诊敏感和患蹄肿胀等临床症状,排除腐蹄病、蹄毛疣和趾间增生等病例,经兽医诊断为蹄叶炎且无其他疾病临床症状,近期无用药记录,经组织胺和内毒素检测[18-20]的泌乳牛10头作为患病组S。对照健康奶牛的选取标准是:肢蹄健康,无其他疾病临床症状,近期无用药记录的泌乳奶牛10头作为对照组C。并统计两组奶牛的年龄、胎次、产奶量和体况评分(body condition score,BCS),各组奶牛基本情况见表1。常规饲养管理,两组奶牛均饲喂相同的日粮、自由采食和饮水,该奶牛场生产用日粮配方为:精料10 kg、青贮15 kg、干草4 kg、脂肪350 g,其日粮营养成分含量见文献[9]。

表1 试验用奶牛的临床资料和理化指标(均值±标准差)
同行数据后所标字母相异表示差异显著(<0.05),所标字母相同表示差异不显著(>0.05)
Different letters in the same row means significant difference between the treatments (<0.05), the same letter in the same row means not significant difference between treatments (>0.05)
1.4 样品采集
在清晨饲喂前采用含有EDTA K2抗凝剂的真空采血管尾静脉采集全血8 mL,3 000×g离心15 min,将血浆分装到EP管内,-80℃冻存备用。
1.5 血浆样品的衍生化
血浆样品在室温下解冻血浆样品后取 50 μL加入150 μL冷甲醇和 10 μL内标(L-2-氯-苯丙氨酸,0.3 mg·mL-1,甲醇配制)涡旋2 min,然后超声提取10 min,再低温离心10 min(14 000 r/min,4℃)。取150 μL上清液至玻璃衍生瓶中,快速蒸干后加入80 μL甲氧胺盐酸吡啶溶液(15 mg·mL-1),涡旋震荡 2 min后,于震荡培养箱中37℃肟化反应90 min,取出后再加入80 μL BSTFA(含1%TMCS)衍生试剂和20 μL正己烷,涡旋震荡 2 min,于70℃反应60 min。室温放置30 min后,上机GC/MS分析小分子代谢物。在测定过程中,插入质控样本(QC),质控样本制备方法为取小部分所有待测样本的混合物,对测定过程进行监督。
1.6 测定条件
气相条件:载气为高纯氦气;载气流速为1.0 mL·min-1;程序升温为0—2 min至 80℃;2—12min至 80—180℃;12—24 min至 180—240℃;24—26 min至 240—280℃;26—35 min至280℃。
质谱条件:EI源温度为220℃;电压为-70V;质量扫描范围为 30—600(m/z);采集速度为20谱/秒。
1.7 代谢物鉴定
使用GC-MS联用仪对血浆样品进行检测分析,所产生的原始数据文件转换至NetCDF格式,之后采用Leco TOF软件,进行数据归一化,包括降噪,保留时间校正,峰对齐和反卷积等数据标准化分析[21]。根据GC-MS总离子流图中各峰的保留时间选取共有峰(即各图中共有的色谱峰),每个化合物的特征离子片段谱的碎片质荷比和丰度与美国国家标准与技术局化学数据库(national institute of standards and technology, NIST)、Feihn代谢组学数据库的标准离子片段谱库比对,以匹配度超过70%的检测物被认为是与之匹配的代谢物。
1.8 多元统计分析
将归一化后的数据矩阵导入SIMCA-P+11.5软件包(Umetrics,Umea,Sweden),先采用无监督的主成分分析(principal component analysis,PCA)观察各样本间的总体分布,然后用有监督的偏最小二乘判别分析(partial least squares-discriminant analysis PLS-DA)区分各组间代谢轮廓的总体差异,找到组间的差异代谢物。为防止模型过拟合,采用七次循环交互验证和200次响应排序检验的方法来考察PLS-DA模型的质量。通过PLS-DA分析,结合t-检验,变量权重值(variable important in projection, VIP)大于1且<0.05的变量被认为是差异变量。
1.9 代谢通路富集分析
使用MBRole(http://csbg.cnb.csic.es/mbrole/)并结合KEGG(Kyoto Encyclopedia of Genes and Genomes,http://www.kegg.jp/)进行代谢通路富集分析,鉴别出两组间差异显著的代谢通路,<0.05说明差异显著。
1.10 验证试验
为进一步验证GC-MS的结果,对患病组和健康组奶牛的血浆进行了相关生化指标和抗氧化能力检测,主要检测了脂质代谢的相关指标TG、TC、HDL-C和LDL-C与抗氧化能力的相关指标T-AOC、SOD、MDA和GSH-Px。
2 结果
2.1 代谢物总离子图分析与代谢物鉴定
对两组血浆样品的总离子流图(TIC图)进行可视化检查(图1),发现所有样品的仪器分析信号强、峰容量大且保留时间重现性好。通过将检测结果与NIST数据库标准质谱图对比,共鉴定出242个代谢物。为了进一步表征两组间代谢差异的特征,采用多元统计和单维统计相结合的方法获得组学特征。
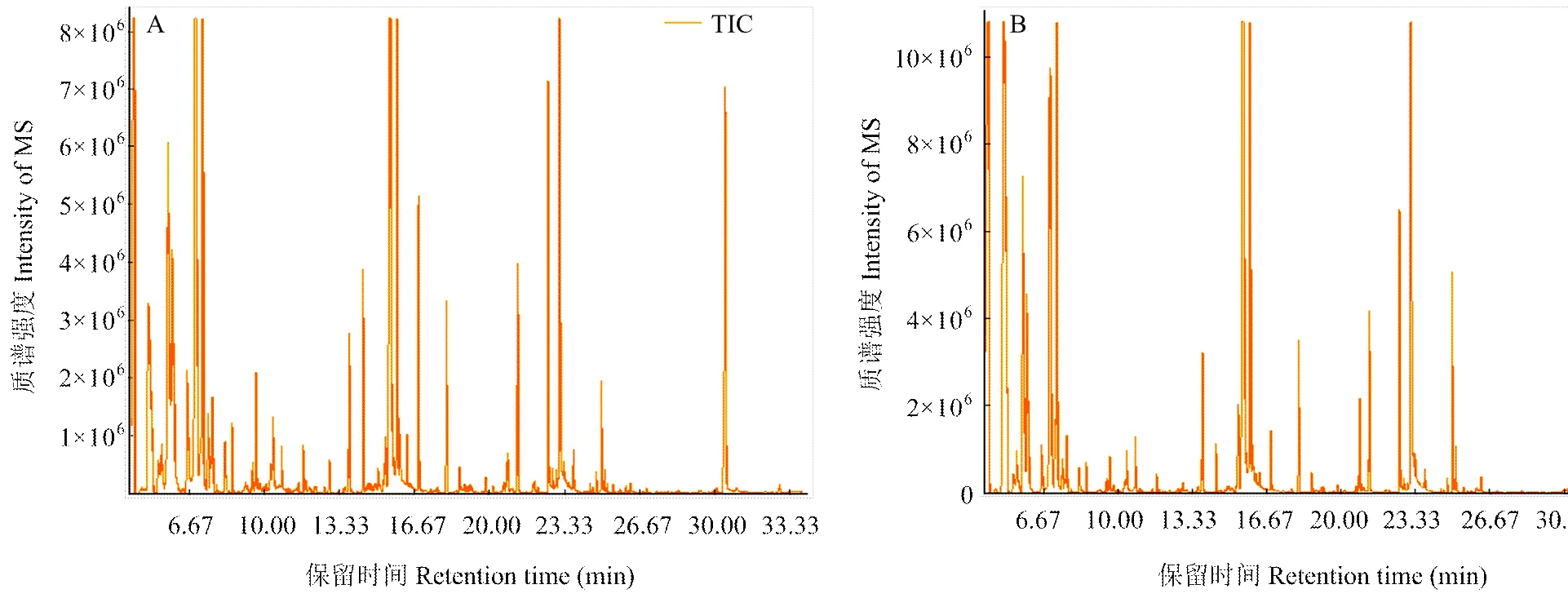
A:S组 S group;B:C组 C group
2.2 多元统计分析
2.2.1 PCA分析 PCA分析结果见图2,图中每个点代表一个样本,所有样本均在95%的置信区间内。PCA分析显示其解释率较高/强(2X=0.559),证实该分析模型可靠。由图可见,S组主要分布在PC1的左侧,C组主要分布在PC1的右侧,在PC2上的分布虽有一定的重合,但大部分样品分别聚类在PC2的上下两侧,说明S组和C组有一定的组间差异性,并且QC样本聚成一类,说明整个分析方法(前处理方法和仪器分析系统)稳健可靠,各试验组间的差异性是真实存在的。
PCA分析显示:其解释率较高/强(2X=0.559),证实该分析模型可靠PCA。得分图中(图2),每一个点代表一个样本,所有样品基本在95%的置信区间内。从图中可以看出,S组主要分布在PC1的左侧,C组主要分布在PC1的右侧,在PC2上的分布虽有一定的重合,但大多数样品分别聚类在PC2的上下两侧,说明S组和C组有一定的组间差异性。并且QC样本聚成一类,说明整个分析方法(前处理方法和仪器分析系统)稳健可靠,各试验组间的差异性是真实存在的。
2.2.2 PLS-DA分析 为了消除与分类不相关的噪音信息,在PCA模型的基础上,建立了PLS-DA模型(2X=0.873,2Y=0.952,Q2=0.766),进一步分析蹄叶炎与健康对奶牛在血浆代谢水平的变化血液代谢模式的影响。其中Q2表示模型的预测率,Q2>0.5表示模型具有较好的判别分析能力。PLS-DA模型得分图(图3)显示,两组样品之间有一定的差异,其中S组主要分布在PC1的右侧,C组主要分布在PC1的左侧,说明两组样本在主成分坐标轴上分离较好。
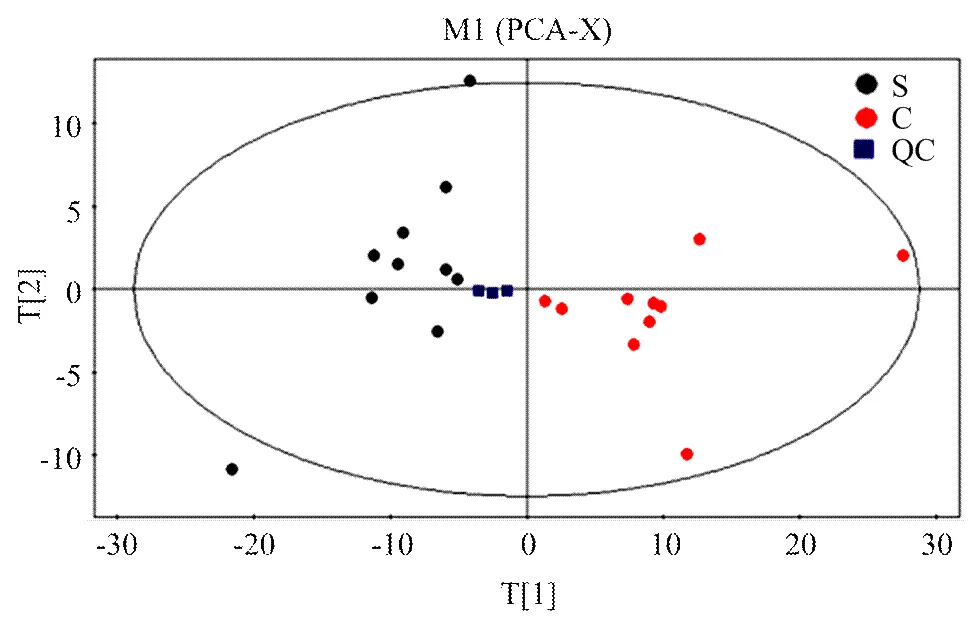
图2 基于2组血浆GC-MS获得的PCA得分图
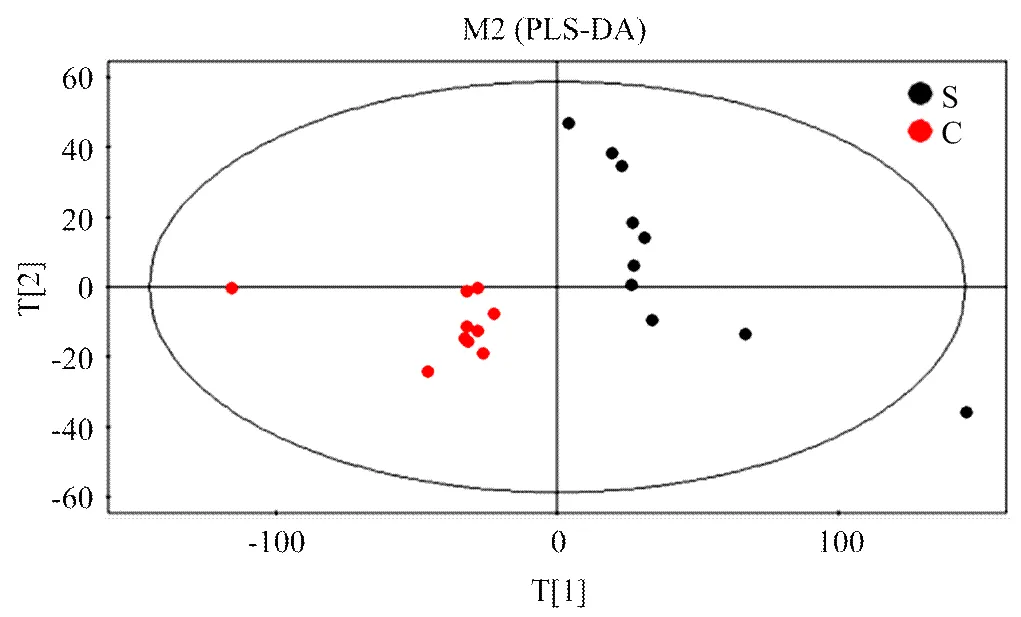
图3 基于2组血浆GC-MS获得的PLS-DA得分图
采用200次响应排序的方法对模型的稳健性进行考察,结果见图4,参数为:2=0.673,Q2=–0.201,说明此模型是稳健可靠。
2.3 差异代谢物鉴定及相关代谢通路分析
通过PLS-DA分析后,并根据VIP>1及t检验的<0.05的相对变量标准分析结果,将代谢物的峰面积进行归一化处理,经过相对定量,得到各个结果在患病组和健康组奶牛血浆中共筛选到37个差异代谢物(表2)。其中有3种代谢物上调,分别是氨基氧乙酸、乳糖和油酸;有34种代谢物下调,代谢物在两组间的变化差异倍数(fold change, FC),其中FC(S/C)为代谢物在患病组和健康组的比值。包括氨基酸、饱和脂肪酸以及与之代谢相关的化合物。

图4 使用200次响应法对PLS-DA进行验证的点图
通过MBRole和KEGG数据库对差异代谢物进行代谢通路富集分析(图5),两组奶牛血浆中脂肪酸代谢(饱和脂肪酸和不饱和脂肪酸的生物合成)、氨基酸代谢存在极显著差异(<0.01),嘌呤代谢、甲烷代谢和氰基氨基酸代谢等相关代谢途径也存在显著差异(<0.05)。且两组血浆中棕榈酸和硬脂酸相对含量有所差异(图6)。

1.脂肪酸生物合成通路,2.甘氨酸/丝氨酸/苏氨酸代谢通路,3.不饱和脂肪酸生物合成通路,4.嘌呤代谢通路,5.甲烷代谢通路,6.苯丙氨酸代谢通路,7.两组奶牛血浆代谢总体通路,8.含腈氨基酸代谢通路

表2 S组和C组间的差异代谢物
RT=保留时间,FC=差异倍数,S组/C组。如果FC>1,代表该物质含量S组高于C组,值由T-检验获得
RT=retention time. FC=fold change, mean value of peak area obtained from S group/ mean value of peak area obtained from C group. If the FC value greater than1, means that metabolite are more in S group than in C group.values were obtained by T-test
2.4 验证试验
奶牛血浆抗氧化能力指标检测结果见表3,患病组奶牛血浆T-AOC和GSH-Px含量均低于健康组,差异显著(<0.05),MDA显著高于健康对照组(<0.05),但两组间SOD差异不显著。奶牛血浆生化相关指标检测结果见表4,蹄叶炎奶牛中的血浆含量TC、TG、LDL-C均显著高于健康组奶牛,差异显著(<0.05)。由此说明奶牛患病后,机体抗氧化能力和脂质代谢发生紊乱,这与代谢组学结果相一致。

表3 两组奶牛血浆抗氧化指标(均值±标准差)
同列不同小写字母表示差异显著(<0.05),同列相同小写字母表示差异不显著(>0.05)
Different letters in the same column mean significant difference (<0.05) and same letters mean no significant difference (>0.05)
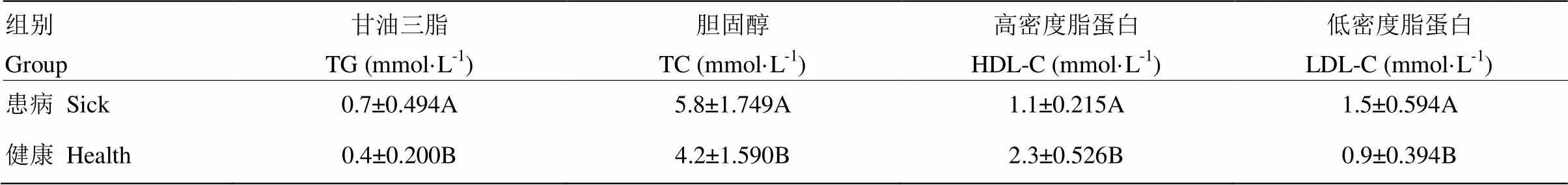
表4 两组奶牛血浆中脂质代谢相关各指标(均值±标准差)
同列不同大写字母表示差异显著(<0.05)
Different letters in the same column mean significant difference (<0.05)
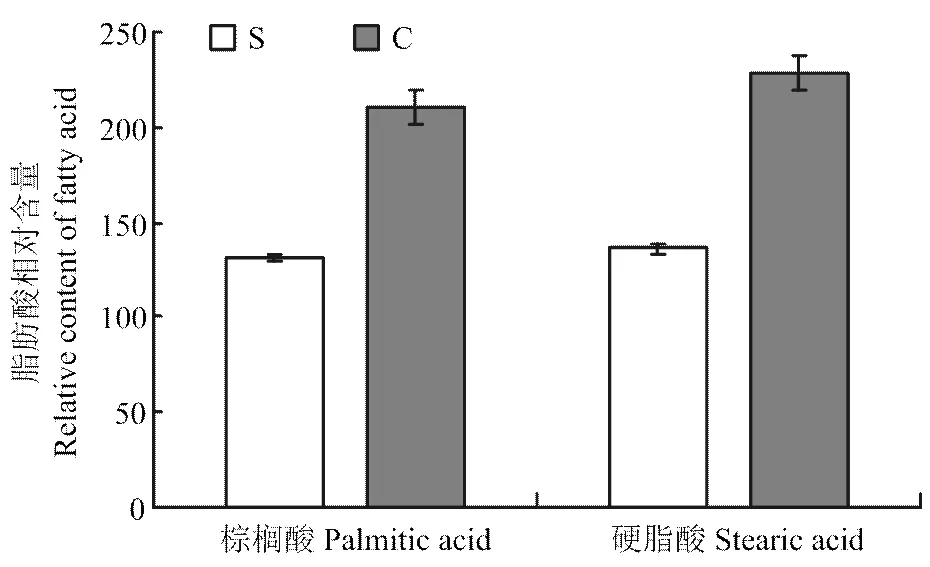
图6 两组奶牛血浆中棕榈酸和硬脂酸的相对含量
3 讨论
3.1 奶牛血浆代谢谱分析
利用代谢组学筛选疾病发生发展过程中的生物标记物,为疾病的早期诊断和治疗提供理论依据,在人类和动物疾病的研究中已有可喜进展[11, 22-23]。但是采用代谢组学方法分析奶牛蹄叶炎的血浆代谢变化,这在国内外尚未见相关报道。目前,普遍认为奶牛蹄叶炎是全身代谢紊乱的局部体现,但具体哪些代谢通路发生了变化还不清楚,本研究利用GC-MS技术发现蹄叶炎患病牛与健康奶牛血浆中存在37种差异代谢物,主要涉及脂肪酸生物合成通路,甘氨酸/丝氨酸/苏氨酸代谢通路和不饱和脂肪酸生物合成通路,另外,嘌呤代谢通路,甲烷代谢通路,苯丙氨酸代谢通路,含腈氨基酸代谢通路也发生了显著变化。本研究全面分析了蹄叶炎患病牛与健康奶牛血浆代谢谱的变化,为进一步解释蹄叶炎的发生提供了一定的理论依据。
目前普遍认为奶牛过量食入精料后,引起亚急性瘤胃酸中毒[24],从而导致蹄叶炎,并且有很多研究通过饲喂过量碳水化合物,成功建立了蹄叶炎病理模型[6],但本试验通过代谢通路富集分析,并未发现血浆中与能量代谢相关的通路存在显著差异,只是与能量代谢相关的部分代谢物有所变化,推测可能是当奶牛发生瘤胃酸中毒时,瘤胃微生物异常发酵,释放出内毒素和组胺,经血液循环运送到蹄部,作用于蹄部微循环,改变了血管通透性,造成蹄部的微循环障碍,从而引起局部的能量代谢变化,而并未表现出全身的能量代谢障碍。这与MEDINA[8]的研究结果一致,他发现马发生蹄叶炎时,在蹄部间质组织中能量代谢发生改变,而在血浆中并未表现出能量代谢障碍,这可能与血液的自我稳态调控有关。
3.2 脂质代谢异常
本研究结果发现,蹄叶炎患病组和健康组奶牛相比,血浆中脂质代谢通路发生了显著变化(图3),并经过相关的试验证明,发现蹄叶炎患病牛与健康奶牛血浆中脂质代谢的相关指标有显著差异(表4),说明奶牛发生蹄叶炎时脂质代谢出现紊乱,这与笔者前期的蛋白质组学研究结果一致[25]。显示,蹄叶炎患病牛血浆中棕榈酸和硬脂酸含量低于健康奶牛,说明奶牛发生蹄叶炎时脂肪酸合成受阻(图6)。已知脂肪酸的生物合成起始于乙酰-CoA转换成丙二酸单酰-CoA,这步反应是在乙酰-CoA羧化酶的作用下实现的。乙酰-CoA羧化酶是脂肪酸生物合成的关键酶,生物素是其辅基。因此生物素含量下降时,会通过抑制乙酰-CoA羧化酶的活性而影响脂肪酸的合成。KHALED[26]等发现,跛行牛和健康牛血清中生物素的含量与机体抗氧化能力显著负相关,当机体抗氧化能力下降时,生物素含量随之下降。本研究中进行的试验也表明蹄叶炎患病牛的抗氧化能力降低,因此,生物素含量会降低,抑制乙酰-CoA羧化酶的活性,使脂肪酸生物合成受阻,导致棕榈酸和硬脂酸含量下降。另有研究表明,奶牛发生蹄叶炎时血浆胆固醇含量升高[9]。众所周知,有机体生物合成胆固醇的原料为乙酰-CoA,奶牛发生蹄叶炎时,胆固醇的大量合成也会影响脂肪酸的合成。
本研究中脂肪酸合成通路和不饱和脂肪酸合成通路均异常,因此,脂质代谢通路可作为一条新的线索来进一步明确蹄叶炎的发病机制。
3.3 氨基酸代谢异常
本研究结果显示蹄叶炎患病牛血浆中许多氨基酸含量低于健康组奶牛,推测可能是丙氨酸、苏氨酸、丝氨酸、甘氨酸碳骨架分解后会形成乙酰-CoA,以调节体内的脂肪酸合成异常。甘氨酸和丝氨酸在动物的生命活动中有重要作用,为核酸和脂质的合成提供前体物质[27],而且在炎症[28],肿瘤[29],癌症[30]的发生过程中也有一定的作用,说明甘氨酸和丝氨酸在维持动物健康方面有重要作用。AMELIO[31]研究发现,丝氨酸的合成还会直接影响细胞的抗氧化能力。蹄叶炎发生时,奶牛体内丝氨酸含量下降,细胞抗氧化能力下降,细胞功能受损,更容易受到组胺和内毒素的侵害。许多氨基酸如:甘氨酸、苏氨酸、丝氨酸等还可作为一碳单位的来源,从而参与嘌呤与嘧啶的生物合成,本研究结果中蹄叶炎患病牛嘌呤代谢异常可能是由于氨基酸含量下降引起的。另外,经KEGG数据库查阅发现,甲烷代谢通路(ko00680,KEGG数据库登录号)中甘氨酸和丝氨酸可通过四氢叶酸转移一碳单位参与其中,因此在本试验中甲烷代谢通路在蹄叶炎奶牛中也表现出异常。
综上所述,氨基酸代谢在蹄叶炎的发生过程中至关重要,且甘氨酸/苏氨酸/丝氨酸代谢通路异常会影响其他几条通路,今后应给予进一步研究,为揭示蹄叶炎的机理和防治提供新的线索。
4 结论
本研究基于气相色谱/质谱联用技术的代谢组学研究方法,研究了奶牛发生蹄叶炎时血浆中小分子代谢物的改变,共有37种差异代谢物被鉴别出,其中3种物质上调,34种物质下调,主要涉及脂肪酸合成通路和甘氨酸/丝氨酸/苏氨酸代谢通路异常等。为进一步研究蹄叶炎的机理和防治提供新的线索。
References:
[1] 齐长明.奶牛疾病学. 北京:中国农业科学技术出版社, 2006:593-595.
QI C M.. Beijing: China Agriculture and Science Press, 2006: 593-595.(in Chinese)
[2] BOOSMAN R, NÉMETH F, GRUYS E. Bovine laminitis: Clinical aspects, pathology and pathogenesiswith reference to acute equine laminitis.1991, 13(3): 163-171.
[3] 赵晓娟. 奶牛蹄叶炎的发病原因及诊治. 浙江畜牧兽医, 2014(2): 44-45.
ZHAO X J.Pathogenesis, treatment and diagnosis of laminitis in dairy cows.2014(2): 44-45. (in Chinese)
[4] NORDLUND K V, COOK N B, OETZEL G R. Investigation strategies for Laminitis problem herds., 2004, 87(Suppl): 27-35.
[5] 赵占中, 刘群. 蹄叶炎:毒素、组织胺与代谢紊乱. 浙江畜牧兽医, 2004(2): 10-11.
ZHAO Z Z, LIU Q. Laminitis: toxin, histamine and metabolic disorders.2004(2):10-11.(in Chinese)
[6] THOEFNER M B, POLLITTC C, EPSA W V, MILINOVICHG J, TROTTD J.Acute bovine laminitis: A new induction model using alimentary oligofructose overload.2004(87): 2932-2940.
[7] 齐长明, 王清兰, 钟友刚, 韩冰, 柴文君. 二磷酸组织胺诱发奶牛蹄叶炎病变的病理学研究. 畜牧兽医学报, 2000, 31(3):241-248.
QI C M, WANG Q L, ZHONG Y G, HAN B, CHAI W J. Experimental studies on histamine diphosphate induced laminitic pathological changes in dairy cows., 2000, 31(3): 241-248. (in Chinese)
[8] MEDINA-TORRES C E, VAN EPS A W, NIELSEN L K, HODSON M P. A liquid chromatography–tandemmass spectrometry-based investigation of the lamellar interstitial metabolome in healthy horses and during experimental laminitis induction.2015, 206(2): 161-169.
[9] 董书伟, 荔霞, 高昭辉, 严作廷, 王胜义, 刘世祥, 齐志明, 刘永明. 奶牛蹄叶炎与血液生理生化指标的相关性分析. 畜牧与兽医, 2012(4): 74-77.
DONG S W, LI X, GAO Z H, YAN Z T, WANG S Y, LIU S X, QI Z M, LIU Y M. Correlation analysisof blood physiological and biochemical indexes of dairy cows with laminitis.2012(4): 74-77. (in Chinese)
[10] 杜智, 刘树业, 刘运德.临床代谢组学.天津: 天津科技翻译出版有限公司, 2013:1-3.
DU Z, LIU S Y, LIU Y D.Tianjin: Tianjin Science and Technology Translation and Publishing Corporation. 2013:1-3. (in Chinese)
[11] SUN L W, ZHANG H Y, WU L, SHU S, XIA C, XU C, ZHENG J S. 1H-Nuclear magneticresonance-based plasma metabolic profiling of dairy cows with clinical and subclinical ketosis.2014, 97(3): 1552-1562.
[12] WU H, XUE R, LU C, DENG C, LIU T, ZENG H, WANG Q, SHEN X. Metabolomic study for diagnostic model of oesophageal cancer using gas chromatography/mass spectrometry., 2009, 877(27): 3111-3117.
[13] 郭延生, 贾启鹏, 陶金忠. 基于GC-MS策略的奶牛热应激血液代谢组学研究. 畜牧兽医学报, 2015(8): 1356-1362.
GUO Y S, JIA Q P, TAO J Z, Blood metabolomic studies of teat stress cow with GC-MS.2015(8): 1356-1362. (in Chinese)
[14] KAWABE M, BABA Y, TAMAI R, YAMAMOTO R, KOMORI M, MORI T, TAKENAKA S. Profiling of plasma metabolites in canine oral melanoma using gas chromatography-mass spectrometry.2015, 77(8): 1025-1028.
[15] DUNN W B, ELLIS D I. Metabolomics: Current analytical platforms and methodologies., 2005, 24(4): 285-294.
[16] DUNN W B, BROADHURST D, ELLIS D I, BROWN M, HALSALL A, O'HAGAN S, SPASIC I, TSENG A, KELL D B. A GC-TOF-MS study of the stability of serum and urine metabolomes during the UK Biobank sample collection and preparation protocols.2008, 37(Suppl. 1): i23-i30.
[17] KIOUSSI M K, LYRIS E M, ANGELIS Y S, TSIVOU M, KOUPPARIS M A, GEORGAKOPOULOS C G. A generic screening methodology for horse doping control by LC-TOF-MS, GC-HRMS and GC-MS.2013, 941: 69-80.
[18] 陈杰, 陈景祥, 邹敦铎, 徐魁梧, 戴杏庭.南京地区患变形蹄奶牛血液和瘤胃生理生化参数的变化. 中国兽医杂志, 1990, 16(6):19-20.
CHEN J, CHEN J X, ZOU D D, XU K W, DAI X T. Biochemical parameters changes of blood and rumen of hoof deformity dairy cows.1990, 16(6): 19-20. (in Chinese)
[19] 林为民, 史文军. 两种组胺受体拮抗剂治疗奶牛蹄叶炎效果观察. 中国奶牛, 2012(12): 36-38.
LIN W M, SHI W J. Effect of treatment of laminitis using two histamine receptor antagonist in dairy cows.2012(12): 36-38.(in Chinese)
[20] JE N. Bovine acidosis:Implications on laminitis., 1997, 80(5):1005-1028.
[21] NIEMAN D C, GILLITT N D, HENSON D A, SHA W, SHANELY R A, KNAB A M, CIALDELLA-KAM L, JIN F.Bananas as an energy source during exercise: a metabolomics approach.2012, 7(5): e37479.
[22] 孙玲伟, 包凯, 李影, 李兰, 张洪友, 夏成, 吴凌. 奶牛临床和亚临床酮病的血浆代谢组学研究. 中国农业科学, 2014(8): 1588-1599.
SUN L W, BAO K, LI Y, LI L, ZHANG H Y, XIA C, WU L. Plasma metabolomics study of dairy cows with clinical and subclinical ketosis.2014(8): 1588-1599. (in Chinese)
[23] KLEPACKI J, KLAWITTER J, KLAWITTER J, THURMAN J M, CHRISTIANS U. A high-performance liquid chromatography - tandem mass spectrometry - based targeted metabolomics kidney dysfunction marker panel in human urine., 2015, 446:43-53.
[24] WESTWOOD C T, BRAMLEY E, LEAN I J. Review of the relationship between nutrition and lameness in pasture-fed dairy cattle., 2003, 51(5): 208-218.
[25] DONG S, ZHANG S, WANG D, WANG H, SHANG X, YAN P, YAN Z, YANG Z. Comparative proteomics analysis provide novel insight into laminitis in Chinese Holstein cows.2015, 11(1):162-169.
[26] AL-QUDAH K M, ISMAIL Z B. The relationship between serum biotin and oxidant/antioxidant activities in bovine lameness.2012, 92(1): 138-141.
[27] NARKEWICZ M R, JONES G, MORALES D. Serine and glycine transport in fetal ovine hepatocytes.2000, 1474(1): 41-46.
[28] SHAN L, LIAO F, JIN H, YE F, TONG P, XIAO L, ZHOU J, WU C. Plasma metabonomic profiling of lumbar disc herniation and its traditional Chinese medicine subtypes in patients by using gaschromatography coupled with mass spectrometry.2014, 10(11): 2965-2973.
[29] VAZQUEZ A, TEDESCHI P M, BERTINO J R. Overexpression of the mitochondrial folate and glycine-serine pathway: a new determinant of methotrexate selectivity in tumors.2013, 73(2): 478-482.
[30] R C, MCMASTERS, CHOY P C. Serine regulates phosphatidylethanolamine biosynthesis in the Hamster heart.1992, 267(July 25): 14586-14591.
[31] AMELIO I, CUTRUZZOLA F, ANTONOV A, AGOSTINI M, MELINO G. Serine and glycine metabolism incancer.2014, 39(4): 191-198.
(责任编辑 林鉴非)
Plasma Metabolic Profiling Analysis of Dairy Cows with Laminitis Based on GC-MS
LI Ya-juan1,2, WANG Dong-sheng1, ZHANG Shi-dong1, YAN Zuo-ting1, YANG Zhi-qiang1, DU Yu-lan2, DONG Shu-wei1, HE Bao-xiang2
(1Key Laboratory of Veterinary Pharmaceutical Development, Ministry of Agriculture/Key Laboratory of New Animal Drug Project, Gansu Province /Lanzhou Institute of Husbandry and Pharmaceutical Sciences of Chinese Academy of Agricultural Sciences, Lanzhou 730050;2College of Animal Science and Technology, Guangxi University, Nanning 530005)
【Objective】In order to discover the difference between the cows suffered with laminitis and healthy cows, metabonomics analysis based on gas chromatograph tandem mass spectrometer technology (GC-MS) was utilized in the study.【Method】Twenty plasma samples were collected from cows with laminitis and healthy groups. Plasma metabolic profiling was obtained by GC-MS after derivatization. Multivariate statistics including principal component analysis (PCA) and supervised partial least squares-discriminant analysis (PLS-DA) were conducted to screen the changed metabolites. Bioinformatics was analyzed to identify the significantly changed metabolic pathways.【Result】A total of 242 variables were detected and 37 compounds were significantly different between healthy and laminitis-suffered cows of which 3 were up-regulated including aminooxyacetic acid, lactose and oleic acid and 34 were down-regulated in laminitis group involved amino acid and fatty acid. The main changed metabolic pathways were fatty acid biosynthesis, Gly, Ser, Thr metabolism, biosynthesis of unsaturated fatty acids, purine metabolism, methane metabolism, cyanoamino acid metabolism and phenylalanine metabolism. Results of the the experiment of validation showed that the indexes related to fatty acid metabolism and antioxidation were significantly different between healthy cows and sick cows. 【Conclusion】 Based on GC-MS, this study revealed the changed regularity of metabolism in plasma with laminitis, and the discovered different metabolites would be potential biomarkers in occurrence and development process of laminitis, which can lay a theoretical foundation for further understanding of the pathogenesis, early diagnosis and therapy of laminitis in dairy cows.
metabonomics; laminitis; gas chromatograph tandem mass spectrometer technology; dairy cow
2016-03-01;接受日期:2016-09-06
国家自然科学青年基金项目(31302156)、甘肃省青年科技基金计划1506RJYA145、中央级基本科研业务费项目(1610322014012)
联系方式:李亚娟,E-mail:18719826933@163.com。通信作者董书伟,E-mail:dongshuwei@caas.cn。通信作者何宝祥,E-mail:hebaox@gxu.edu.cn

