液相色谱-串联质谱法测定水果及其制品中氯吡脲残留量*
尚岩岩,张岩岩,王桂苓
(阜阳市产品质量监督检验所,安徽阜阳 236000)
液相色谱-串联质谱法测定水果及其制品中氯吡脲残留量*
尚岩岩,张岩岩,王桂苓
(阜阳市产品质量监督检验所,安徽阜阳 236000)
建立了液相色谱-三重四极杆串联质谱测定水果及其制品中氯吡脲的方法。样品经乙腈提取,氨基固相萃取小柱净化后,用ZORBAX Extend-C18柱(150 mm×2.1 mm,5 μm)分离,以甲醇-水为流动相等度洗脱,采用多反应监测正离子模式检测,外标法定量。氯吡脲的质量浓度在4.0~200.0 ng/mL范围内线性良好,相关系数大于0.999,在5.0,10.0,20.0 μg/kg 3个添加水平下,氯吡脲的平均加标回收率为86%~92%,测定结果的相对标准偏差为5.3%~7.6%(n=5),方法定量下限为2.0 μg/kg。方法灵敏度高,操作简便,定量准确,可满足梨、柑桔、黄桃等水果及其罐头制品中氯吡脲残留的检测与确证需要。
氯吡脲;液相色谱-串联质谱;水果及其制品
氯吡脲[Forchlorfenuron,1-(2-氯-4-吡啶)-3-苯基脲]简称CPPU[1-2],是目前人工合成的活性最高的细胞分裂素,具有加速细胞分裂、促进细胞增大与分化、诱导芽的发育、防止落花落果等作用。作为一种植物生长调节剂,氯吡脲近年被广泛应用于苹果、草莓、橘子、猕猴桃、西红柿、黄瓜、西瓜等水果和蔬菜生产,以促进果实肥大、提高产量、保鲜等。研究表明,长期接触氯吡脲会引起体内蛋白质代谢紊乱、肺气肿和体形消瘦[3]。日本“肯定列表”规定西红柿等42种水果、蔬菜中氯吡脲最高残留限量为0.1 mg/kg(杏仁中为0.01 mg/kg),美国和韩国规定氯吡脲在葡萄中的最高残留限量分别为0.03, 0.05 mg/kg[3]。2009年,我国规定西瓜、黄瓜中氯吡脲最高残留限量为0.1 mg/kg,猕猴桃、葡萄中氯吡脲最高残留限量为0.05 mg/kg,而其它水果、蔬菜中氯吡脲最高残留限量尚未制定标准,水果及蔬菜制品(如罐头、果蔬饮料等)中氯吡脲最高残留也未制定限量标准。
目前,国内外关于氯吡脲在农作物中残留量的分析方法主要是液相色谱法[4-7],胡继业等[8]采用PSA法进行样品前处理,以高效液相色谱法测定西瓜中的氯吡脲残留量;Sharma等[9]研究了氯吡脲在葡萄、土壤和水中的残留行为,使用的是HPLC-UV检测法;Antonio Valverde等[10]采用液相色谱-飞行时间质谱(LC/TOF-MS)法测定了蔬菜中的氯吡脲残留;张军等[11]采用电喷雾离子源多反应监测模式HPLC-MS/MS法分析检测葡萄果实中的氯吡脲;郑玲等[12]利用液相色谱-电喷雾串联质谱,建立了葡萄、西瓜、柑桔、梨中的氯吡脲分析方法。笔者采用液相色谱-三重四极杆串联质谱法,通过优化液相色谱和质谱检测条件,结合固相萃取净化技术,测定了蔬菜水果及其制品中氯吡脲的残留量,该法具有灵敏度高、抗干扰能力强等优点。
1 实验部分
1.1主要仪器与试剂
高效液相色谱仪:Agilent 1260型,美国安捷伦科技有限公司;
三重四极杆质谱仪:Agilent 6430型,配ES源,美国安捷伦科技有限公司;
离心机:TD16-WS型,湖南赛特湘仪离心机有限公司;
超声波提取仪:JK-3200DB型,合肥金尼克机械制造有限公司;氮吹仪:N-EVAP 111型,美国Organomation公司;氯吡脲标准品:纯度99.5%,德国Dr. Ehrenstorfer 公司;
氯吡脲标准储备液:1 mg/mL,准确称取氯吡脲标准品适量,用甲醇溶解并定容,使用时根据需要稀释成适当浓度的标准工作液,于4℃下保存;
乙腈、甲醇:HPLC级,美国Tedia 公司;
氨基固相萃取柱:500 mg/(3 mL),美国Supelco公司;
实验用水:屈臣氏超纯水。
1.2样品处理
1.2.1提取
准确称取样品5.0 g于50 mL具螺旋盖聚丙烯离心管中,加入20 mL乙腈,涡旋振荡1 min,加入3 g NaCl,振荡混匀1 min,超声提取30 min,以5 000 r/min 离心10 min,准确移取10 mL上层有机相,转移至旋蒸瓶中,于45 ℃下旋转浓缩至近干,用二氯甲烷溶解后待净化。
1.2.2净化
将待净化液转移至活化后的氨基固相萃取柱中,用10 mL二氯甲烷淋洗后,以10 mL甲醇洗脱;收集洗脱液并于40℃下用氮气吹干,用1 mL甲醇-水(1∶1)溶液溶解定容[13],过0.22 μm有机系微孔滤膜,供LC-MS/MS仪测定。
1.3仪器工作条件
1.3.1色谱条件
色谱柱:ZORBAX Extend-C18柱(100 mm×2.1 mm,3.5 μm);流动相:甲醇-水(50∶50),流量为0.50 mL/min;柱温:30℃;进样体积:20 μL。
1.3.2质谱条件
扫描方式:ESI正离子模式(ESI+)扫描;检测方式:多反应监测(MRM);干燥气温度:300 ℃;干燥气流量:10 L/min ;雾化器压力:206.85 kPa ;毛细管电压:4 000 V;母离子:m/z 248;定量离子:m/z 129;定性离子:m/z 93;碰撞电压:95 V;碰撞能量:定量15 eV,定性35 eV。
2 结果与讨论
2.1提取溶剂及提取方式的选择
水果罐头中含有大量水分,应选择极性溶剂溶解,且试剂需对试样中的糖、蛋白质和脂肪的溶解性较小。本实验中待测物具有微酸性,选择乙腈(加入适量的盐酸)作为提取剂,超声波振荡30 min提取,回收率可达90%以上。同时,对净化方法进行优化。在报道的氯吡脲测定方法中,净化方法有液相萃取和固相萃取,其中固相萃取因使用溶剂量少、净化效果好而应用较多,使用的固相萃取柱有PSA柱、活性炭柱等。根据文献[13],选用Waters Sep-Pak NH2固相萃取小柱,经过阴性样品加标试验,确定了净化条件,过柱回收率均在95%以上,且净化效果好,样品检测时均无干扰,且无基质抑制现象,可用外标法进行定量。
2.2质谱条件的优化
用1 μg/mL氯吡脲标准溶液,分别在ESI正离子和负离子模式下进行母离子扫描,结果表明,在正离子模式下具有较高的灵敏度,因此确定氯吡脲的检测模式为ESI 正离子模式,母离子为m/z 248。优化得到碰撞电压为95 V,以m/z 248为母离子进行子离子扫描,选取相对丰度最强的子离子m/z 129,93作为氯吡脲的监测离子,并分别对子离子的碰撞能进行优化。最后在MRM模式下优化了干燥气温度、干燥气流量和雾化器压力。在1.3.2质谱条件下的质谱图见图1。
2.3色谱条件和定容液的选择
在正离子模式下,通常选择乙腈-水或甲醇-水体系作为流动相。试验对比发现,以甲醇-水为流动相时,待测物色谱峰形及灵敏度均较好,故选用甲醇-水体系作为流动相。同时对定容液进行选择,分别用甲醇和不同比例的甲醇-水作为定容液进行试验,结果表明,当定容液中甲醇的比例增大时,待测物色谱峰面积增加,色谱峰高在甲醇比例为50%时达到最高,其后峰面积的增加完全来自于峰的展宽贡献。综合考虑色谱峰形和响应值,选择体积比为1∶1的甲醇-水作为定容液。在1.3.1色谱条件下加标样品色谱图如图2。由图2可知,氯吡脲与样品基质分离良好。
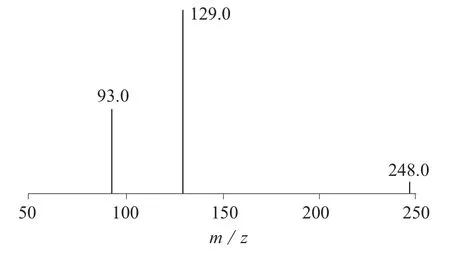
图1 氯吡脲HPLC-MS/MS多反应监测图谱
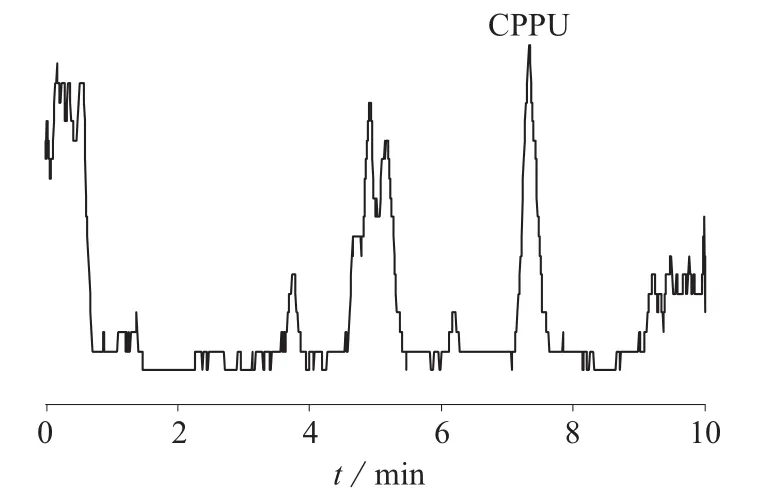
图2 2.0 μg/kg加标样品色谱图
2.4线性范围、检出限
取氯吡啶标准储备液适量,用甲醇-水溶液(1∶1)分别稀释成4.0,8.0,20.0,40.0,80.0,100.0,200.0 ng/L的氯吡脲系列标准工作溶液,分别进样测定,以氯吡啶标准工作溶液的质量浓度X(ng/L)对色谱峰面积进行线性回归,得氯吡脲的线性方程为Y=12 391.65X+3 736.47,相关系数r2=0.999 6,表明线性良好。对空白样品进行加标回收试验,以信噪比为10确定本方法测定水果罐头中氯吡脲的定量下限为2.0 μg/kg。
2.5加标回收与精密度试验
以梨罐头为测试样品,分别添加氯吡脲5.0,10.0,20.0 μg/kg,每个水平做5个平行样,样品加标回收试验结果见表1。由表1可知,氯吡脲的平均回收率为86%~92%,测定结果的相对标准偏差为5.3%~7.6%,表明本方法精密度和准确度均较高。
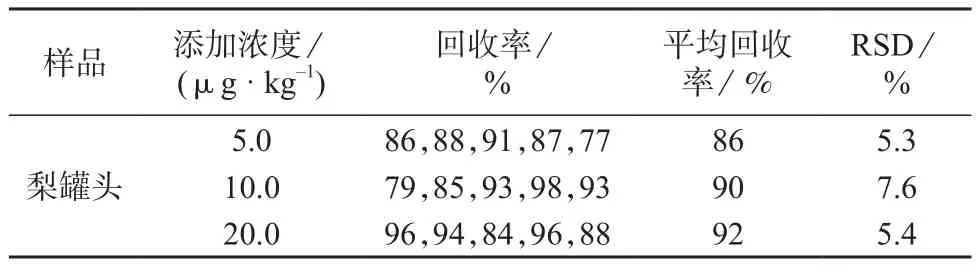
表1 氯吡脲样品加标回收试验结果(n=5)
3 结语
建立了水果及其制品中氯吡脲残留检测的LC-MS/MS分析方法。通过对仪器条件和样品处理条件进行优化,应用于梨、橘子、黄桃等水果饮料的检测时,方法的灵敏度、精密度均能满足农药残留分析的要求。
[1] 张卫炜,杨永珍.氯吡脲的研究及应用进展[J].农药科学与管理,2006,27(5): 36-40.
[2] Shinichi A,Koya M,Zenichi M,et al. The Use of CPPU for Efficient Propagation of Pineapple[J]. Science Horticulture,2004,100: 7-14.
[3] 史晓梅,金芬,黄玉婷,等.水果中常用植物生长调节剂的研究进展[J].食品工业科技,2012,33(4): 417-422,426.
[4] Liu Qiang,Gong Daxin,Peng Xiaochun,et al. Determination of forchlorfenuron dissipation and residue in cucumbers and red soil[J]. Journal of Northeast Agricultural University(English Edition),2010,17(1): 27-31.
[5] 侯玉茹,杨媛,石磊,等.固相萃取-高效液相色谱法检测葡萄中氯吡脲的研究[J].食品科技,2011,36: 255-258.
[6] 李瑞娟,于建垒,宋国春,等.氯吡脲在猕猴桃和土中的消解动态与残留测定[J].山东农业科学,2009(2): 78-80,83.
[7] Chen C L,Li J Z,Wu H L. Residue analysis on forchlorfenuron in watermelon soil field[J]. Environmental Chemistry,2006,25:789-792.
[8] Hu Jiye,Li Jianzhong. Determination of forchlorfenuron residues in watermelon by solid-phase extraction and high-performance liquid Chromatography[J]. AOAC International,2006,89(6):1 635-1 639.
[9] Sharma D,Awasthi M D. Behaviour of forchlorfenuron residues in grape,soil and water[J]. Chemosphere,2003,50: 589-594.
[10] Antonio V,Ana A,Carmen F,et al. Analysis of forchlorfenuron in vegetables by LC/TOF-MS after extraction with the buffered QuEChERS method[J]. Agric Food Chem,2010,58(6):2 818-2 823.
[11] 张军,杜平.高效液相色谱-串联质谱法测定葡萄中的吡效隆和赤霉素[J],色谱,2011,29: 1 133-1 136.
[12] 郑玲,李丽华,黄大新,等.液相色谱-串联质谱法对水果中氯吡脲残留的测定[J].食品工业,2011(7): 90-92.
[13] 罗伟强肖小华,李攻科,等.蔬果中氯吡脲残留样品前处理及分析方法研究进展[J].食品安全质量检测学报,2013(4):1 090-1 092.
Determination of Forchlorfenuron Residues in Fruits and Fruit Products by LC-MS/MS
Shang Yanyan, Zhang Yanyan, Wang Guiling
(Fuyang City Product Quality Supervision and Inspection Institute, Fuyang 236000, China)
A method for determination of forchlorfenuron residues in fruits and fruit products was established by liquid chromatography-tandem mass spectrometry(LC-MS/MS). After being extracted by acetonitrile, the sample was cleaned up by solid-phase extraction NH2column. The separation of compounds was carried on a ZORBAX Extend-C18column(150 mm×2.1 mm, 5 µm) by an isocratic elution using methanol-water as mobile phase. The analyte was detected by tandem mass spectrometry under multiple reaction monitoring mode with positive electrospray ionization. The forchlorfenuron was quantified by external standard method. Under the optimal conditions, the calibration curve showed a good linearity over the concentration of forchlorfenuron in the range of 4.0-200.0 ng/mL with a correlation coefficient more than 0.999. The average recoveries from spiked samples at three concentration levels of 5.0, 10.0, 20.0 µg/kg ranged from 86%-92% with the relative standards deviations of 5.3%-7.6%(n=5), the limit of quantitation was 2.0 μg/kg. The method is simple and suitable for the determination and confirmation of forchlorfenuron in pear, orange and yellow peach or their canned products.
forchlorfenuron; liquid chromatography-tandem mass spectrometry; fruit and fruit products
O657.7
A
1008-6145(2016)02-0031-03
10.3969/j.issn.1008-6145.2016.02.009
*国家质检总局项目(2011QK166)
联系人:张岩岩;E-mail: youyouqingren12@sina.com
2015-12-31

