类胡萝卜素清除自由基的动力学及体外模拟消化对清除率的影响
刘晓庚,袁 磊,高 梅,胡秋辉,王立峰,刘 琴(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工技术重点实验室,江苏 南京 210023)
类胡萝卜素清除自由基的动力学及体外模拟消化对清除率的影响
刘晓庚,袁 磊,高 梅,胡秋辉,王立峰,刘 琴
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工技术重点实验室,江苏 南京 210023)
测定不同质量浓度类胡萝卜素在不同温度条件下清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的能力;考察经人工胃液、肠液及胃液-肠液3 种方法模拟消化后类胡萝卜素清除DPPH自由基能力的变化情况。结果表明:反应温度(T)对类胡萝卜素清除DPPH自由基的速率(k)影响显著(P<0.05),T升高,k增大,即k45℃>k37℃>k30℃,而对清除率(α)无显著影响;类胡萝卜素初始质量浓度(ρ)对α影响显著,ρ升高,α增大,而对k无显著影响;类胡萝卜素对DPPH自由基的清除作用符合一级反应动力学模型;T对半数效应浓度(EC50)、k和半衰期(t1/2)影响显著,T升高,EC50减小(EC50(45 ℃)<EC50(37 ℃)<EC50(30 ℃))、k增大(k45℃>k37℃>k30℃)、t1/2减小(t1/2(45℃)<t1/2(37℃)<t1/2(30 ℃));表观活化能(Ea)和方程常数(K0)不受ρ的影响,Ea=17.039 kJ/mol、K0=7.38×106;体外模拟消化后的类胡萝卜素对DPPH自由基的清除率减小,且底物浓度越大,清除率下降百分比越大,降幅越小;与油脂混合后的类胡萝卜素经体外模拟消化后对DPPH自由基的清除率低于不加油脂组,即脂溶性的类胡萝卜素与油脂混合后更易被人体消化吸收,但因不同植物油的脂肪酸组成不同,对其消化吸收的影响存在差异。
类胡萝卜素;动力学;表观活化能;1,1-二苯基-2-三硝基苯肼自由基;模拟肠胃道消化
刘晓庚, 袁磊, 高梅, 等. 类胡萝卜素清除自由基的动力学及体外模拟消化对清除率的影响[J]. 食品科学, 2016, 37(11): 65-73. DOI:10.7506/spkx1002-6630-201611012. http://www.spkx.net.cn
LIU Xiaogeng, YUAN Lei, GAO Mei, et al. Kinetics of free radical scavenging activity of carotenoids and effect of in vitro simulated gastrointestinal digestion on their radical scavenging capacity[J]. Food Science, 2016, 37(11): 65-73. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611012. http://www.spkx.net.cn
类胡萝卜素作为天然抗氧化剂有预防心血管疾病、抗衰老、抗癌、保护视力等功效[1-4],广泛应用于食品和医药等领域。这也使得近年来我国富含类胡萝卜素的胡萝卜生产量节节攀升,种植面积、产量和出口量超过全球的40%,并居全球第一[5]。
目前类胡萝卜素抗氧化动力学缺乏系统研究,而动力学研究对探明其抗氧化机理有直接作用。Jiménez-Escrig等[6]发现不同结构类胡萝卜素(如番茄红素、β-胡萝卜素)与1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基反应达到平衡的时间有差异。不同地区和季节温度的差异及实验原料的不同、固定反应时间易对类胡萝卜素的抗氧化能力造成误判,因此在评估类胡萝卜素抗氧化能力和机理时应先进行动力学研究。本研究以胡萝卜粉中提取的类胡萝卜素为受试对象,测定不同质量浓度类胡萝卜素在不同的反应温度和反应时间条件下清除DPPH自由基的能力,从而确定相关动力学参数;采用人工胃液、肠液及胃液-肠液考察人工模拟消化后类胡萝卜素清除DPPH自由基能力的变化情况,明确类胡萝卜素在模拟体液环境中的真实抗氧化值,为开发该类功能性食品提供实验依据,进一步提高类胡萝卜素的深加工附加值。
1 材料与方法
1.1 材料与试剂
将新鲜胡萝卜洗净、烘干粉碎后过80 目筛并置于-4 ℃保存。
β-胡萝卜素标准品(编号7235-40-7)、DPPH、VE、胃蛋白酶(酶活力3 200~4 500 U/mg) 美国Sigma-Aldrich公司;2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT) 江苏强盛功能化学股份有限公司;胰蛋白酶(酶活力>2 500 U/mg)、胆素 国药集团化学试剂有限公司;福临门一级大豆油、金龙鱼精炼一级菜籽油均购自超市;水为自制超纯水,其他试剂为分析纯。
1.2 仪器与设备
HH-2数显恒温水浴锅 常州国华电器有限公司;UV-8000A紫外-可见分光光度计 上海元析仪器有限公司;SHA-B恒温水浴振荡器 金坛荣华仪器制造有限公司。
1.3 方法
1.3.1 类胡萝卜素的提取及含量的测定
参照文献[7]的方法进行类胡萝卜素的提取,以紫外光谱法进行类胡萝卜素含量的测定。
1.3.2 类胡萝卜素清除DPPH自由基能力的测定
参照文献[8]方法并作如下调整:称取DPPH 0.019 7 g,用无水乙醇溶解并定容至50.00 mL作储备液。取DPPH储备液10.00 mL稀释为100 μmol/L DPPH自由基工作液(现配现用)。
用无水乙醇配制1.3.1节提取到的类胡萝卜素样品,使溶液中β-胡萝卜素质量浓度分别为70.68、141.36、212.04、282.72 μg/mL。将3.00 mL 100 μmol/L DPPH自由基工作液与1.00 mL样液混匀,分别在30、37、45 ℃反应不同时间后于517 nm波长处测定吸光度。以DPPH自由基清除率(α)和半数效应浓度(EC50)评估类胡萝卜素样品清除自由基的能力,其中EC50是指将原始DPPH自由基清除50%所需的类胡萝卜素质量浓度。按下式计算DPPH自由基清除率。

式中:Ai为加入类胡萝卜素后反应体系的吸光度;Aj为未加DPPH自由基工作液反应体系的吸光度;Ac为未加类胡萝卜素样液反应体系的吸光度。
1.3.3 体外模拟消化对类胡萝卜素抗氧化特性的影响
人工体外模拟消化实验方法参照文献[9],并作如下修改。
1.3.3.1 人工胃液模拟消化对类胡萝卜素抗氧化特性的影响
配制1.00 mg/mL β-胡萝卜素标准品溶液,分别取0.50、1.00、1.50、2.00 mL β-胡萝卜素标准品溶液于试管中,加1.00 mL吐温-40,35 ℃旋干溶液后依次加生理盐水(NaCl质量分数为0.9%,下同)、人体电解质(含0.33% NaCl、0.11% KCl、0.15% CaCl2、0.07% MgCl2和0.05% KH2PO4,下同)和40 mg/mL胃蛋白酶溶液(用0.1 mol/L HCl溶解,现配现用)各5 mL,用生理盐水定容至终体积为25.00 mL,再用1 mol/L HCl调节pH值至2.0,密封避光,于37 ℃水浴中100 r/min振荡不同时间(10、20、30、40、50、60、70 min),后取样进行DPPH自由基清除实验。
1.3.3.2 人工肠液模拟消化对类胡萝卜素抗氧化特性的影响
分别取0.50、1.00、1.50、2.00 mL的β-胡萝卜素标准品溶液于旋蒸瓶中,加1.00 mL吐温-40,35 ℃旋干溶液后依次加5.00 mL生理盐水、5.00 mL人体电解质和8.00 mL胰蛋白酶液(以0.1 mol/L NaHCO3溶解,使胰蛋白和胆素质量浓度分别为2、12 mg/mL,现配现用),用生理盐水定容至25.00 mL,再用1 mol/L NaOH调节pH值至7.0,密封避光,于37 ℃水浴中100 r/min振荡不同时间(20、40、60、80、100、120 min)后进行DPPH自由基清除实验。
1.3.3.3 人工胃液-肠液二步法模拟消化对类胡萝卜素抗氧化特性的影响
取两份0.50、1.00、1.50、2.00 mL β-胡萝卜素标准品溶液于试管中,分别与不同大豆油、菜籽油混合,加1.00 mL吐温-40,35 ℃旋干溶液后依次加5.00 mL生理盐水、5.00 mL人体电解质和5.00 mL胃蛋白酶液,用生理盐水定容至25.00 mL,再用1 mol/L HCl调节pH值为2.0,密封避光,于37 ℃水浴中100 r/min振荡70 min。用1 mol/L NaOH调节pH值至5.3,加8.00 mL胰蛋白酶液,再用1 mol/L NaOH逐滴调节pH值至7.0,密封避光,于37 ℃水浴中100 r/min水浴振荡120 min后进行DPPH自由基清除实验。
1.4 数据处理分析
运用SPSS 18.0软件,采用t检验法进行差异显著性分析;运用Origin 8.5软件作图。所有实验均重复3 次,数据均以±s表示。
2 结果与分析
2.1 样品的类胡萝卜素含量
按1.3.1节方法,测得β-胡萝卜素标准品的标准曲线方程为y=130.96x-2.299 9(R2=0.990 4),其中y表示β-胡萝卜素的质量浓度/(μg/mL),x表示吸光度,准确性高,说明该方法可用来定量检测样品中的类胡萝卜素含量。根据以上标准曲线方程求得试样中类胡萝卜素质量浓度为7 068 μg/mL。
2.2 类胡萝卜素抗氧化动力学研究
2.2.1 反应温度及类胡萝卜素质量浓度对类胡萝卜素抗氧化动力学的影响
图1A~D分别表示类胡萝卜素质量浓度为282.72、212.04、141.36、70.68 μg/mL时,反应温度(45、37、30 ℃)对类胡萝卜素清除DPPH自由基动力学曲线的影响。

图1 温度对类胡萝卜素清除DPPH自由基动力学的影响Fig. 1 Effect of temperature on the kinetics of DPPH free radical scavenging
图2A~C分别表示反应温度为45、37、30 ℃时,不同质量浓度(282.72、212.04、141.36、70.68 μg/mL)的类胡萝卜素清除DPPH自由基的动力学曲线。


图2 类胡萝卜素质量浓度对清除DPPH自由基动力学的影响Fig. 2 Effect of initial concentration of carotenoids on the kinetics of DPPH free radical scavenging
综合分析图1、2结果,类胡萝卜素清除DPPH自由基动力学的反应模式均表现为质量浓度及反应温度的双重依赖关系(表1):随反应时间的延长,类胡萝卜素清除DPPH自由基动力学曲线均呈先快后慢、逐渐趋缓、最终趋于平衡的趋势;反应温度对类胡萝卜素清除DPPH自由基的速率(k)影响显著(P<0.05),对清除率(α)无显著影响;类胡萝卜素质量浓度对k无显著影响,对α影响显著。类胡萝卜素清除DPPH自由基的能力随反应时间的延长而增强,当达到平衡时间时,α趋于某一固定值;类胡萝卜素清除DPPH自由基的能力随类胡萝卜素质量浓度的增大而增强,当类胡萝卜素质量浓度增加到某一值时,α也趋于某一固定值;理论上的最大清除率为100%。

表1 类胡萝卜素清除DPPH自由基动力学的剂量及反应时间双重依赖结果Table 1 Kinetic results of DPPH radical scavenging depending on both dose and reaction time
表2为不同反应温度条件下类胡萝卜素清除DPPH自由基的回归方程及EC50,即反应温度对EC50影响显著;回归方程的精确度高,R2均大于0.98;45 ℃条件下EC50最小,为15.650 μg/mL;其次为37 ℃条件下的EC50为91.275 μg/mL;30 ℃条件下EC50最大,为165.045 μg/mL。

表2 类胡萝卜素清除DPPH自由基的回归方程及EC50Table 2 Regression equation and EC50 of DPPH radical scavenging
此外,不同结构的类胡萝卜素EC50也存在差异,如李海毅[10]报道叶黄素对DPPH自由基的EC50为0.408 μg/mL;袁永成[11]报道番茄红素对DPPH自由基的EC50为52.62 μg/mL;Jiménez-Escrig等[6]评价6 种类胡萝卜素清除DPPH自由基的能力,发现6 种结构相似的类胡萝卜素的t(EC50)从12~29 min不等。原因可能为不同结构的类胡萝卜素的活性存在差异;反应时间的不同导致对其抗氧化活性的评价造成了误判。因此,若在不了解抗氧化剂与DPPH自由基反应的动力学机制的情况下,就简单将反应控制在某一时间内,并在相同条件下与其他抗氧化剂的EC50值进行比较,可能会造成误判。
2.2.2 类胡萝卜素与BHT、VE的清除自由基能力比较分别配制不同质量浓度的类胡萝卜素、BHT和VE溶液,比较3 种抗氧化剂对DPPH自由基的清除能力,并参照2.2.1节结果将反应时间固定为30 min。

图3 类胡萝卜素与BHT及VE清除DPPH自由基能力比较Fig. 3 Comparison of DPPH radical scavenging activity among carotenoids, BHT and VE
如图3所示,类胡萝卜素、BHT和VE这3 种物质对DPPH自由基的清除率大小由强到弱为:VE>类胡萝卜素>BHT。当质量浓度小于80 μg/mL时,类胡萝卜素对DPPH自由基的清除率显著低于VE对DPPH自由基的清除率,而当质量浓度大于80 μg/mL时,类胡萝卜素对DPPH自由基的清除率与VE对DPPH自由基清除率的差异不显著,且显著高于BHT对DPPH自由基的清除率,可见类胡萝卜素具有良好的DPPH自由基清除能力。
由于类胡萝卜素的一条较长的共轭不饱和双键链形成一个由所有C原子共享的π键系统,而π电子系统从基态到激发态的能量差相对较小,因此类胡萝卜素具有明显的同时作为电子供体和受体的特性,这使其具有较强的反应活性,易与自由基反应形成无害产物或通过破坏自由基链反应将自由基清除[12]。
2.3 类胡萝卜素抗氧化动力学参数分析
将实验测得的数据进行不同反应级数的模型拟合与分析,以282.72 μg/mL类胡萝卜素为例,分别以(1-α)-t、ln(1-α)-t、1/(1-α)-t作图。由图4可知,在45、37、30 ℃条件下,(1-α)-t拟合曲线的R2分别为0.950 1、0.997 2和0.999 7;ln(1-α)-t拟合曲线的R2分别为0.753 9、0.869 0和0.925 2;1/(1-α)-t拟合曲线的R2分别为0.958 1、0.922 5和0.908 6,即ln(1-α)-t曲线图的R2最高,拟合度最好。用相同方法考察其余3 组质量浓度的类胡萝卜素,均得到一致的结果。可见,类胡萝卜素清除DPPH自由基的反应动力学模型属一级反应动力学模型[13-14]。
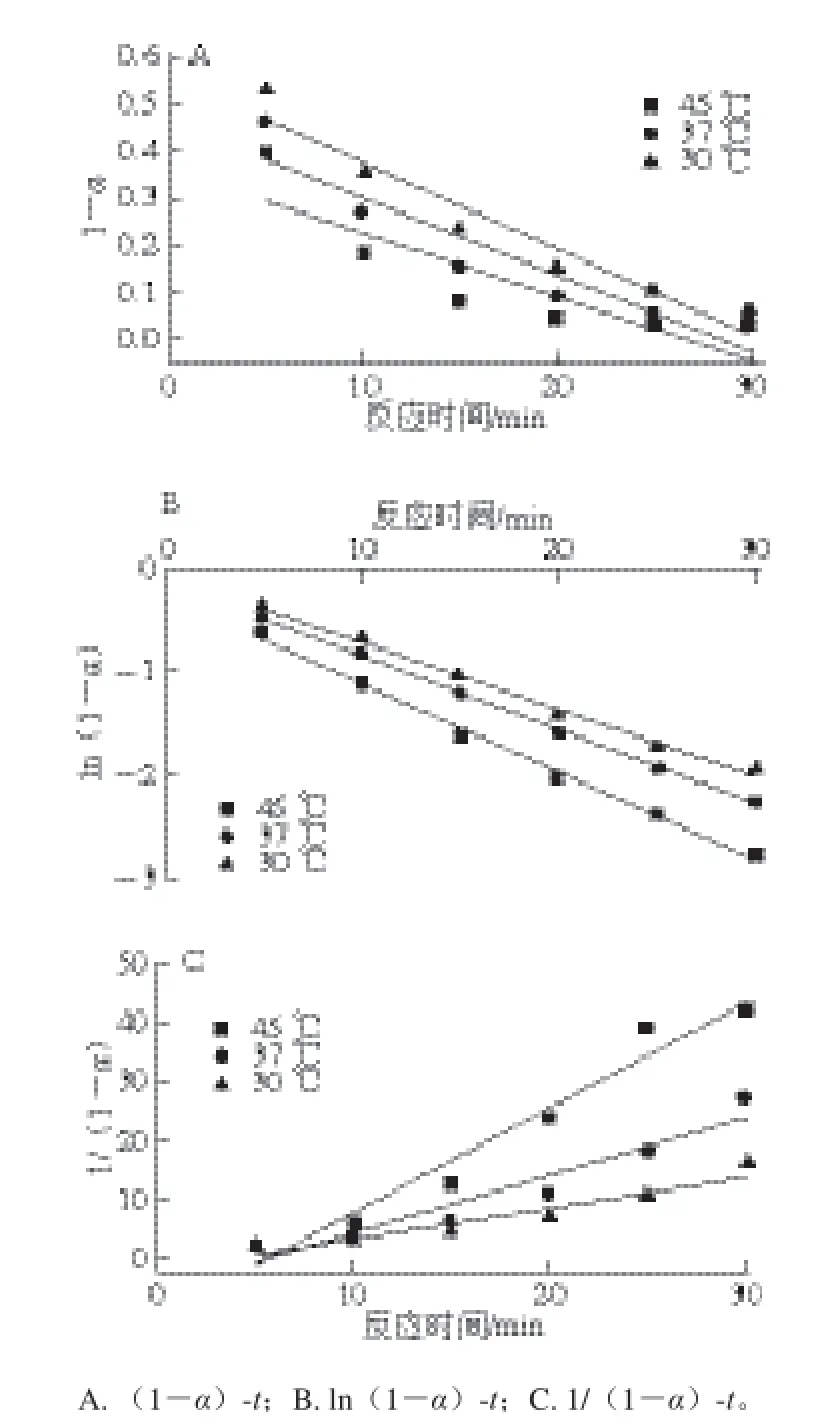
图4 类胡萝卜素抗氧化动力学拟合曲线Fig. 4 Kinetic curves of (1-a)-t, ln(1-a)-t and 1/(1-a)-t
根据图4求得反应速率常数k,依据Arrhenius公式(k=K0×exp(-Ea/RT),式中:Ea为表观活化能/(kJ/mol);K0为方程常数;k为速率常数;R为气体常数,8.314 dm3·kPa/(K·mol);T为绝对温度/K),以lnk对1/T绘制曲线,得到Ea及K0,并由k计算得半衰期t1/2(此处的半衰期是指清除一半DPPH自由基所需的时间),结果见表3。k随反应温度的升高和类胡萝卜素质量浓度的增大而增大,这说明升温利于反应的进行;不同类胡萝卜素质量浓度下Ea和K0虽存在差异,但差异不显著,故Ea和K0不受类胡萝卜素质量浓度的影响。反应温度对k影响显著,即升温可提高反应速率,有利于反应的进行,t1/2也越小。但并非T越高k就越大,较高的反应温度会破坏类胡萝卜素的活性结构,从而使k大大降低;反应温度的升高促使EC50降低。

表3 类胡萝卜素抗氧化动力学参数Table 3 Parameters for antioxidant kinetics of carotenoids
2.4 体外模拟消化对类胡萝卜素抗氧化特性的影响
体外模拟消化模型可预测食物成分的释放、食物结构变化等,具有经济简便、准确性高、重现性好等特点,近年来在食品营养吸收、药物代谢、食品摄入安全评价等方面越来越受重视[15]。目前对类胡萝卜素抗氧化性的研究多停留在检测其化学抗氧化活性方面,但化学分析法往往忽略了抗氧化剂在机体中的摄入状况、生物利用率及生理代谢等生物指标而不能准确反映抗氧化剂真实的体内抗氧化能力。研究消化后类胡萝卜素的抗氧化特性可为其发挥功能的机理研究提供参考依据。由于脂溶性的类胡萝卜素难进入水相中,而DPPH自由基清除实验是在水溶性的乙醇体系中反应,因此借鉴前人研究成果[16],选择吐温-40乳化类胡萝卜素。
2.4.1 人工胃液模拟消化类胡萝卜素


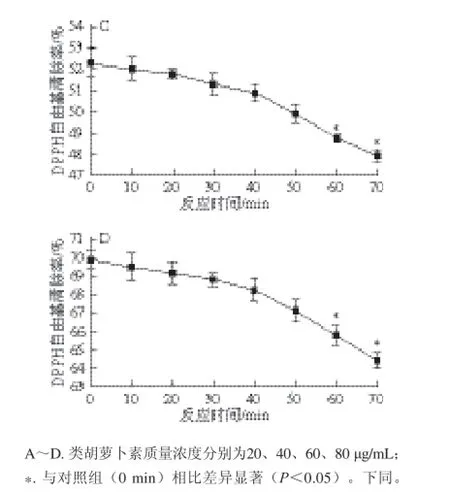
图5 体外人工胃液模拟消化对类胡萝卜素清除DPPH自由基的影响Fig. 5 Effect of in vitro artifi cial gastric juice digestion on the DPPH free radical scavenging activity of carotenoids
图5A~D分别表示质量浓度为20、40、60、80 μg/mL的类胡萝卜素经人工胃液模拟消化后清除DPPH自由基的效果。经体外胃液模拟消化后,类胡萝卜素清除DPPH自由基的能力均有所降低,模拟消化时间为60、70 min的类胡萝卜素DPPH自由基清除率与对照组(0 min)相比差异显著;类胡萝卜素的初始质量浓度越高,经胃液模拟消化后其清除DPPH自由基能力下降的百分点越大,而降幅则越小:20 μg/mL类胡萝卜素的DPPH自由基清除率从16.18%降至13.48%,降幅16.69%(图5A);40 μg/mL类胡萝卜素的DPPH自由基清除率从37.65%降至34.05%,降幅9.56%(图5B);60 μg/mL类胡萝卜素的DPPH自由基清除率从52.26%降至47.92%,降幅8.31%(图5C);80 μg/mL类胡萝卜素的DPPH自由基清除率从69.88%降至64.45%,降幅7.77%(图5D)。
2.4.2 人工肠液模拟消化类胡萝卜素
图6A~D分别表示质量浓度为20、40、60、80 μg/mL的类胡萝卜素经人工肠液模拟消化后清除DPPH自由基的效果。经体外肠液模拟消化后,类胡萝卜素清除DPPH自由基的能力均有所降低,模拟消化时间为120 min的类胡萝卜素DPPH自由基清除率与对照组(0 min)相比差异显著;类胡萝卜素的初始质量浓度越高,经肠液模拟消化后其清除DPPH自由基能力下降的百分点越大,而降幅则越小:20 μg/mL类胡萝卜素的DPPH自由基清除率从18.70%降至14.99%,降幅19.84%(图6A);40 μg/mL类胡萝卜素的DPPH自由基清除率从39.76%降至35.41%,降幅10.94%(图6B);60 μg/mL类胡萝卜素的DPPH自由基清除率从53.83%降至48.75%,降幅9.44%(图6C);80 μg/mL类胡萝卜素的DPPH自由基清除率从73.87%降至67.51%,降幅8.61%(图6D)。

图6 体外人工肠液模拟消化对类胡萝卜素清除DPPH自由基的影响Fig. 6 Effect of in vitro artifi cial intestinal juice digestion on the DPPH free radical scavenging activity of carotenoids
2.4.3 人工胃液-肠液二步法模拟消化类胡萝卜素

图7 体外人工胃液-肠液模拟消化对类胡萝卜素清除DPPH自由基的影响Fig. 7 Effect of in vitro gastrointestinal digestion on the DPPH free radical scavenging activity of carotenoids
图7是质量浓度分别为20、40、60、80 μg/mL的类胡萝卜素与不同种类植物油混合后经人工胃液-肠液模拟消化后清除DPPH自由基的效果。20 μg/mL类胡萝卜素经模拟消化后,DPPH自由基清除率由弱到强分别为:大豆油组(7.49%)<菜籽油组(9.02%)<对照组(不加植物油)(11.39%),与对照组相比,大豆油组和菜籽油组的DPPH自由基清除率分别下降30.64%和20.81%;40 μg/mL类胡萝卜素经模拟消化后,DPPH自由基清除率由弱到强分别为:大豆油组(25.17%)<菜籽油组(27.59%)<对照组(29.89%),与对照组相比,大豆油组和菜籽油组DPPH自由基清除率分别下降15.79%和7.69%;60 μg/mL类胡萝卜素经模拟消化后,DPPH自由基清除率由弱到强分别为:大豆油组(38.23%)<菜籽油组(40.54%)<对照组(43.17%),与对照组相比,大豆油组和菜籽油组DPPH自由基清除率分别下降11.44%和6.09%;80 μg/mL类胡萝卜素经模拟消化后,DPPH自由基清除率由弱到强分别为大豆油组(53.37%)<菜籽油组(56.06%)<对照组(58.81%),与对照组相比,大豆油组和菜籽油组的DPPH自由基清除率分别下降9.25%和4.68%。故得出结论,类胡萝卜素经体外人工模拟消化后,DPPH自由基清除能力由弱到强的顺序为:大豆油组<菜籽油组<对照组,与对照组相比,DPPH自由基清除率下降幅度则是大豆油组>菜籽油组;且大豆油组与对照组具有明显差异,而菜籽油组与其他两组的差异不明显。
与植物油混合后的类胡萝卜素清除DPPH自由基的能力低于对照组(不加植物油),说明油脂的加入利于类胡萝卜素的消化吸收,这与“脂类的存在对促进类胡萝卜素的生物利用率具有重要意义”[17]的结论相符。Prince等[18]也发现类胡萝卜素与脂肪同时食用可促进人体对类胡萝卜素的消化吸收,原因是胡萝卜素脂溶性的特点使之与脂肪同服能促进吸收,机理可能是脂肪的摄入促进了胆汁的释放,进而使类胡萝卜素在肠道内形成胶束,促进其吸收[19]。不同质量浓度类胡萝卜素中添加不同种类的植物油(大豆油和菜籽油),经模拟消化后DPPH自由基清除率为大豆油组<菜籽油组,即类胡萝卜素生物利用率为大豆油组>菜籽油组。Nidhi等[17]也发现不同植物油对类胡萝卜素生物利用率影响不同,各种油脂中类胡萝卜素的生物利用率从大到小依次为橄榄油>玉米油>大豆油>葵花籽油>花生油>米糠油>棕榈油,推测原因为不同油脂的饱和度及脂肪酸组成对类胡萝卜素消化率具有影响。大豆油中主要脂肪酸为亚油酸(含量50.84%),其次是油酸(含量20.68%),饱和脂肪酸含量14.92%,不饱和脂肪酸含量80.70%;菜籽油中的主要脂肪酸为油酸(含量51.07%),其次是亚油酸(含量18.03%),饱和脂肪酸含量6.66%,不饱和脂肪酸含量89.24%[20],即大豆油中以亚油酸为主,菜籽油中以油酸为主,且大豆油中的饱和脂肪酸含量高于菜籽油。故推测造成此现象的原因有:1)饱和脂肪酸含量较高的植物油更能促进类胡萝卜素的吸收。类胡萝卜素与饱和脂肪酸形成的胶束大小小于与不饱和脂肪酸形成的胶束大小,进而利于人体的消化吸收。Gleize等[21]也发现,饱和度高的椰子油比饱和度低的菜籽油更利于类胡萝卜素的吸收。2)植物油中亚油酸对类胡萝卜素消化吸收的影响大于油酸,即多不饱和脂肪酸会增加类胡萝卜素在食糜中的氧化程度。Clark等[22]也发现,油脂中的高不饱和脂肪酸会促进番茄红素自身的氧化程度。3)目前关于促进类胡萝卜素生物利用率的最佳油脂含量仍不确定,但很可能与类胡萝卜素及油脂的种类有关[23]。此外,经体外人工模拟消化后类胡萝卜素对DPPH自由基的清除率降幅不是很大,说明类胡萝卜素被人体消化吸收的量较少,即类胡萝卜素不易被人体吸收,这与类胡萝卜素在人体内的吸收率较低(3%~34%)的报道相吻合[24]。

图8 不同体外模拟消化方法对类胡萝卜素清除DPPH自由基能力的影响Fig. 8 Comparative effects of different in vitro digestion models on theDPPH free radical scavenging activity of carotenoids
图8 是质量浓度分别为20、40、60、80 μg/mL类胡萝卜素经人工胃液、肠液和胃液-肠液3 种方法模拟消化后清除DPPH自由基的效果。20 μg/mL类胡萝卜素经模拟消化后,DPPH自由基清除率由弱到强分别为胃液-肠液模拟组(11.39%)<胃液模拟组(13.48%)<肠液模拟组(14.99%);40 μg/mL类胡萝卜素经模拟消化后,DPPH自由基清除率由弱到强分别为胃液-肠液模拟组(29.89%)<胃液模拟组(34.05%)<肠液模拟组(35.41%);60 μg/mL类胡萝卜素经模拟消化后,DPPH自由基清除率由弱到强分别为胃液-肠液模拟组(43.17%)<胃液模拟组(47.92%)<肠液模拟组(48.75%);80 μg/mL类胡萝卜素经模拟消化后,DPPH自由基清除率由弱到强分别为胃液-肠液模拟组(58.81%)<胃液模拟组(64.45%)<肠液模拟组(67.51%)。故得出结论,类胡萝卜素经人工胃液、肠液和胃液-肠液3 种方法模拟消化后,DPPH自由基清除能力由弱到强的顺序为:胃液-肠液模拟组<胃液模拟组<肠液模拟组;且胃液-肠液模拟组与其他两组具有明显差异。经人工胃液、肠液和胃液-肠液3 种方法模拟消化后的类胡萝卜素对DPPH自由基清除能力减弱。这说明类胡萝卜素在胃中的消化程度大于在小肠中,可能是由于胃中强酸环境导致类胡萝卜素结构不稳定所致;Courraud等[25]也发现胃液的酸性环境对类胡萝卜素结构的影响极大。经胃液-肠液二步法消化后类胡萝卜素的消化率高于单一步骤的原因可能是在胃液中转化的部分前体物质继续在肠液中被消化成不具有抗氧化活性的成分。
3 结 论
类胡萝卜素对DPPH自由基有较强的清除作用,当类胡萝卜素质量浓度高于80 μg/mL时,其清除DPPH自由基能力与VE相当,且高于BHT清除DPPH自由基的能力;反应时间对清除速率常数k影响显著且表现为:k45℃>k37℃>k30℃,但对DPPH自由基清除率(α)影响不显著;类胡萝卜素质量浓度对DPPH自由基清除率影响显著且表现为:α(282.72 μg/mL)>α(212.04 μg/mL)>α(141.36 μg/mL)>α(70.68 μg/mL),即在一定范围内类胡萝卜素质量浓度越高,其DPPH自由基清除能力越强,而对k影响不显著,而当类胡萝卜素质量浓度增大到某个临界值时,DPPH自由基清除率保持稳定。由此可见,类胡萝卜素作为抗氧化剂在30 min内可达到较好的抗氧化效果。
在体温附近的温度范围内,类胡萝卜素清除DPPH自由基的回归方程分别为:45 ℃:y=8.181x-393.4,EC50为15.650 μg/mL;37 ℃:y=7.922 1x-304.83,EC50为91.275 μg/mL;30 ℃:y=7.899 7x-229.94,EC50为165.045 μg/mL。EC50的变化趋势与所求的反应速率一致。类胡萝卜素清除DPPH自由基的反应符合一级反应动力学方程,具有一级反应动力学的特征,其表观活化能Ea和方程常数K0受类胡萝卜素质量浓度的影响甚微。
经模拟消化后的类胡萝卜素清除DPPH自由基的能力降低,且初始质量浓度越高,类胡萝卜素DPPH自由基清除能力下降越明显,而降幅越小;加油脂组与不加油脂的对照组相比,DPPH自由基清除率由弱到强的顺序为:大豆油组<菜籽油组<对照组,且大豆油组与对照组呈显著性差异,而菜籽油组与其他两组的差异不显著;人工胃液-肠液二步法与人工胃液、人工肠液一步法相比,DPPH自由基清除率由弱到强的顺序为:胃液-肠液模拟组<胃液模拟组<肠液模拟组,且胃液-肠液模拟组分别与胃液模拟组、肠液模拟组呈显著性差异。
虽然类胡萝卜素人工模拟消化的数据与从人体内得到的数据相近,但人工模拟消化仅是静态的、有限因素的模拟,而人体消化是一个受酶浓度、环境因素、人体体质等众多因素影响的动态的、极复杂的过程,因此有许多研究者进行了模拟消化体系的改进[26-27],这也是今后值得进一步完善的工作。另外,对实验方法、类胡萝卜素消化代谢产物及其机理的探索,以及体外细胞培养研究模拟类胡萝卜素在体内摄入和分泌过程等均有待进一步探明。
[1] DWYER J H, NAVAB M, DWYER K M, et al. Oxygenated carotenoid lutein and progression of early atherosclerosis: the Los Angeles atherosclerosis study[J]. Circulation, 2001, 103(24): 2922-2927. DOI:10.1161/01.CIR.103.24.2922.
[2] BENDICH A. Carotenoids and the immune response[J]. Journal of Nutrition, 1989, 119(1): 112-115.
[3] ZIEGLER R G. A review of epidemiologic evidence that carotenoids reduce the risk of cancer[J]. Journal of Nutrition, 1989, 119(1): 116-122.
[4] OLIVER J, PALOU A. Hromatographic determination of carotenoids in foods[J]. Journal of Chromatography A, 2000, 881(1/2): 543-555. DOI:10.1016/S0021-9673(00)00329-0.
[5] Food and Agriculture Organization of the United Nations (FAO) statistical yearbook 2014: Europe and Central Asia food and agriculture[EB/OL]. [2014-10-03]. http://www.fao.org/3/a-i3621e.pdf.
[6] JIMÉNEZ-ESCRIG A, JIMÉNEZ-JIMÉNEZ I, SÁNCHEZMORENO C, et al. Evaluation of free radical scavenging of dietary carotenoids by the stable radical 2,2-diphenyl-1-picrylhydrazyl[J]. Journal of the Science of Food and Agriculture, 2000, 80(11): 1686-1690. DOI:10.1002/1097-0010(20000901)80:11<1686::AIDJSFA694>3.0.CO;2-Y.
[7] 惠伯棣. 类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社, 2005: 1-20.
[8] MÜLLER L, FRÖHLICH K, BÖHM V. Comparative antioxidant activities of carotenoids measured by ferric reducing antioxidant power (FRAP), ABTS bleaching assay (αTEAC), DPPH assay and peroxyl radical scavenging assay[J]. Food Chemistry, 2011, 129(1): 139-148. DOI:10.1016/j.foodchem.2011.04.045.
[9] LEMMENS L, van BUGGENHOUT S, van LOEY A M, et al. Particle size reduction leading to cell wall rupture is more important for the β-carotene bioaccessibility of raw compared to thermally processed carrots[J]. Journal of Agricultural and Food Chemistry, 2010, 58(24): 12769-12776. DOI:10.1021/jf102554h.
[10] 李海毅. 叶黄素的质量标准研究及抗氧化活性评价[D]. 长春: 吉林大学, 2012: 7-9.
[11] 袁永成. 番茄皮渣中番茄红素的提取、稳定性及其抗氧化性研究[D].无锡: 江南大学, 2011: 14-15.
[12] KARNAUKHOV V N. Caroteniods: recent progress, problems and prospects[J]. Comparative Biochemistry and Physiology, 1990, 95(1): 1-20. DOI:10.1016/0305-0491(90)90241-K.
[13] 张玉军. 物理化学[M]. 北京: 化学工业出版社, 2008: 28-30.
[14] TUBARO F, RAPUZZI P, URSIN F. Kinetic analysis of antioxidant capacity of wine[J]. Biofactors, 1999, 9(1): 37-47.
[15] BLANQUET S, ZEIJDNER E, BEYSSACE E, et al. A dynamic artificial gastrointestinal system for studying the behavior of orally administered drug dosage forms under various physiological conditions[J]. Pharmaceutical Research, 2004, 21(4): 585-591. DOI:10.1023/B:PHAM.0000022404.70478.4b.
[16] 颜秀花, 王正武, 刘汉文. O/W型微乳液对β-胡萝卜素增溶作用[J].食品科技, 2010, 35(2): 40-43.
[17] NIDHI B, BASKARAN V. Infl uence of vegetable oils on micellization of lutein in a simulated digestion model[J]. Journal of the American Oil Chemists’ Society, 2011, 88(3): 367-372. DOI:10.1007/s11746-010-1677-8.
[18] PRINCE M R, FRISOLI J K. β-Carotene accumulation in serum and in skin[J]. American Journal of Clinical Nutrition, 1993, 57(2): 175-181.
[19] HERDEN E, DIAZ V, SVAMBERG U. Estimation of carotenoids accessibility from carrots determined by an in vitro digestion methodl[J]. European Journal of Clinical Nutrition, 2002, 56(5): 425-430. DOI:10.1038/sj/ejcn/1601329.
[20] 陈月晓, 马玉霞, 陆颖, 等. 常见食用植物油中特征性脂肪酸的检测及鉴别[J]. 中国食品卫生杂志, 2012, 24(4): 301-305.
[21] GLEIZE B, TOUMIAIRE F, DEPEZAY L, et al. Effect of type of TAG fatty acids on lutein and zeaxanthin bioavailability[J]. British Journal of Nutrition, 2013, 110(1): 1-10. DOI:10.1017/ S0007114512004813.
[22] CLARK R M, YAO L, SHE L, et al. A comparison of lycopene and astaxanthin absorption from corn oil and olive oil emulsions[J]. Lipids, 2000, 35(7): 803-806. DOI:10.1007/s11745-000-0589-8.
[23] BOHN T. Bioavailability of non-provitamin a carotenoids[J]. Current Nutrition and Food Science, 2008, 4(4): 240-258. DOI:10.2174/157340108786263685.
[24] CASTENMILLER J J, WEST C E. Bioavailability and bioconversion of carotenoids[J]. Annual Review of Nutrition, 1998, 18(1): 19-38. DOI:10.1146/annurev.nutr.18.1.19.
[25] COURRAUD J, BERGER J, CRISTOL J P, et al. Stability and bioaccessibility of different forms of carotenoids and vitamin A during in vitro digestion[J]. Food Chemistry, 2013, 136(2): 871-877. DOI:10.1016/j.foodchem.2012.08.076.
[26] ERIC B, ANOUK K, LUCIEN H, et al. Dietary and host-related factors infl uencing carotenoid bioaccessibility from spinach (Spinacia oleracea)[J]. Food Chemistry, 2011, 125(4): 1328-1334. DOI:10.1016/ j.foodchem.2010.09.110.
[27] ERDMAN J W, FAHEY G C, WHITE C B. Effects of purifi ed dietary fiber sources on β-carotene utilization by the chick[J]. Journal of Nutrition, 1986, 116(12): 2415-2423.
Kinetics of Free Radical Scavenging Activity of Carotenoids and Effect of in Vitro Simulated Gastrointestinal Digestion on Their Radical Scavenging Capacity
LIU Xiaogeng, YUAN Lei, GAO Mei, HU Qiuhui, WANG Lifeng, LIU Qin
(Key Laboratory of Grains and Oils Quality Control and Processing, Collaborative Innovation Center for Modern Grain Circulation and Safety, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China)
The 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity of carotenoids at different concentrations was determined as a function of temperature and changes in this activity after in vitro simulated digestion in artifi cial gastric juice, artifi cial intestinal juice and artifi cial gastrointestinal juice were investigated. The radical scavenging rate constant k was significantly negatively correlated with reaction temperature (P < 0.05), that is, k45℃> k37℃> k30℃. The radical scavenging capacity α was not signifi cantly infl uenced by reaction temperature, but it was signifi cantly positively correlated with initial carotenoids concentration, which did not signifi cantly affect k value. The scavenging reaction was fi tted to a first-order reaction kinetics. EC50, k and half-life t1/2were significantly influenced by reaction temperature and higher temperature resulted in reduced EC50and t1/2, and increased k. The apparent activation energy Eaand the constant K0were not infl uenced by the initial concentration of carotenoids, which were 17.039 kJ/mol and 7.38 × 106, respectively. The radical scavenging capacity of carotenoids was decreased after in vitro gastrointestinal digestion. Moreover, the radical scavenging capacity of carotenoids mixed with oil was lower than that with no oil added, suggesting that fat-soluble carotenoids are more easily digested in oil. The digestion and absorption of carotenoids were signifi cantly infl uenced by different types of oil containing different fatty acid compositions.
carotenoids; kinetics; apparent activation energy; 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical; in vitro gastrointestinal digestion
10.7506/spkx1002-6630-201611012
TS201.1
A
2015-06-22
江苏高校优势学科建设工程资助项目(2014-2016);“十二五”国家科技支撑计划项目(2012BAD37B08);江苏高校粮油质量安全控制及深加工技术重点实验室项目(LYPK201301)
刘晓庚(1962—),男,教授,硕士,研究方向为食品科学。E-mail:lxg_6288@163.com

