香蕉BBI型蛋白酶抑制剂(MaBBI1)的诱导、变性和复性
黄司法,唐志敏,杨礼香
(广州大学生命科学学院,广东 广州 510006)
香蕉BBI型蛋白酶抑制剂(MaBBI1)的诱导、变性和复性
黄司法,唐志敏,杨礼香
(广州大学生命科学学院,广东 广州510006)
BBI(Bowman-Birk protease inhibitor)是一种富含半胱氨酸的植物蛋白酶抑制剂,其抑制的蛋白酶主要包括胰蛋白酶、糜蛋白酶和弹性蛋白酶等丝氨酸蛋白酶。以从香蕉(Musa acuminata L. cv.Brazilian)根中提取的总RNA逆转录成的cDNA为模板,根据NCBI公布的野生型马来西亚蕉(Musa acuminata subsp. Malaccensis)BBI基因(收录号:XM_009415512)的序列设计引物,克隆了1个BBI型蛋白酶抑制剂基因(MaBBI1)。MaBBI1基因大小为381 bp,编码126个氨基酸,包括12个半胱氨酸(9.5%),将该基因构建到载体pGEX-6P-1上转化大肠杆菌Rossetta菌株进行重组蛋白GST-MaBBI1的诱导表达。在IPTG诱导3 h后,一个预测分子量为40.8953 ku的GST-MaBBI1融合蛋白被大量表达。IPTG诱导后的GST-MaBBI1融合蛋白是不溶的并累积成包涵体,通过对包涵体进行变性和复性的方法得到可溶的GST-MaBBI1融合蛋白,为进一步在体外研究该蛋白的功能奠定基础。
香蕉;Bowman-Birk蛋白酶抑制剂(BBI);诱导;变性;复性
黄司法,唐志敏,杨礼香. 香蕉BBI型蛋白酶抑制剂(MaBBI1)的诱导、变性和复性[J].广东农业科学,2016,43(9):44-50.
蛋白酶抑制剂广泛存在于动植物中,可抑制不同来源的蛋白水解酶。植物含有大量的蛋白酶抑制剂,生殖器官、储藏器官和营养器官均可表达此类蛋白。植物在正常生长发育、遭遇草食性动物侵食、病原菌和害虫侵害时均可产生蛋白酶抑制剂以抵御病虫害[1-2]。目前,59个不同的蛋白酶抑制剂家族已经被归类[3],其中富含半胱氨酸的蛋白酶抑制剂被归纳为BBI(Bowman-Birk protease inhibitor)家族[4]。BBI最早由Bowman在大豆中发现,并由Birk纯化[5-6],其抑制的蛋白酶主要包括胰蛋白酶、糜蛋白酶和弹性蛋白酶等丝氨酸蛋白酶[7]。大量研究表明,BBI型蛋白酶抑制剂具有多种生理功能,包括调节内源蛋白酶活性、存储含硫氨基酸、防止病原微生物入侵和抵抗虫害[8-9]。体外实验表明,BBI可以抑制昆虫肠道消化酶的活性[10],体内实验表明,昆虫食用含BBI的食物后表现出营养不良[11]。此外,BBI抗炎、免疫激活和抗癌的功能也陆续被报道[12-14],这表明BBI在防卫反应中起重要作用。
香蕉是三倍体,难以通过常规育种方法得到品种改良。因此,充分挖掘香蕉自身的抗性基因尤为重要。本研究从香蕉(Musa acuminata L.cv.Brazilian)中克隆了1个BBI型蛋白酶抑制剂基因(MaBBI1),构建了GST融合蛋白表达载体pGEX-6P-1-MaBBI1,并成功诱导出GSTMaBBI1融合蛋白。诱导后的GST-MaBBI1融合蛋白累积成包涵体,通过对包涵体进行变性和复性的方法得到了可溶的GST-MaBBI1蛋白,为进一步在体外研究其生物学功能奠定基础。
1 材料与方法
1.1试验材料
香蕉苗(Musa acuminata L.cv.Brazilian)由广东省农业科学院提供,大肠杆菌菌株DH5α、Rossetta,蛋白表达载体pGEX-6P-1均由中国科学院华南植物园提供。
1.2试验方法
1.2.1目的基因MaBBI1的克隆 用苗龄2周的香蕉出根苗为试验材料,取5 g根用于提取总RNA,总RNA的提取依照Magen公司HiPure Plant RNA Kits(R4151)的说明书进行。以总RNA为模板采用两步法逆转录cDNA,cDNA链的合成依照全式金公司TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix 的说明书进行。根据NCBI(http://www.ncbi.nlm. nih.gov/)公布的野生型马来西亚蕉(Musa acuminata subsp. Malaccensis)BBI基因(收录号:XM_009415512) 的序列,通过网站Convert PCR Primers Into In-Fusion® Primers(http:// bioinfo.clontech.com/infusion/convertPcrPrimersInit. do)在线设计引物,MaBBI1-PEF:5′-GGGGC CCCTGGGATCCATGAGGTACAACATGGTG-3′和 MaBBI1-PER:5′-GGAATTCCGGGGATCCCT ACTGGGCGAGGAGCGG-3′。以cDNA为模版,采用高保真Taq酶PCR扩增MaBBI1基因全长。目的片段的回收依照Magen公司HiPure Gel Pure DNA Kits说明书进行。基因所表达蛋白的分子量通过网站ProtParam(http://web.expasy. org/protparam/)进行预测。
1.2.2蛋白表达载体的构建 将蛋白表达载体pGEX-6P-1用BamHⅠ进行酶切,酶切后的载体的回收依照Magen公司HiPure Gel Pure DNA Kits说明书进行。通过In-Fusion的方法将目的基因与载体连接,依照TaKaRa公司In-FusionTMAdvantage PCR Cloning Kit的说明书进行。将连接产物加入100 μL 大肠杆菌DH5α感受态细胞中,在冰上放置30 min;42℃热击60 s后于冰中放置1 min;再加入800 μL LB液体培养基,于37℃恒温摇床(200 r/min)培养60 min。将上述菌液在LB 固体培养基(含100 μg/mL Amp)上涂板;待平板干燥后置于37℃恒温培养箱中倒置培养过夜形成单菌落;用引物MaBBI1-PEF 和MaBBI1-PER进行PCR鉴定阳性菌落。将筛选出来的阳性单菌落接种到LB液体培养基(含100 μg/mL Amp)中,于37℃恒温摇床(200 r/min)培养过夜;依照Magen公司HiPure Plasmid Micro Kit说明书提取重组质粒pGEX-6P-1-MaBBI1。重组质粒用BamHⅠ进行酶切鉴定,并送往Invitrogen公司测序。
1.2.3重组质粒pGEX-6P-1-MaBBI1转化大肠杆菌Rossetta 分别将测序正确的重组质粒pGEX-6P-1-MaBBI1和空载体pGEX-6P-1转化大肠杆菌Rossetta感受态细胞,方法如2.2.2所述。将上述菌液在LB 固体培养基(含100 μg/mL Amp、50 μg/mL Kan和34 μg/mL Chl)上涂板;待平板干燥后置于37℃恒温培养箱中倒置培养过夜形成单菌落。重组质粒转化菌株用引物MaBBI1-PEF 和 MaBBI1-PER进行PCR鉴定阳性菌落。
1.2.4GST-MaBBI1重组蛋白的诱导 分别挑取携带有重组表达载体和空载体(对照)的大肠杆菌Rossetta单菌落至5 mL 2×YT液体培养基(含100 μg/mL Amp、50 μg/mL Kan和34 μg/mL Chl)中;于37℃恒温摇床(200 r/min)培养过夜达到饱和。将上述培养液按1:100的比例转接到100 mL 新鲜的2×YT 液体培养基(含100 μg/mL Amp、50 μg/mL Kan和34 μg/mL Chl)中,于37℃恒温摇床(200 r/min)继续培养;待OD600至0.4~0.6时(约3 h),加入终浓度为0.2 mmol/L的IPTG,于37℃恒温摇床(200 r/min)继续培养3 h,将菌液于4℃、8000 r/min下离心8 min收集菌体。用4 mL预冷的1 ×PBS缓冲液(pH8.0)悬浮菌体,于冰上将重悬的菌体进行超声破碎(Φ3探头,20%功率,超声9 s,停止9 s,共30 min),离心(4℃、10 000 r/min,30 min)收集上清和沉淀。分别取上清和沉淀(包涵体)进行12% SDS-PAGE电泳检测,电泳后的胶用考马斯亮蓝R-250染色液进行染色,再用脱色液(5%乙醇,10%醋酸,85% dH2O)进行脱色以显示蛋白条带。
1.2.5包涵体(重组蛋白GST-MaBBI1)的变性与复性 将沉淀(包涵体)用2 mL洗涤缓冲液(10 mmol/L Tris-HCl pH7.8,300 mmol/L NaCl,1 mmol/L EDTA,1% TritonX-100,1 mol/L urea)悬浮,离心(4℃、8 000 r/min,8 min)收集沉淀;再加入2 mL溶解缓冲液(50 mmol/L Tirs-HCl pH7.8,5 mmol/L MgCl2,2.5 mmol/L β-mercaptoethanol,0.1% Tween20,8 mol/L urea)对沉淀进行重悬,将上述混合样品进行超声破碎(Φ3探头,20%功率,超声9 s,停止9 s,共30 min),离心(4℃、10 000 r/min,30 min)取上清;再往上清中逐滴加入复性缓冲液(0.4 mol/L L-Arginine,2 mmol/L DTT,0.5 mol/L NaCl,50 mmol/L Tris-HCl pH8.0)至urea终浓度为1 mol/L。把复性液转入透析袋中并用预冷的1×PBS缓冲液(pH8.0)透析6 h,期间每隔1 h换1次1×PBS缓冲液(pH8.0);用PGE20000将上述复性液浓缩至2 mL。取复性液进行12% SDS-PAGE电泳检测,电泳后的胶采用1.2.4所述方法进行染色和脱色以显示蛋白条带。
2 结果与分析
2.1MaBBI1基因的克隆
电泳显示MaBBI1大小位于300~500 bp之间(图1),测序结果表明其与NCBI公布的野生型马来西亚蕉BBI基因的序列相同,大小为381 bp,编码126个氨基酸,包括12个半胱氨酸(9.5%),预测MaBBI1基因所表达蛋白的分子量为14.0711 ku。

图1 克隆的MaBBI1基因电泳结果
2.2GST-MaBBI1重组蛋白在大肠杆菌Rossetta中的超量表达
将MaBBI1构建到pGEX-6P-1载体上转化大肠杆菌Rossetta进行GST-MaBBI1重组蛋白的诱导超量表达。在IPTG的诱导下大肠杆菌Rossetta表达1个预测分子量为40.8953 ku的GST-MaBBI1融合蛋白。12% SDS-PAGE电泳显示,诱导3 h后大量的重组蛋白GST-MaBBI1被表达(图2),累积蛋白条带位于34~43 ku之间,与预期相符。而转空载的对照则大量表达GST(图3),累积蛋白带大小约为26 ku。虽然诱导3 h后GST-MaBBI1融合蛋白的累积量较大,但以包涵体的形式存在于菌体沉淀中(图4)。
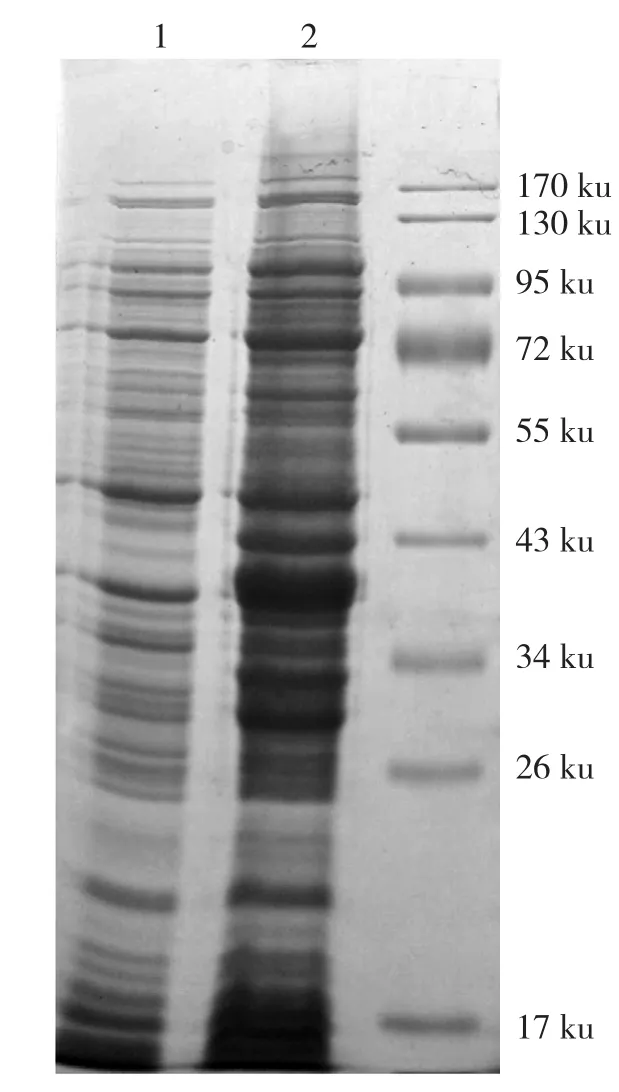
图2 GST-MaBBI1重组蛋白的诱导
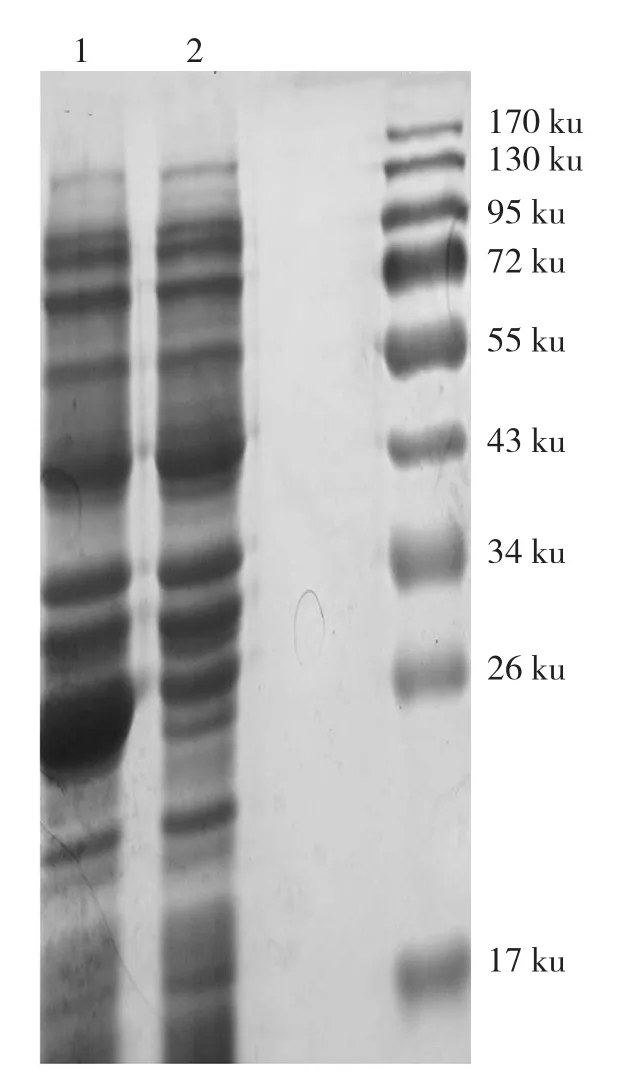
图3 GST蛋白的诱导
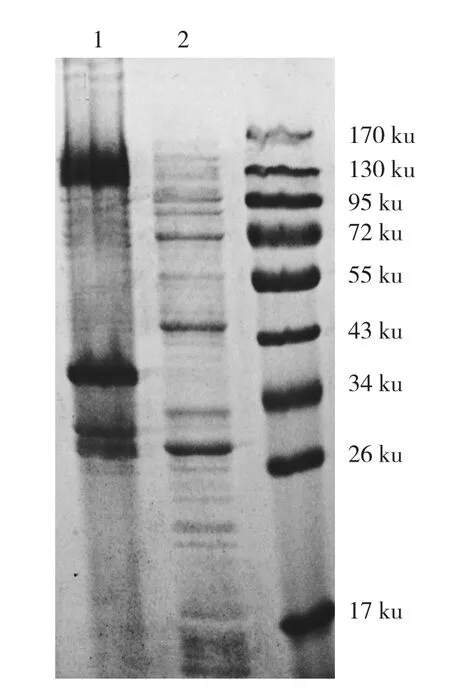
图4 GST-MaBBI1重组蛋白在IPTG诱导后累积成包涵体
2.3可溶的重组蛋白GST-MaBBI1
GST-MaBBI1包涵体在变性和复性后的12% SDS-PAGE电泳分析如图5所示。复性后的可溶蛋白条带位于34~43 ku 之间,符合GST-MaBBI1(40.8953 ku)的大小,成功获得可溶的重组蛋白GST-MaBBI1。
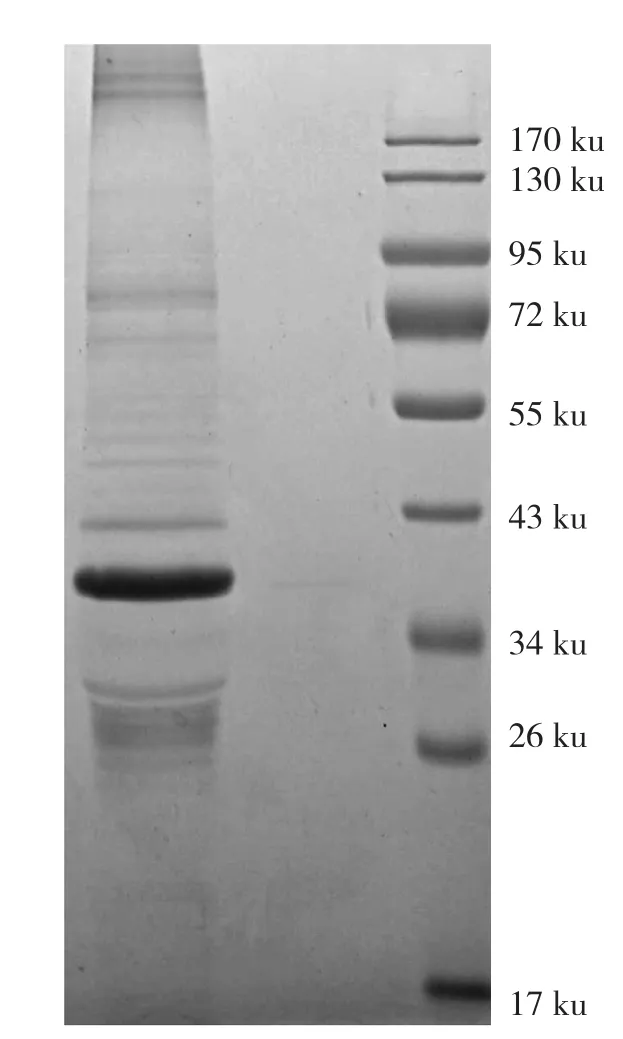
图5 包涵体变性和复性后可溶的GST-MaBBI1重组蛋白
3 结论与讨论
BBI是植物进化过程中获得的防御机制[15],广泛参与植物抗病虫害和抗逆的防卫反应。在抗病方面,大豆BBI参与免疫调节和抗炎反应[16],能通过抑制病原菌蛋白酶的活性,使病原菌不能水解寄主细胞的蛋白而无法获取充足营养,继而导致病原菌生长繁殖受限,浸染与扩展受阻,从而达到抗病目的[17]。在水稻中过量表达BBTI4可以增强水稻对白叶枯病的抗性[18]。在抗虫方面,抑制剂干预害虫的消化是植物天然的防御机制[19],这种防御机制表现为一种或多种防御蛋白如蛋白酶抑制剂、α淀粉酶抑制剂和凝集素的积累[20]。BBI能抑制的蛋白酶包括胰蛋白酶、糜蛋白酶及弹性蛋白酶等丝氨酸蛋白酶[7],而自然界多数昆虫的蛋白消化酶正是丝氨酸类蛋白消化酶[21]。作为蛋白酶抑制剂,BBI能抑制昆虫肠道中与消化相关的蛋白酶活性,使昆虫不能消化所食的蛋白质,继而导致昆虫缺乏营养及生长发育不良而死亡,从而起到抗虫的作用[22]。赤豆(Vigna umbellata)BBI在体外可以强烈抑制黑森瘿蚊(Mayetioa destructor)肠道胰蛋白酶和糜蛋白酶的活性[10],冥蛾(kuehniella)幼虫食用含有巴西木碟豆(Clitoria fairchildiana)BBI的食物后表现出营养不良[11]。在抗逆方面,水稻BBI家族可以通过形成二硫键来螯合重金属以减少游离的重金属对细胞的伤害[23]。花生(Arachis hypogaea L.)AhBBI参与干旱胁迫的耐受性[24],小麦BBI型蛋白酶抑制剂基因在烟草中超量表达可提高后代株系的耐盐性[25]。由此可见BBI在植物抗病虫害和抗逆基因工程育种中具有广阔的应用前景。
香蕉是许多热带和亚热带国家和地区的重要粮食作物,也作为我国南方的主要经济作物之一出口各国。香蕉枯萎病是制约香蕉产业发展的重要因素,是由古巴尖孢镰刀菌(Fusarium oxysporum f. sp. cubense)引起的一种由土壤传播的病害。近年来枯萎病迅速蔓延,几乎所有种植香蕉的国家和地区都遭受香蕉枯萎病的侵害,枯萎病对香蕉产业的发展构成了巨大的威胁[26]。目前尚未找到一种有效的化学防治方法应对香蕉枯萎病问题,而生物防治和抗病育种的方法越来越受到人们的重视。
香蕉为三倍体,难以通过常规杂交的方法获得改良品种,急需大力挖掘香蕉自身的抗病基因资源,研究其抗病机理。通过微观层面操纵抗病基因的表达,将从根本上解决香蕉病害的问题,对香蕉品种的改良具有重要意义。目前还没有关于香蕉BBI基因功能研究的报道,本研究从香蕉中克隆了1个MaBBI1基因,大小为381 bp,编码126个氨基酸,包括12个半胱氨酸(9.5%),预测MaBBI1基因所表达蛋白的分子量为14.0711 ku。植物蛋白酶抑制剂是一类分子量为8~20 ku的小分子蛋白,广泛分布于单子叶植物和双子叶植物中[27],富含半胱氨酸是BBI型蛋白酶抑制剂的特征[4]。MaBBI1具有BBI型蛋白酶抑制剂的一般特征。将MaBBI1构建到pGEX-6P-1载体上转化大肠杆菌Rossetta进行GST-MaBBI1重组蛋白的诱导超量表达。在IPTG诱导3 h后一个预测分子量为40.8953 ku的GST-MaBBI1融合蛋白在大肠杆菌Rossetta中大量表达。虽然大多数带GST标签的重组蛋白是可溶的,但GSTMaBBI1在IPTG诱导后累积成包涵体。Li等[28]在诱导GST-RBBI8时遇到相同的问题,原因可能是RBBI8富含的半胱氨酸影响了重组蛋白的折叠。MaBBI1与RBBI8相似,富含的半胱氨酸同样可能影响重组蛋白的正常折叠,从而使得GST-MaBBI1的二硫键无法正确配对而形成包涵体。通过对包涵体进行变性和复性的方法成功获得可溶的GST-MaBBI1蛋白,为进一步在体外探究该蛋白的生物学功能奠定基础。
[1]Lopes A R,Juliano M A,Juliano L,et al. Coevolution of insect trypsins and inhibitors[J]. Arch Insect Biochem Physiol,2004,55:140-152.
[2]Oliveira C F R,de Paula S T,Parra J R P,et al.Insensitive trypsins are differentially transcribed during Spodoptera frugiperda adaptation againstplant protease inhibitors[J]. Comp Biochem Physiol,2013,165:19-25.
[3]Christeller J T. Evolutionary mechanisms acting on proteinase inhibitor variability[J]. FEBS Journal,2005,272:5710-5722.
[4]Prakash B,Selvaraj S,Murthy M R N,et al. Analysis of the amino acid sequences of plant Bowman-Birk inhibitors[J]. Journal of Molecular Evolution,1996,42(5):560-569.
[5]Bowman D E. Differentiation of soybean antitryptic factors[J]. Proc Soc Exp Biol Med,1946,63:547-550.
[6]Birk Y. Purification and some properties of a highly active inhibitor of trypsin and a-chymotrypsin from soybean[J]. Biochim Biophys Acta,1961,54:378-380.
[7]Barros B d A,da Silva W G,Moreira M A,et al. In silico characterization and expression analysis of the multigene family encoding the Bowman-Birk protease inhibitor in soybean[J]. Mol Biol Rep,2012,39(1):327-334.
[8]Prasad E R,Dutta-Gupta A,Padmasree K. Insecticidal potential of Bowman-Birk proteinase inhibitors from red gram(Cajanus cajan)and black gram(Vigna mungo)against lepidopteran insect pests[J]. Pestic Biochem Physiol,2010,98:80-88.
[9]Lioi L,Galasso I,Daminati M,et al. Inhibitory properties and binding loop polymorphism in Bowman-Birk inhibitors from Phaseolus species[J]. Genet Resour Crop Evolution,2010,57:533-542.
[10]Katoch R,Singh S K,Thakur N,et al. Cloning,characterization,expression analysis and inhibition studies of a novel gene encoding Bowman-Birk type protease inhibitor from rice bean[J]. Gene,2014,546:342-351.
[11]Dantzger M,Vasconcelos I M,Scorsato V,et al. Bowman-Birk proteinase inhibitor from Clitoria fairchildiana seeds:Isolation,biochemical properties and insecticidal potential[J]. Phytochemistry,2015,118:224-235.
[12]Kennedy A R. The Bowman-Birk inhibitor from soybeans as an anticarcinogenic agent[J]. Amer J Clin Nutr,1998,68:1406S-1412S.
[13]Sampaio C A M,Oliva M L V,Sampaio M U,et al. Plant serine proteinase inhibitors. Structure and biochemical applications on plasma kallikrein and related enzymes[J]. Immunopharmacology,1996,32:62-66.
[14]Fang E F,Hassanien A A,Wong J H B,et al. Isolation of a new trypsin inhibitor from the Faba bean(Vicia faba cv. Giza 843)with potential medicinal applications[J]. Protein Pept Lett,2011,18:64-72.
[15]Katoch R,Thakur N. RNA interference:a promising technique for improvement of neglected crops[J]. Int J Food Sci Nutr,2013,64(2):248-259.
[16]Safavi F,Rostami A. Role of serine proteases in inflammation:Bowman-Birk protease inhibitor(BBI)as a potential therapy for autoimmune diseases[J]. Experimental and Molecular Pathology,2012,93:428-433.
[17]Baral A,Fox P F,O’Connor T P. Isolation and characterization of an extra-cellular proteinase from Pseudomousa tolaasii[J]. Phytochemistry,1995,39(4):757-762.
[18]Pang Z,Zhou Z,Yin D,et al. Transgenic rice plants overexpressing BBTI4 confer partial but broad-spectrum bacterial blight resistance[J]. Journal of Plant Biology,2013,56(6):383-390.
[19]Katoch R,Sethi A,Thakur N,et al. RNAi for insect control:current perspective and future challenges[J]. Appl Biochem Biotechnol,2013,169:1579-1605.
[20]Furstenberg-Hagg J,Zagrobelny M,Bak S. Plant defense against insect herbivores[J]. Int J Mol Sci,2013,14:10242-10297.
[21]胡华刚,王慧,张风. 几种植物抗虫基因研究进展[J]. 热带农业科技,2006,29(4):18-34.
[22]Mcamanus M T,Burgess E P J. Effects of the soybean trypsin inhibitor on growth and proteases of larvae of Spodoptera litura[J]. Insect Physiol,1995,41(9):721-738.
[23]Hassinen V H,Tervahauta A I,Schat H,et al. Plant metallothioneins-metal chelators with ROS scavenging activity[J]. Plant Biology,2011,13(2):225-232.
[24]Dramé K N,Passaquet C,Repellin A,et al. Cloning,characterization and differential expression of a Bowman-Birk inhibitor during progressive water deficit and subsequent recovery in peanut(Arachis hypogaea)leaves[J]. J Plant Physio,2013,170(2):225-229.
[25]徐平丽,彭振英,马小凤,等. 小麦一个新BBI型蛋白酶抑制剂基因TaUES的克隆及初步分析[J]. 植物遗传资源学报,2014,15(2):354-361.
[26]许乐,阮小蕾,李冬丽,等. 对枯萎病不同抗性的香蕉品种的内生细菌多样性及群落结构[J].微生物学通报,2012,39(9):1250-1259.
[27]Laskowski Jr M,Kato I. Protein inhibitors of proteinases[J]. Annu Rev Biochem,1980,49:593-626.
[28]Li N,Qu L J,Liu Y Y,et al. The refolding,purification,and activity analysis of a rice Bowman-Birk inhibitor expressed in Escherichia coli[J]. Protein Expression and Purification,1999,15(1):99-104.
(责任编辑 崔建勋)
Induction,denaturation and renaturation of Musa acuminata Bowman-Birk type protease inhibitor (MaBBI1)
HUANG Si-fa,TANG Zhi-min,YANG Li-xiang
(School of Life Sciences,Guangzhou University,Guangzhou 510006,China)
BBI (Bowman-Birk protease inhibitor) is a kind of plant-derived protease inhibitor and rich in cysteine,it can inhibit serine proteases,including trypsase,chymase,elastase and so on. A Bowman-Birk type protease inhibitor gene (MaBBI1) was cloned with the cDNA templates isolated and reversely transcribed from total RNA of banana (Musa acuminata L. cv.Brazilian) roots and the primers were designed according to the sequence of wild Malaysian banana (Musa acuminata subsp. Malaccensis) BBI gene (GenBank: XM_009415512)published in NCBI. The full length of MaBBI1 gene with 381 bp encoding 126 amino acids including 12 cysteines(9.5%) was inserted into vector pGEX-6P-1 and transformed Escherichia coli Rossetta to induce the expression of recombinant proteins GST-MaBBI1. A lot of GST-MaBBI1 fusion proteins with predicted molecular mass of 40.8953 ku were induced by IPTG at 3 h. However,the GST-MaBBI1 fusion proteins were insoluble after IPTG induction and accumulating as inclusion bodies. To get the soluble GST-MaBBI1 fusion proteins,the inclusion bodies were denatured and renatured. The soluble fusion proteins GST-MaBBI1 laid the foundation for its further study in vitro.
Musa acuminata;Bowman-Birk protease inhibitor(BBI);induction;denaturation;renaturation
S336;Q786
A
1004-874X(2016)09-0044-07
2016-06-30
黄司法(1991-),男,在读硕士生,E-mail:415339522@qq.com
杨礼香(1972-),女,博士,副教授,E-mail:365084473@qq.com

