miRNAs与腹膜纤维化关系的研究进展
李栋,闫铁昆
综述
miRNAs与腹膜纤维化关系的研究进展
李栋,闫铁昆△
近年发现微小RNA(miRNAs)是转录后基因调控的关键因素,参与诸多疾病的发生、发展。腹膜透析是终末期肾脏疾病的主要替代治疗方法之一,腹膜纤维化是导致腹透患者退出腹透治疗的最主要因素,制约了腹膜透析的应用和发展。miRNAs与腹膜纤维化发生密切相关。本文就miRNAs在腹膜纤维化发病机制及治疗中的作用进行综述。
微RNAs;腹膜后纤维化;间质细胞;腹膜透析;综述;上皮间充质转分化
腹膜透析(peritoneal dialysis,PD)是终末期肾脏疾病(end stage renal disease,ESRD)的主要替代治疗方法之一[1]。长期PD所导致的腹膜纤维化(peritoneal fibrosis,PF)是ESRD患者被迫中断长期PD的最主要因素,制约了PD的应用和发展[2]。因此,如何延缓甚至阻断PF进程,已成为一个亟待解决的重要问题。微小RNA(microRNAs,miRNAs)是一类在进化上高度保守、具有重要调控功能的非编码小分子RNA,大小约为18~22个碱基,可通过与靶mRNA的3′非翻译区完全或不完全的碱基互补配对结合,在蛋白质翻译水平上抑制靶mRNA表达或诱导其降解,被认为是转录后基因调控的关键因素[3]。近年来研究发现,miRNAs与PF发生密切相关[4]。本文就miRNAs在PF发病机制及治疗中的作用进行综述。
1 miRNAs的生物发生及作用机制
miRNAs由DNA上被称为mitron的特定区域编码,在细胞核内,初始miRNA在RNA聚合酶Ⅱ的作用下,首先转录形成500~3 000碱基长度有发夹样结构的前体miRNAs,后在RNaseⅢ家族酶Drosha和辅助因子DGCR8的作用下,裂解成60~70个核苷酸的pre-miRNA,后者由转运蛋白Exportin5/RanGTP运送至细胞质,再由胞浆内的RNaseⅢ内切酶Dicer剪切形成约20个核苷酸的成熟miRNAs[5]。后者展开后,功能链与RNA诱导沉默复合物(RNA-induced silencing complex,RISC)结合,通过与目标mRNA的3′非翻译区不完全碱基配对,抑制mRNA翻译,实行基因表达的负调控[6]。最新研究表明,miRNAs还能够与靶基因的启动子区域结合抑制基因转录从而诱导基因沉默[7]。因此,miRNAs能够在转录与翻译水平共同调节靶基因的表达,在不同的生物学过程中发挥重要作用。
2 miRNAs在PD相关PF发病机制中的作用
2.1 miRNAs与上皮细胞间充质转分化(epithelialmesenchymal transition,EMT)EMT是指上皮细胞层失去极性和细胞间连接,转换成具有迁移能力、在细胞基质间自由移动的间充质细胞的过程[8]。EMT能促进组织修复,但同时也与器官纤维化密切相关[9]。EMT过程复杂,主要涉及3个方面。(1)细胞间紧密连接解聚。即间皮细胞间紧密连接和黏附连接松解,细胞失去细胞极性,微绒毛消失。间皮细胞间黏附连接是由细胞外的E-钙黏素(E-cadherin)等蛋白相互交联而成。E-cadherin在EMT的间皮细胞中表达逐渐下降,而在来源于骨髓的CD34阳性细胞(腹膜成纤维母细胞)中则完全不表达,提示E-cadherin可以作为腹膜间皮细胞(peritoneal mesothelial cells,PMCs)EMT的特异生物标志物[10]。(2)细胞骨架的重构和α-平滑肌肌动蛋白(α-SMA)表达增多。在EMT中,角蛋白表达减少而波形蛋白(Vimentin)和α-SMA表达增多[11]。(3)基底膜遭到破坏,细胞侵袭力和迁移力增强。间皮细胞基底膜的完整性是维持其形态的重要结构基础,基底膜完整性如果遭到破坏即触发EMT的发生。Xiao等[12]应用Northern blot方法检测腹透液中分离的PMCs miR-129-5p的表达水平,发现与小于等于6个月透析龄腹透患者相比,miR-129-5p在超过6个月透析龄的PD患者PMCs中表达明显下降,以转化生长因子(TGF)-β1处理PMCs后发现Vimentin、纤连蛋白(Fibronectin)、转录因子SIP1和SOX4表达明显上调,E-cadherin明显下调,且SIP1和SOX4是miR-129-5p的靶基因,TGF-β1/miR-129-5p/ SIP1(SOX4)信号通路可能通过EMT机制在PF中起重要作用。Yu等[13]通过超声微泡技术使PF小鼠过表达miR-29b后发现,与对照组相比,miR-29b可以有效保护PF小鼠的腹膜功能,并可显著抑制PMCs的EMT发生,miR-29b的上述功能与其阻断Sp1-TGF-β/Smad3信号通路有关。Zhang等[14]发现miR-589表达无论是在腹透液分离的PMCs还是TGF-β1处理后的永生化HMrSV5中都显著下降,而miR-589过表达可以显著抑制TGF-β1介导的EMT。
2.2 miRNAs与腹膜血管新生腹膜血管新生是长期PD的主要并发症之一,是PF的重要特征及超滤失败的关键因素。目前公认血管内皮生长因子(vascular endothelial growth factor,VEGF)在血管新生中居主导地位,并发现其在腹膜毛细血管内皮细胞和PMCs中有阳性表达。尽管PMCs在PD过程中会丢失,但其在血管新生中也起重要作用。Realtime PCR分析发现,高糖培养PMCs 48 h后,miR-193a表达明显上升,miR-15a及let-7e表达均明显下降[15]。诸多体外实验证实,miR-15a通过靶定调控VEGF起到抗血管新生的作用[16]。由此可以推断,受腹膜透析液影响,PMCs分泌miR-15a的能力下降,失去调控VEGF生成的能力,是造成PD相关血管增生可能的原因之一。最新研究发现,miR-497在PF大鼠模型中表达明显下调[17],而体外实验证实,miR-497可以通过靶定调控血管内皮生长因子受体2(VEGFR2)的表达,有效诱导人脐静脉内皮细胞的凋亡,从而抑制血管形成,故PF过程中的血管新生部分原因可能与miR-497的分泌不足有关[18]。高糖刺激下,人脐静脉内皮细胞miR-492表达明显增高,而过表达miR-492的脐静脉内皮细胞表现为增殖和血管新生能力的下降,miR-492的上述作用是通过靶定调控内皮型一氧化氮合酶(eNOS)和下调VEGF实现的,故miR-492可作为潜在的抗血管新生药物[19]。
2.3 miRNAs与腹膜炎症PD相关性腹膜炎是PD最常见的并发症,主要表现为腹膜层单核巨噬细胞浸润和PMCs外基质的沉积,长期的腹膜炎症促使PMCs表型改变、新血管生成增加、细胞外基质(extracellular matrixc,ECM)沉积和炎症细胞浸润,使腹膜处于高转运状态,最终导致PF发生[20]。腹腔巨噬细胞是腹腔局部防御中关键的免疫细胞群体。研究发现,腹腔巨噬细胞低分泌纤连蛋白与PD患者腹膜炎的高发病率密切相关[21]。Xie等[22]研究发现miR-27a在脂多糖(LPS)刺激的小鼠腹腔巨噬细胞内表达下调,过表达的miR-27a可靶定下调白细胞介素(IL)-10增强其抗炎功能来参与炎症反应。Liu等[23]报道miR-147可在LPS刺激后显著上调,并可明显抑制腹腔巨噬细胞的炎症应答,miR-147的上调与核因子(NF)-κB和信号转导与转录因子1(STAT1)α对其的转录调控有关。miR-21可以显著延长LPS引起的腹膜炎小鼠生存时间,而miR-21的这种作用是通过影响TNF-α和IL-10的表达以及靶定调控磷酸酶及张力蛋白同源物(PTEN)实现的[24]。高迁移率族蛋白-1是新发现的具有显著促炎效应的细胞因子,可以通过RAGE和Toll样受体对免疫系统造成损伤。陈硕等[25]发现高浓度葡萄糖刺激可以通过激活高迁移率族蛋白1/晚期糖基化终末产物受体(HMGB-1/RAGE)信号通路,上调TGF-β1,参与高糖所致的腹膜损伤,HMGB-1同时能上调甲状腺乳头状癌细胞miR-221和miR-222表达[26]。有研究表明,肺炎克雷伯菌诱导的腹膜炎小鼠miR-221呈高表达,并靶定调控金属蛋白酶(TIMP)-3水平[27-28]。ECM受TIMP-3调节,ECM堆积是PF重要的病理特点。由此可见,PD过程中,HMGB1/RAGE/ miR-221轴可能被激活,并在ECM堆积等病理改变过程中起重要作用,参与了腹膜炎及PF的发生。这些研究提示,miRNAs分子通过正向或负向调控腹腔巨噬细胞的功能参与了PD相关腹膜炎的发生。
3 miRNAs与PF相关生物标志物
由于PF缺乏有效的治疗手段,故PF的早期诊断变得尤为重要。但作为PF诊断金标准的腹膜活检属有创操作,实行起来存在一定困难,所以寻找简单、无创、特异性和敏感性高的生物标志物成为预防PF的关键。
由于miRNAs在血清等体液中非常稳定地存在,可以抵抗内源性RNA酶分解,在多种储存条件和反复冻融情况下亦可保持稳定,目前其作为理想生物标志物的价值已被公认。miR-29与纤维化疾病密切相关,Roderburg等[29-31]发现miR-29a在晚期肝硬化血清表达水平较正常对照及早期肝硬化明显增高,提示检测血清miR-29a水平有助于快速判断肝硬化患者病变程度。对于PF的诊断也可以按照上述方法完成。Chen等[32]对新PD患者、维持性PD患者和超滤衰竭PD患者的透出液中miRNAs进行差异表达分析发现,3组间miR-15a和miR-21表达有显著差异;同时还发现miR-377和miR-17与PD超滤量密切相关;miR-192与腹膜转运类型和腹膜溶质面积转运系数密切相关;miR-30与滤出液蛋白浓度密切相关。Zhang等[33]收集12例新PD患者和16例透析龄超过6个月患者的腹透液并分离培养PMCs,用定量聚合酶链反应(qPCR)方法分别检测2组细胞miR-200c的表达水平,结果示后者miR-200c的表达水平明显下调,伴随纤连蛋白和Ⅰ型胶原表达水平的上调,提示腹透液中miR-200c表达水平的下降与PMCs发生EMT有关,故miR-200c可能是PD患者早期PF的生物标志物之一。Morishita等[4]对甲基乙二醛腹腔注射的大鼠腹膜组织进行miRNA聚类分析,找到81条差异表达的miRNAs,其中miRNA-21-5p、miRNA-221-3p、miRNA-223-3p、miRNA-142-3p、miRNA-34a-5p、miRNA-327表达增高均在2倍以上。qPCR方法比较PD患者和正常对照之间上述miRNAs的表达水平,发现PD患者血清miRNA-21-5p、miRNA-221-3p、miRNA-327表达明显上调,血清miRNA-34a-5p水平明显下调。miRNA-21-5p反义寡聚核苷酸序列腹腔内注射可以上调过氧化物增殖激活受体-α(PPAR)-α的表达,有效缓解PF。既往研究证实,PPAR-α的下调与肾间质纤维化有关[34],故甲基乙二醛腹腔注射的PF大鼠模型中,miRNA-21-5p有可能通过下调PPAR-α的表达引起PF,上述资料提示miRNA-21-5p、miRNA-221-3p、miRNA-327可作为PF早期诊断的生物标志物和干预的靶点。
综上,本文从PD相关PF发病机制和生物标志物角度总结了miRNAs与PF之间的关系,见表1。
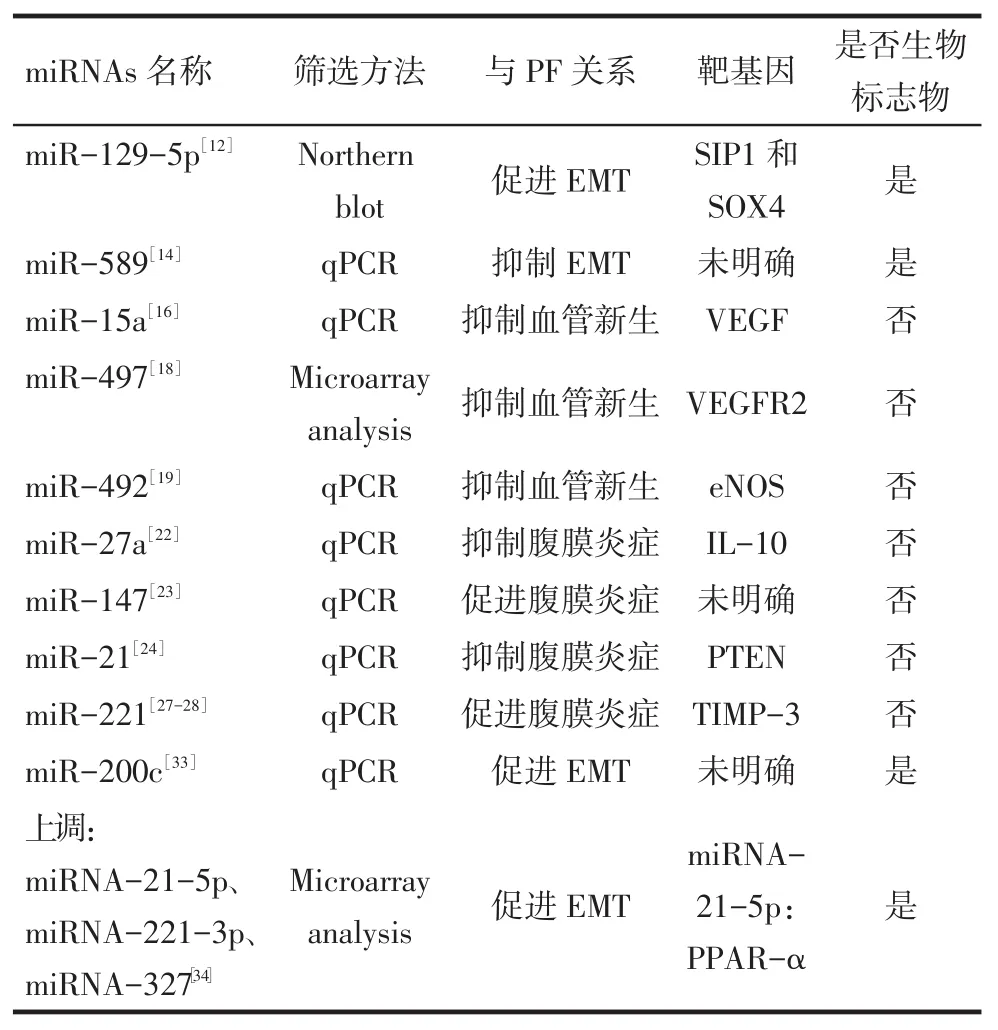
Tab.1Summary table of miRNAs related with peritoneal fibrosis associated with peritoneal dialysis表1 miRNAs与PD相关PF关系汇总表
作为目前生命科学领域研究的一大热点,miRNAs在PF中的研究价值正日益受到重视,其不仅可以揭示潜在的PF发病机制,更重要的是,随着越来越多miRNAs拟似物和抑制剂的功能在体外实验中得到证实,作为潜在的生物标志物,miRNAs或将为PF的早期诊断、治疗提供新的策略。
[1]Heaf J.Underutilization of peritoneal dialysis[J].JAMA,2004,291(6):740-742.doi:10.1001/jama.291.6.740.
[2]Mizuno M,Ito Y.Rat models of acute and/or chronic peritoneal injuriesincludingperitonealfibrosisandperitonealdialysis complications[J].Methods Mol Biol,2016,1397:35-43.doi: 10.1007/978-1-4939-3353-2_4.
[3]Ambros V.The functions of animal miRNAs[J].Nature,2004,431(7006):350-355.doi:10.1038/nature02871.
[4]Morishita Y,Yoshizawa H,Watanabe M,et al.MicroRNA expression profiling in peritoneal fibrosis[J].Transl Res,2016,169:47-66.doi:10.1016/j.trsl.2015.10.009.
[5]Lee HM,Nguyen DT,Lu LF.Progress and challenge of microRNA research in immunity[J].Front Genet,2014,5:178.doi:10.3389/ fgene.2014.00178.
[6]Towler BP,Jones CI,Newbury SF.Mechanisms of regulation of mature miRNAs[J].Biochem Soc Trans,2015,43(6):1208-1214. doi:10.1042/BST20150157.
[7]Kim DH,Saetrom P,Snøve O Jr,et al.MicroRNA-directed transcriptional gene silencing in mammalian cells[J].Proc Natl Acad Sci USA,2008,105(42):16230-16235.doi:10.1073/ pnas.0808830105.
[8]Li Y,Yang J,Dai C,et al.Role for integrin-linked kinase in mediating tubular epithelial to mesenchymal transition and renal interstitial fibrogenesis[J].J Clin Invest,2003,112:503-516.doi: 10.1172/JCI17913.
[9]Masola V,Zaza G,Onisto M,et al.Impact of heparanase on renal fibrosis[J].J Transl Med,2015,13:181.doi:10.1186/s12967-015-0538-5.
[10]Selgas R,Bajo A,Jiménez-Heffernan JA,et al.Epithelial-tomesenchymal transition of the mesothelial cell--its role in the response of the peritoneum to dialysis[J].Nephrol Dial Transplant,2006,21(Suppl 2):ii2-7.doi:10.1093/ndt/gfl183.
[11]Liu J,Bao J,Hao J,et al.HSP70 inhibits high glucose-induced Smad3 activation and attenuates epithelial-to-mesenchymal transition of peritoneal mesothelial cells[J].Mol Med Rep,2014,10(2):1089-1095.doi:10.3892/mmr.2014.2279.
[12]Xiao L,Zhou X,Liu F,et al.MicroRNA-129-5p modulates epithelial-to-mesenchymal transition by targeting SIP1 and SOX4 during peritoneal dialysis[J].Lab Invest,2015,95(7):817-832. doi:10.1038/labinvest.2015.57.
[13]Yu JW,Duan WJ,Huang XR,et al.MicroRNA-29b inhibits peritoneal fibrosis in a mouse model of peritoneal dialysis[J].Lab Invest,2014,94(9):978-990.doi:10.1038/labinvest.2014.91.
[14]Zhang K,Zhang H,Zhou X,et al.miRNA589 regulates epithelialmesenchymal transition in human peritoneal mesothelial cells[J].J Biomed Biotechnol,2012,2012:673096.doi:10.1155/2012/ 673096.
[15]Bao JF,Hao J,Liu J,et al.The abnormal expression level of microRNA in epithelial-mesenchymal transition of peritoneal mesothelial cells induced by high glucose[J].Eur Rev Med Pharmacol Sci,2015,19(2):289-292.
[16]Sun CY,She XM,Qin Y,et al.Vascular endothelial cell-specific microRNA-15a inhibits angiogenesis in hindlimb ischemia[J].JBiol Chem,2012,287(32):27055-27064.doi:10.1074/jbc. M112.364414.
[17]Lin F,Wu X,Zhang H,et al.A microRNA screen to identify regulators of peritoneal fibrosis in a rat model of peritoneal dialysis[J].BMC Nephrol,2015,16:48.doi:10.1186/s12882-015-0039-z.
[18]Tu Y,Liu L,Zhao D,et al.Overexpression of miRNA-497 inhibits tumor angiogenesis by targeting VEGFR2[J].Sci Rep,2015,5: 13827.doi:10.1038/srep13827.
[19]Patella F,Leucci E,Evangelista M,et al.MiR-492 impairs the angiogenic potential of endothelial cells[J].J Cell Mol Med,2013,17(8):1006-1015.doi:10.1111/jcmm.12085.
[20]Szeto CC.Peritoneal dialysis-related infection in the older population[J].Perit Dial Int,2015,35(6):659-662.doi:10.3747/ pdi.2014.00348.
[21]Bellón T,Martínez V,Lucendo B,et al.Alternative activation of macrophages in human peritoneum:implications for peritoneal fibrosis[J].Nephrol Dial Transplant,2011,26:2995-3005.doi: 10.1093/ndt/gfq771.
[22]Xie N,Cui H,Banerjee S,et al.miR-27a regulates inflammatory response of macrophages by targeting IL-10[J].J Immunol,2014,193(1):327-334.doi:10.4049/jimmunol.1400203.
[23]Liu G,Friggeri A,Yang Y,et al.miR-147,a microRNA that is induced upon Toll-like receptor stimulation,regulates murine macrophage inflammatory responses[J].Proc Natl Acad Sci U S A,2009,106(37):15819-15824.doi:10.1073/pnas.0901216106.
[24]Barnett RE,Conklin DJ,Ryan L,et al.Anti-inflammatory effects of miR-21 in the macrophage response to peritonitis[J].J Leukoc Biol,2016,99(2):361-371.doi:10.1189/jlb.4A1014-489R.
[25]Chen S,Wang EM,Zhou HL.Influence of high glucose on rat peritoneal mesothelium cell HMGB-1/RAGE signal pathway expression[J].Chinese Journal of Gerontology,2015,35(15): 4175-4177.[陈硕,王二敏,周红丽.高糖对大鼠腹膜间皮细胞HMGB-1/RAGE信号通路表达的影响[J].中国老年学杂志,2015,35(15):4175-4177].doi:10.3969/j.issn.1005-9202.2015.15.029.
[26]Mardente S,Mari E,Consorti F,et al.HMGB1 induces the overexpression of miR-222 and miR-221 and increases growth and motility in papillary thyroid cancer cells[J].Oncol Rep,2012,28(6):2285-2289.doi:10.3892/or.2012.2058.
[27]Barnett RE,Keskey RC,Rao JM,et al.Poor outcome in bacterial peritonitisisassociatedwithdysregulatedmiRNAsandan increased inflammatory response[J].Surgery,2013,154(3):521-527.doi:10.1016/j.surg.2013.06.048.
[28]Fiorentino L,Cavalera M,Mavilio M,et al.Regulation of TIMP3 in diabetic nephropathy:a role for miRNAs[J].Acta Diabetol,2013,50(6):965-969.doi:10.1007/s00592-013-0492-8.
[29]Roderburg C,Urban GW,Bettermann K,et al.Micro-RNA profiling reveals arole for miR-29 in human and murine liver fibrosis[J].Hepatology(Baltimore,Md),2011,53:209-218.doi: 10.1002/hep.23922.
[30]van Rooij E,Sutherland LB,Thatcher JE,et al.Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis[J].Proc Natl Acad Sci USA,2008,105:13027-13032.doi:10.1073/pnas.0805038105.
[31]Maurer B,Stanczyk J,Jungel A,et al.MicroRNA-29,a key regulator of collagen expression in systemic sclerosis[J].Arthritis Rheumat,2010,62:1733-1743.doi:10.1002/art.27443.
[32]Chen J,Kam-Tao P,Kwan BC,et al.Relation between microRNA expression in peritoneal dialysis effluent and peritoneal transport characteristics[J].Dis Markers,2012,33(1):35-42.doi:10.3233/ DMA-2012-0901.
[33]Zhang L,Liu F,Peng Y,et al.Changes in expression of four molecular marker proteins and one microRNA in mesothelial cells of the peritoneal dialysate effluent fluid of peritoneal dialysis patients[J].Exp Ther Med,2013,6(5):1189-1193.doi:10.3892/ etm_2013.1281.
[34]Gomez IG,MacKenna DA,Johnson BG,et al.Anti-microRNA-21 oligonucleotidespreventAlportnephropathyprogressionby stimulating metabolic pathways[J].J Clin Invest,2015,125:141-156.doi:10.1172/JCI75852.
(2016-06-12收稿2016-08-11修回)
(本文编辑魏杰)
Research on the relationship between miRNAs and peritoneal fibrosis
LI Dong,YAN Tiekun△
Department of Nephrology,Tianjin Medical University General Hospital,Tianjin 300052,China△Correspongding AuthorE-mail:tjtiekun@163.com
In recent years,microRNAs(miRNAs)have been found to be one of the key factors of post transcriptional gene regulation,which are involved in occurrence and development of many diseases.Peritoneal dialysis(PD)has become an effective alternative treatment approaches for patients with end stage renal disease(ESRD).Peritoneal fibrosis is one of the most important factors leading patients to withdraw from long-term PD,hence restricts the application and development of PD.MicroRNAs are closely related to the development of peritoneal fibrosis.This article reviews the role of miRNAs in the pathogenesis and treatment of peritoneal fibrosis.
microRNAs;retroperitoneal fibrosis;stromal cells;peritoneal dialysis;review;epithelial mesenchymal transdifferentiation
R459.5
A
10.11958/20160541
天津市应用基础与前沿技术研究计划项目(15JCYBJC26200)
天津医科大学总医院肾内科(邮编300052)
李栋(1978),男,博士,主要从事腹膜纤维化和糖尿病肾病研究
△通讯作者E-mail:tjtiekun@163.com

