高效液相色谱法检测诺丽果浆及其中药复方保健品中莨菪亭
陈 晨,刘平怀,罗 宁,李 昂,何沂飞,符 晶(海南大学 教育部热带多糖资源利用工程研究中心,热带作物种质资源保护与开发利用教育部重点实验室,海南 海口 570228)
高效液相色谱法检测诺丽果浆及其中药复方保健品中莨菪亭
陈 晨,刘平怀*,罗 宁,李 昂,何沂飞,符 晶
(海南大学 教育部热带多糖资源利用工程研究中心,热带作物种质资源保护与开发利用教育部重点实验室,海南 海口 570228)
为研究诺丽果浆及其中药复方保健品中莨菪亭的高效液相检测方法,优化色谱条件:依利特SinoChrom ODS-BP色谱柱(4.6 mm×200 mm,5 øm),流动相为乙腈-0.1%磷酸溶液(30∶70,V/V),流速1 mL/min,柱温25 ℃,进样量20 øL,检测波长348 nm。结果表明,莨菪亭在0.5~20 øg/mL质量浓度范围内与其色谱峰峰面积线性关系良好,回归方程Y=73.86X-0.554(R2=0.999),诺丽果浆和保健品中莨菪亭测定结果的平均回收率分别为104.05%和97.11%,相对标准偏差分别为0.81%和1.99%。该方法准确可靠,可用于定性、定量测定诺丽果浆及其保健品中的莨菪亭。
诺丽果浆;保健品;莨菪亭;高效液相色谱
诺丽(Morinda citrifolia Linn.)又称海巴戟,为巴戟天属茜草科植物,其果实诺丽果可用来治疗多种疾病,如糖尿病、高血压、心脏不适、疼痛、精神压抑及消化不良等[1],其叶则对牙龈炎、牙周炎、喉炎、风湿性关节炎、皮肤病、扭伤等具有一定的疗效[2]。生活在南太平洋岛国的当地人用诺丽果保健养生已有2 000多年的历史,并将之誉为“植物之后,上帝的恩赐”[3]。诺丽中主要的微营养成分是酚类物质、有机酸和生物碱,其中,酚类物质中最重要的是蒽醌[4-5]。其中莨菪亭(又名东莨菪素、东莨菪内酯等)是酚类中最重要的组分之一,亦是诺丽果的功效性成分,其具有较强的生物活性,不仅能够驱虫[6],还有祛风、抗炎、止痛、祛痰作用,常见于中药中治疗风湿、类风湿关节炎,防治高尿酸血症,降血压血脂以及心肌保护作用等[7-11]。
之前,人们对诺丽的研究主要集中于对其化学成分[4-5,12-14]、药理活性[1,2,15-18]、营养成分[19-20]以及组织培养[21-23]等方面的研究,而在将其研发成保健食品及相关质量控制方面的研究相对较少。世界各国在发展保健品的过程中,大体都经历了3 个阶段。目前,我国的保健品已发展至第3阶段。第3代保健食品,不仅其特定生理调节功能需经动物或人体实验,且还需确知其功效性成分的化学结构及含量。由于诺丽果浆属于新食品原料,因此,其具有食用安全性[24],且其功效性成分明确,故本实验考虑以其为原料制成第3代保健食品。本实验中先按25∶1的比例添加赋形剂麦芽糊精将诺丽果浆冻干,再混以其他中药材及辅料制成原料自制诺丽复方保健品(颗粒冲剂剂型)。
莨菪亭在文献[25]中“丁公藤”含量测定的参考流动相为:甲醇-水-冰醋酸(32∶68∶0.16,V/V)[25],经实验证明,该流动相体系无法有效分离测定诺丽果浆及保健品中的莨菪亭。为定性、定量检测诺丽果浆中的莨菪亭,以及判定粉末状保健品中莨菪亭的检测是否受其他原辅料的干扰,探索新的检测方法。
1 材料与方法
1.1 材料与试剂
诺丽果浆 海南万维生物制药技术有限公司;复方保健品 实验室自制;莨菪亭对照品(纯度98%,批号40575)、磷酸(优级纯) 阿拉丁试剂(上海)有限公司;甲醇、乙腈(均为色谱纯) 美国Tedia公司。
1.2 仪器与设备
高效液相色谱仪(包括230+二极管阵列检测器、P230恒流泵和EC-2000色谱工作站) 大连依利特公司;SCIENTZ-10Z冷冻干燥机 宁波新芝公司;RV10数显旋转蒸发仪 德国IKA公司;PHS-3G pH计 上海仪电公司;JP-040S超声波清洗机 深圳市洁盟公司。
1.3 方法
1.3.1 样品前处理
取新鲜诺丽果浆,过滤后5 ℃冷藏备用。取新制复方保健品颗粒,置于研钵内研碎,50 ℃真空干燥2 h备用。
1.3.2 莨菪亭含量的测定
1.3.2.1 对照品溶液的制备
精密称取莨菪亭对照品5 mg,用甲醇超声辅助溶解后定容至100 mL,0.45 øm滤膜过滤,取续滤液备用。
1.3.2.2 供试品溶液的制备
精密移取1 mL诺丽果浆于10 mL容量瓶中,用甲醇稀释至刻度,超声辅助提取,因水溶果浆会存在部分高聚物,因此,过滤之后,收集滤液重新定容至10 mL,再用0.45 øm滤膜过滤后备用。
精密称保健品粉末0.1 g,加甲醇超声辅助溶解后定容至10 mL,0.45 øm滤膜过滤后备用。
1.3.2.3 色谱条件
色谱柱:依利特SinoChrom ODS-BP(4.6 mm×200 mm,5 øm);检测波长:348 nm;流动相:乙腈-0.1%磷酸溶液(30∶70,V/V);流速:1 mL/min;进样量:20 øL;理论塔板数以莨菪亭计算不低于5 000。
1.3.3 专属性实验
1.3.3.1 辅料干扰实验
分别取供试品诺丽果浆1 mL,诺丽复方保健品1 g,置于10 mL容量瓶中,在用甲醇超声辅助溶解后的溶液加入适量辅料,加溶剂稀释至刻度,摇匀、滤过,取过滤后的液体作为辅料干扰实验供试品溶液。
1.3.3.2 未破坏实验
分别取供试品诺丽果浆1 mL,诺丽复方保健品1 g,置于10 mL容量瓶中,之后分别按照诺丽果浆和诺丽复方保健品供试品溶液配制对其进行处理。
1.3.3.3 高温水浴破坏实验
分别取供试品诺丽果浆1 mL,诺丽复方保健品1 g,置于10 mL容量瓶中,将用甲醇超声辅助溶解后的溶液置于70 ℃条件下水浴破坏40 min,冷却,加溶剂稀释至刻度,摇匀、滤过,取过滤后的液体作为高温水浴破坏供试品溶液。
分别取供试品诺丽果浆1 mL,诺丽复方保健品1 g,置于10 mL容量瓶中,将用甲醇超声辅助溶解后的溶液置于70 ℃恒温干燥箱破坏40 min,冷却,加溶剂稀释至刻度,摇匀、滤过,取过滤后的液体作为高温烘箱破坏供试品溶液。
1.3.3.5 强光破坏实验
分别取供试品诺丽果浆1 mL,诺丽复方保健品1 g,置于10 mL容量瓶中,将用甲醇超声辅助溶解后的溶液置于光照强度为(4 500±500) lx的光照箱中48 h,加溶剂稀释至刻度,摇匀、滤过,取过滤后的液体作为强光破坏供试品溶液。
1.3.3.6 氧化破坏实验
分别取供试品诺丽果浆1 mL,诺丽复方保健品1 g,置于10 mL容量瓶中,在用甲醇超声辅助溶解后的溶液中加入0.3%过氧化氢溶液1 mL,摇匀,于室温条件下放置15 h后,加溶剂稀释至刻度,摇匀、滤过,取过滤后的液体作为氧化破坏供试品溶液。
2 结果与分析
2.1 方法学考察结果
从图2可看出,谷索的就位对吊索索力影响很小;脊索就位对不同索的索力影响不同;膜的安装将提高吊索的索力。
2.1.1 系统适应性
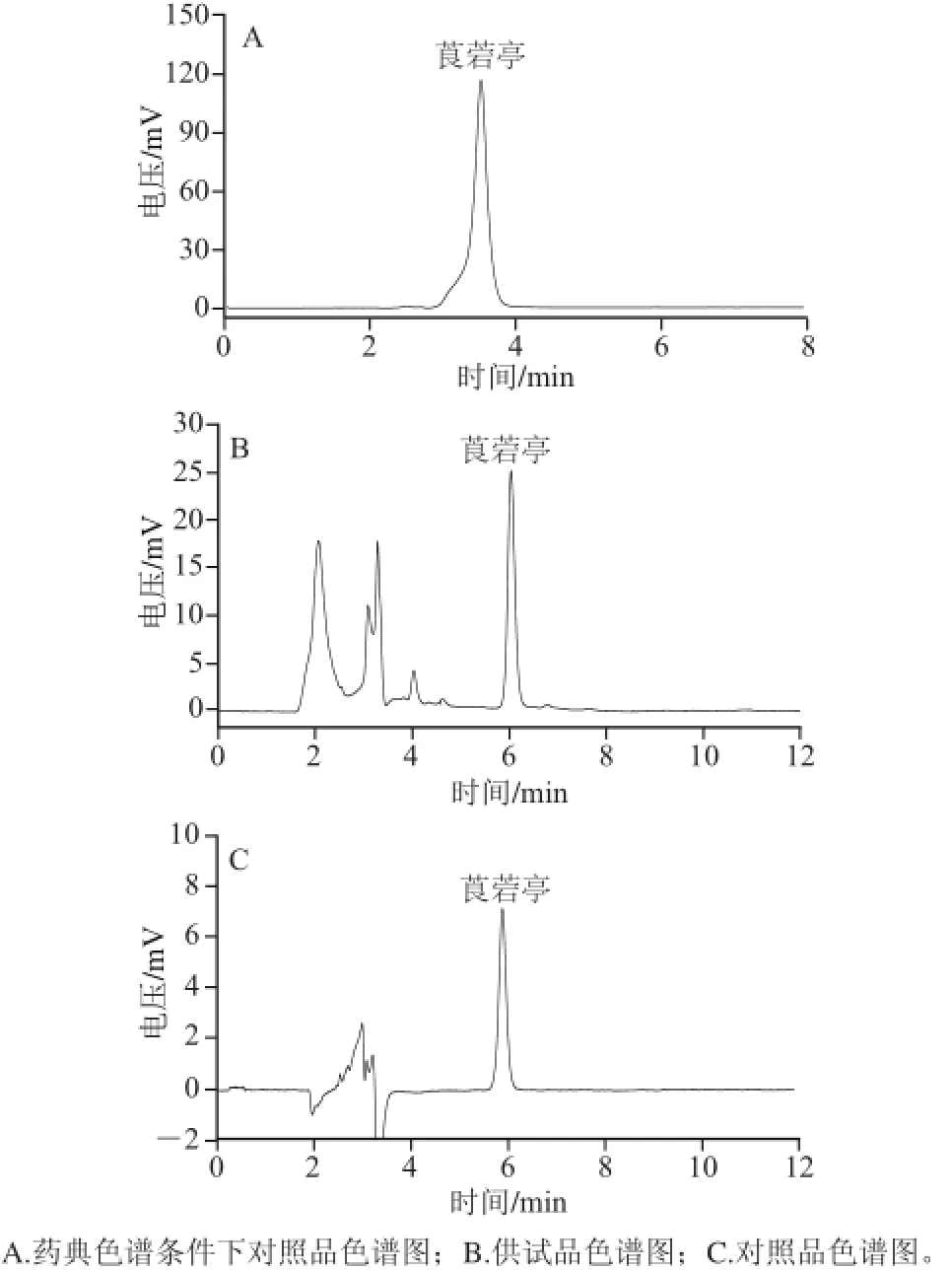
图1 莨菪亭高效液相色谱图Fig.1 High performance liquid chromatogram of scopoletin
按药典中的色谱条件所得莨菪亭对照品色谱图如图1A所示,莨菪亭对照品峰前沿较严重且出峰时间过久,无法准确对莨菪亭进行测定。在药典色谱条件基础上,用乙腈替换甲醇,同时使用磷酸溶液替换冰醋酸溶液,最终获得色谱条件如1.3.2.3节。在此色谱条件下,以莨菪亭含量为指标,连续进样6 次考察高效液相色谱系统的适用性。如图1B、C所示,莨菪亭峰与前一杂质峰的分离度均大于1.5,其分离度较好,且理论塔板数均大于5 000,说明系统适应性良好。而图1A所示,按药典中的色谱条件所得对照品色谱图前沿较严重,出峰时间过久,无法准确对莨菪亭进行测定。
2.1.2 专属性实验
根据1.3.3节实验方法,专属性实验结果均有较强烈破坏,但专属性好,在上述色谱条件下,能够很好地检测出破坏实验后的莨菪亭含量及破坏实验所产生的莨菪亭降解产物,因此可用上述色谱条件来测定本品中莨菪亭。
2.1.3 检测限和定量限测定
将莨菪亭对照品溶液反复稀释进样,根据基线噪声的3 倍确定检测限,10 倍确定定量限[25]。结果确定在该色谱条件下莨菪亭的检测限为0.011 øg/mL,定量限为0.023 øg/mL。定量限溶液重复进针6 次,峰面积相对标准偏差(relative standard deviation,RSD)为1.05%,说明检测结果合理。
2.1.4 稳定性实验
取供试品溶液20 øL注入色谱仪,分别于0、2、4、6、8 h和12 h测定莨菪亭峰面积,计算RSD值。如表1所示,果浆中莨菪亭的平均峰面积为252.26 μV•s,RSD为1.60%,保健品中莨菪亭的平均峰面积为129.60 μV•s,RSD为3.01%。结果表明诺丽果浆和保健品中莨菪亭在12 h内稳定性良好。
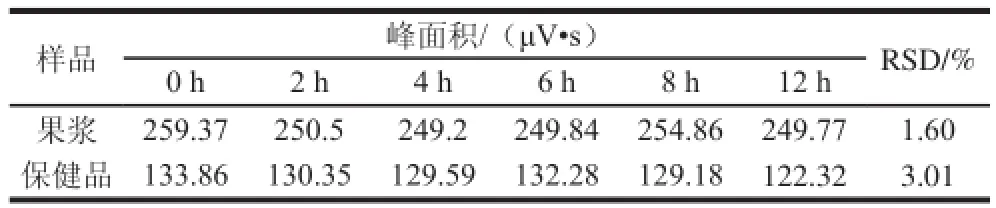
表1 莨菪亭稳定性实验结果Table 1 Results of stability test
2.1.5 精密度实验
取同一供试品溶液重复进样6次,分别测定峰面积,计算RSD值。如表2所示,果浆中莨菪亭的平均峰面积为233.40 μV•s,RSD为0.89%,保健品中莨菪亭的平均峰面积为132.92 μV•s,RSD为2.07%。结果表明仪器精密度良好。
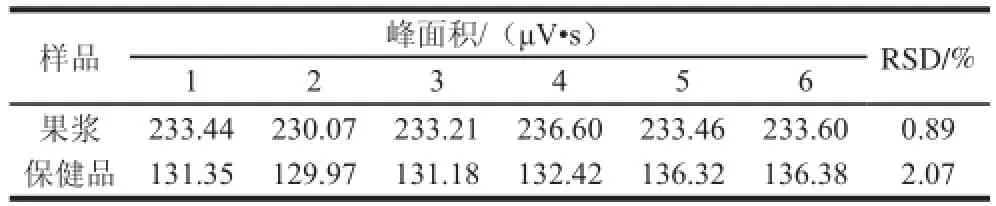
表2 莨菪亭精密度实验结果Table 2 Results of scopoletin precision test
2.1.6 重复性实验
平行制备6 份供试品溶液,进样后分别测定峰面积,计算RSD值。如表3所示,果浆中莨菪亭的平均峰面积为254.00 μV•s,RSD为1.44%,保健品中莨菪亭的平均峰面积为131.38 μV•s,RSD为2.43%。结果表明此方法重复性良好。
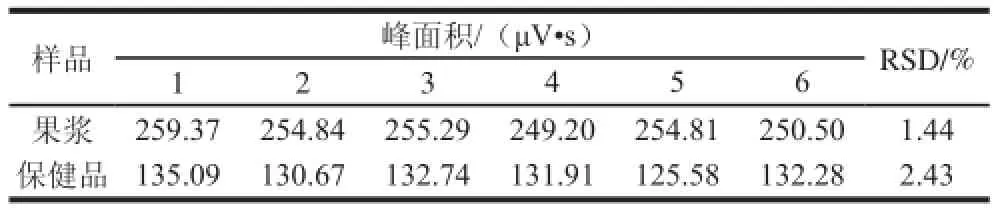
表3 莨菪亭重复性实验结果Table 3 Results of reproducibility test
2.1.7 回收率实验
精密称取已知含量的果浆供试品3 份,每份分别精密称取对照品按50%、100%、150%的对照品溶液质量浓度配制成低、中、高3 份回收率溶液。将上述溶液过滤、定容并各进样2 次分析,根据峰面积结果计算平均回收率和RSD值。如表4所示,其平均回收率为104.05%,RSD为0.81%,保健品中莨菪亭回收率实验结果如表5所示,其平均回收率为97.11%,RSD为1.99%。结果说明本色谱条件的准确性良好,能满足诺丽果浆及诺丽复方保健品中莨菪亭含量的检测。
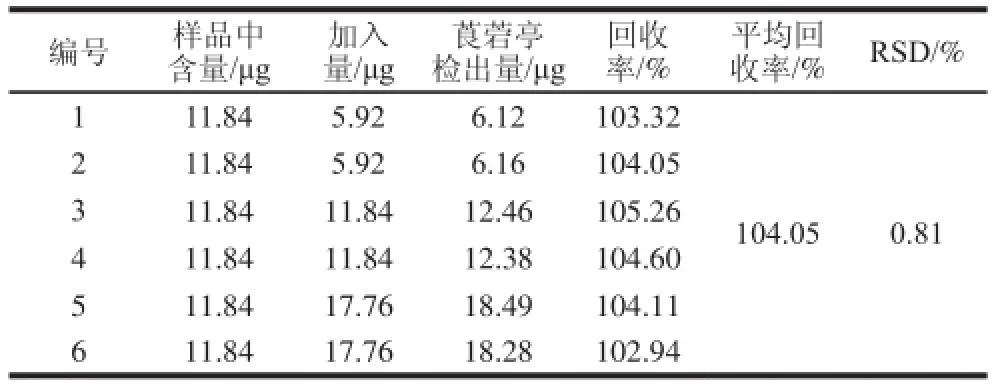
表4 果浆中莨菪亭回收率实验结果Table 4 Recovery of scopoletin spiked into noni juice
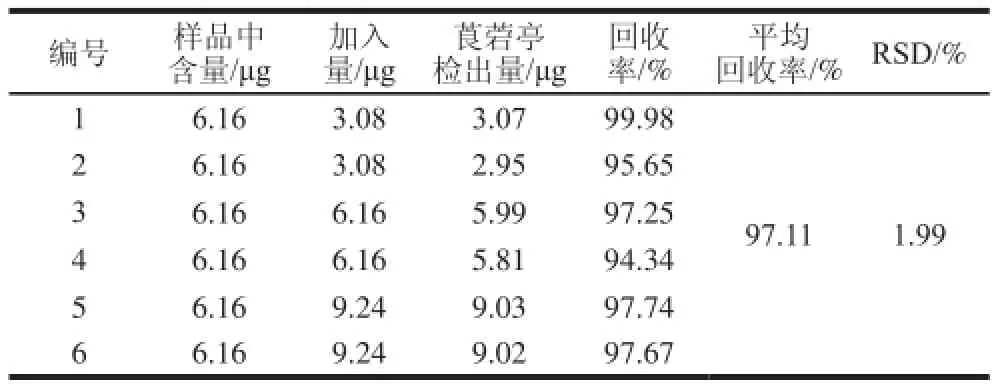
表5 保健品中莨菪亭回收率实验结果Table 5 Recovery of scopoletin spiked into the health product
2.1.8 线性关系
分别吸取2.0、1.0、0.5、0.1、0.05 mL对照品溶液于5 mL容量瓶中,用甲醇稀释至刻度,得20、10、5、1、0.5 øg/mL的标准液,0.45 øm滤膜过滤,取续滤液备用。进样,以色谱峰峰面积Y(μV•s)为纵坐标,对照品质量浓度X(øg/mL)为横坐标,得线性回归方程为:Y=73.86X-0.554,R2=0.999 (n=5)。结果表明莨菪亭在0.5~20 øg/mL质量浓度范围内与其色谱峰峰面积线性关系良好。
2.1.9 耐用性实验
改变检测波长±5 nm,进样后分别测定峰面积并计算莨菪亭含量,测得果浆RSD为0.428%,保健品RSD为1.72%;改变流速±0.1 mL/min,进样后分别测定峰面积并计算莨菪亭含量,测得果浆RSD为0.33%,保健品RSD为0.67%。说明在波长、流速有小的变动时,主峰仍能得到较好的分离,所测定的有关物质结果基本不变,说明此色谱条件的耐用性良好,能满足本品中莨菪亭测定的要求。
2.2 样品测定结果
准确取3 批果浆及保健品样品,注入高效液相色谱仪,分别平行测定3 次,取平均值,得果浆莨菪亭含量为29.8 μg/mL,保健品中莨菪亭含量为17.0 μg/g。
3 结 论
与文献[25]“丁公藤”莨菪亭含量测定方法相比,本实验建立的色谱方法能在相对合理的保留时间内出峰(约6 min),且峰形、分离度和拖尾因子良好,能在较短的时间内出峰完毕,减少杂质的干扰,供试品的主峰分离良好,基线平整,可作为诺丽果浆中莨菪亭含量检测的参考方法。
在专属性实验中,因莨菪亭含有酚羟基,具有弱酸性,故在对其进行碱性破坏时,破坏程度较大,主峰严重拖尾,难以准确定量测定。故在实验中流动相选择加入少量磷酸的酸性溶液,保持峰形稳定良好,利于莨菪亭的检测。
本实验建立的色谱条件下,测得保健品中莨菪亭的含量为17.0 μg/g,经换算,还原成诺丽果浆中的莨菪亭含量与实际添加量偏差为-1.25%,故本保健品中的原辅料添加对莨菪亭含量测定无明显干扰。
本实验建立了一种高效液相色谱方法,能对诺丽果浆及其中药复方保健品中莨菪亭含量进行有效地测定,此方法对新资源食品诺丽果浆的开发、检测以及药品的质量控制具有一定的现实意义。
[1] NEILS M D. Noni: nature’s amazing healer[M]. Pleasan Grove: Woodland Publishing, 1999: 11-104.
[2] 张伟敏, 魏静, 施瑞诚, 等. Noni果的活性成分和生理功能的研究进展[J]. 天然产物研究与开发, 2007, 19(3): 72-74. DOI:10.3969/ j.issn.1001-6880.2007.06.041.
[3] WEST B J, JENSEN C, NOWICKI D, et al. Morinda citrifolia (Noni): a literature review and recent advances in Noni research[J]. Acta Pharmacologica Sinica, 2002, 23(12): 1127-1141. DOI:10.1097/00007890-199602270-00002.
[4] WANG M Y, SU C. Cancer preventive effect of Morinda citrifolia (Noni)[J]. Annals of the New York Academy of Sciences, 2001, 952: 161-168. DOI:10.1111/j.1749-6632.2001.tb02737.x.
[5] 何其伟, 吴培云, 梁益敏, 等. 诺丽果肉化学成分研究[J]. 中成药, 2012, 34(9): 1729-1733. DOI:10.3969/j.issn.1001-1528.2012.09.025.
[6] 雍小菊, 张永强, 丁伟. 东莨菪内酯对朱砂叶螨的驱避和产卵抑制活性[J]. 应用昆虫学报, 2012, 49(2): 422-427. DOI:10.7679/ j.issn.2095-1353.2012.058.
[7] FYLAKTAKIDOU K C, HADIPAVLOU-LITINA D J, LITINAS K E, et al. Natural and synthetic coumarin derivatives with antiinflammatory/ antioxidant activities[J]. Current Pharmaceutical Design, 2004, 10(30): 3813-3833. DOI:10.2174/1381612043382710.
[8] OBIDOA O, OBASI S C. Coumarin compounds in cassava diets: 2 health implications of scopoletin in gari[J]. Plant Foods for Human Nutrition 1991, 41(3): 283-289. DOI:10.1007/BF02196398.
[9] MANUELE M G, FERRARO G, BARREIRO A M L, et al. Comparative immunomudulatory effect of scopoletin on tumural and normal lymphocytes[J]. Life Sciences 2006, 79(25): 2043-2048. DOI:10.1016/j.lfs.2006.06.045.
[10] XIA Y F, DAI Y, WANG Q, et al. Determination of scopoletin in rat plasma by high performance liquid chromatographic method with UV detection and its application to a pharmacokinetic study[J]. Journal of Chromatography B, 2007, 857(2): 332-336. DOI:10.1016/ j.jchromb.2007.07.023.
[11] 胡鸣旭, 张洪才, 于纯淼, 等. 诺丽果提取物的抗氧化活性及心肌保护作用研究[J]. 现代食品科技, 2014, 30(2): 31-36. DOI:10.13982/ j.mfst.1673-9078.2014.02.021.
[12] 黄惠玲, 李继勇, 蒋江云. 诺丽果中脂肪酸成分与含量的分析[J]. 热带作物学报, 2003, 24(1): 73-75. DOI:10.3969/ j.issn.1000-2561.2003.01.016.
[13] 张洪财, 王文姌, 刘树民. 诺丽果化学成分的研究进展[J]. 哈尔滨医药, 2011, 31(3): 213-214. DOI:10.3969/j.issn.1001-8131.2011.03.049.
[14] 汤建国, 任福才, 刘吉开. 诺丽青果化学成分研究[J]. 天然产物研究与开发, 2009, 21(5): 779-781. DOI:10.3969/ j.issn.1001-6880.2009.05.014.
[15] SAWPHEEYAH N, SRIRAT K, WIBOOL R, et al. Gastrokinetic activity of Morinda citrifolia aqueous fruit extract and its possible mechanism of action in human and rat models[J]. Journal of Ethnopharmacology, 2012, 142(2):154-161. DOI:10.1016/ j.jep.2012.04.044.
[16] 林卫华, 郑定仙, 王湛, 等. 诺丽果粉对小鼠缺氧耐受力的影响[J]. 时珍国医国药, 2012, 23(12): 3009-3010. DOI:10.3969/ j.issn.1008-0805.2012.12.027.
[17] 张建军, 王林元, 欧丽娜, 等. 诺丽果浆对老龄小鼠抗氧化功能影响的实验研究[J]. 食品工业科技, 2011, 32(12): 392-394. DOI:10.13982/j.mfst.1673-9078.2014.02.021
[18] JULIANE C M, GIULIANA G K, BOTELHO A C, et al. Morinda citrifolia Linn (Noni): in vivo and in vitro reproductive toxicology[J]. Journal of Ethnopharmacology, 2009, 121(2): 229-233. DOI:10.1016/ j.jep.2008.10.019.
[19] 李戈, 赵俊凌. 响应面法优化诺丽多糖提取工艺[J]. 云南中医学院学报, 2015, 38(2): 21-24.
[20] 张伟敏, 符文英, 施瑞城, 等. 诺丽果实和叶中主要功能性物质的分布与营养评价[J]. 食品科学, 2008, 29(10): 575-577. DOI:10.3321/ j.issn:1002-6630.2008.10.139.
[21] 黄骐, 何文锦, 叶冰莹, 等. 诺丽(Morinda citrifolia L.)离体快速繁殖研究[J]. 福建师范大学学报(自然科学版), 2007, 23(1): 87-91. DOI:10.3969/j.issn.1000-5277.2007.01.021.
[21] 吴田, 蓝增全. 诺丽离体培养研究[J]. 山东农业大学学报(自然科学版), 2011, 42(2): 179-182. DOI:10.3969/ j.issn.1000-2324.2011.02.003.
[23] 黄骐, 何文锦, 叶冰莹, 等. 海巴戟(Morinda citrifolia L.)组织培养研究[J]. 天然产物研究与开发, 2006, 18(6): 910-913. DOI:10.3969/ j.issn.1001-6880.2006.06.005.
[24] 林卫华, 郑定仙, 冯丁山, 等. 诺丽果粉食用安全性研究[J]. 中国热带医学, 2011, 12(11): 1509-1511. DOI:10.13604/j.cnki.46-1064/ r.2011.12.017.
[25] 中国药典委员会.中国药典: 一部[M]. 北京: 化学工业出版社, 2005: 3; 附录115.
Determination of Scopoletin in Noni Juice and Traditional Chinese Medicinal Compound Health Product Containing Noni Juice by HPLC
CHEN Chen, LIU Pinghuai*, LUO Ning, LI Ang, HE Yifei, FU Jing
(Key Laboratory of Protection and Development Utilization of Tropical Crop Germplasm Resources, Ministry of Education, Key Study Center of the National Ministry of Education for Tropical Resources Utilization, Hainan University, Haikou 570228, China)
A high performance liquid chromatography (HPLC) method was established for the determination of scopoletin in noni juice and a traditional Chinese medicinal compound health product containing noni juice. The chromatographic separation was performed on an Elite SinoChrom ODS-BP column (4.6 mm × 200 mm, 5 øm) using acetonitrile-0.1% phosphoric acid aqueous solution (30:70, V/V) as the mobile phase at a flow rate of 1 mL/min. The column temperature was 25 ℃, and the detection wavelength was set at 348 nm. The results showed a good linear relationship between peak area and scopoletin concentration in the range of 0.5–20 μg/mL. The average recoveries for noni juice and the health product containing noni juice were 104.05% and 97.11%, with relative standard deviations (RSDs) of 0.81% and 1.99%, respectively. This method proved to be accurate and reliable and could be used to qualitatively and quantitatively determine scopoletin in noni juice and the compound health product containing noni juice.
noni juice; health product; scopoletin; high performance liquid chromatography (HPLC)
10.7506/spkx1002-6630-201604015
R284.2
A
1002-6630(2016)04-0083-05
陈晨, 刘平怀, 罗宁, 等. 高效液相色谱法检测诺丽果浆及其中药复方保健品中莨菪亭[J]. 食品科学, 2016, 37(4): 83-87. DOI:10.7506/spkx1002-6630-201604015. http://www.spkx.net.cn
CHEN Chen, LIU Ping huai, LUO Ning, et a l. Determination of scopoletin in noni juice and its traditional Chinese medicine compound health care products by HPLC[J]. Food Science, 2016, 37(4): 83-87. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201604015. http://www.spkx.net.cn
2015-05-15
“十二五”国家科技支撑计划项目(2011BAD14B01);海南省中药现代化科技专项(ZY201327);
国家科技型中小企业技术创新基金项目(13C26244604892);海南省产学研一体化项目(CXY20150034)
陈晨(1990—),男,硕士研究生,主要从事南药研究与开发。E-mail:276676255@qq.com
*通信作者:刘平怀(1967—),男,教授,硕士,主要从事微藻生物能源及生物制药研究。E-mail:twlph@163.com

