石榴叶多酚对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官的抗氧化作用
王美菊,陶明煊,牛文颖,朱 成,叶理跃,邢 佳
石榴叶多酚对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官的抗氧化作用
王美菊,陶明煊*,牛文颖,朱 成,叶理跃,邢 佳
(南京师范大学金陵女子学院,江苏 南京 210097)
目的:研究石榴叶多酚(purified polyphenols from Punica granatum L. leaves,PPPL)对酒精所致急性肝损伤小鼠肾脏、心脏、脾脏、胸腺的保护作用。方法:将66 只雄性小鼠随机分为空白对照组、模型对照组、阳性对照组(联苯双酯150 mg/(kg·d)),PPPL低、中、高剂量组(100、200、400 mg/(kg·d)),连续灌胃30 d,第31天除空白对照组外其余各组给予50%乙醇(12 mL/kg),建立小鼠急性肝损伤模型。将小鼠脱臼处死后取肾脏、心脏、脾脏及胸腺,测定其超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力及丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(glutat hione,GSH)含量。结果:与模型对照组相比,PPPL各剂量组均能提高小鼠各脏器的SOD、CAT、GSH-Px活性和GSH含量,降低MDA含量。结论:PPPL对酒精性肝损伤小鼠肾脏、心脏及免疫器官具有明显的抗氧化作用。
石榴叶多酚;酒精性肝损伤;抗氧化作用;心脏;肾脏;免疫器官
随着社会和经济的发展,饮酒已成为一种普遍行为,酒的消耗量呈逐年上升趋势,长期过量饮酒导致的健康隐患已成为全世界关注的公共卫生问题[1]。大量研究表明,饮酒与冠心病、高血压、动脉粥样硬化等疾病的发生呈“J”型曲线关系,少量饮酒可降低这些疾病的发生率,而饮酒过量则会大大增加发病的风险[2]。长期大量饮酒会导致心肌细胞膜脂质过氧化而被破坏,造成心肌损伤,亦会降低心肌收缩力,出现心室肥大和纤维化,重度饮酒还会导致心律失常[3-5];乙醇进入机体后,有5%~10%通过肾脏代谢,过量饮酒则使肾脏代谢超负荷[6],乙醇、乙醛便积聚浓缩在肾脏细胞和间质内,导致肾脏损伤[7],有研究称乙醇可导致肾小管-间质损伤,最终表现为肾间质纤维化、慢性肾功能衰竭[8-9]。脾脏和胸腺是机体重要的免疫器官,有研究表明哺乳动物过量饮酒会显著抑制二者的生长发育,导致脾脏和胸腺细胞脂质过氧化,细胞膜通透性增强,使膜表面受体损伤,免疫机能降低[10]。
石榴(Punica granatum L.)为石榴科石榴属落叶灌木,大量研究表明石榴及其产品中含有丰富的抗氧化成分,具有延缓衰老、治疗心脑血管疾病、抗癌、提高机体免疫力等功效[11-12]。现代研究显示,石榴叶具有收敛止泻、解毒杀虫、治疗跌打损伤、调节血脂水平、清除自由基等功效[13-14],富含没食子酸型多酚类物质和鞣花酸等具有抗氧化活性的化合物[14],近年来对其抗氧作用的研究已不断深入。本实验以石榴叶为原料,研究石榴叶纯化多酚(purified polyphenols from Punica granatum L. leaves,PPPL)对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官的抗氧化作用,旨在为天然药物或保健食品的研制、开发提供理论和实验依据。
1 材料与方法
1.1 材料
石榴叶采自江苏省南京市鼓楼区,经洗净烘干、粉碎后,过60 目筛,得石榴叶细粉,将其与50%乙醇按1∶20(m/V)料液比混匀,冰水浴超声波破碎10 min,调节pH值为2,70 ℃水浴1.5 h,5 000 r/min冷冻离心10 min后过滤,得石榴叶粗多酚(crude polyphenols from Punica granatum L. leaves,CPPL),将CPPL旋转蒸发、冷冻干燥后过大孔树脂AB-8,所得样品过聚酰胺即得PPPL[15-16]。经Folin-酚比色法[17]测得PPPL的多酚纯度为92.83%。
1.2 动物
6 周龄昆明种雄性小鼠,体质量(27±2) g,在江苏省中医院动物饲养中心饲养,动物饲养许可证号:SYXK(苏)2012-0047,保持饲养室环境温度为(23±2) ℃,相对湿度(50±5)%,照明时间为12 h。
1.3 试剂与仪器
四乙氧基丙烷 美国Fluka公司;还原型谷胱甘肽(glutathione,GSH)、牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma公司;氯化硝基四氮唑蓝(nitro blue tetrazolium,NBT)、5,5’-二硫双-2-硝基苯甲酸(5,5’-dithiobis-2-nitrobenzoic acid,DTNB)南京卓尔生化有限公司;H2O2、无水乙醇、硫代巴比妥酸(thiobarbituric acid,TBA)、甲硫氨酸(methionine,Met)等生化试剂为国产分析纯。
722可见分光光度计 上海精密科学仪器有限公司;754紫外-可见分光光度计 上海光谱仪器有限公司;HH-δ数显恒温水浴锅 金坛市富华仪器有限公司;GL-22M高速冷冻离心机 湖南赛特湘仪离心机厂。
1.4 方法
1.4.1 动物分组及模型建立
66 只小鼠适应性喂养3 d后,随机分为空白对照组,模型对照组,阳性对照组(联苯双酯150 mg/(kg·d)),PPPL低、中、高剂量组(100、200、400 mg/(kg·d)),用蒸馏水配制样品,每天灌胃1 次,连续灌胃30 d,空白对照组及模型对照组灌胃等剂量蒸馏水,每周称小鼠体质量两次。实验期间提供全价颗粒饲料,不限制饮食饮水。第31天,各组小鼠禁食不禁水12 h,除空白对照组外其余各组用50%乙醇灌胃,剂量为12 mL/kg,建立小鼠急性酒精性肝损伤模型,空白对照组灌胃等体积蒸馏水。去除死亡小鼠后每组剩余10 只小鼠,在灌胃12 h后,脱臼处死小鼠,取肾脏、心脏、脾脏及胸腺测定抗氧化指标。
1.4.2 10%脏器匀浆及组织粗酶液的制备
测定各抗氧化指标前,将脏器置于4 ℃冰箱存放过夜。准确称取0.1 g脏器,用生理盐水洗去污血后拭干,置于表面皿中,在冰浴上用手术刀切碎,移入1.5 mL离心管中,再加入0.9 mL预冷的50 mmol/L磷酸盐缓冲液(pH 7.8),冰水浴超声波破碎(400 W,5 s/次,间隙10 s,重复5~7 次),然后在4 ℃条件下10 000 r/min离心10 min,取上清液即为10%组织匀浆液,该匀浆用于测定丙二醛(malondialdehyde,MDA)、GSH含量。
10%组织匀浆液与饱和硫酸铵溶液以3∶1(V/V)混合,10 000 r/min离心10 min,取上清液即为粗酶液,用于测定GSH-Px、CAT、SOD活力。
1.4.3 蛋白质含量的测定
采用Bradford法[18]测定蛋白质含量,以BSA为标准蛋白。
1.4.4 MDA含量的测定
采用TBA法[19]测定MDA含量。
1.4.5 SOD活力的测定
参照Stewart等[20]的NBT光还原法测定SOD活力。
1.4.6 CAT活性的测定
采用紫外吸收法[21]测定CAT活力。
1.4.7 GSH-Px活力的测定
采用照DTNB法[22]测定GSH-Px活力。
1.4.8 GSH含量的测定
按文献[23]的方法测定GSH含量。
1.5 数据统计分析
采用DPS 13.5统计软件对实验数据进行分析,单因素方差分析检验组间数据是否存在显著性差异,数据用x±s表示,以P<0.05及P<0.01为差异具有统计学意义。
2 结果与分析
2.1 PPPL对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官MDA含量的影响
MDA是脂质过氧化的终产物之一,是评价细胞膜过氧化程度的重要指标,其含量与细胞损伤程度成正相关。如表1所示,模型对照组小鼠肾脏、脾脏、胸腺MDA含量明显高于空白对照组,且差异极显著(P<0.01),心脏MDA含量与空白对照组相比也有显著差异(P<0.05)。给予PPPL后,小鼠各脏器的MDA含量均明显下降,且存在一定的剂量-效应关系。PPPL高剂量组小鼠各脏器的MDA含量均达到阳性对照组水平,与模型对照组相比差异显著或极显著(P<0.05或P<0.01)。以上结果说明PPPL能显著提高酒精性肝损伤小鼠肾脏、心脏及免疫器官的抗氧化水平,对酒精性脏器损伤具有一定的保护作用。
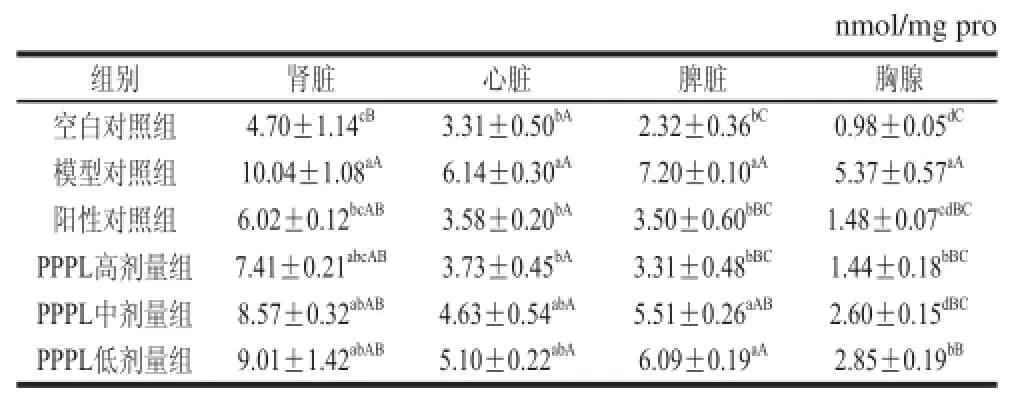
表1 PPPL对小鼠肾脏、心脏及免疫器官MDA含量的影响(x±s , n= 10)Table 1 Effect of PPPL on MDA contents in kidney and heart and immune organs of mice (x±s , n= 10)
2.2 PPPL对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官SOD活性的影响SOD是生物体内重要的抗氧化酶,能有效清除代谢过程中产生的氧自由基,减缓细胞衰老进程,测定其活性可间接反映机体的抗氧化能力。如表2所示,模型对照组小鼠各脏器SOD活力均极显著低于空白对照组(P<0.01),表明造模成功。给予PPPL后,小鼠各脏器的SOD活力明显增强,且存在剂量-效应关系。PPPL高剂量组小鼠心脏、胸腺的SOD活力与阳性对照组无极显著差异(P>0.01)。以上结果说明PPPL能有效提高小鼠肾脏、心脏及免疫器官的SOD活性,减缓其氧化进程,减轻酒精对其损害。
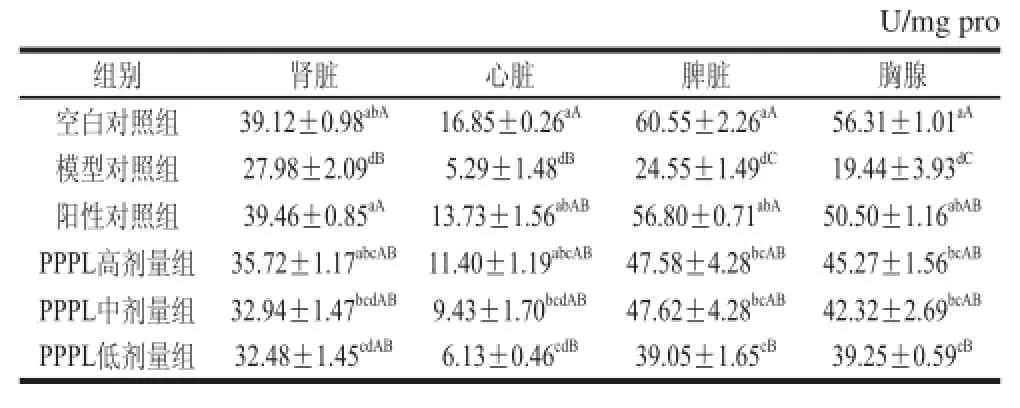
表2 PPPL对小鼠肾脏、心脏及免疫器官SOD活力的影响 (x±s , n= 10)Table 2 Effect of PPPL on SOD activities in kidney, heart and immune organs of mice (x±s , n= 10)
2.3 PPPL对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官CAT活性的影响

表3 PPPL对小鼠肾脏、心脏及免疫器官CAT活力的影响 (x±s , n= 10)Table 3 Effect of PPPL on CAT activities in kidney, heart and immune organs of mice (x±s , n= 10)
CAT可催化过氧化氢分解为水和分子氧,从而清除机体内的过氧化氢,减轻其对细胞的损害。如表3所示,模型对照组小鼠肾脏、心脏、胸腺的CAT活力明显低于空白对照组(P<0.01),脾脏CAT活力的变化虽然不及其他3 个脏器明显,但与空白对照组相比,仍具有显著差异(P<0.05),表明造模成功。给予PPPL后,小鼠各脏器的CAT活力均明显增强,且存在一定的剂量-效应关系。PPPL高剂量组小鼠的各脏器CAT活力均达到阳性对照组水平。以上结果说明PPPL能有效提高急性酒精性肝损伤小鼠肾脏、心脏及免疫器官的CAT活性,增强了小鼠机体的抗氧化能力。
2.4 PPPL对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官GSH-Px活性的影响GSH-Px是广泛存在于机体内的一种含硒酶,能够清除机体代谢产生的自由基,减缓脂质过氧化进程,从而保护细胞膜结构和功能的完整性。如表4所示,模型对照组小鼠各脏器GSH-Px活力均极显著低于空白对照组(P<0.01),表明造模成功。给予PPPL后,小鼠各脏器的GSH-Px活力明显升高,且存在一定的剂量-效应关系。
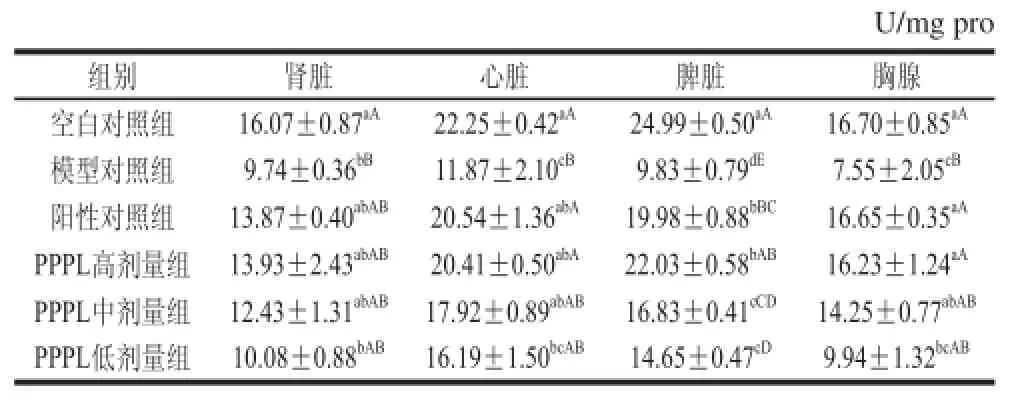
表4 PPPL对小鼠肾脏、心脏及免疫器官GSH-Px活力的影响(x±s , n= 10)Table 4 Effect of PPPL on GSH-Px activities in kidney, heart and immune organs of mice(x±s , n= 10)
PPPL高剂量组小鼠的各脏器GSH-Px活力与阳性对照组相比均无极显著差异(P>0.01),且PPPL中剂量组小鼠的肾脏、心脏GSH-Px活力亦达到阳性对照组水平。以上结果说明PPPL能显著提高急性酒精性肝损伤小鼠肾脏、心脏及免疫器官的GSH-Px活性,提高其清除自由基的能力,抑制小鼠衰老进程。
2.5 PPPL对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官GSH含量的影响
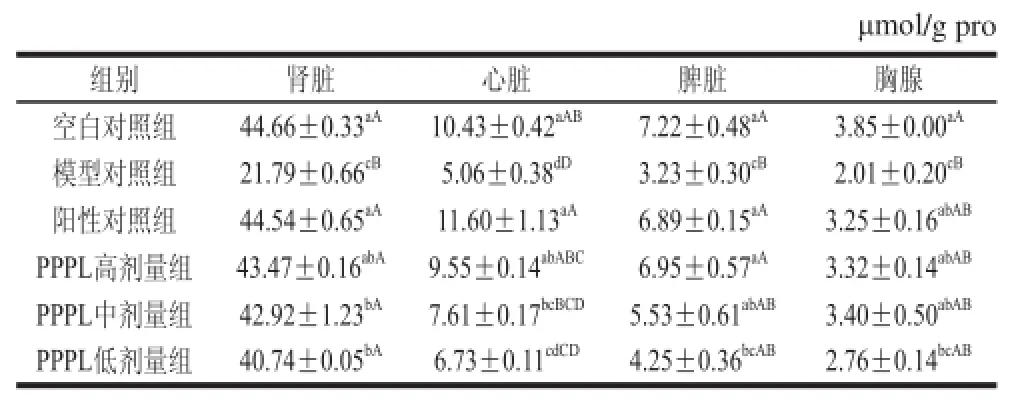
表5 PPPL对小鼠肾脏、心脏及免疫器官GSH含量的影响(x±s , n= 10)Table 5 Effect of PPPL on GSH contents in kidney, heart and immune organs of mice(x±s , n= 10)
GSH是由谷氨酸、半胱氨酸、甘氨酸组成的小分子肽,是一种重要的抗氧化剂,其结构中含有极其活泼的巯基,容易氧化脱氢,从而可清除自由基,提高机体免疫力,延缓衰老。如表5所示,模型对照组小鼠各脏器的GSH含量明显低于空白对照组,且差异极显著(P<0.01),说明急性酒精灌胃(12 mg/kg)会降低小鼠肾脏、心脏、脾脏及胸腺的GSH含量。阳性对照组小鼠各脏器的GSH活力明显高于模型对照组(P<0.01或 P<0.05),说明实验方法及操作可靠,重复性良好,实验数据具有统计学意义。给予PPPL后,小鼠各脏器的GSH含量明显高于模型对照组,且随着PPPL剂量的增大而提高,PPPL高剂量组小鼠各脏器的GSH含量甚至与阳性对照组无极显著差异(P>0.01)。以上结果说明PPPL可明显提高急性酒精性肝损伤小鼠肾脏、心脏及免疫器官的GSH含量,增强其抗氧化能力,对酒精所致以上脏器损伤具有一定保护作用。
3 讨 论
过量饮酒会导致急性或慢性酒精中毒。乙醇进入机体后,在代谢过程中会产生大量的超氧阴离子自由基、过氧化物、羟自由基等活性氧,这些自由基极其活泼,能与细胞膜上的不饱和脂肪酸反应,破坏脂质的氧化-抗氧化体系平衡,促进脂质过氧化进程[24-25],导致生物膜严重受损;自由基还会导致蛋白质、DNA等生物大分子发生修饰、交联,破坏其正常结构及功能[26]。自由基造成的氧化损伤广泛存在于机体的组织或器官中,对心脏、肾脏、脾脏及胸腺均存在一定的危害。
机体内的抗氧化防御体系分为酶和非酶两大类,抗氧化酶类包括SOD、GSH-Px、CAT等,非酶抗氧化剂则包括GSH、VC及VE等。现代研究表明,大多数酚类体外清除自由基的能力要高于VC,且吸收率高[27];除了作用于活性氧,这些酚类物质还可提高酶类抗氧化剂的活性[28-29];此外,其具有螯合金属离子的作用,能够有效阻断金属离子对氧化反应的催化进程;以上因素协同配合,最终使酚类化合物具有良好的抗氧化活性。石榴叶多酚的具体组分包括鞣花酸、没食子酸和短叶苏木酚等鞣质类成分以及以木犀草素4’-O-β-葡萄糖苷为代表的黄酮类成分[30-31]。鞣质类成分的结构中含有没食子酰基或六羟基联苯二酰基,易与自由基反应,生成相对稳定的中间产物;黄酮类物质含有大量酚羟基,在自由基的清除方面也表现出良好的活性[14];以上活性成分的存在,使石榴叶多酚表现出良好的抗肿瘤、抗突变及抗氧化功效。
本实验以石榴叶为原材料提取多酚,并通过建立小鼠急性酒精性脏器损伤模型,测定各组小鼠脏器MDA、GSH含量及SOD、GSH-Px、CAT活性,研究PPPL对小鼠肾脏、心脏及免疫器官酒精性损伤的保护作用。结果表明,造模后小鼠以上脏器SOD、GSH-Px、CAT活性和GSH含量均明显低于空白对照组,而MDA含量明显著高于空白对照组,其机制是过量乙醇进入机体,代谢产生大量活性氧自由基,导致SOD、GSH、GSH-Px、CAT耗竭,机体抗氧化防御机能降低,细胞膜脂质过氧化,最终导致其产物MDA含量升高。给予PPPL后,与模型对照组相比小鼠各脏器的SOD、GSH-Px、CAT活性及GSH含量明显提高,MDA含量明显降低,说明PPPL能够提高急性酒精性肝损伤小鼠肾脏、心脏及免疫器官的抗氧化酶活性,增强机体抗氧化能力,减轻酒精对以上脏器的毒害。
过量饮酒甚至酗酒引发的一系列健康及社会问题不容忽视,本研究结果表明,PPPL具有较好的抗酒精性脏器损伤作用,机制与其较强的抗氧化作用有关,PPPL有望被开发成一种抗化学性脏器损伤的保健食品。
[1] 李欣. 全球葡萄酒及烈酒市场展望[J]. 中国食品, 2013(7): 50-53.
[2] 杨明亮, 尹章汉, 吴炎忠, 等. 饮酒与健康[J]. 中国卫生监督杂志, 2002, 9(4): 196-201. DOI:10.3969/j.issn.1077-6131.2002.04.002.
[3] 孙雪莲, 沈潞华, 谢苗荣, 等. 急性过量饮酒对大鼠心脏功能的影响[J]. 中华急诊医学杂志, 2004, 13(6): 389-391. DOI:10.3760/ j.issn:1671-0282.2004.06.009.
[4] 王俊杰, 关章顺. 过量饮酒对机体的影响及其机制[J]. 郴州医学高等专科学校学报, 2003, 5(2): 49-52. DOI:10.3969/j.issn.1673-498X.2003.02.028.
[5] 关媛媛, 于宁. 过量饮酒与健康[J]. 健康研究, 2010, 30(3): 223-225. DOI:10.3969/j.issn.1674-6449.2010.03.019.
[6] VAMVAKAS S, TESCHNER M, BAHNER U, et al. Alcohol abuse: potential role in electrolyte disturbances and kidney diseases[J]. Clinical Nephrology, 1998, 49(4): 205-213.
[7] 邱皓, 吕晓云, 刘文, 等. 中药活血利湿方对酒精性肾损害的干预作用[J]. 中国实验方剂学杂志, 2010, 16(18): 187-189. DOI:10.3969/ j.issn.1005-9903.2010.18.056.
[8] 曹艳雪, 王炳元, 傅宝玉. 酒精性肝肾损害及肾层粘连蛋白、Ⅲ型胶原的表达[J]. 世界华人消化杂志, 2001, 9(10): 1134-1138. DOI:10.3969/j.issn.1009-3079.2001.10.007.
[9] 张健, 鞠晓华, 王炳元, 等. 酒精性肾损害时核转录基因子κB的表达及复方中药的干预作用[J]. 中国医科大学学报, 2005, 34(6): 509-510. DOI:10.3969/j.issn.0258-4646.2005.06.007.
[10] 杨郑州, 田伟, 王正朝, 等. 长期饮酒对哺乳动物免疫器官生长发育的影响[J]. 家畜生态学报, 2008, 29(4): 65-67. DOI:10.3969/ j.issn.1673-1182.2008.04.016.
[11] 高翔. 石榴的营养保健功能及其食品加工技术[J]. 中国食物与营养, 2005(7): 40-42. DOI:10.3969/j.issn.1006-9577.2005.07.013.
[12] 袁丽, 高瑞昌, 田永全. 石榴营养保健功能及开发利用[J]. 农业工程技术(农产品加工), 2007(10): 38-40. DOI:10.3969/ j.issn.1673-5404.2007.10.011.
[13] 国家中医药管理局《中华本草》编委会. 中华本草(第5卷)[M]. 上海: 上海科学技术出版社, 1999: 664.
[14] 花雷. 石榴叶化学成分及对肝药酶活性影响的研究[D]. 北京: 清华大学, 2010: 1-26.
[15] 王彩云. 石榴叶多酚的提取富集工艺及其药理作用研究[D]. 北京:北京林业大学, 2013: 3-17.
[16] 颜栋美, 焦士荣, 唐远谋, 等. 石榴皮提取工艺及活性研究进展[J].西华大学学报, 2009, 30(2): 43-45.
[17] 李国秀. 石榴皮多酚类物质分离鉴定和抗氧化活性研究[D]. 西安:陕西师范大学, 2008: 18-25.
[18] 谢宁昌. 生物化学实验多媒体教程[M]. 上海: 华东理工大学出版社, 2001: 2-9.
[19] 中华人民共和国卫生部. 保健食品检验与评价技术规范(2003年版)[EB/OL]. (2003-02-14) [2015-01-22].
[20] STEWART R R C, BEWLEY J D. Lipid peroxidation associated with accelerated aging of soybean axes[J]. Plant Physiology, 1980, 65(2): 245-248. DOI:10.1104/pp.65.2.245.
[21] CHIAND M C, CHOU C C. Expression of superoxide dismutase, catalase and thermostable direct hemolysin by, and growth in the presence of various nitrogen and carbon sources of heat-shocked and ethanol-shocked Vibrio parahaemolyticus[J]. International Journal of Food Microbiology, 2008, 121(3): 268-274. DOI:10.1016/ j.ijfoodmicro.2007.11.001.
[22] YAO P, LI K, JIN Y, et al. Oxidative damage after chronic ethanol intake in rat tissues: prophylaxis of Ginkgo biloba extract[J]. Food Chemistry, 2006, 99: 305-314. DOI:10.1016/j.foodchem.2005.07.047. [23] JAYAKUMAR T, SAKTHIVEL M, THOMAS P A, et al. Pleurotus ostreatus, an oyster mushroom, decreases the oxidative stress induced by carbon tetrachloride in rat kidneys, heart and brain[J]. Chemico-Biological Interactions, 2008, 176(2): 108-120. DOI:10.1016/ j.cbi.2008.08.006.
[24] 石同幸, 赵美英, 聂木海, 等. 酒精中毒大鼠抗氧化防御能力代谢[J].中国公共卫生, 2001(10): 895-896.
[25] CHEN L H, ZHAO Y, CIECIA R, et al. Effects of alcohol feeding and thiamin defi ciency on antioxidant defenses in the liver and spleen of rats[J]. Biochemical Archives, 1999, 15(2): 103-116.
[26] 王秀平, 丁仲元. 自由基对人体的影响及其清除方法的研究[J]. 高校理论研究, 2008(34): 476-477.
[27] 吉琳琳. 不同抗氧化活性蔬菜对衰老机体抗氧化防御体系功能改善作用的比较研究[D]. 南宁: 广西医科大学: 23-36.
[28] 阎红, 刘英莉, 李清钊. 茶多酚和抗坏血酸对染石英粉尘大鼠抗氧化酶活性的影响[J]. 卫生研究, 2002, 31(1): 62-70. DOI:10.3969/ j.issn.1000-8020.2002.01.025.
[29] 李建科, 李国秀, 赵艳红, 等. 石榴皮多酚组成分析及其抗氧化活性[J]. 中国农业科学, 2009, 42(11): 4035-4041. DOI:10.3864/ j.issn.0578-1752.2009.11.034.
[30] 林佳, 李琰, 徐丽珍. 石榴叶的化学成分研究[J]. 中南医药, 2005, 3(2): 70-72. DOI:10.3969/j.issn.1672-2981.2005.02.002.
[31] 丁运生, 孙小虎, 李有桂. 鞣花酸及其衍生物研究进展[J]. 合肥工业大学学报(自然科学版), 2008, 31(11): 1809-1812. DOI:10.3969/ j.issn.1003-5060.2008.11.020.
Antioxidant Effects of Purified Polyphenols from Leaves of Punica granatum L. on Kidney, Heart and Immune Organs in Mice with Acute Alcoholic Liver Injury
WANG Meiju, TAO Mingxuan*, NIU Wenying, ZHU Cheng, YE Liyue, XING Jia
(Ginling College, Nanjing Normal University, Nanjing 210097, China)
Objective: To investigate the protective effect of purified polyphenols from leaves of Punica granatum L. (PPPL) on kidney, heart, spleen and thymus in a mouse model of acute alcohol-induced hepatic injury. Methods: Sixty-six male mice were randomly divided into blank control group, alcoholic injury model group, positive control group (administered with 150 mg/(kg d) bifendate by gavage) and PPPL low, medium, and high dose groups (100, 200 and 400 mg/(kg d)). All mice were administered for 30 days. On the next day, the mice from all groups except t he blank control group were administered with 50% alcohol (12 mL/kg), and then all the mice were subjected to dislocation death to assay the activities of SOD, CAT and GSH-Px and the contents of MDA and GSH in kidney, heart, spleen and thymus. Results: Compared with the alcoholic injury model group, the activities of SOD, CAT and GSH-Px and the contents of GSH in kidney, heart, spleen and thymus revealed an obvious increase in the PPPL treatment groups while the contents of MDA were obviously decreased. Conclusion: PPPL has pronounced antioxidant effect on kidney, heart and immune organs in mice with alcoholic hepatic injury.
purified polyphenols from leaves of Punica granatum L. (PPPL); alcohol liver injury; antioxidantion; heart; kidney; immune organs
10.7506/spkx1002-6630-201601037
TS201.4
A
1002-6630(2016)01-0208-05
王美菊, 陶明煊, 牛文颖, 等. 石榴叶多酚对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官的抗氧化作用[J]. 食品科学, 2016, 37(1): 208-212. DOI:10.7506/spkx1002-6630-201601037. http://www.spkx.net.cn
WANG Meiju, TAO Mingxuan, NIU Wenying, et al. Antioxidant effects of purified polyphenols from leaves of Punica granatum L. on kidney, heart and immune organs in mice with acute alcoholic liver injury[J]. Food Science, 2016, 37(1): 208-212. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601037. http://www.spkx.net.cn
2015-03-26
王美菊(1992—),女,硕士研究生,研究方向为生物活性物质与保健功能因子。E-mail:wmjessie@yeah.net
*通信作者:陶明煊(1970—),男,副教授,硕士,研究方向为生物活性物质与保健功能因子。E-mail:45017@njnu.edu.cn

