非典型先天性肾上腺皮质增生症误诊为多囊卵巢综合征二例报告
王含必,平凡,刘美芝,邓成艳
(中国医学科学院 北京协和医学院 北京协和医院妇产科,北京 100730)
非典型先天性肾上腺皮质增生症误诊为多囊卵巢综合征二例报告
王含必,平凡,刘美芝,邓成艳*
(中国医学科学院北京协和医学院北京协和医院妇产科,北京100730)
目的总结分析避孕药引起高孕酮血症患者的临床特征,探讨其诊治要点、鉴别诊断及治疗。方法两例患者因月经紊乱及不育而就诊,误诊为多囊卵巢综合征。口服避孕药治疗后孕酮值异常升高,以此为线索最终确诊为非典型先天性肾上腺皮质增生症。结果明确诊断后进行强的松类药物治疗,一例有3次试管婴儿治疗失败史的患者,治疗控制病情后一次试管婴儿即成功。另一例经强的松治疗后疗效明显,月经恢复正常。结论非典型先天性肾上腺皮质增生误诊为多囊卵巢综合征二例报告,提示早卵泡期血清孕酮水平的升高可作为诊断线索,口服避孕药使孕酮水平升高的案例非常罕见,发生这种情况必须进一步进行排除诊断。
孕酮;非典型先天性肾上腺皮质增生症;多囊卵巢综合症;口服避孕药
Methods:Two patients were treated in gynecological clinics for menstrual disorders and infertility. According to the symptom and physical signs,polycystic ovary syndrome (PCOS) was diagnosed firstly. The progesterone levels were increased significantly after administration of oral contraceptive. Based on deeper investigation of the clues,the terminal diagnosis was non-classic congenital adrenal cortex hyperplasia (NCCAH).
Results:The prednisone was used in the two patients after positive diagnosis. One patient had received IVF-ET therapy for three times in another hospital and failed. After the standard treatment for the NCCAH,the woman got pregnancy through one cycle of IVF-ET treatment. The another patient got the regular menstrual.
Conclusions:NCCAH was easily misdiagnosed as PCOS. The elevation of progesterone level during the early follicular phase could be used as a clue for the diagnosis. The progesterone level being significantly higher after administration of oral contraceptive was rare. In this case,further evaluation to exclude the other diseases should be carried out.
(JReprodMed2016,25(10):932-936)
临床中引起高孕酮血症的疾病最常见于非典型先天性肾上腺皮质增生症(nonclassic congenital adrenal hyperplasia,NCCAH),由于这类疾病的女性患者常常伴发月经紊乱而到妇产科首诊。如果基础性激素水平中孕酮水平高于生育年龄女性排卵后孕酮值(≥9.54 nmol/L),通常会引起妇产科医生的重视,很快会转入内分泌科就诊。但有时孕酮水平仅轻度升高,如(3.18~6.36)nmol/L左右,常常易被忽略。因为在月经期有黄体残留的患者以及实验室的检测过程中定标过高,都可能测定出孕酮值轻度升高。由于月经紊乱加之高雄激素症状及卵巢多囊表现,容易忽略轻度升高的孕酮,而被误诊为多囊卵巢综合征(PCOS)。PCOS患者为了控制月经周期及纠正高雄激素血症或高黄体生成素(LH)状态时,通常使用复方口服避孕药(COC)治疗,而PCOS患者不会因服用COC而引起孕酮水平进一步升高。在诊断为PCOS后,使用COC治疗导致孕酮水平进一步升高的病理现象在临床中罕见,容易延误诊断及治疗。特以两例患者为例分析这一类疾病的临床特点、诊治要点及文献复习,供妇产科大夫分享。
临床资料
一、研究对象
回顾性分析2例因月经紊乱及不育而在本院妇产科就诊的患者,最初诊断为PCOS。在使用口服避孕药调整月经及激素状态的过程中发现血孕酮值异常升高,进一步鉴别诊断,最终确诊为NCCAH。
二、临床特征及诊治经过
病例1:34岁,因不育就诊,初潮13岁,6~7/50~90 d,面部痤疮,B超示卵巢多囊样改变,外院诊断为PCOS。外院多次检查早卵泡期孕酮(P)值(3.18~6.36)nmol/L,未予重视。因不育,反复用克罗米芬及来曲唑诱导排卵治疗9个周期,B超监测均有排卵但未孕,此后经3次体外受精-胚胎移植(IVF-ET)周期亦未孕后,用优思明控制月经周期。转本院就诊,COC控制周期的月经第2天抽血,早卵泡期P值30.69 nmol/L,疑为肾上腺相关疾病转到内分泌科就诊。检查发现血压正常,血清总皮质醇(STC 或 F)、促肾上腺皮质激素(ACTH)及17羟孕酮(17-OHP)升高,小剂量地塞米松抑制试验被抑制。停药后随诊观察各项激素值(表1、2)。21羟化酶基因测定未发现异常,排除PCOS诊断,确诊为NCCAH。停用优思明,给予地塞米松0.375 mg/d治疗,用促性腺激素释放激素激动剂控制高LH状态,血P值降至正常水平后,接受IVF-ET治疗一个周期成功怀孕妊娠为双胎。
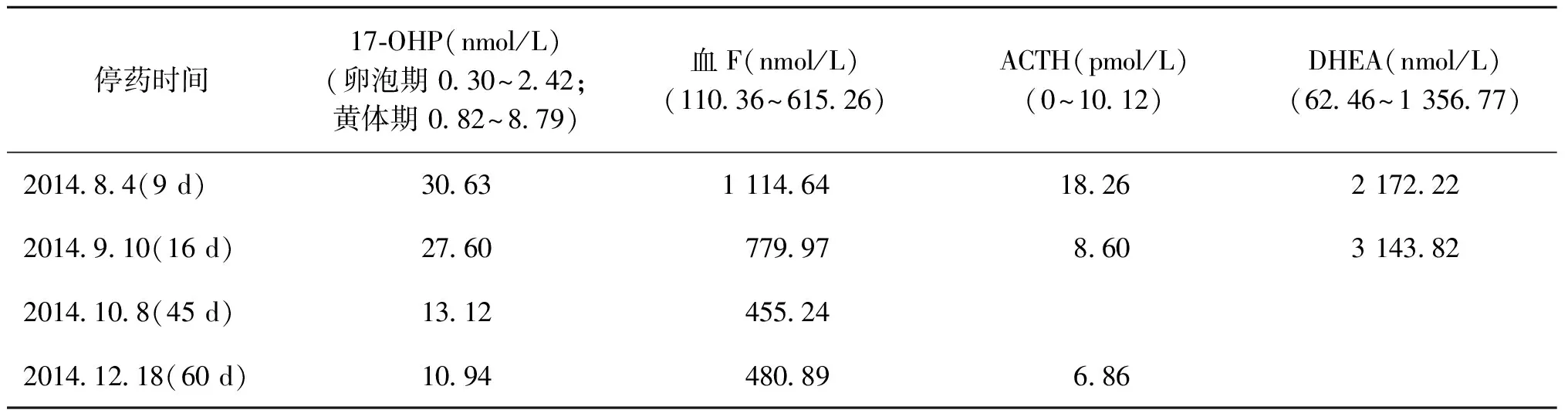
表1 停用COC后不同时间段各项激素水平的变化
注:DHEA:脱氢表雄酮(Dehydroepiandrosterone)

表2 使用COC前后不同时间段性激素水平的变化
病例2:24岁,身高156 cm,体重47.5 kg。因月经不规律伴多毛痤疮8年余就诊。13岁初潮,开始月经规律,自16岁开始间断出现月经不规律,青春期起脱发严重,皮肤油脂分泌多,耻骨联合至脐毛发增多。基础P值 5.02 nmol/L,外院诊断为PCOS予达英35治疗。患者转我院治疗,我院门诊随诊时发现服药期间早卵泡期血P值明显升高,进一步检测17-OHP 163.07 nmol/L(升高),DHEA 13 682.21 nmol/L(升高),血F 946.06 nmol/L(升高),ACTH 35.2 pmol/L(升高),24 h尿游离皮质醇(24 h UFC)259.89 nmol/24 h[正常值范围(33.95~285.66)nmol/24 h],胰岛素70.42 pmol/L(正常)。糖耐量筛查正常,骨密度无骨质疏松表现,肾素水平正常,无血压升高。肾上腺CT示肾上腺增粗增长。考虑达英35对激素水平有影响,停达英35后ACTH、血F、P均降为正常,服达英35前后及用药期间血性激素水平的变化详见表3。中剂量地塞米松抑制试验T被抑制大约80%,详见表4。21羟化酶基因测序结果显示:C.185 A>T,P. H62L,为已报道的有意义的突变[1-3],结合肾上腺CT诊断为NCCAH。明确诊断后给予泼尼松每日5 mg的剂量治疗,月经恢复正常。因尚无生育要求,根据病情逐渐调整到强的松每日3.75 mg维持治疗,月经规律。
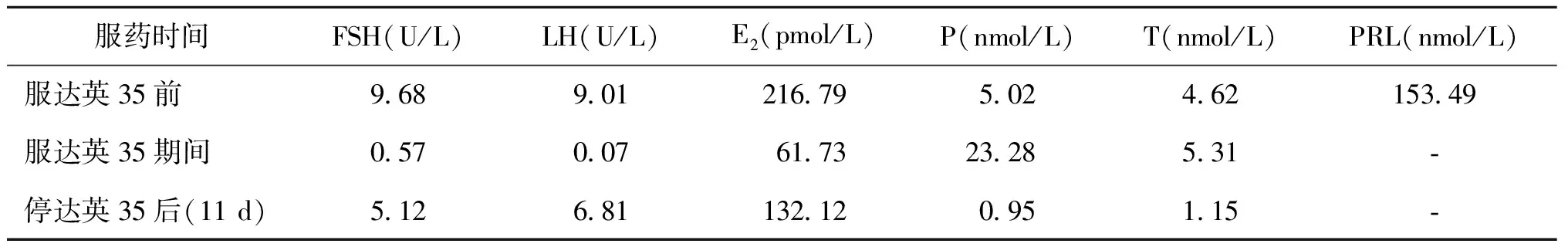
表3 服达英35前、中、后性激素水平的变化
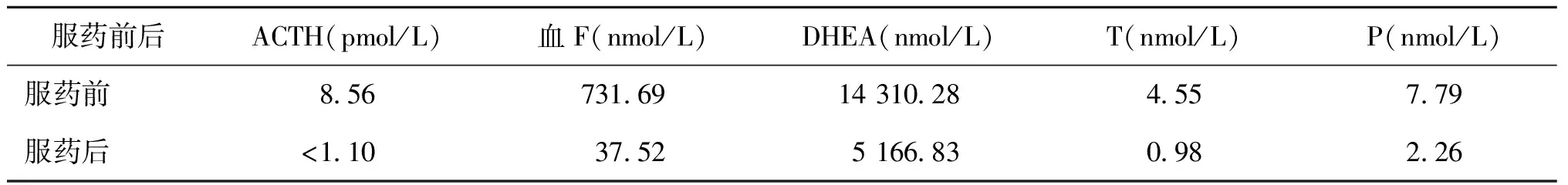
表4 中剂量地塞米松试验
讨 论
本文中两例患者以月经稀发、痤疮、有或无高雄激素血症及B超提示的卵巢多囊样改变而忽视了P值的轻度升高,被误诊为PCOS。转我院治疗后,发现基础P值轻度升高,服用COC后血P值进一步升高。以此为线索,进一步检查发现17-OHP、血F及ACTH均升高,上述指标升高符合先天性肾上腺皮质增生症(CAH)表现,经诊断实验确诊为NCCAH。
一、非典型先天性肾上腺皮质增生症
CAH分为经典型与非经典型,经典型患者因有典型的临床表现而易诊断。NCCAH临床表现虽轻,但发病率较高1/30~1/1 000,并与地域、种族有关,地中海、中东、德系犹太人患病率高。NCCAH患者因保留有20%~60%的21羟化酶活性,糖皮质激素、盐皮质激素处于代谢正常范围内,因此仅有雄激素过多的表现。文献[4]报道在高雄激素血症妇女中,1.1%~33%为NCCAH。女性出现多毛,原发性及继发性闭经或无排卵性不育,雄激素性秃发和痤疮也是常见的特征,有时还合并P值升高,甚至有部分患者无临床症状[5],故常因无典型CAH症状而易被误诊。事实上,NCCAH是一种公认的引起类似PCOS表现的一个原因,易被误诊为PCOS。21羟化酶缺乏可能占所有PCOS患者总数的1%~3%。
二、孕酮水平升高的临床诊断价值
月经规律的妇女早卵泡期抽血通常不查P值,一般在体温上升7 d或28 d月经周期的第21天查P值。正常月经周期者早卵泡期如果P值升高与上一个周期黄体萎缩是否彻底有关,对于月经不规律者,性激素分析若FSH、LH、E2是早卵泡期水平,P值升高则预示可能存在其他的激素代谢异常疾病,如CAH、NCCAH等。故月经不规律的女性在早卵泡期也应进行P值的检测。正常女性人群早卵泡期P值范围在(3.85±2.10)nmol/L,两例患者早卵泡期血P值在正常值上线范围内而未引起重视,又因其他症状符合PCOS的诊断而误诊。CAH和NCCAH均可导致P值升高,因肾上腺类固醇合成途径中,孕酮在17羟化酶和21羟化酶的作用下继续向下游代谢生成睾酮、雌激素、醛固酮和皮质醇。当上述两种酶完全或部分缺乏时,孕酮的代谢途径被阻断而导致孕酮的蓄积。
PCOS的诊断延用2013年鹿特丹会议制定的标准,并特别强调排除性诊断[6]。PCOS通常需要使用COC来控制月经周期和纠正高LH、高T水平。真正的PCOS患者服用COC不会引起P值升高。绝大多数情况下,CAH和NCCAH患者在服用COC时也不会引起P值升高,至今尚缺少COC导致P值升高的报道。这两例患者在服用COC时P值进一步升高的原因可能是:正常情况下,LH作用于泡膜细胞表面受体,刺激细胞色素P45017羟化酶和17,20裂解酶活性,使得P经4途径,孕烯醇酮经5途径生成17-OHP,进而降低了孕酮浓度[7]。而COC的使用抑制了LH的释放,使P的下游转化途径受到一定程度的限制,导致P值升高。由于正常人群有良好的自我调控能力,轻微的改变并不会引起P值升高,而这两例患者因基础病变是NCCAH,酶的部分缺失使P的代谢通路受阻,服用COC后因外源性激素打破了体内勉强维持的脆弱平衡,出现了P值升高。
三、口服避孕药使血孕酮水平升高的可能机制
COC也可能对血中激素水平产生影响。达英35说明书指出服用达英35可能影响某些实验室检查结果,包括肝脏、甲状腺、肾上腺和肾脏功能的生化指标。醋酸环丙孕酮(CPA)血清水平分两个时相下降,半衰期分别为0.8 h和2.3 d~3.3 d,代谢物排泄半衰期约1 d,估计约10 d药物可清除干净,但无法估计该药影响类固醇激素分泌的持续时间。2008年美国临床内分泌代谢杂志上的Cushing指南[8]指出炔雌醇使糖皮质结合蛋白升高,可导致血F水平升高,假阳性率甚至高达50%。因此应在停药6周后进行皮质醇的测定[9]。CPA可降低F、DHEA。达英35可抑制或对ACTH水平无明显影响,尚未发现其使ACTH升高的情况。17-OHP可能因CPA假性升高,化学发光法测定17-OHP说明书中提示0.49%与P发生交叉反应,所以使用CPA时可能出现P值假性升高。优思明中的孕激素成分是屈螺酮,而屈螺酮对激素代谢方面的影响目前尚无证据。
四、NCCAH与PCOS的鉴别诊断
NCCAH患者常有雄激素过多的表现,而此两例患者中仅一例出现血清T值升高。分析T值正常的可能原因:(1)NCCAH的患者由于酶的部分缺失,使甾体代谢通路上雄激素生成增多,酶活性缺失的越少,雄激素升高的程度也就越轻。(2)雄激素在血液循环中以3种形式存在:与性激素结合球蛋白(SHBG)紧密结合;与白蛋白疏松结合;游离状态。血液中大约60%的睾酮与SHBG紧密结合,l%~2%的睾酮与白蛋白结合。与SHBG结合的睾酮不具有生物活性。只有与白蛋白结合的睾酮和游离睾酮具有生物活性。游离睾酮只占总睾酮的1%~2%,由于游离睾酮能透过细胞膜与雄激素受体相互作用,因此认为游离睾酮是与生理学最相关的部分[10]。但是,由于游离睾酮的浓度非常低,加上测量技术有限,游离睾酮很少以临床常规方法被检测到。目前的检测方法是检测总睾酮,所以不能准确反映真正具有生物活性的睾酮的浓度。2014年最新的欧洲内分泌学会多囊卵巢综合征声明[11]中指出由于T水平各异和测试标准化不佳,很难定义确诊PCOS或其他原因引起的高雄激素血症的绝对水平。临床症状与生化检查阳性两者具备其一便可诊断高雄激素血症,此两例患者都有高雄激素的临床症状,但仅一例患者睾酮水平升高。
PCOS亦有肾上腺来源的雄激素水平升高[12],其中DHEA升高可见于25%的PCOS患者,17-OHP、雄烯二酮(AND)等亦可在PCOS患者中轻度升高。有PCOS表现的患者中大约有8%~10%其实是NCCAH。在NCCAH患者中,肾上腺来源的雄激素升高可促进类似PCOS发生。因此鉴别NCCAH与PCOS非常困难。目前学界认为NCCAH与PCOS间最显著的差异在于17-OHP的水平:17-OHP<4.55 nmol/L可有效排除非典型性21羟化酶缺乏症;当早卵泡期的基础17-OHP水平>12.12 nmol/L的情况下,诊断NCCAH敏感性90%,特异性100%;一般将<6.06 nmol/L作为排除NCCAH的切点(cut off 值),但亦有13%的NCCAH患者17-OHP<6.06 nmol/L。因此,基础17-OHP水平只是筛选试验,进一步确诊需进行ACTH兴奋试验。Ambrpziak等[13]认为17-OHP刺激试验有可能导致假阳性的诊断。ACTH兴奋试验的方法为首先抽取受试者基础水平的17-OHP后,给予250 μg二十四肽促皮质激素(替可克肽)60 min后再进行测定。刺激后17-OHP显著升高>33.33 nmol/L[14-15]。但刺激试验不总是必须的,早卵泡期,基础17-OHP>24.24 nmol/L,怀疑隐匿NCCAH(21羟化酶缺乏);17-OHP>606 nmol/L,可诊断CAH,不必做刺激实验。目前国内无法进行ACTH兴奋试验,采用中剂量地塞米松试验1 d法进行鉴别诊断。方法为口服地塞米松后17-OHP抑制率超过90%可诊断CAH。中剂量地塞米松抑制试验中CAH患者睾酮水平通常可抑制80%,但对PCOS患者睾酮水平只可抑制10%~20%。基因分型将逐步成为激素测量的有效补充。因21羟化酶缺乏所致的CAH中,基因型和表型之间的关系已经被确定。临床表型与等位基因较轻的突变相关,因此与剩余的21羟化酶活性有关。虽然已观察到有基因和表型间的分歧,但是这种相关性是相当强的。NCCAH和CAH实际上均是推测性诊断,无论进行哪种实验都是根据产物的缺失来推测酶的缺失。
本文中两例患者经上述鉴别诊断确诊为NCCAH,给予相应的治疗后激素水平恢复正常。其中第一例患者有迫切生育要求。在诊断NCCAH前未进行相应的治疗,使子宫内膜长期处于高P作用下,不利于胚胎种植,在外院虽经各种助孕技术均未能受孕。在我院明确诊断后,经地塞米松治疗使血P值降为正常,一次IVF-ET即成功受孕双胎妊娠。
本次报道为初步诊断PCOS服用COC后血P水平进一步升高,以此为线索进一步检查发现血F、ACTH及17-OHP均有升高,在进行了相关的鉴别诊断试验后证实这两例患者均为NCCAH的病患。在临床工作中,PCOS的诊断要排除其它相关疾病,特别是NCCAH尤易混淆,加之妇科医生对于NCCAH的诊断不熟悉,易造成漏诊。因此,当临床中发现基础状态P升高应提高警惕,发现P值升高时推荐在PCOS患者中常规进行血F、ACTH及17-OHP的筛查试验。
[1]Findling JW,Raff H. Newer diagnostic techniques and problems in Cushing’s disease[J]. Endocrinol Metab Clin North Am,1999,28:191-210.
[2]Wood PJ,Barth JH,Freedman DB,et al. Evidence for the low dose dexamethasone suppression test to screen for Cushing’s syndrome-recommendations for a protocol for biochemistry laboratories[J].Ann Clin Biochem,1997,34:222-229.
[3]邓明群,平凡,聂敏,等. 4例口服复方避孕药致假性库欣综合征病例分析[J]. 重庆医科大学学报,2015,40:989-992.
[4]Witchel SF,Azziz R. Nonclassic congenital adrenal hyperplasia [J]. Int J Pediatr Endocrinol,2010:625105.DOI:10.1155/2010/625105.
[5]Witchel SF. Non-classic congenital adrenal hyperplasia [J]. Steroids,2013,78:747-750.
[6]Legro RS,Arslanian SA,Ehrmann DA,et al. Diagnosis and treatment of polycystic ovary syndrome:an Endocrine Society clinical practice guideline [J]. J Clin Endocrinol Metab,2013,98:4565-4592.
[7]Payne AH,Hales D. Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones [J]. Endocr Rev,2004,25:947-970.
[8]Nieman LK,Biller BM,Findling JW,et al. The diagnosis of Cushing’s syndrome:an Endocrine Society Clinical Practice Guideline[J]. J Clinic Endocrinol Metab,2008,93:1526-1540.
[9]Macut D,Bozic Antic I,Nestorov J,et al. The influence of combined oral contraceptives containing drospirenone on hypothalamic-pituitary-adrenocortical axis activity and glucocorticoid receptor expression and function in women with polycystic ovary syndrome[J]. Hormones (Athens),2015,14:109-117.
[10]Yeap BB,Wilce JA,Leedman PJ. The androgen receptor mRNA [J].Bioessays,2004,26:672-682.
[11]Conway G,Dewailly D,Diamanti-Kandarakis E,et al. The polycystic ovary syndrome:a position statement from the European Society of Endocrinology [J]. Eur J Endocrinol,2014,171:P1-29.
[12]Pignatelli D. Non-classic adrenal hyperplasia due to the deficiency of 21-hydroxylase and its relation to polycystic ovarian syndrome [J]. Front Horm Res,2013,40:158-170.
[13]Ambroziak U,Kępczyńska-Nyk A,Kuryowicz A,et al. The diagnosis of nonclassic congenital adrenal hyperplasia due to 21-hydroxylase deficiency,based on serum basal or post-ACTH stimulation 17-hydroxyprogesterone,can lead to false-positive diagnosis [J]. Clin Endocrinol (Oxf),2016,84:23-29.
[14]Dewailly D. Nonclassic 21-hydroxylase deficiency [J]. Semin Reprod Med,2002,20:243-248.
[15]Witchel SF. Nonclassic congenital adrenal hyperplasia [J]. Curr Opin Endocrinol Diabetes Obes,2012,19:151-158.
[编辑:侯丽]
Atypical congenital adrenal hyperplasia misdiagnosed as polycystic ovary syndrome:a report of two cases
WANG Han-bi,PING Fan,LIU Mei-zhi,DENG Cheng-yan*
DepartmentofObstetrics&Gynecology,PekingUnionMedicalCollegeHospital,PekingUnionMedicalCollege,ChineseAcademyofMedicalScience,Beijing100730
Objective:To analyze the diagnosis,differential diagnosis and treatment of two patients with hyperlutemia induced by combined oral contraceptives (COC).
Progesterone;Non-classic congenital adrenal cortex hyperplasia;Polycystic ovary syndrome;Oral contraceptive
10.3969/j.issn.1004-3845.2016.10.015
2016-05-30;
2016-07-07
王含必,女,北京人,博士,副教授,妇科内分泌专业.(*

