微小RNA-136在骨关节炎发生发展中的作用及分子机制探究
阿布都艾尼·热吾提,缪晓刚,王利,瓦热斯江·尼亚孜,孙俊刚,袁宏
(新疆维吾尔自治区人民医院骨科中心关节外科,新疆 乌鲁木齐 830001)
实验研究
微小RNA-136在骨关节炎发生发展中的作用及分子机制探究
阿布都艾尼·热吾提,缪晓刚,王利,瓦热斯江·尼亚孜,孙俊刚,袁宏*
(新疆维吾尔自治区人民医院骨科中心关节外科,新疆 乌鲁木齐830001)
目的检测微小RNA-136(miR-136)在骨关节炎软骨中的表达,探究其对关节软骨细胞的作用并阐明其分子机制。方法收集36 例原发性膝关节骨关节炎软骨组织及36 例外伤性截肢后的膝关节软骨组织,采用荧光定量PCR检测软骨组织中miR-136的表达情况。瞬时转染miR-136模拟物至软骨细胞,并观察其对软骨细胞增殖及凋亡能力的影响。采用生物信息学预测miR-136靶基因,并通过双荧光素酶试验予以验证。结果miR-136在骨关节炎软骨组织的表达量明显低于正常软骨组织(P=0.02)。过表达miR-136可显著抑制软骨细胞的增殖能力,增加半胱氨酸天冬氨酸蛋白酶-3(cysteinyl aspartate specific proteinase,CASP3)及Bcl-2相关X蛋白(Bcl-2 associatal x protein,BAX)的表达,并降低B细胞淋巴瘤/白血病-2(B-cell CLL/Lymphone-2,BCL-2)蛋白的表达。BCL-2是miR-136的靶基因,miR-136可与BCL-2mRNA的3′-非编码区结合并抑制其翻译。结论miR-136在骨关节炎软骨组织中呈现低表达,过表达miR-136可显著抑制软骨细胞的增殖并增加其凋亡;BCL-2是miR-136的下游直接靶基因,miR-136可能通过调控BCL-2参与骨关节炎的发生发展过程。
miR-136;骨关节炎;软骨细胞;增殖;凋亡;BCL-2
骨关节炎(osteoarthritis,OA)是最常见的一种退行性关节疾病,又称骨关节病、退行性关节炎[1]。骨关节炎病情进展与年龄相关,对中老年人群的日常工作和生活质量产生严重的影响,是老年人致畸致残的重要原因。微小RNA分子(microRNAs或miRNAs)是一类长度约为21-25核苷酸的小型非编码RNA分子[2-3]。miRNAs通过碱基互补配对方式与靶基因的3′非翻译区(3′-ntranslated region,3′-UTR)结合,进而调控编码基因的表达[3-4]。大量研究表明,miRNAs可广泛参与肿瘤形成、免疫性疾病及内分泌疾病等几乎所有疾病的病理过程[5-6]。最近研究发现,miRNAs与OA的发生发展密切相关,miRNAs可能成为OA新的诊断标志物和分子治疗靶点[7]。
miR-136属于miRNA家族的成员之一。研究发现,miR-136在非小细胞癌高表达,并与肿瘤的恶性程度及转移密切相关[8]。miR-136通过下调通道蛋白Smad2和Smad3抑制肺腺癌细胞的转移与侵袭[9]。miR-136通过下调星形胶质细胞、上调基因-1抑制胶质瘤细胞的凋亡[10]。目前关于miR-136在OA的研究尚未见相关文献报道,本研究旨在分析miR-136在OA中的表达及功能,并初步探究其分子生物学机制,为OA的预防与治疗提供新的思路。
1 资料与方法
1.1实验仪器和试剂普通PCR仪购自美国BIO-RAD公司,LightCycler480荧光定量PCR仪购自瑞士Roche公司。总RNA提取试剂Trizol及SYBR premix Ex TaqTM Ⅱ PCR Kit购自日本Takara公司,蛋白裂解液RIPA及lipofectamine2000转染试剂购自美国Life technology公司,双荧光素酶检测试剂盒购自美国Promega公司。miR-136模拟物(mimics)(5′-UGAUGGAUUCUUAUGCUCCAUCA-3′)及阴性对照(mimics control)(5′-GUCCCACUUCGACCGUGCUUCCA-3′)购自苏州吉马公司,DMEM培养基+胎牛血清+Opti-MEM均购自美国Gibco公司,兔抗人BCL-2单抗(ab32124),BAX单抗(ab32503),CASP3单抗(ab32351)及内参GAPDH抗体(ab181602)均购自美国Abcam公司。
1.2临床资料本实验所用36 例人原发性膝关节骨关节炎软骨组织及36 例外伤性截肢后的膝关节软骨组织为2009年1月至2014年6月于新疆维吾尔自治区人民医院骨科中心收集,所用标本均经过新疆维吾尔自治区人民医院医学伦理委员会批准,并获得全部患者知情同意。36 例原发性膝关节骨关节炎患者其中男22 例,女14 例,平均年龄52 岁(38~73 岁);36 例外伤性截肢患者其中男26 例,女10 例,平均年龄43 岁(25~57 岁)。
1.3总RNA提取及荧光定量PCR试验按照Trizol说明书提取各样本总RNA,并进行逆转录试验合成cDNA。荧光定量PCR反应按照SYBR premix Ex TaqTM Ⅱ PCR Kit试剂盒说明书,以合成的cDNA作为模版在Roche LightCycler 480Ⅱ荧光定量PCR仪上进行。反应总体系为:模版cDNA 1μL,miR-136特异性引物0.4μL,2×SYBR premix Ex TaqTM Ⅱ PCR 8μL,10×miScript Universal Primer 1μL,miR-136上游引物序列为5′-AGGTAGTAGTTTTGTTTACCTCA-3′,下游引物序列为通用引物;以U6为作为内参,U6上游引物序列为5′-CCATGCTCTTCTACTCCT-3′,下游引物序列为5′-CACTGATGTCGGTTAGTT-3′,最后加RNase-free water补充反应总体积为20μL。荧光定量PCR反应条件为:95℃ 20 min,随后95℃ 10 s,60℃ 30 s,72℃ 30 s,共45个循环。以实验所用内参U6作为标准化对照,采用ΔΔCT分析方法分析荧光定量PCR仪所得数据[11]。
1.4细胞培养及转染实验所用软骨细胞购自中科院上海细胞库。采用DMEM培养基+10% FBS进行培养,细胞培养条件为37℃,5% CO2。采用Lipofetamine 2000转染试剂进行细胞转染。实验均分为2组,其中试验组转染miR-136 mimics,阴性对照组转染mimics control。
1.5细胞增殖试验将培养好的对数期生长的软骨细胞使用96孔板进行细胞铺板,每孔细胞数约为4 500个,采用lipofectamine 2000按上述分组进行细胞转染,转染细胞每孔连续4 d每天加入16 μL MTT(5 g/L,Sigma-Aldrich)并室温孵育4 h后去上清,之后每孔加入130 μL二甲亚砜孵育15 min予以充分溶解。测定各孔450 nm波长时的吸光度,并绘制生长曲线。
1.6蛋白质印迹将收集好的软骨细胞按照蛋白裂解液RIPA试剂说明书提取总蛋白,105℃加热15 min充分变性,常规制备12% SDS聚丙烯酰胺凝胶,每孔上样量15 μL,按照电泳、转膜、封闭,加入抗BCL-2单抗(1︰1 000稀释),抗CASP3单抗(1︰2 000稀释),抗BAX单抗(1︰1 000稀释)及内参GAPDH抗体(1︰10 000稀释),4℃孵育过夜,第2天使用抗兔二抗(1︰10 000稀释)室温孵育1 h,TBST洗涤3次,每次5 min。ECL发光液处理后暗室内曝光胶片,于常温下自然风干,扫描结果保存。
1.7miR-136靶基因生物信息学预测通过miRanda[12]生物信息学数据库预测并分析miR-136的下游靶基因。
1.8双荧光素酶报告基因试验委托苏州吉马公司构建BCL-2的双荧光素酶报告
基因载体:以psiCHECK2为基础载体,psiCHECK2-BCL-2-WT为野生型报告载体,psiCHECK2-BCL-2-MUT为突变型报告载体。将培养好的对数期生长的软骨细胞使用24孔板进行铺板,每孔细胞数达4×105个,共同转染miR-136 mimics或mimics control与野生型及突变型报告载体至软骨细胞。24 h后,按照Dual-Luciferase ○R Reporter Assay System试剂盒说明处理,验证靶基因BCL-2与miR-136结合位点。
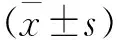
2 结 果
2.1miR-136在骨关节炎软骨及正常软骨组织的表达情况采用荧光定量PCR分析miR-136在原发性膝关节骨关节炎软骨组织及外伤性截肢后的膝关节软骨组织的表达特征。结果发现,以外伤截肢后的膝关节软骨组织中miR-136的表达水平为1,原发性膝关节骨关节炎软骨组织中miR-136的表达水平为(0.24±0.08),两组差异有统计学意义(P=0.02)。
2.2miR-136转染效率检测按上述实验分组采用Lipofetamine 2000转染试剂进行细胞转染。48 h后,采用荧光定量PCR比较两组软骨细胞中miR-136的表达情况。以mimics control组软骨细胞中miR-136表达量为1,miR-136 mimics组相对表达量为(128.22±12.45),两组差异有统计学意义(P<0.001)。
2.3miR-136对软骨细胞增殖能力的影响采用MTT实验检测软骨细胞增殖。结果如图1所示:miR-136 mimics组软骨细胞增殖速度较mimics control组明显降低(P<0.05)。转染后1、2、3 d细胞生长抑制率[1-(miR-136 mimics/mimics control)×100%]分别为5.24%、7.63%和13.11%(见图1)。
注:*代表P<0.05
2.4miR-136对软骨细胞凋亡的影响将培养好的软骨细
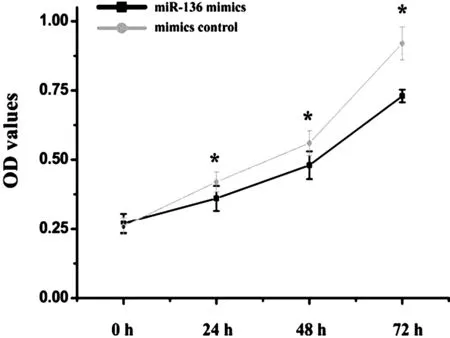
胞使用6孔细胞培养板进行铺板,并转染miR-136 mimics和mimics control,48 h后抽提蛋白,使用Western blot检测凋亡相关蛋白半胱氨酸天冬氨酸蛋白酶-3(cystenyl aspartate specific proteinose,CASP3)、Bcl-2相关X蛋白(Bcl-2 associatal x protein,BAX)、B细胞淋巴瘤/白血病-2(B-cal CLL/Lymphone-2,BCL-2)蛋白的表达情况。结果如图2所示,过表达miR-136可明显增加软骨细胞中CASP3与BAX蛋白的表达,并抑制BCL-2蛋白表达(P<0.05,见图2)。
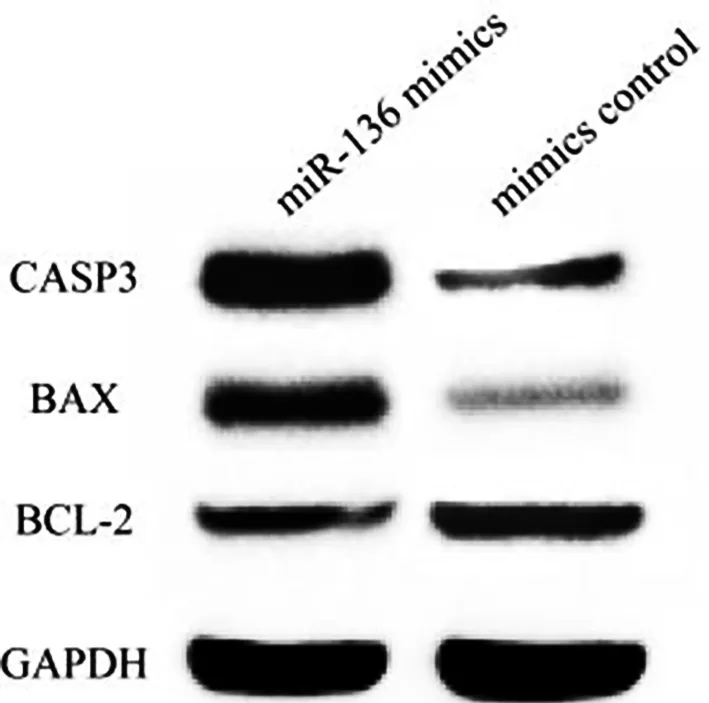
图2 miR-136对软骨细胞凋亡的影响
2.5miR-136靶基因生物信息学预测利用miRanda数据库分析miR-136的靶标基因,结果发现BCL-2可能是其靶基因。miR-136与BCL-2 mRNA 3′-UTR结合区域预测结果见图3。

图3 miR-136与BCL-2 mRNA 3′-UTR结合区域预测结果
2.6miR-136靶基因BCL-2双荧光素酶实验验证按照lipofectamine2000说明书,共同转染miR-136 mimics或mimics control与野生型及突变型报告基因载体至软骨细胞。24 h后利用Promega双荧光素酶报告基因检测试剂盒进行检测。结果见图4,miR-136可与BCL-2 mRNA 3′-UTR预测位点结合,并降低相对荧光比值;当结合位点突变后,miR-136结合能力消失,相对荧光比值恢复正常(见图4)。
3 讨 论
OA的病因十分复杂,主要由遗传因素、机体免疫调控失衡和局部物理因素等长期作用所致,但其确切的发病机制仍不明确[13]。OA好发于活动较频繁或负重关节的关节,如膝、手部、颞下颌关节、髋、踝等,其主要临床病理特征为受损关节的软骨细胞数量减少,关节软骨基质破坏,关节滑膜炎症反应等,病变涉及软骨细胞、软骨下骨以及周围肌肉韧带等组织,最终导致关节变形及功能障碍[13]。miRNAs是一类非编码的微小RNA分子,近些年有研究提示miRNAs在基因调控中的独特作用,可能成为治疗OA新的分子靶点[14]。Araldi等[15]研究发现miR-140是关节软骨发育过程中的重要分子,其可通过靶向调控人血小板反应蛋白解整合素金属肽酶5(ADAMTS-5)而降低骨关节炎的发病风险。Akhtar等[16]研究证实miR-27b通过抑制基质金属蛋白酶13(MMP-13)的表达进而减缓骨关节炎的进程。Yamasaki等[17]报道miR-146a在骨关节炎软骨中高表达,干扰miR-146a可明显抑制软骨细胞的增殖能力。
注:*代表P<0.05
miR-136定位于人14q 32.2号染色体上,目前已有文献报道miR-136在肺癌、胶质瘤、卵巢癌及甲状腺癌等多种疾病中起到了重要作用[8,18-20],但在骨关节炎中的作用及分子机制仍不明确。本研究发现miR-136在骨关节炎软骨组织的表达量明显低于正常软骨组织。体外细胞增殖和凋亡实验显示,过表达miR-136可显著抑制软骨细胞的增殖并诱导其凋亡。通过生物信息学分析,我们发现BCL-2 mRNA 3′-UTR存在miR-136的保守结合位点。因此,我们推测BCL-2可能为miR-136的靶基因之一。
细胞凋亡(apoptosis)又称为程序性细胞死亡,是由基因调控的细胞自主的消亡,该过程涉及一系列基因的激活、失活以及调控等的作用[21]。越来越多的研究表明,凋亡过程持续存在于骨关节炎病理过程中,软骨细胞的增殖与凋亡涉及多条信号通路,在骨关节炎的发生发展中起着十分关键作用[22]。BCL-2是细胞凋亡过程重要的调控因子[23]。为了进一步验证BCL-2为miR-136的靶基因,我们构建了BCL-2野生型及突变型报告基因载体与miR-136 mimics共转染到软骨细胞,探讨miR-136与BCL-2 mRNA 3′-UTR的靶向结合作用。结果发现,转染miR-136 mimics可导致野生型组相对荧光比值下降,而对突变型组相对荧光比值无影响,提示miR-136可与BCL-2 mRNA 3′-UTR结合,进而抑制其翻译。
综上所述,本研究观察到miR-136低表达于骨关节炎软骨组织,并初步揭示了miR-136可通过下调BCL-2抑制软骨细胞的增殖并诱导凋亡,miR-136有望成为OA诊断新的分子标志物及和治疗靶点。
[1]Lotz MK,Kraus VB.New developments in osteoarthritis.Posttraumatic osteoarthritis:pathogenesis and pharmacological treatment options[J].Arthritis Res Ther,2010,12(3):211.
[2]Mo YY.Microrna regulatory networks and human disease[J].Cell Mol Life Sci,2012,69(21):3529-3531.
[3]Bartel DP.Micrornas:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[4]Ambros V.The functions of animal micrornas[J].Nature,2004,431(7006):350-355.
[5]Ivey KN,Srivastava D.Micrornas as developmental regulators[J].Cold Spring Harb Perspect Biol,2015,7(7):a008144.
[6]Siomi H,Siomi MC.Posttranscriptional regulation of microrna biogenesis in animals[J].Mol Cell,2010,38(3):323-332.
[7]Amrouche L,Bonifay R,Anglicheau D.Micrornas in pathophysiology of renal disease:an increasing interest[J].Med Sci(Paris),2011,27(4):398-404.
[8]Shen S,Yue H,Li Y,etal.Upregulation of mir-136 in human non-small cell lung cancer cells promotes erk1/2 activation by targeting ppp2r2a[J].Tumour Biol,2014,35(1):631-640.
[9]Yang Y,Liu L,Cai J,etal.Targeting smad2 and smad3 by mir-136 suppresses metastasis-associated traits of lung adenocarcinoma cells[J].Oncol Res,2013,21(6):345-352.
[10]Yang Y,Wu J,Guan H,etal.Mir-136 promotes apoptosis of glioma cells by targeting aeg-1 and bcl-2[J].FEBS Lett,2012,586(20):3608-3612.
[11]Schmittgen TD,Livak KJ.Analyzing real-time pcr data by the comparative C(T) method[J].Nat Protoc,2008,3(6):1101-1108.
[12]John B,Enright AJ,Aravin A,etal.Human microrna targets[J].PLoS Biol,2004,2(11):e363.
[13]Oliveria SA,Felson DT,Cirillo PA,etal.Body weight,body mass index,and incident symptomatic osteoarthritis of the hand,hip,and knee[J].Epidemiology,1999,10(2):161-166.
[14]Herrera BM,Lockstone HE,Taylor JM,etal.Global microrna expression profiles in insulin target tissues in a spontaneous rat model of type 2 diabetes[J].Diabetologia,2010,53(6):1099-1109.
[15]Araldi E,Schipani E.Microrna-140 and the silencing of osteoarthritis[J].Genes Dev,2010,24(11):1075-1080.
[16]Akhtar N,Rasheed Z,Ramamurthy S,etal.Microrna-27b regulates the expression of matrix metalloproteinase 13 in human osteoarthritis chondrocytes[J].Arthritis Rheum,2010,62(5):1361-1371.
[17]Yamasaki K,Nakasa T,Miyaki S,etal.Expression of microrna-146a in osteoarthritis cartilage[J].Arthritis Rheum,2009,60(4):1035-1041.
[18]Xiong Y,Kotian S,Zeiger MA,etal.Mir-126-3p inhibits thyroid cancer cell growth and metastasis,and is associated with aggressive thyroid cancer[J].PLoS One,2015,10(8):e0130496.
[19]Zhao H,Liu S,Wang G,etal.Expression of mir-136 is associated with the primary cisplatin resistance of human epithelial ovarian cancer[J].Oncol Rep,2015,33(2):591-598.
[20]Chen W,Yang Y,Chen B,etal.Mir-136 targets E2f1 to reverse cisplatin chemosensitivity in glioma cells[J].J Neurooncol,2014,120(1):43-53.[21]Ray T,Pal A.Par-1 mediated apoptosis of breast cancer cells by V.Cholerae hemagglutinin protease[J].Apoptosis,2016,21(5):609-620.
[22]Wei Z,Li HH.Igfbp-3 may trigger osteoarthritis by inducing apoptosis of chondrocytes through nur 77 translocation[J].Int J Clin Exp Pathol,2015,8(12):15599-15610.
[23]Zhou Y,Liu SQ,Yu L,etal.Berberine prevents nitric oxide-induced rat chondrocyte apoptosis and cartilage degeneration in a rat osteoarthritis model via ampk and P38 mapk signaling[J].Apoptosis,2015,20(9):1187-1199.
The Function and Molecular Mechanism of miR-136 in Osteoarthritis
Abuduaini·Rewuti,Miu Xiaogang,Wang Li,etal
(Department of Orthopaedics,People′s Hospital of Xinjiang Uygur Autonomous Region,Urumqi 830001,China)
ObjectiveTo detect the expression of miR-136 in cartilage of osteoarthritis,and investigate the function and molecular mechanism of miR-136 in chondrocyte.Methods36 paired cartilage tissues and matched normal cartilage tissues from traumatic amputees were obtained from knee osteoarthritic of patients.Quantitative RT-PCR was applied to detect the expression level of miR-136 in cartilage tissues.miR-136 mimics was transient transfected in order to explore proliferation and apoptosis of chondrocyte.Bioinformatic analysis and dual luciferase reporter assay were used to predict and verify the target gene of miR-136 in chondrocyte.ResultsThe expression level of miR-136 was significantly lower expressed in cartilage of osteoarthritis compared with normal cartilage tissues(P=0.02).Exogenous over-expression of miR-136 could significantly inhibit chondrocyte proliferation and increased CASP3 and BAX expression,but decreased BCL-2 expression.BCL-2 was the target gene of miR-136 in chondrocyte.miR-136 could repress BCL-2 expression via binding to complimentary sequences in its mRNA 3′-untranslated regions(UTRs).ConclusionmiR-136 is significantly down-regulated in cartilage of osteoarthritis,over-expression of miR-136 can significantly inhibit chondrocyte proliferation and induced apoptosis.BCL-2 is a directly target gene of miR-136 in chondrocyte,miR-136 might involve in the occurrence of osteoarthritis by suppressing BCL-2.
miR-136;osteoarthritis;chondrocyte;proliferation and apoptosis;BCL-2
1008-5572(2016)10-0906-05
R684.3
A
2016-05-31
阿布都艾尼·热吾提(1982- ),男,主治医师,新疆维吾尔自治区人民医院骨科中心关节外科,830001。
*本文通讯作者:袁宏

