肺纤维化合并肺气肿综合征的病理特征及影响因素分析
王利玲 吴强鹏 程黎
肺纤维化合并肺气肿综合征的病理特征及影响因素分析
王利玲吴强鹏程黎
目的探讨肺纤维化合并肺气肿(CPFE)综合征的病理特征,并对其影响因素进行分析,为研究提供依据。方法选择诊断为存在肺气肿的慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)的患者120例作为观察对象,根据其是否合并肺纤维化分为CPFE组与COPD组,采用回顾性方法记录相关信息。对患者的血氧饱和度及肺功能:肺活量(VC)、残气量/肺总量(RV/TCL)、通气/血流比值(V/Q)等进行分析,同时行肺组织病理学检查。记录基本信息:性别、年龄、体重指数(BMI)、吸烟史、吸烟量(包/d)、高血压病史、糖尿病史、慢性肾脏疾病、反流性食管炎等,同时记录高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、三酰甘油(TG)、胆固醇(TC)、空腹血糖(FBG)、高敏C-反应蛋白(hs-CRP)、降钙素原(PCT)等。筛选出CPFE发生的相关因素,应用logistic回归分析进行多因素回归分析。结果CPFE组患者VC、RV/TCL、V/Q及FEVl/FVC<70%例数均明显低于COPD组患者,且血氧饱和度亦比COPD组患者低,差异均有统计学意义(P<0.05)。20例CPFE组患者具有不同程度的肺间质纤维化,以Ⅲ型胶原纤维为主,主要发生于支气管分支,以Ⅵ级以下的支气管分支最常见,5例患者累及呼吸性细支气管和肺泡壁;有6例患者出现肺上叶中心型肺气肿或肺大泡,肺下叶表现为间质性肺纤维化;3例患者在肺气肿后期可见肺间质纤维化改变逐渐取代肺气肿的固有变化。CPFE组患者吸烟史、吸烟量、慢性肾脏疾病及反流性食管炎均明显高于COPD组患者(P<0.05)。吸烟史、吸烟量及反流性食管炎是CPFE综合征发生的独立危险因素(P<0.05)。结论CPFE综合征表现为肺容积相对正常而弥散功能显著下降,吸烟、吸烟量及反流性食管炎是其发生的独立危险因素,在临床实际中需要对CPFE综合征引起重视。
肺纤维化合并肺气肿综合征;病理;危险因素
临床上肺纤维化主要是指当肺间质受损时,纤维母细胞通过分泌胶原蛋白修补肺间质而造成肺纤维化[1]。肺气肿指终末细支气管的弹性减退,进而出现充气及肺容积的增加。一般而言肺气肿诊断需要排除肺纤维化。但Okazaki等[2]以胸部高分辨率CT(HRCT)为基础,提出了肺纤维化合并肺气肿(CPFE)综合征的概念,并认为CPFE综合征是一种独立的疾病。由于CPFE综合征与既往知识存在差异,因此临床上对该病的报道笔者所见较少。陈昊等[3]对CPFE综合征的临床特点进行分析,但对其病理特征及影响因素未行进一步分析。本研究探讨CPFE综合征的病理特征,并对其影响因素进行分析,为研究提供依据。
1 资料与方法
1.1一般资料回顾性收集2010年1月至2015年3月攀枝花学院附属医院诊断为存在肺气肿的慢性阻塞性肺病(COPD)的120例高龄患者作为观察对象,其中男73例,女47例;年龄60~89岁,平均年龄(69.6±6.5)岁。患者均不同程度咳嗽、咳痰、气促、喘息及反复发作的呼吸道感染表现。合并有肺纤维化20例患者为CPFE组,其中男13例,女7例;年龄60~88岁,平均年龄(70±6)岁。未合并肺纤维化100例患者为COPD组,其中男60例,女40例;年龄62~89岁,平均年龄(70±6)岁。2组患者的性别比、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2纳入与排除标准
1.2.1纳入标准:①符合COPD诊断[4]:既往吸烟等高危因素史,咳嗽、咳痰,吸入支气管舒张药后FEV1/FVC<70%及FEV1<80%预计值确定为不完全可逆性气流受限;无咳嗽、咳痰症状,仅在肺功能检查时FEV1/FVC<70%,而FEV1≥80%预计值,在除外其他疾病后,诊断为COPD。②肺气肿诊断[5]:HRCT显示胸腔前后径增大,肺部存在以上肺野为主的边界清晰的无壁的低密度灶,或者直径>1 cm的肺大泡。③肺纤维化诊断[6]:HRCT显示肺组织结构破坏,网状阴影或磨玻璃影。
1.2.2排除标准:结缔组织病相关的肺部疾病,Wegener肉芽肿,恶性肿瘤,心功能不全,出血性疾病等。
1.3研究方法入院后均积极完善相关检查,所有患者均行胸部HRCT检查。给予相应的对症支持治疗措施。对患者的血氧饱和度及肺功能:肺活量(VC)、残气量/肺总量(RV/TCL)、通气/血流比值(V/Q)等进行分析,同时行肺组织病理学检查。记录基本信息:性别、年龄、体重指数(BMI)、吸烟史、吸烟量(包/d)、高血压病史、糖尿病史、慢性肾脏疾病、反流性食管炎等,同时记录高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、三酰甘油(TG)、胆固醇(TC)、空腹血糖(FBG)、高敏C-反应蛋白(hs-CRP)、降钙素原(PCT)等。筛选出CPFE发生的相关因素,应用logistic回归分析进行多因素回归分析。
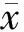
2 结果
2.12组患者肺功能比较CPFE组患者VC、RV/TCL、V/Q及FEVl/FVC<70%比例均明显低于COPD组患者,且血氧饱和度亦比COPD组患者低,差异均有统计学意义(P<0.05)。见表1。

表1 2组患者肺功能比较
2.22组病理特征分析CPFE组患者具有不同程度的肺间质纤维化,以Ⅲ型胶原纤维为主,主要发生于支气管分支,以Ⅵ级以下的支气管分支最常见,5例患者累及呼吸性细支气管和肺泡壁;有6例患者出现肺上叶中心型肺气肿或肺大泡,肺下叶表现为间质性肺纤维化;3例患者在肺气肿后期可见肺间质纤维化改变逐渐取代肺气肿的固有变化。100例COPD组患者仅表现为不同程度肺气肿或肺大泡,部分患者可见肺泡壁的断裂,肺泡毛细血管破坏,毛细血管受肺泡膨胀的挤压而退化。
2.3CPFE综合征发生的单因素分析CPFE综合征发生的单因素分析结果显示:CPFE组患者吸烟史、吸烟量、慢性肾脏疾病及反流性食管炎均明显高于COPD组患者,2组比较差异有统计学意义(P<0.05);其他因素比较差异无统计学意义(P>0.05)。见表2。

表2 CPFE综合征发生的单因素分析
2.4CPFE综合征发生的独立危险因素分析CPFE综合征发生的独立危险因素分析结果表明:吸烟史、吸烟量及反流性食管炎是CPFE综合征发生的独立危险因素(P<0.05)。见表3。
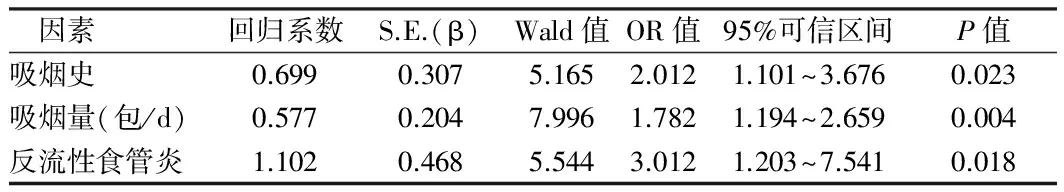
表3 CPFE综合征发生的独立危险因素分析
3 讨论
研究证实,CPFE综合征患者由于存在肺气肿与肺纤维化,因此引起肺组织存在通气功能与换气功能双重障碍,其临床表现明显不同于COPD或单纯肺纤维化,可以表现为反复发作的呼吸道感染症状以及日益严重的胸憋、气促、呼吸困难,部分患者可合并有肺动脉高压[7,8]。
本研究分析120例存在肺气肿的COPD患者发现,20例该类患者合并有肺纤维化,发生率为16.7%。可见CPFE综合征患者并不少见。随着医学技术的发展,胸部HRCT的广泛应用,其更容易协助CPFE综合征的诊断,胸部HRCT主要表现为上肺野肺气肿表现,同时合并有下肺野的纤维化样改变[9]。本研究20例CPFE组患者具有不同程度的肺间质纤维化,以Ⅲ型胶原纤维为主,主要发生于支气管分支,以Ⅵ级以下的支气管分支最常见,5例患者累及呼吸性细支气管和肺泡壁;有6例患者出现肺上叶中心型肺气肿或肺大泡,肺下叶表现为间质性肺纤维化;3例患者在肺气肿后期可见肺间质纤维化改变逐渐取代肺气肿的固有变化。Aurie等[10]通过对41例COPD患者尸检发现,有12例患者存在肺间质及肺泡的纤维化,分析其原因为由于COPD病程的延长,长期反复的感染病史,使病变进一步发展到肺组织深部,肺组织为修复炎性损伤,造成纤维化的发生。
本研究对肺功能进行比较发现CPFE组患者VC、RV/TCL、V/Q及FEV1/FVC<70%例数均明显低于COPD组患者,且血氧饱和度亦比COPD组患者低。可见CPFE综合征肺功能可以表现为肺容积相对正常而弥散功能显著下降。分析认为其可能是由于肺气肿引起的过度充气抵消了肺纤维化引起的肺容积下降,因此表现为肺容积相对正常;但两者均对肺的弥散功能有影响,通过叠加作用进一步降低了弥散功能[11]。有研究发现,有22%的单纯弥散功能下降患者同时存在肺气肿与肺纤维化[12],因此当患者出现单纯的肺组织弥散功能下降时,需要考虑CPFE综合征。
本研究进一步分析CPFE综合征发生的单因素发现,CPFE组患者吸烟史、吸烟量、慢性肾脏疾病及反流性食管炎均明显高于COPD组患者;校正相关因素后发现吸烟史、吸烟量及反流性食管炎是CPFE综合征发生的独立危险因素。吸烟已被证实是肺纤维化发生的高危因素,吸烟者出现肺纤维化的风险是不吸烟者的5倍多[13]。同时吸烟可以引起支气管炎症,长期吸烟或吸烟量较大可以引起管腔狭窄,甚至发生阻塞,进而使进入肺泡的空气不能有效排除,滞留肺泡中引起压力增加,最终引起肺泡扩张、破裂[14,15]。亦有研究发现,吸烟吐出的烟雾有趋化中性粒细胞的作用,进而激活蛋白酶,促进弹性蛋白的降解,在肺组织发生炎性反应引起肺气肿的基础上,进一步破坏肺组织,此时肺组织为修复损伤需要大量分泌胶原与细胞外基质,最终导致肺间质纤维化[16,17]。研究发现,反流性食管炎可以引起反复的微量吸入,进而对肺组织产生反复的刺激损伤,增加了肺组织发生纤维化的风险[18]。Ando等[19]通过动物实验认为肺组织是糖尿病的靶器官,与正常小鼠相比,糖尿病小鼠更容易发生肺泡壁的增厚及间质的增宽,进而肺纤维化风险增加。但本研究未发现糖尿病是CPFE综合征发生的独立危险因素。分析认为可能与研究对象不同有关,该研究为动物实验,本研究为病例对照研究。
1Dierksen GA,Skehan ME,Khan MA,et al.Spatial telation between microbleeds and amyloid deposits in amyloid angiopathy.Ann Neurof,2010,68:545-548.
2Okazaki S,Sakaguchi M,Hyun B,et al.Cerebral microbleeds predict impending intracranial hemorrhage in infective endocarditis.Cerebrovasc Dis,2011,32:483-488.
3陈昊,陈碧,刘平莉,等.慢性阻塞性肺疾病合并肺纤维化的临床特征分析.徐州医学院学报,2013,33:187-190.
4彭敏,蔡丰,田欣伦,等.肺纤维化合并肺气肿综合征八例并文献复习.中华结核和呼吸杂志,2010,33: 515-518.
5Poels MM,Ikram MA,Vander-Lugt A,et al.Cerebral microbleeds are associated with worse cognitive function:the rotterdam scan study.Neurology,2012,78:326-333.
6陆芳,葛虓俊,滑炎卿.肺纤维化合并肺气肿的临床和影像学研究进展.中华临床医师杂志,2013,14: 6618-6620.
7Appelman AP,Vincken KL,van der Graadf Y,et al.White matter lesions and lacunar infarcts are independently and differently associated with brain atrophy: the SMART MR study.Cerebmvasc Dis,2010,29: 28-35.
8Jankowich MD,Rounds S.Combined pulmonary fibrosis and emphysema alters physiology but has similar mortality to pulmonary fibrosis without emphysema.Lung,2010,188:365-373.
9张志直,张永海,何晓芬,等.高海拔地区肺间质疾病合并肺纤维化的HRCT表现及其临床特点分析.实用放射学杂志,2013,29:1578-1581,1592.
10Aurie IE,Bomstien NM,Berenyi E,et al.Ciinical,radiological and pathological correlates of leukoaziosis.Acta Neurol Scand,2010,13:1600-1604.
11Smilh EE.Leukoaraiosis and stroke. Stroke,2010,41: 139-143.
12王晓莲,吴剑卿,邹春英,等.老年肺纤维化合并肺气肿综合征的临床特点.江苏医药,2013,39:2610-2611.
13Werring DJ,Gregoire SM,Cipolotti L.Cerebral microbleeds and vascular cognitive impairment.J Neurol Sci,2010,299:131-135.
14马江伟,李振华,许慧,等.特发性肺间质纤维化合并肺气肿与未合并肺气肿患者的临床对比研究. 中华结核和呼吸杂志,2013,36: 173-176.
15孙健,沈巨信,余月芳.肺纤维化合并肺气肿综合征3例并文献复习.国际呼吸杂志,2012,32:891-895.
16Nunes H,Monnet I,Kannengiesser C,et al.Is telomeropathy the explanation for combined pulmonary fibrosis and emphysema syndrome:report of a family with TERT mutation.Am J Respir Crit Care Med,2014,189: 753-754.
17Casali L,Carratù P,Sofia M.Clinical variability of respiratory pulmonary hypertension: implications for diagnosis and management.Multidiscip Respir Med,2013,8:72.
18Nagata N,Watanabe K,Yoshimi M,et al.Combined unclassifiable interstitial pneumonia and emphysema:a report of two cases.Intern Med,2013,52: 2337-2341.
19Ando K,Sekiya M,Tobino K,et al.Relationship between quantitative CT metrics and pulmonary function in combined pulmonary fibrosis and emphysema.Lung,2013,191: 585-591.
10.3969/j.issn.1002-7386.2016.21.029
项目来源:重庆市卫生医学科研计划项目(编号:20142077)
617000四川省攀技花市,攀枝花学院附属医院呼吸科(王利玲),内分泌科(吴强鹏);重庆市医疗急救中心呼吸科(程黎)
R 563.3
A
1002-7386(2016)21-3299-03
2016-03-09)

