冬虫夏草菌丝体提取物通过抑制炎性因子及Treg细胞功能缓解肺纤维化
岳会敏 刘 飞 李范林 马菲雅 沈苏南 侯亚义
(南京大学医学院和生物医药技术国家重点实验室,南京210093)
冬虫夏草菌丝体提取物通过抑制炎性因子及Treg细胞功能缓解肺纤维化
岳会敏刘飞李范林马菲雅沈苏南侯亚义
(南京大学医学院和生物医药技术国家重点实验室,南京210093)
目的:观察冬虫夏草菌丝体(Hirsutella sinensis mycelium,HSM)提取物对盲肠穿孔结扎(CLP)小鼠的炎症反应和肺纤维化程度的影响。方法:建立CLP诱导脓毒症5 d和10 d小鼠模型,分别分为假术组(sham,n=5)、模型组(CLP,n=11)、治疗组(HSM,n=11)。冬虫夏草菌丝体组在术前2 h和术后给予HSM提取物200 mg/(kg·d)(低于人体用量0.27 g/kg),假术组和模型组给予等量的生理盐水。利用Q-PCR检测了肺组织中炎性因子TNF-α和IL-1β及纤维化因子TGF-β1、TIMP1和MMP9的表达;利用流式细胞术分析了小鼠外周血和脾脏中Th1细胞以及脾脏组织中Treg细胞的数量;另外,还对肺组织切片进行了HE染色以及α-平滑肌肌动蛋白(α-SMA)和纤连蛋白(fibronection)免疫组化染色。结果:模型组外周血和脾脏中Th1细胞以及脾脏组织中Treg细胞的数量较假术组显著降低,而HSM提取物治疗能上调上述细胞的数量。5 d时,模型组肺组织中IL-1β及纤维化因子TGF-β1、MMP9和TIMP1表达显著上调,到第10天时有所降低但仍高于sham组,而治疗组上述因子表达明显降低;各组肺组织TNF-α表达无显著差异;HE染色显示模型组肺部炎性样变明显,到第10天时炎性样变比5 d时减轻,而治疗组均有改善;免疫组化显示与假术组比,模型组肺内间质α-SMA和fibronection表达明显增多,而治疗组肺内间质表达低于模型组。结论:HSM提取物具有抑制炎症、平衡免疫及缓解肺纤维化的功能。
冬虫夏草菌丝体;炎症反应;肺纤维化
肺纤维化是一种慢性的、不可逆的肺部间质性疾病,可造成肺泡结构的破坏,进而导致病人呼吸困难,最终因呼吸衰竭而死亡[1]。此类疾病病因尚不明确,但被普遍认为与暴露于职业危害、环境因素及基因易感性相关[2]。肺纤维化预后较差,通常在患病早期启动炎症反应,以上皮细胞转分化、成纤维细胞大量增殖、纤维化病灶的形成以及肺结构破坏为特征[3]。上皮细胞向间质细胞转化(EMT)和间质标志vimentin表达伴随着E-cadherin的表达消失都是肺纤维化的标志[4]。肺纤维化的发生和发展与TGF-β1活化密切,TGF-β1诱导过多的胶原和ECM产生积聚以及基底膜MMP/TIMP失衡。由于其病理机制复杂,目前为止现代医学仍缺乏良好的临床治疗手段[5]。
冬虫夏草菌丝体是我国传统的名贵中药材,它是由冬虫夏草菌寄生于蝙蝠蛾幼虫而形成的幼虫尸体和干燥子座的复合体。冬虫夏草现在常被用来治疗呼吸系统疾病,也有报道称其可作为抗氧化剂和血管生成抑制剂。近年来有研究表明冬虫夏草菌丝体可通过抑制TGF-β1表达及促进胶原降解缓解肝肾肺纤维化等功能[6-9]。Keshar等[10]证实,脓毒症诱导的急性呼吸窘迫综合征(ARDS)可能诱发持续的纤维化病变,本实验构建了CLP诱导脓毒症模型,主要目的是明确冬虫夏草菌丝体缓解肺纤维化的作用,探讨其作用的潜在机制。
1 材料与方法
1.1材料
1.1.1实验动物4~6周龄的C57BL/6小鼠,雄性,体重18~20 g,购自南京大学模式动物所,饲养于SPF级动物房内,保证饮食和饮水,昼夜循环,使用前饲养不少于1周。
1.1.2药物与试剂冬虫夏草菌丝体提取物由南京中科药业有限公司提供(批号:20140778);免疫组化所用fibronectin抗体购自SANTA CRUZ公司,1∶50稀释 ;α-SMA抗体是abcam公司产品,1∶200稀释;DAB显示试剂盒购自武汉博士德生物工程有限公司(产品编号:AR1022);SABC-AP免疫组化染色试剂盒购自武汉博士德生物工程有限公司(产品编号:SA1050);实验用流式抗体均为eBioscience产品。
1.1.3实验动物处理两种模型各27只小鼠在SPF级动物房饲养1周后,随机分组,实验分组如下:(1)sham组:小鼠腹腔注射100 μl/10 g生理盐水,2 h后用4%水合氯醛(200 μl/每只)麻醉小鼠打开腹腔暴露盲肠,不结扎不穿刺,然后将盲肠放入腹腔,逐层关闭腹腔,缝好伤口;每组5只小鼠;(2)实验组:①CLP组:小鼠腹腔注射100 μl/10 g生理盐水,2 h后用4%水合氯醛(200 μl/每只)麻醉小鼠打开腹腔抽出盲肠结扎穿刺,之后将盲肠放入腹腔逐层关闭腹腔,缝好伤口;每组11只小鼠;②治疗组:冬虫夏草菌丝体液(200 mg/kg)预处理2 h,随后进行CLP手术,术后每天菌丝体液(200 mg/kg)灌胃,每组11只小鼠,术后5 d或10 d处死小鼠。
1.2方法
1.2.1流式细胞术将收集的细胞用PBS洗3遍,然后用PBS重悬并转移至标准BD流式管中,按抗体说明书加入相应用量的流式抗体,4℃避光孵育30 min, PBS洗2遍,重悬细胞后使用流式细胞仪检测。标记胞内因子的,PBS洗两遍后,加500 μl 4%的PFA室温固定20 min,离心去上清;加500 μl 含0.1%saponin的PBS,破膜15 min,离心去上清;按抗体说明书加入相应用量的流式抗体,4℃避光孵育30 min,然后用含0.1% saponin的PBS洗2遍,重悬细胞后上流式细胞仪检测。
1.2.2Q-PCR将肺组织匀浆后,加入Trizol,提总RNA,核酸蛋白检测仪检测RNA的纯度和浓度后,取1 g RNA进行反转录。反转录体系(20 μl):4 μl 5×RT buffer,2 μl dNTP,0.5 μl RNase inhibitor,0.5 μl Oligo dT,0.5 μl ReverTra Ace,1 μg RNA,加DEPC水至20 μl;采用三步法进行Q-PCR反应,反应在Applied BioSystems 7300 Sequence Detection System中进行,得到各个基因的Ct值,然后以GAPDH为内参,按照2-ΔΔCt进行计算确定目的基因的表达。其中IL-1β、TNF-α、TGF-β1、MMP9和TIMP1引物均按primer bank查询设计合成,GAPDH引物根据文献合成。
1.2.3组织学观察肺组织取出后用4%多聚甲醛固定,常规HE染色,切片在光学显微镜10×20视野下观察肺组织形态变化。
1.2.4免疫组化染色石蜡切片脱蜡、水化后,热修复;冷却后,3%H2O2阻断过氧化氢酶;PBS洗3遍,然后按抗体说明书滴加适当浓度的一抗,4℃孵育过夜;按说明书滴加适量二抗,37℃孵育45 min后,用PBST洗3遍,加底物SABC 37℃孵育20 min;随后用PBST洗4遍,DAB(武汉博士德生物公司)显色;复染透明后封片;在光学显微镜10×20视野下观察。
2 结果
2.1冬虫夏草菌丝体对肺组织炎性反应的影响Q-PCR结果显示,与sham组相比,5 d CLP组小鼠肺组织重要的炎性因子IL-1β的mRNA的表达升高(P<0.05),而HSM治疗组IL-1β的mRNA表达相比CLP组明显降低(P<0.05);此外,TNF-α也有与IL-1β相似的变化趋势,但改变不明显,见图1A。10 d CLP组小鼠肺组织重要的炎性因子IL-1β的mRNA的相比5 d 模型组有所降低但仍高于sham组,而给予HSM治疗后降低(P<0.05);此外,TNF-α也有与IL-1β相似的变化趋势,但改变不明显,见图1B。
肺组织HE染色显示,模型组小鼠的肺组织出现炎性细胞浸润、系膜基质增生,血管充血等变化;给予HSM提取物治疗后,上述症状减轻。见图1C。以上结果说明肺组织炎性样变随病程进展而减轻,而冬虫夏草菌丝体改善了小鼠肺组织炎性病变。
2.2冬虫夏草菌丝体对小鼠免疫细胞的影响本实验利用流式细胞术研究了HSM提取物对小鼠脾脏中Treg 细胞以及PBMC和脾脏中Th1细胞数量的影响。结果显示:与sham组相比,5 d CLP组小鼠脾脏中Treg细胞数量均显著增多(P<0.05),而与CLP组相比,给予HSM提取物治疗后,小鼠脾脏中Treg细胞数量明显降低(P<0.05),见图2A;10 d组各组间变化趋势与5 d组相似,见图2B;与sham组相比,5 d CLP组小鼠脾脏中Th1细胞数量显著减少(P<0.05),而与CLP组相比,给予HSM提取物治疗后,小鼠脾脏中Th1细胞数量有显著增加(P<0.05),见图3A;10 d组各组小鼠脾脏中Th1细胞数量变化趋势与5 d组相似,见图3B ;与sham组相比,5 d和10 d CLP组中小鼠PBMC中Th1细胞数量均有下降趋势,而给予HSM提取物治疗后Th1细胞数量有增多的趋势,见图3A和图3B。
2.3冬虫夏草菌丝体对肺组织纤维化分子表达的影响Q-PCR结果显示,5 d CLP组小鼠肺组织TGF-β1、金属基质蛋白酶9(MMP9)和金属蛋白酶组织抑制物1(TIMP1)的mRNA表达均显著上调;而HSM治疗组小鼠肺组织TGF-β1和MMP9的表达与CLP组相比均有显著下降(P<0.05),TIMP1有下降趋势;见图4A;10 d CLP组小鼠肺组织TGF-β1的mRNA表达有上调趋势, MMP9和TIMP1的mRNA表达相比第5天时有所降低但仍显著高于sham组,而与CLP组相比,给予HSM提取物治疗后,TGF-β1和MMP9的表达均明显下调,见图4B;提示CLP组小鼠肺部可能出现纤维化病变且纤维化病变在发病后期有减轻的趋势,经HSM提取物治疗后小鼠肺部ECM的合成和降解失衡得到控制、肺纤维化病变可能得到改善。

图1 HSM改善小鼠肺部炎性反应(n=3)Fig.1 HSM can improve inflammation in mice′s renal sections(n=3)Note: HE staining was performed on renal sections.Original magnification,*.P<0.05,**.P<0.01,***.P<0.001.
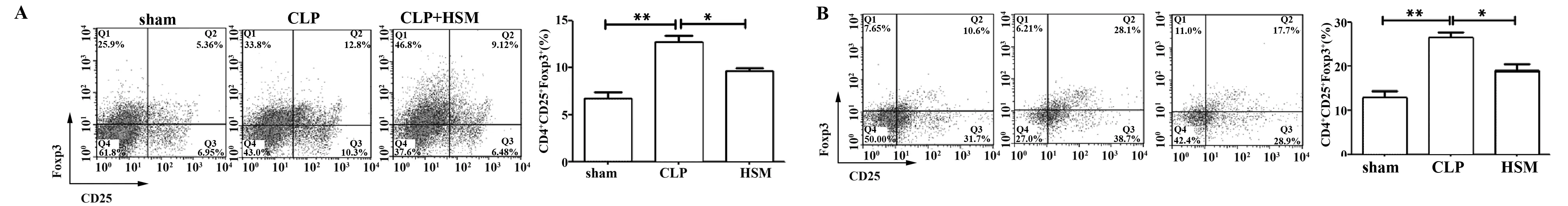
图2 HSM对小鼠脾脏Treg细胞数量的影响(n=3)Fig.2 HSM influences amounts of mice′s Treg in spleen(n=3)Note: *.P<0.05,**.P<0.001.

图3 HSM对小鼠外周血和脾脏中Th1细胞数量的影响(n=3)Fig.3 HSM influences amounts of mice′s Th1 cells in PBMC and spleen(n=3)Note: *.P<0.05,**.P<0.01,***.P<0.001.
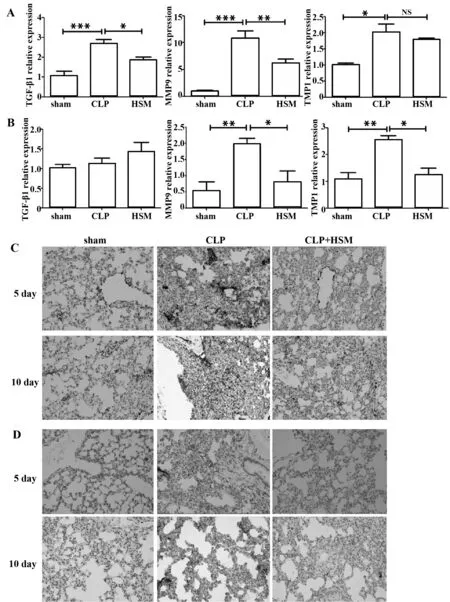
图4 HSM改善小鼠肺纤维化情况(n=3)Fig.4 HSM can improve mice′s pulmonary fibrosis(n=3)Note: Immunohistochemical staining was performed on lung sections.Original magnification×20.*.P<0.05,**.P<0.01,***.P<0.001.
2.4冬虫夏草菌丝体对肺组织α-SMA和fibrone-ctin蛋白表达影响α-SMA和fibronectin在sham组小鼠肺组织内表达很弱;经过CLP手术后表达增强,其主要表达于肺上皮细胞和肺内间质中;而给予HSM提取物治疗后,两种蛋白的表达明显减少见图4C和图4D。它们在不同时间点的表达也有不同。
3 讨论
在肺纤维化的发生和发展过程中,肺组织受到损伤,由于炎症区域会出现明显的巨噬细胞、中性粒细胞和淋巴细胞的浸润,这些浸润的炎症细胞可以产生IL-1、TNF-α和MCP-1等细胞因子,进而形成复杂的细胞因子网络,调控间质成纤维细胞和肺泡上皮细胞的增殖和凋亡,导致ECM活化增殖,最终促进肺纤维化的发生。Th1细胞产生的IFN-γ可以抑制TGF-β表达,抑制胶原产生而减轻肺纤维化损伤,本实验中CLP组脾脏中Th1细胞数量较sham组减少,给予HSM治疗后有明显上调。此外,肺组织炎性因子TNF-α和IL-1β的mRNA水平表达量以及肺HE染色结果显示,进行CLP处理第5天时炎症因子表达升高较为显著且肺组织损伤较明显,而到第10天时炎症因子有所改善;给予冬虫夏草菌丝体治疗能够显著改善小鼠肺间质炎性细胞浸润情况和降低肺组织炎性因子的表达。证实在CLP诱导脓毒症早期肺组织以炎症改变为主,随病程向晚期发展,炎性改变减弱;冬虫夏草菌丝体具有抑制炎症和调节免疫的功能。
为了进一步探讨HSM发挥作用的机制,我们分析了脾脏中Treg细胞比例以及外周血和脾脏中Th细胞比例,发现HSM能够显著降低CLP引起的脾脏中Treg细胞比例增多,对Th细胞也有部分影响。
纤维母细胞异常转化为成纤维细胞,进而产生大量ECM并分泌因子影响相邻细胞的功能[11]。金属基质蛋白酶(MMPs) 是分解胞外基质的主要酶类,而金属蛋白酶组织抑制物(TIMPs)可以特异性的抑制其对ECM的分解作用,两者对维持ECM合成和降解的平衡至关重要。除了纤维化细胞过表达MMP/TIMPs,上皮细胞向间质转化(EMT)也是肺纤维化的显著特征;在EMT过程中,细胞失去胞间接合蛋白E-cadherin并表达α-SMA和vimentin等间质标志。本实验中肺组织纤维化相关因子TGF-β1 、MMP9和TIMP1的mRNA水平表达量在进行CLP处理第5天时升高较为显著,到第10天时有所下降但仍高于sham组,而给予HSM治疗后均有相应改善。免疫组化结果也表明α-SMA和fibronectin在进行CLP处理第5天时升高较为显著,到第10天时有所下降但仍高于sham组,给予HSM提取物治疗后小鼠肺部α-SMA和fibronectin 表达均下降,说明冬虫夏草菌丝体具有抗肺纤维化的功能。
本研究结果证实冬虫夏草菌丝体具有抑制炎症及平衡免疫缓解肺纤维化的功能,且这种作用可能是通过抑制炎性因子及Treg细胞功能达到的;对此进行进一步研究将有利于阐明其抗纤维化的作用机制,为寻找抗肺纤维化药物提供新视角。
[1]Chen M,Cheung FW,Chan MH,etal.Protective roles of Cordyceps on lung fibrosis in cellular and rat models[J].J Ethnopharmacology,2012,143(2):448-454.
[2]Antoniou KM,Pataka A,Bouros D,etal.Pathogenetic pathways and novel pharmacotherapeutic targets in idiopathic pulmonary fibrosis[J].Pulm Pharmacol Ther,2007,20(5):453-461.
[3]Verma S,Slutsky AS.Idiopathic pulmonary fibrosis-new insights[J].N En J Me,2007,356(13),1370-1372.
[4]Willis BC,du Bois RM,Borok Z .Epithelial origin of myofibroblasts during fibrosis in the lung[J].Proc Am Thorac Soc,2006,3(4):377-382.
[5]Coward WR,Saini G,Jenkins G.The pathogenesis of idiopathic pulmonary fibrosis[J].Ther Adv Respir Dis,2010,4(6):367-388.
[6]Das SK,Masuda M,Sakurai A,etal.Medicinal uses of the mushroom Cordyceps militaris:current state and prospects[J].Fitoterapia,2010,81(8):961-968.
[7]Chai JJ,Chen YP,Rui HL.Effects of Hirsutella sinensis on TGF-beta1 and Snail expressions and transdifferentiation of tubular epithelial-myofibroblast in renal tissue of rats with chronic aristolochic acid nephropathy[J].Zhongguo Zhongxiyi Jiehe Za Zhi,2009,29(4):325-329.
[8]Xu H,Li S,Lin Y,etal.Effectiveness of cultured Cordyceps sinensis combined with glucocorticosteroid on pulmonary fibrosis induced by bleomycin in rats[J].Zhongguo Zhong Yao Za Zhi,2011,36(16):2265-2270.
[9]Li SP,Yang FQ,Tsim KW.Quality control of Cordyceps sinensis,a valued traditional Chinese medicine[J].J Pharmaceutical Biomedical Analysis,2006,41(5):1571-1584.
[10]Keshari RS,,Silasi-Mansat R,Zhu H,etal.Acute lung injury and fibrosis in a baboon model of Escherichia coli sepsis[J].Am J Respir Cell Mol Biol,2014,50(2):439-450.
[11]Nakasaki M,Hwanq Y,Xie Y,etal.The matrix protein Fibulin-5 is at the interface of tissue stiffness and inflammation in fibrosis[J].Nat Commun,2015,6:8754.
[收稿2016-03-02修回2016-04-25]
(编辑张晓舟)
Hirsutella sinensis mycelium (HSM) extract relieves pulmonary fibrosis though suppress inflammation and function of Treg cells
YUE Hui-Min ,LIU Fei ,LI Fan-Lin,MA Fei-Ya,SHEN Su-Nan,HOU Ya-Yi.
Medical School & State Key Laboratory of Pharmaceutical Biotechnology,Nanjing University,Nanjing 210093,China
Objective:To investigate the effect of HSM on the inflammation and pulmonary fibrosis in mice with cecal ligation and puncture (CLP) .Methods: Both 5 day and 10 day timepoint pulmonary fibrosis were induced by CLP;mice were randomly divided into three groups,including sham group (sham,n=5),model group (CLP,n=11),therapy group (HSM,n=11).HSM extract (200 mg/kg,less than human dose of 0.27 g/kg) was orally administered to HSM group 2 hour before surgery and repeated everyday,while sham group and model group were given the same dose of normal saline.We used Q-PCR assay to analyze the expression of inflammatory molecules (IL-1β and TNF-α) and fibrogenic cytokines (TGF-β,MMP9 and TIMP1) from lung tissues ,we used FACS assay to analyze the amount of Th1 cells in PBMC and spleen sections,as well as Treg in spleen sections.Besides,lung sections were subjected to HE stain and immunohistochemical staining with α-SMA and fibronectin.Results: The amount of model group′s Th1 cells in PBMC and spleen sections,as well as Treg in spleen sections were significantly lower than sham group′s,whereas HSM succeeded in raising them.By day 5, the expression of inflammatory molecules IL-1β and fibrogenic cytokines (TGF-β,MMP9 and TIMP1) from CLP group′s lung sections were remarkably improved,by day 10,the expression had decreased but was higher than sham group′s ;HSM inhibited these cytokines′ expression.The expression of TNF-α of CLP group and HSM group had no significant changes.The CLP group′s HE results showed obvious pulmonary inflammatory damage,by day 10,the situation had improved,whereas HSM reduced the histopathologic alterations;contrast to sham group,model group′s expression of α-SMA and fibronectin was remarkably improved,while HSM group showed lower expression.Conclusion: HSM extract can suppress inflammation,balances immune system and relieves pulmonary fibrosis.
Hirsutella sinensis;Inflammation;Pulmonary fibrosis
10.3969/j.issn.1000-484X.2016.10.014
岳会敏(1991年-),女,硕士,主要从事细胞与分子免疫研究,E-mail: yuehuimin914@126.com。
及指导教师:侯亚义(1960年-),男,教授,博士生导师,主要从事细胞与分子免疫方面的研究,E-mail: yayihou@nju.edu.cn。
R392
A
1000-484X(2016)10-1472-05