吉西他滨相关性血液系统不良反应的自动监测研究
寇 炜,郭代红,王伟兰,贾王平,王啸宇(解放军总医院药品供应中心,北京 100853)
吉西他滨相关性血液系统不良反应的自动监测研究
寇炜,郭代红,王伟兰,贾王平,王啸宇(解放军总医院药品供应中心,北京 100853)
目的:研究住院患者使用吉西他滨致血液系统药品不良反应发生情况。方法:采用回顾性分析,通过对我院开发的“医疗机构ADE主动监测与智能评估警示系统”事件配置器的设置,筛选我院2016年1月1日- 2016年6月30日使用吉西他滨化疗的住院患者作为研究对象,研究吉西他滨致血液系统ADR发生率,并对其相关因素进行分析。结果:系统共纳入620例患者,白细胞减少、中性粒细胞减少、血小板减少及贫血的阳性报警率分别为92.11%、98.73%、95.08%、85.00%。吉西他滨致白细胞减少、中性粒细胞减少、血小板减少及贫血的发生率分别为33.18%、18.48%、10.49%、18.48%,其中严重ADR发生率分别为4.27%、4.50%、3.44%、0。通过对三个模块作为整体研究分析表明,吉西他滨致血液系统ADR总体发生率为45.29%,且多发生在45 ~ 75岁之间。本研究未发现吉西他滨致血液系统ADR的发生在性别、年龄、BMI及住院次数上差别有统计学意义(P > 0.05)。结论:利用专项研发的自动监测系统能够高效、准确的对抗肿瘤药致血液系统ADR进行筛查,为临床合理用药提供参考,以减少或避免ADR的发生。吉西他滨致血液系统ADR发生率高,在临床用药过程中要密切监测,做好预防。
吉西他滨;自动监测;血液系统;药品不良反应
吉西他滨(gemcitabine)是一种具有细胞周期特异性的抗代谢类抗肿瘤药,其主要作用于肿瘤细胞合成期(S期),在一定的条件下,可以阻止肿瘤细胞由G1期向S期的进展。临床主要用于治疗非小细胞肺癌和胰腺癌。吉西他滨药品不良反应(ADR)主要有骨髓抑制、肝肾功能异常、胃肠道反应等,但以骨髓抑制为主[1],其临床主要表现为白细胞减少、血小板减少、贫血,能够严重制约化疗进程及疗效。本研究借助我院自主研发的“医疗机构ADE主动监测与智能评估警示系统[2-3]”,开展对住院患者使用吉西他滨化疗后导致血液系统ADR的自动监测回顾性研究,为防范临床用药风险提供理论依据,促进临床合理用药。
1 资料与方法
1.1研究对象
利用基于HIS系统的“医疗机构ADE主动监测与智能评估警示系统”(简称“系统”),回顾性调取2016年1月1日- 6月30日我院使用吉西他滨化疗的住院患者。
1.2研究内容
基于系统的“白细胞”“血红蛋白”以及“血小板”三个模块(白细胞模块中包括中性粒细胞),对吉西他滨致血液系统ADR进行以下两个方面的研究:①三个模块各自独立研究,即分别对该药所致白细胞减少、中性粒细胞减少、血小板减少及贫血进行研究;②将三个模块作为整体,对该药的血液系统ADR进行研究,即保证用药前纳入病例的上述各项指标均正常。
1.3系统事件配置器参数设置
基于吉西他滨的说明书、临床用药特点和血液系统ADR等相关资料,以及国家ADR监测中心《药品不良反应术语使用指南》(征求意见稿)[4],对白细胞、血小板、血红蛋白三个模块进行纳入标准、排除标准以及报警规则设置。
1.3.1纳入标准 三个模块配置器纳入标准相同,均为应用礼来公司生产的200 mg注射用盐酸吉西他滨治疗的住院患者。
1.3.2排除标准 三个模块分别设置为使用吉西他滨前:①白细胞计数WBC < 4.0×109·L-1;血小板计数PLT < 100×109·L-1; 血红蛋白测定男性Hb < 120 g·L-1,女性Hb < 110 g·L-1。②检验指标缺失。
1.3.3报警规则 用药后各指标检测值。白细胞减少:WBC< 4.0×109·L-1;中性粒细胞减少:NEUT<2.0×109·L-1;血小板减少:PLT<100×109·L-1;贫血:Hb值,男性<120 g·L-1、女性<110 g·L-1。
1.4数据评价
针对系统自动筛查结果,由两名药师分别对报警病例进行关联性评价,最终筛选出阳性病例,并依据美国国家癌症研究所(NCI)不良事件评价标准(CTCAE 4.03)对其严重程度分级,计算系统的阳性报警率以及ADR发生率,并对吉西他滨所致血液系统ADR的相关因素进行分析。
1.5统计学处理
采用Microsoft Excel 2013对导出数据进行整理,应用SPSS 22.0统计学软件对计量资料进行t检验(参数)和Mann-Whitney U 检验(非参数),对计数资料进行χ2检验分析各指标的组间差异,检验水准α = 0.05。
2 结果
2.1白细胞、血小板及血红蛋白三个模块独立研究结果
2.1.1报警率及ADR发生率 系统共监测住院病人611例,共计620例次。经临床药师人工再评价后,系统报警率及ADR发生率结果详见表1。
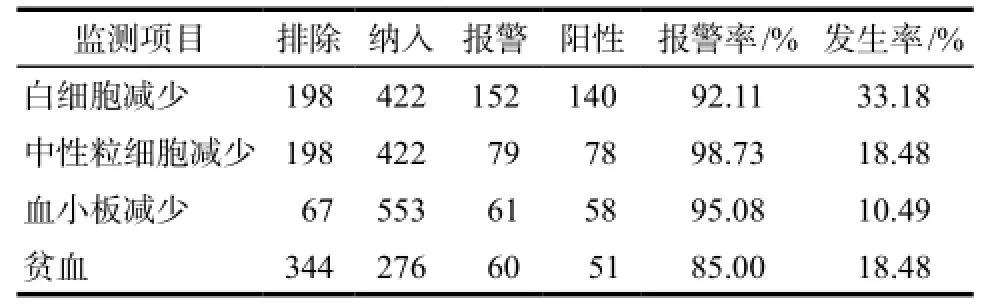
表1 吉西他滨致血细胞减少再评价结果Tab 1 The re-evaluation result of hypocytosis caused by gemcitabine
2.1.2吉西他滨相关性血液系统ADR严重程度分级 3级及以上不良反应为严重不良反应,未发生5级不良反应,详见表2。
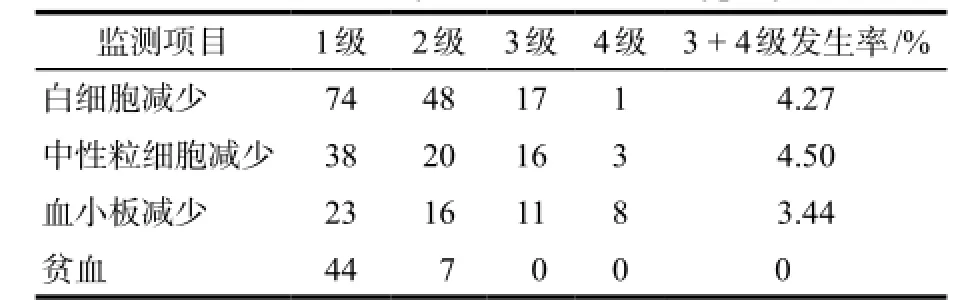
表2 血细胞减少严重程度分级Tab 2 The severity classification of hypocytosis
2.2白细胞、血小板及血红蛋白三个模块作为整体研究结果
2.2.1筛选患者基本情况 研究共纳入223例患者,其中男性患者144例,女性患者79例,233例患者平均年龄为(58.04 ± 8.06)岁;血液系统ADR共发生101例,年龄分布情况见表3。
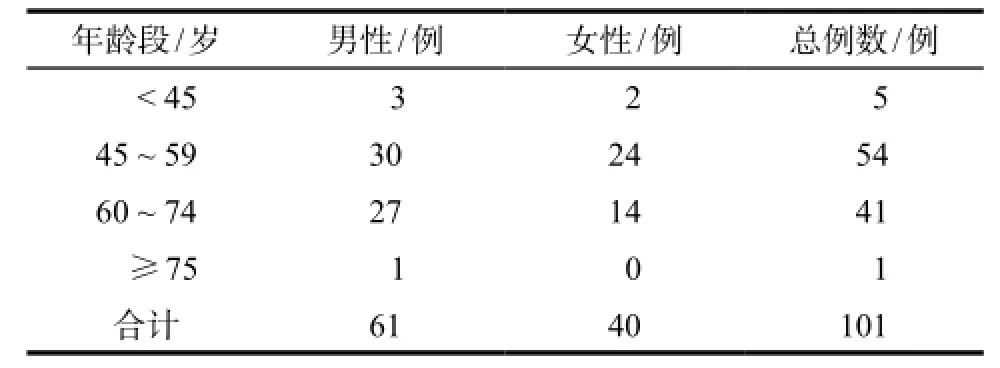
表3 发生药品不良反应患者年龄分布情况Tab 3 Age distribution of patients involved in ADR
2.2.2吉西他滨相关性血液系统ADR风险因素分析 对患者性别、年龄、BMI及住院次数等相关因素进行统计学处理,结果显示P > 0.05,差异无统计学意义,详见表4(A组:吉西他滨所致血液系统ADR; B组:未发生吉西他滨所致血液系统ADR)。
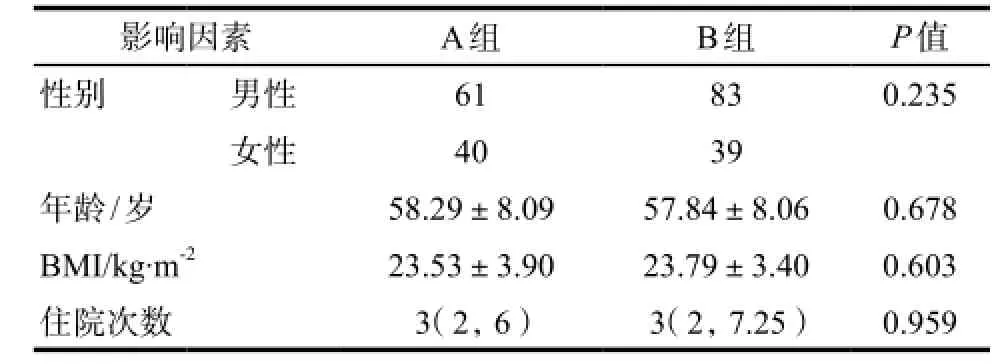
表4 吉西他滨致血液系统ADR相关因素分析Tab 4 Analysis of related factors about hematologic ADR caused by gemcitabine
2.2.3吉西他滨致血液系统ADR发生率 吉西他滨致血液系统ADR的总体发生率为45.29%,详见表5。

表5 吉西他滨致血液系统ADR发生率情况Tab 5 Incidence rate of gemcitabine-related hematologic ADR
3 讨论
3.1借助专项软件系统实施自动监测高效准确
本研究基于“医疗机构ADE主动监测与智能评估警示系统”,通过合理设置系统事件配置器,计算机高速筛查,经人工再评价后白细胞、中性粒细胞、血小板减少及贫血的阳性报警率分别达到92.11%、98.73%、95.08%、85.00%。系统充分体现了高效、准确、人工成本低的特点,为开展大样本的重点药品安全性评价研究提供了可能。选择实时监测则能追踪评估ADR发生趋势,警示临床评估用药方案。
3.2吉西他滨相关性血液系统ADR发生率
文献报道血液学毒性是吉西他滨化疗时最常见ADR[5]。本研究所得结果与这一结论相符,血液系统ADR总发生率为45.29%,其中白细胞、中性粒细胞、血小板减少及贫血的发生率较为常见;提示临床在用药过程中,应加强对吉西他滨相关性血液学指标的监测,特别是对长程化疗后骨髓功能下降[6]、有合并用药[7]患者更要给予更多关注,根据出现的ADR及其严重程度及时调整用药,预防其严重ADR的发生。
与以往研究[5,8-10]相比,本研究结果显示吉西他滨致血液系统ADR发生率有不同程度减少,分析其原因:1)临床研究通常针对某个肿瘤的联合化疗方案进行研究,多数追踪其用药患者某个完整化疗周期或多个周期后进行分析,而本研究只对住院期间的病例进行监测,评价病例时仅考虑单药影响,可能存在遗漏;2)专项软件系统筛选时,会排除用药前指标缺失的住院病人;而住院前在门急诊已完善血液学检查、住院后随即化疗、住院过程较短促的病人,可能会因缺乏住院后检查指标而被排除在纳入病例之外,导致遗漏;3)我院的肿瘤中心临床治疗经验丰富,对治疗中潜在ADR因素能够给予有效防范,使其发生率减少。
3.3吉西他滨相关性血液系统ADR风险因素分析
吉西他滨相关性血液系统三系ADR研究结果显示,阳性病例多集中在45 ~ 75岁年龄段之间,这与文献[11]报道的我国肿瘤各年龄段发病率统计数据基本一致,可以推断肿瘤患者用药后ADR发生的年龄分布,与肿瘤发病年龄分布可能存在相关性。吉西他滨所致血液系统ADR患者在性别、年龄、身高体重指数(BMI)及住院次数上没有统计学差异。
总之,利用我院研发的“医疗机构ADE主动监测与智能评估警示系统”能够高效、准确的对抗肿瘤药物所致血液系统ADR进行筛查,获取准确的ADR发生率与相关风险因素,为提升临床合理用药提供可信的依据。本研究结果提示吉西他滨所致血液系统ADR发生率高,均属于非常常见;在临床用药过程中,应随时注意患者血液学指标的变化并及时调整用药方案,以尽量减少和避免ADR的发生。
[1] 吴洪斌,潘丽琴,刘加葳.吉西他滨的不良反应及其防治[J].药物不良反应杂志,2003,5(3):176-177.
[2] 陈超,郭代红,刘皈阳,等.医疗机构药品不良反应监测的优化实践[J].中国药物警戒,2010,7(3):164-168.
[3] 陈超,郭代红,薛万国,等.住院患者药品不良事件主动监测与评估警示系统的研发[J].中国药物警戒,2013,10(7):411-414,418.
[4] 国家药品不良反应监测中心.药品不良反应术语使用指南(征求意见稿)[S].监测与评价综[2016]77号.
[5] Wang Y, Hu GF, Zhang QQ, et al. Efficacy and safety of gemcitabine plus erlotinib for locally advanced or metastatic pancreatic cancer: a systematic review and meta-analysis[J]. Drug Des Devel Ther, 2016, 10: 1961-1972.
[6] Anderson H, Lund B, Bach F, et al. Single-agent activity of weekly gemcitabine in advanced non-small-cell lung cancer: a phase Ⅱ study[J]. J Clin Oncol, 1994, 12(9): 1821-1826.
[7] GEMZAR-gemcitabine hydrochloride injection,powder, lyophilized, for solution[EB/OL]. [2016-07-01]. https:// dailymed.nlm.nih.gov/dailymed/drugInfo.cfm? Setid=9dc35c59-f4f3-43b4-8251-0cf5c06cdc80.
[8] 朱巧兰,林能明,程斌,等.吉西他滨单一化疗200例肿瘤患者不良反应分析[J].中国肿瘤,2002,11(11):677-678.
[9] 王明媚,潘宏铭,沈丽蓉.国产与进口吉西他滨血液学不良反应比较[J].中国药业,2008,17(7):56-57.
[10] 陈芳,姜雪秋,许一清,等.吉西他滨联合奥沙利铂治疗晚期恶性肿瘤的近期疗效和血液学不良反应观察[J].肿瘤药学,2013,3(6):459-462.
[11] Wanqing Chen, Rongshou Zheng, Peter D. Baade, et al. Cancer Statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115-132.
Study on gemcitabine-related hematologic adverse drug reaction by automatic surveillance
KOU Wei, GUO Dai-hong, WANG Wei-lan, JIA Wang-ping, WANG Xiao-yu(Department of Pharmaceutical Care, PLA General Hospital, Beijing 100853, China)
Objective: To study the incidence of hematologic adverse drug reaction caused by gemcitabine. Methods:The research objects were screened out by adverse drug events' active surveillance and assessment system developed by our hospital. The collected data of the hospitalized patients in General Hospital of PLA who
gemcitabine from January 1, 2016 to June 30, 2016 were analyzed retrospectively. The incidence of hematologic ADR caused by gemcitabine and the related factors were investigated. Results: A total of 620 cases using gemcitabine were automatically monitored. Positive alarm rate of leukopenia,neutropenia, thrombocytopenia and anemia were 92.11%, 98.73%, 95.08% and 85.00% respectively. Incidence of leukopenia,neutropenia, thrombocytopenia and anemia induced by gemcitabine were 33.18%, 18.48%, 10.49% and 18.48% respectively. And the incidences of severe ADR were 4.27%, 4.50%, 3.44% and 0 respectively. By analyzing the data of the three modules as a whole, it was found that overall incidence of gemcitabine-related hematologic ADR was 45.29%, and the adverse reactions occurred mostly in the age of 45 to 75 years old. There was no significant difference in incidence of hematologic ADR among the gender, age, BMI and frequencies of hospitalization (P > 0.05). Conclusion: By using the automatic surveillance and assessment system, pharmacists can effectively and accurately screen the hematologic ADR induced by anti-cancer drugs and make guidance for rational drug use in order to reduce and avoid the occurrence of adverse reactions. The rate of gemcitabine-related hematologic ADR is high and hematological indexes should be closely monitored in the course of clinical drug use to prevent the occurrence of adverse reactions.
Gemcitabine; Automatic surveillance; Hematological system; Adverse drug reaction
R969.4
A
1672 - 8157(2016)05 - 0315 - 03
2014年全军后勤科研重点项目(BWS14R039)
郭代红,女,主任药师,硕士生导师,研究方向:临床药学与药物警戒。E-mail:guodh301@163.com
寇炜,男,主治医师,硕士研究生,主要从事临床药物治疗学工作。E-mail:kouwei-kw@163.com
(2016-07-05
2016-07-25)

