H2S处理下小麦叶片蛋白质组表达谱的分析
刘 辉,査日扬,杨 波,刘 艳*
(1.江苏省连云港市农业科学院,江苏 连云港 222000;2.扬州大学 农学院,江苏 扬州 225009;3.江苏省连云港市黄淮农作物育种研究所,江苏 连云港 222000)
H2S处理下小麦叶片蛋白质组表达谱的分析
刘 辉1,2,査日扬3,杨 波1,刘 艳1*
(1.江苏省连云港市农业科学院,江苏 连云港 222000;2.扬州大学 农学院,江苏 扬州 225009;3.江苏省连云港市黄淮农作物育种研究所,江苏 连云港 222000)
采用硫氢化钠作为硫化氢的外源性供体,研究了不同浓度(0、0.05、0.10、0.20、0.40、0.80、1.60、3.20 mmol/L)硫氢化钠处理对小麦幼苗叶片蛋白质差异表达谱的影响,以探寻H2S对小麦幼苗生长发育的调控机制。对幼苗叶片的比较蛋白质组学分析发现,不同浓度的硫氢化钠处理引起了涉及光合作用、糖代谢和能量代谢、氧化还原平衡、蛋白质合成、加工与降解以及信号转导等途径的蛋白质的差异表达。我们初步推测,硫化氢可能通过调节参与上述代谢途径的功能蛋白质的表达量,进而相应地影响到植株的生理与生物量等指标,从而引起植株表型的变化。
硫化氢:小麦;叶片:比较蛋白质组:主成分分析法
植物幼苗影响到植物的生长发育及作物产量。硫化氢(H2S)是继CO和NO后被发现的第3种气体信号分子[1],在植物的生长发育和调控植物应对非生物胁迫等过程中发挥重要的作用[2-26](详见表1);它与其它两种信号分子一起,协同调节植物体的生理功能。但是有关H2S对植物幼苗的生理功能以及对植物及其蛋白质表达调控作用机制的研究尚未见报道,因此进一步开展H2S调控植物生长发育的相关研究将有助于进一步明确该气体信号分子的作用机制及作用范畴,从而为植物生长发育机理及植物抗逆研究等提供一定的理论依据。本文以不同浓度的H2S外源性供体NaHS处理小麦幼苗,应用比较蛋白质组学研究用不同浓度H2S处理小麦后其叶片蛋白质的差异表达谱,在蛋白质水平上研究H2S调控植物生理生化过程的可能途径,旨在探讨H2S在小麦幼苗生长发育中的作用。
1 材料和方法
1.1试验材料
试验材料为连云港市农业科学院小麦新品种——连麦7号。
挑选颗粒饱满的种子,用0.1%(v/v)HgCl2消毒10 min,再用去离子水冲洗数次,在25 ℃恒温暗箱中浸种催芽。在萌发后,选取露白一致的完整种子,用镊子将它们整齐地摆放在垫有双层滤纸的培养皿(直径15 cm)中,加入适量清水,水量以浸没种子一半为标准,保持培养皿中水量充足。当幼苗长至一叶一心期时,选择长势均一、高度4~5 cm的幼苗,用海绵包裹,嵌入打孔泡沫板(厚度1.5 cm)中,每板40株,转入装有2 L Hoagland(1/2)营养液的塑料培养桶内,置于HP1000GS型智能人工气候箱中培养。每日给予12 h光照,强度为1000 μmol/(m2·s),昼夜温度分别设为28、25 ℃,RH保持在60%~70%。
NaHS购自Aladdin公司。用去离子水将NaHS配成100 mmol/L的母液,现配现用,按所需浓度稀释即可。

表1 信号分子H2S在植物生长发育中的调节作用
1.2蛋白质组学实验及方法
1.2.1蛋白样品的制备采用TCA/丙酮沉淀方法[27]提取小麦叶片与根部的总蛋白。
1.2.2用Bradford方法定量测定蛋白质含量
1.2.2.1制作标准曲线 按表2先加入ddH2O和G250,轻轻晃动混匀后,再加入配好的BSA溶液,静置2 min后,以超纯水为空白,测定其在595 nm下的OD值。再以蛋白质含量为横坐标,595 nm下的OD值为纵坐标,绘制出光密度-蛋白质浓度标准曲线,得出标准曲线方程为:y=0.0093x+0.0826,R2为0.9967。
1.2.2.2小麦叶和根蛋白浓度测定及结果先将于-80 ℃冷冻的蛋白样品在室温下化冻;再用超纯水稀释5倍,根据上述方法测定595 nm处的光密度;最后根据上述标准曲线方程计算出小麦叶和根的蛋白质浓度,结果见表3。

表2 用Bradford法定量测定蛋白质的标准曲线溶液配方

表3 经不同浓度NaHS提取处理的小麦幼苗叶片的蛋白质浓度 μg/μL
1.2.3蛋白质双向电泳
1.2.3.1蛋白质双向电泳 参考杨立明等[28]的方法进行蛋白质双向电泳。
1.2.3.2凝胶扫描和图像分析使用BIO-RAD凝胶成像系统扫描成像,将凝胶放置在扫描板上,调整焦距与曝光时间后,对凝胶进行扫描成像,保存图像。使用Quantity One和PDquest软件分析图像。
1.2.4蛋白质表达差异分析对每个处理的3块重复胶的蛋白点相对表达量(体积分数,%)进行比较。
1.2.5蛋白质的胶内酶解用剪掉的枪头将蛋白点从胶上人工切取,放置在1 mL离心管中,通过胰蛋白酶进行胶内酶解。参考Katayama H[29]的方法,略有改动。用镊子将蛋白点切成适宜大小后,用超纯水清洗两遍。用100 mmol/L的NH4HCO3和乙腈根据1∶1的体积比配制脱色液。每管加入200μL脱色液,间隔涡旋。脱色3~4次,直至完全脱去考马斯亮蓝的颜色。然后,直接加入乙腈进行脱水,重复2~3次;将装有蛋白的离心管盖打开,对称放置在真空干燥机中,在低温下真空干燥30~40 min,直至完全干燥。
将10 μg测序级的胰蛋白酶加入到离心管中,根据蛋白点的大小,适量增加酶解液。最后用报纸包裹离心管,倒置在37 ℃培养箱中过夜。
1.2.6蛋白质的质谱鉴定及数据库检索使用MALDI-TOF-MS/MS质谱仪进行分析。参考杨立明等[28]的方法进行数据库检索。
1.3统计分析方法
使用SPSS 19.0软件进行数据统计分析。采用One-Way ANOVA法进行单因素方差分析;采用Duncan法进行均值多重比较,以P<0.05为差异显著的标准。以Pearson相关系数进行距离相关性分析;以主成分法(PCA)提取公因子进行探索性因子分析以及主成分分析。
2 结果与分析
2.1小麦叶片蛋白质双向电泳图谱
分别用0(CK)、0.05、0.10 、0.20、0.40、0.80、1.60、3.20 mmol/L的硫化氢供体硫氢化钠(NaHS)处理小麦幼苗6 d,取叶片进行双向电泳实验,所得图谱见图1。在pH 4~7的范围内8个样品经考马斯亮蓝G250染色后,经电泳图谱分析软件 PDQuest 8.0对各个图谱的蛋白点进行对比,共获得93个匹配的蛋白点,这些匹配蛋白点多分布在胶的中上部。

图中数字为差异表达蛋白点编号,相应箭头所指为差异蛋白点。A: CK,未用NaHS处理的小麦; B、C、D、E、F、G、H:分别用0.05、0.10、0.20、0.40、0.80、1.60、3.20 mmol/L NaHS处理的小麦。
图1不同浓度NaHS处理下小麦叶片双向电泳蛋白表达图谱
2.2小麦叶片蛋白质表达谱的差异分析
通过对检测到的蛋白点进行量化分析,找出了至少在1个处理浓度组比对照组蛋白质表达丰度有2倍改变,并且具有显著性差异的41个蛋白点(P<0.05)。为了清晰展示这些点,在8块胶上标示出了这些点(如图2)。
利用MALDI-TOF/MS质谱分析,获得了41个完整肽指纹图谱,在NCBI数据库中导入肽段数据,并用MASCOT软件进行搜索,最终鉴定出41个蛋白点。根据质谱检测得到的结果,可获得该蛋白点匹配的得分值、匹配肽段序列覆盖率,并在NCBI和ExPASY,通过GI号,查询到匹配率最高的蛋白名称及其理论等电点和分子量(见表4)。
将这41种差异表达蛋白点在不同处理浓度下与对照差异表达量比值数据用Mev软件进行聚类分析,使用的是皮尔逊相关(Pearson’s corrleation)和平均连锁聚类(Average linkage clustering),聚类分析结果见图2。
如图2所示,聚类分析将差异表达蛋白分为7类。第1类蛋白表达量在0.20 mmol/L与1.60 mmol/L处理组出现相互接近的峰值,并且蛋白表达量都比对照组高2~18倍,从上向下按顺序分别是依赖硫氧还蛋白过氧化物酶(thioredoxin-dependent peroxidase)、抗坏血酸过氧化物酶(ascorbate peroxidase)、锰超氧化物歧化酶(manganese superoxide dismutase)、D-蛋白(D-protein)。根据蛋白质的功能,可以看出第1类为氧化还原蛋白类,正是这些氧化还原蛋白表达量的提高,使得1.60 mmol/L NaHS能够有效缓解自身高浓度产生的抑制作用,在形态、生理生化指标上达到与0.20 mmol/L处理组相近的水平。第2类蛋白质表达的主要特点是在0.05 mmol/L和0.10 mmol/L NaHS处理下,表达量是对照组的2~5倍,在0.20 mmol/L处理组为波谷值。此类蛋白主要是能量代谢、氨基酸代谢和氧化还原平衡类蛋白,在低浓度处理下这些蛋白高水平表达促进小麦幼苗生长发育。第3类为光合相关蛋白,都在0.20 mmol/L处理组为峰值。纵向分析全部差异表达蛋白在各个浓度组的表达情况,发现:在0.20 mmol/L NaHS处理下,小麦幼苗叶片中存在多个高水平表达的蛋白质,且与左右处理浓度组相比,表达量更高;16.0 mmol/L处理组也具有相似的趋势,比左右处理组的表达量高;0.10 mmol/L处理组与0.05 mmol/L处理组的差异表达蛋白质具有相似的表达水平。
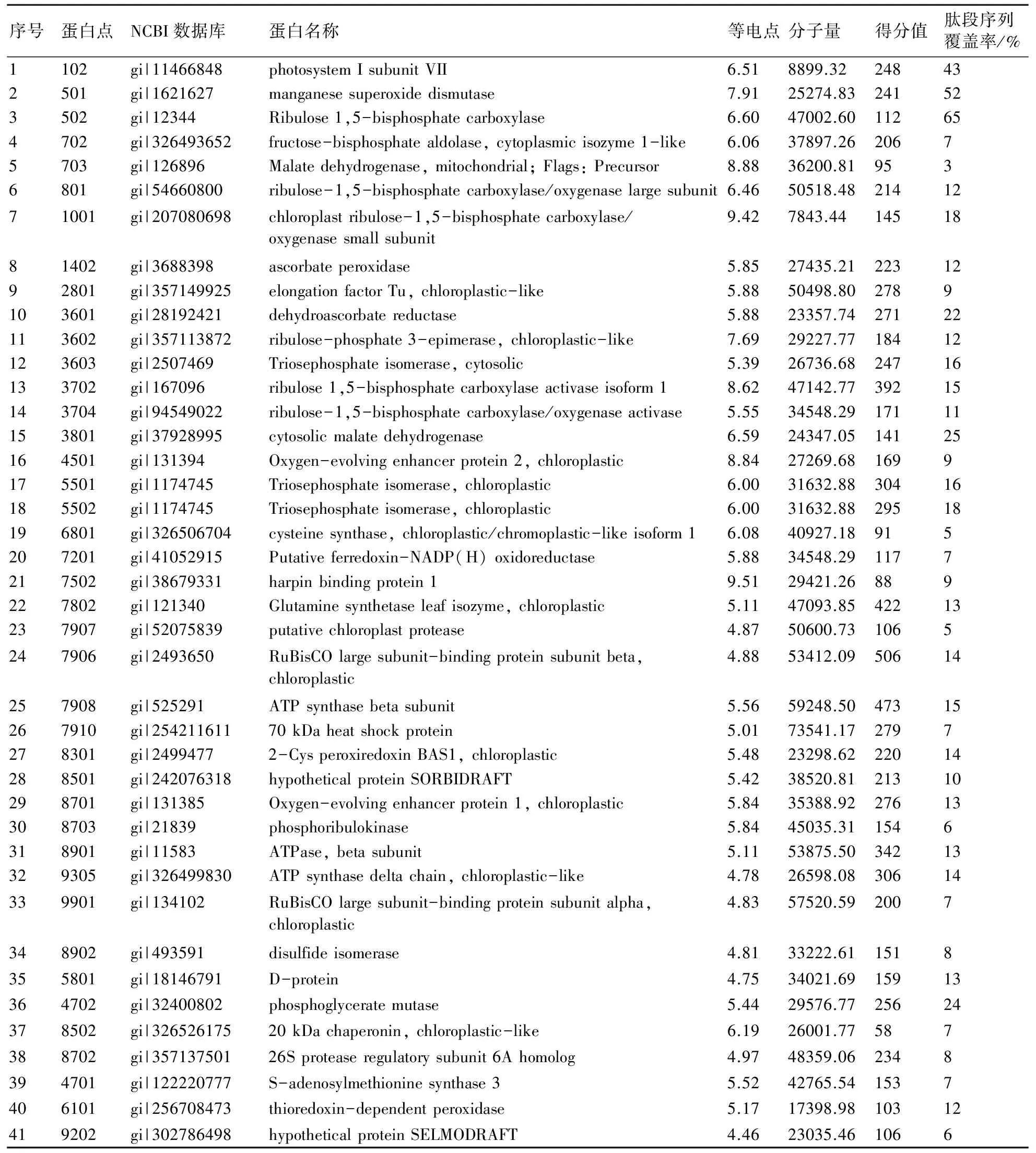
表4 不同NaHS处理下小麦叶片差异表达蛋白鉴定结果

根据右下侧的颜色标度,图中不同颜色代表蛋白点在整块胶上体积的平均值。
2.3小麦叶片差异表达蛋白的功能鉴定及分析
采用Matrix science网站的Mascot检索程序,进行数据库检索分析。鉴定出的蛋白种类有1,5-二磷酸核酮糖羧化酶/加氧酶大亚基、放氧复合体1、磷酸甘油酸脱氢酸、磷酸丙糖异构酶、锰超氧化物歧化酶、抗坏血酸过氧化物酶、mRNA结合蛋白前体等。参考GO分类的标准和相关文献,将这些差异表达蛋白分为能量代谢(糖代谢)相关蛋白(占比27%)、氧化还原平衡类蛋白(19%)、光合过程相关蛋白(15%)、蛋白质生物合成(10%)、信号转导(5%)、蛋白质降解(5%)、蛋白质加工与折叠(12%)、氨基酸代谢(7%),见图3。
2.4不同浓度NaHS处理组叶片蛋白差异表达量的主成分分析
为了进一步探究样品间的关系,我们进行了主成分分析。以41个叶片差异表达蛋白的表达量为指标,应用主成分法分析,提取出2个主成分,其解释方差变异的累计贡献率达到86.8%。计算各个NaHS处理组在主成分1、2上的特征向量,结果见表5。分别以主成分1、2为横、纵坐标轴,可得到各个NaHS处理组在主成分1、2的分布情况,如图4。分析可知:第一主成分最主要代表1.60 mmol/L处理组,而0.20 mmol/L处理组在第二主成分上的特征向量值最高,这两个浓度处理下多个蛋白质表达与其他组相比差异度最大;而NaHS浓度为0.05、0.10、0.40、0.80 mmol/L处理组多个差异表达蛋白具有相似的表达水平,图4显示它们聚在一起。
如图5所示,在这41个差异表达蛋白点中,椭圆框中蛋白点的表达量在0~0.20 mmol/L处理组中随浓度升高而逐渐下降,在0.20 mmol/L处理组蛋白表达水平上升,但未超过CK;在更高浓度组蛋白表达水平出现显著下降趋势。长方形框中蛋白点在0.20 mmol/L处理组的表达量高于CK的,而且随浓度升高,在主成分1主要代表的1.60 mmol/L处理组的表达量比左右浓度组高,为极大值,所以这几种蛋白分布在第一象限,在两个主成分上都有较高的特征向量值。这与之前的聚类分析结果相吻合;蛋白点29、31、40在1.60 mmol/L处理组出现高表达水平,比左右处理组的高,为极大值,这3个点分别为叶绿体内囊体氧发生系增强蛋白、ATP酶和依赖硫氧还蛋白过氧化物酶,其为氧化还原平衡与能量代谢相关蛋白,这可能是经1.60 mmol/L处理后小麦幼苗叶片在形态和生理生化指标上出现上升趋势的内在原因。
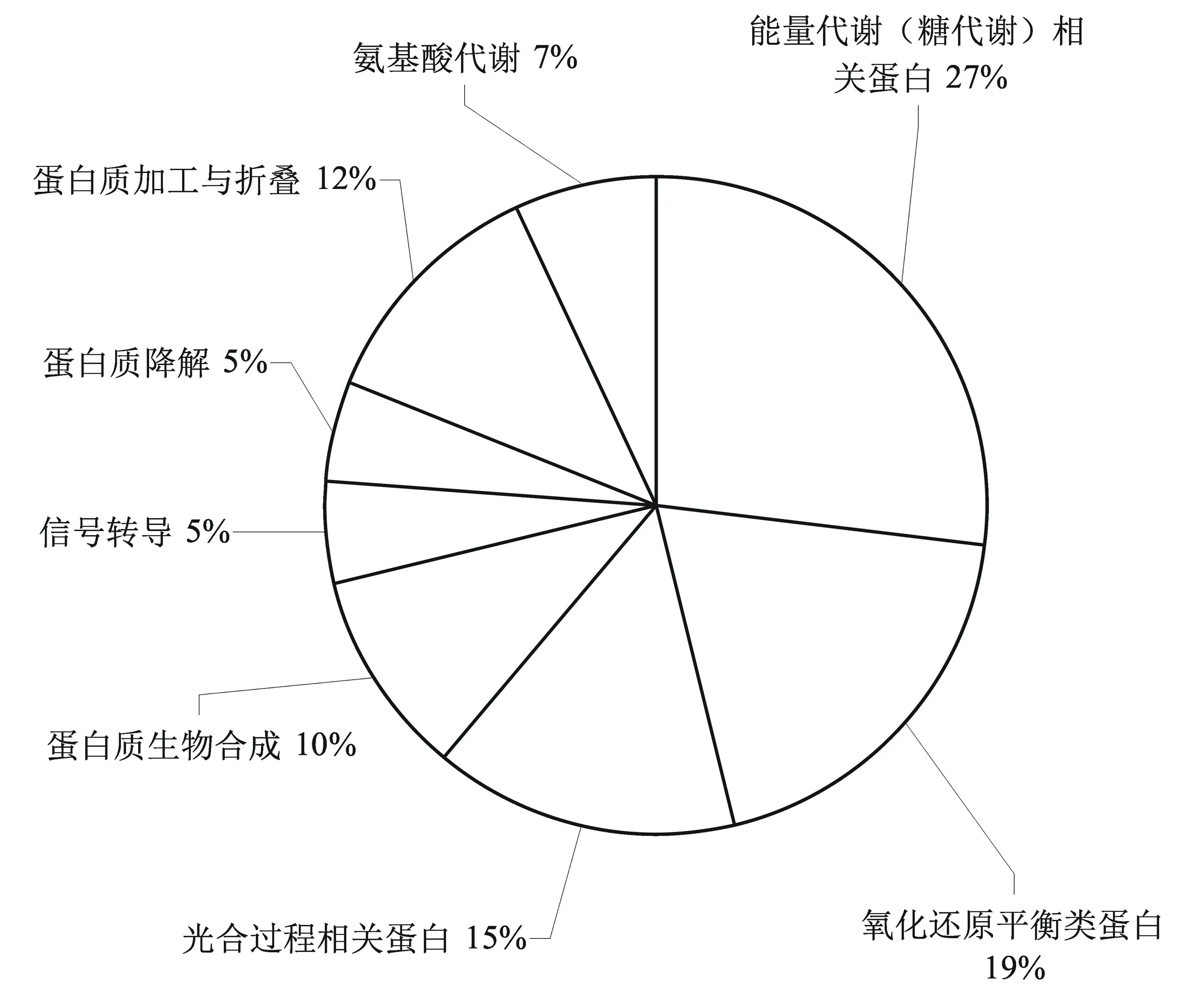
图3 不同浓度NaHS处理下小麦幼苗叶差异表达蛋白的功能分类
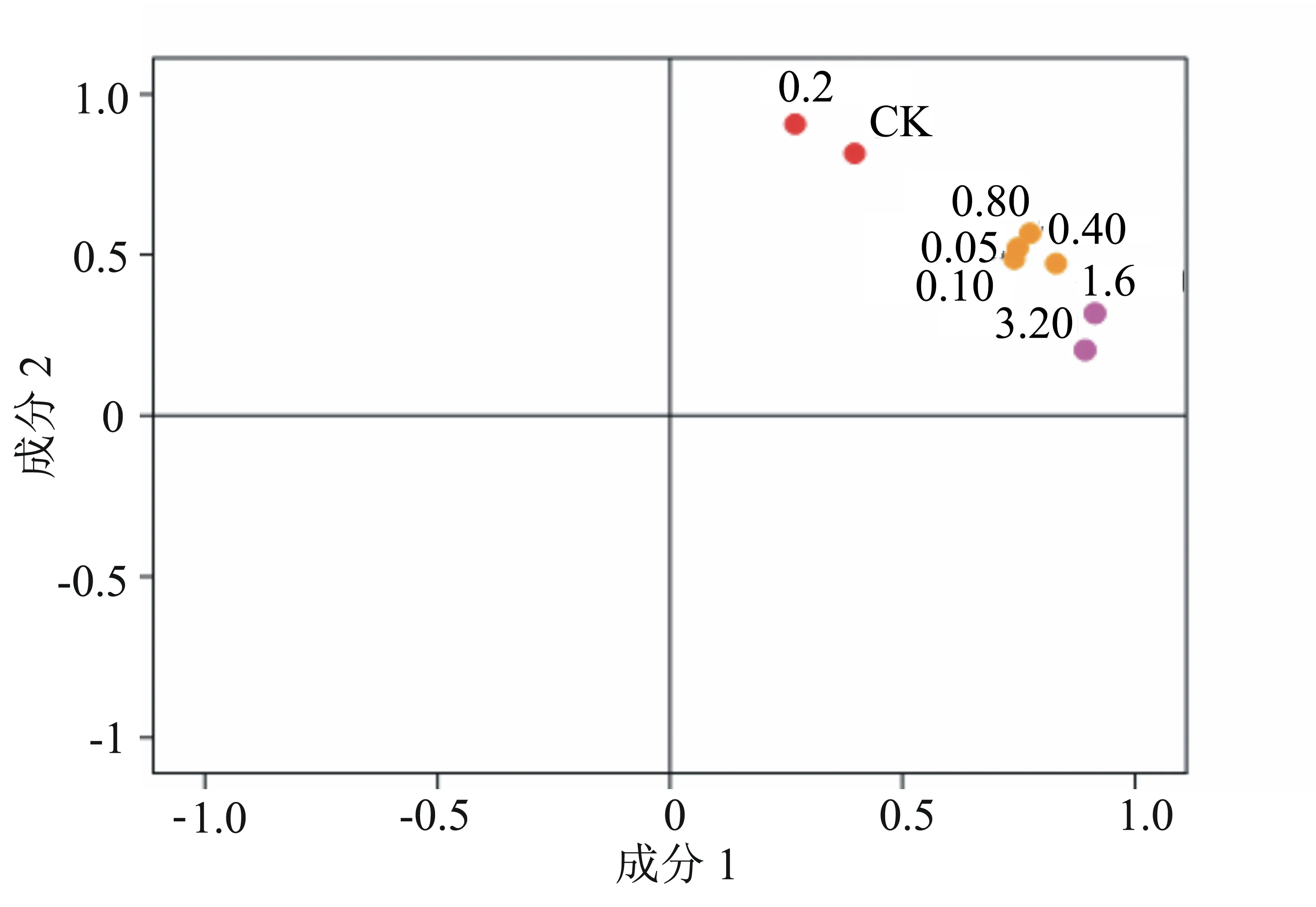
图中数值表示NaHS处理浓度(mmol/L)

图5 小麦叶片差异表达蛋白点主成分分析及功能分类
3 结论与讨论
对小麦幼苗叶片差异蛋白质的表达量进行聚类分析,研究发现,与光合作用相关的1,5-二磷酸核酮糖羧化酶/加氧酶大亚基、3-磷酸甘油醛脱氢酶、二磷酸核酮糖羧化酶大链、叶绿体磷酸核酮糖激酶、放氧复合体的表达量在低浓度处理时均上调,在1.60 mmol/L和3.20 mmol/L处理时均下调。1,5-二磷酸核酮糖羧化酶/加氧酶大亚基是羧化酶的活性亚基,3-磷酸甘油醛脱氢酶是CO2还原阶段的重要酶,这两个蛋白在植物光合过程中CO2固定和光呼吸的调节,以及决定净光合作用的过程中起关键作用。表明信号分子H2S影响了光合作用电子传递及碳同化两个主要过程的进行。低浓度H2S处理促进了光合作用的进行,植株高度增加,生物量增加;而在处理浓度增加后,抑制了光合作用的进行,植株生长受到抑制。本研究还发现,叶片中与植物光合作用和能量代谢(糖代谢)有关的蛋白占的比例比较大,而且表达量大。这说明H2S是通过影响与光合作用有关酶的活化、CO2的活化、光系统单位和电子传递链构成来影响和调节光合作用的。该研究结果对指导小麦构建高光效群体、延缓后期叶片衰老、增加光合势和光合产物提供了理论依据。
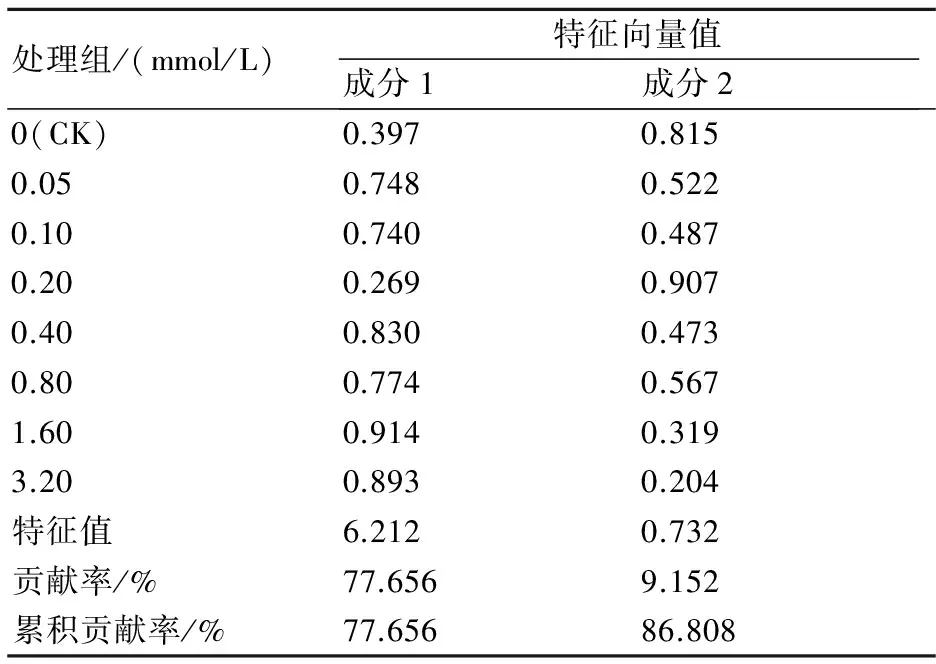
表5 不同NaHS处理小麦叶片差异蛋白表达的主成分分析结果
[1] 张英聚.植物的硫营养[J].植物生理学通讯,1987(2):9-15.
[2] Zhong G L, Ming G, Ping L. Hydrogen sulfide is a mediator in H2O2-induced seed germination inJatrophacurcas[J]. Acta Physiol Plant, 2012, 34: 2207-2213.
[3] Zhang H, Tang J, Liu X P, et al. Hydrogen sulfide promotes root organogenesis inIpomoeabatatas,SalixmatsudanaandGlycinemax[J]. Journal of Integrative Plant Biology, 2009, 51(12): 1086-1094.
[4] Zhao X, Qiao X R, Yuan J, et al. Nitric oxide inhibits blue light-induced stomatal opening by regulating the K+influx in guard cells [J]. Plant Science, 2012, 184: 29-35.
[5] Liu J, Hou Z H, Liu G H, et al. Hydrogen sulfide may function downstream of nitric oxide in ethylene-induced stomatal closure inViciafabaL. [J]. Journal of Integrative Agriculture, 2012, 11(10): 1644-1653.
[6] Chen J, Wu F H, Wang W H, et al. Hydrogen sulphide enhances photosynthesis through promoting chloroplast biogenesis, photosynthetic enzyme expression, and thiol redox modication inSpinaciaoleraceaseedlings [J]. J Exp Bot, 2011, 62(13): 4481-4493.
[7] Riemenschneider A, Nikiforova V, Hoefgen R, et al. Impact of elevated H2S on metabolite levels, activity of enzymes and expression of genes involved in cysteine metabolism [J]. Plant Physiology and Biochemistry, 2005, 43(5): 473-483.
[8] Müller M, De Kok L C, Weidner W, et al. Differential effects of H2S on cytoplasmic and nuclear thiol concentrations in different tissues ofBrassicaroots [J]. Plant Physiol Biochem, 2002, 40: 585-589.
[9] Brunold C, Schmidt A. Regulation of adenosine-5'-phosphosulfate sulfotransferase activity by H2S inLemnaminorL. [J]. Planta, 1976, 133: 85-88.
[10] Westerman S, Weidner W, De Kok L C, et al. Effect of H2S exposure on35S-sulfate uptake, transport and utilization inCurlykale[J]. Phyton, 2000, 40: 293-302.
[11] Hu L Y, Hu S L, Wu J, et al. Hydrogen sulfide prolongs postharvest shelf life of strawberry and plays an antioxidative role in fruits [J].Journal of Agricultural and Food Chemistry, 2012, 60(35): 8684-8693.
[12] Zhang H, Hu S L, Zhang Z J, et al. Hydrogen sulde acts as a regulator ofower senescence in plants [J]. Postharvest Biology and Technology, 2011, 60(3): 251-257.
[13] Wang Y Q, Li L, Cui W T, et al. Hydrogen sulfide enhances alfalfa (Medicagosativa) tolerance against salinity during seed germination by nitric oxide pathway [J]. Plant and Soil, 2012, 351(1-2): 107-119.
[14] 黄玉辉,黄如葵,黄熊娟,等.外源激素影响苦瓜种子发育过程中蛋白表达的初步分析[J].南方农业学报,2015,46(4):555-559.
[15] Li Z G, Gong M, Xie H, et al. Hydrogen sulfide donor sodium hydrosulfide-induced heat tolerance in tobacco (NicotianatabacumL.) suspension cultured cells and involvement of Ca2+and calmodulin [J].Plant Science, 2012, 185: 185-189.
[16] Li Z G, Ding X J, Du P F. Hydrogen sulfide donor sodium hydrosulfide-improved heat tolerance in maize and involvement of proline [J]. Journal of Plant Physiology, 2013(Available online): 21.
[17] Zhang H, Ye Y K, Wang S H, et al. Hydrogen sulde counteracts chlorophyll loss in sweet potato seedling leaves and alleviates oxidative damage against osmotic stress [J]. Plant Growth Regul, 2009, 58(3): 243-250.
[18] Jin Z P, Shen J J, Qiao Z J, et al. Hydrogen sulfide improves drought resistance inArabidopsisthaliana[J]. Biochemical and Biophysical Research Communications, 2011, 414(3): 481-486.
[19] Jin Z P, Xue S W, Luo Y N, et al. Hydrogen sulfide interacting with abscisic acid in stomatal regulation responses to drought stress inArabidopsis[J]. Plant Physiology and Biochemistry, 2013, 62: 41-46.
[20] Zhang H, Jiao H, Jiang C X, et al. Hydrogen sulfide protects soybean seedlings against drought-induced oxidative stress [J]. Acta Physiol Plant, 2010, 32(5): 849-857.
[21] Chen J, Wang W H, Wu F H, et al. Hydrogen sulfide alleviates aluminum toxicity in barley seedlings [J]. Plant and Soil, 2013, 362(1-2): 301-318.
[22] Wang B L, Shi L, Li Y X, et al. Boron toxicity is alleviated by hydrogen sulfide in cucumber (CucumissativusL.) seedlings [J]. Planta, 2010, 231(6): 1301-1309.
[23] Zhang H, Hu L Y, Hu K D, et al. Hydrogen sulfide promotes wheat seed germination and alleviates oxidative damage against copper stress [J]. Journal of Integrative Plant Biology, 2008, 50(12): 1518-1529.
[24] Zhang H, Tan Z Q, Hu L Y, et al. Hydrogen sulfide alleviates aluminum toxicity in germinating wheat seedlings [J]. Journal of Integrative Plant Biology, 2010, 52(6): 556-567.
[25] Zhang H, Hu L Y, Li P, et al. Hydrogen sulfide alleviated chromium toxicity in wheat [J]. Biologia Plantarum, 2010, 54(4): 743-747.
[26] Bloem E, Riemenschneider A, Volker J, et al. Sulphur supply and infection withPyrenopezizabrassicaeinfluence L-cysteine desulphydrase activity inBrassicanapusL. [J]. J Exp Bot, 2004, 55(406): 2305-2312.
[27] Damerval C, Vienne D, Zivy M, et al. Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins [J]. Electrophoresis, 1986(7): 52-54.
[28] Yang L M, Luo Y M, Wei J F, et al. Methods for protein identification using expressed sequence tags and peptide mass fingerprinting for seed crops without complete genome sequences [J]. Seed Sci Res, 2010, 20: 257-262.
[29] Hiroyuki K,Takeshi N,Yoshiya O. Improvement of in-gel digestion protocol for peptide mass fingerprinting by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry [J]. Rapid Communications in Mass Spectrometry, 2001, 15: 1416-1421.
(责任编辑:黄荣华)
Expression Profile Analysis of Proteome in Wheat Leaves Treated with H2S
LIU Hui1,2, ZHA Ri-yang3, YANG Bo1, LIU Yan1*
(1. Lianyungang Academy of Agricultural Sciences in Jiangsu Province, Lianyungang 222000, China; 2. College of Agronomy, Yangzhou University, Yangzhou 225009, China; 3. Lianyungang Institute of Crop Breeding for Huang-Huai River Basin in Jiangsu Province, Lianyungang 222000, China)
In order to explore the action mechanism of H2S on wheat growth and development, we researched the expression profile of protein in wheat seedling leaves treated with different concentrations (0, 0.05, 0.10, 0.20, 0.40, 0.80, 1.60 and 3.20 mmol/L) of NaHS (an exogenous donor of H2S). The comparative proteomics analysis of wheat seedling leaves found that the treatments with different concentrations of NaHS caused the different expressions of proteins which were involved in the metabolism approaches of photosynthesis, energy metabolism (glucose metabolism), redox equilibrium, protein synthesis, processing and degradation, and signal transduction. We initially concluded that H2S affected the physiological and biomass indexes of wheat plants, thus led to their phenotypic changes by regulating the expression level of above various functional proteins in wheat seedling leaves.
Hydrogen sulfide: Wheat; Leaf: Comparative proteomics; Principal component analysis
2016-05-08
江苏省普通高校研究生科研创新计划(CXZZ12-0905)。
刘辉(1979─),男,安徽凤阳人,助理研究员,在读博士,从事稻麦新品种选育与应用推广工作。*通讯作者:刘艳。
S512.1
A
1001-8581(2016)10-0001-07

