蔬菜连作改为蓝莓种植后土壤细菌群落多样性变化的分析
祁石刚,田 畅,却 枫,徐志胜,王 枫,熊爱生*
(1.江苏省宿迁市土壤肥料技术指导站,江苏 宿迁 223800;2.南京农业大学 园艺学院 作物遗传与种质创新国家重点实验室,江苏 南京 210095)
蔬菜连作改为蓝莓种植后土壤细菌群落多样性变化的分析
祁石刚1,田 畅2,却 枫2,徐志胜2,王 枫2,熊爱生2*
(1.江苏省宿迁市土壤肥料技术指导站,江苏 宿迁 223800;2.南京农业大学 园艺学院 作物遗传与种质创新国家重点实验室,江苏 南京 210095)
基于第二代Illumina Miseq高通量测序平台,利用16S rDNA技术分析了江苏省宿迁市蔬菜连作改为蓝莓种植后土壤细菌多样性的分布和细菌群落多样性的变化。结果表明: Kaistobacter、假交替单胞菌属(Pseudoalteromonas)、硫杆状菌属(Thiobacillus)、Rubritalea、浮霉菌属(Planctomyces)、Lysobacter、纤维弧菌属(Cellvibrio)、噬氢菌属(Hydrogenophaga)、鞘脂单胞菌属(Sphingomonas)和热单胞菌属(Thermomonas)为蔬菜连作改为蓝莓种植后土壤细菌的主要类群;Sporosarcina、Alicyclobacillus、氨氧化古细菌(Candidatusnitrososphaera)和Pontibacter是蔬菜连作土壤细菌的主要类群;蔬菜连作改为种植蓝莓后,土壤细菌多样性和丰度降低,优势菌群也出现了显著的变化。
高通量测序;细菌多样性;土壤;蔬菜连作;蓝莓
随着经济的发展和人们生活水平的逐步提高,蔬菜消费量的增加及蔬菜生产的高效益促使蔬菜产业快速发展。但农民为了获得最大的经济效益,在同一块土地上连续种植同一种蔬菜作物,加速了种植田块土壤环境恶化。蔬菜作物病虫害严重,作物长势变弱、品质下降等一系列连作障碍现象,已成为目前亟待解决的问题[1]。研究证实,这些连作障碍现象都不同程度地与土壤中的微生物相关,并且与蔬菜种类及连作年限有关[2]。土壤是一种重要的维持地球生态系统的自然资源,为植物生长发育提供必需的养分及作为废物分解的生物介质。作为植物生长的媒介,土壤环境在很大程度上影响着作物健康及生产能力[3]。土壤微生物是土壤生态系统的一个重要组成部分,在促进作物生长、改良土壤构成、改善养分循环等方面起积极的作用。土壤微生物和所栽种的作物间是会相互影响的。植物的根系分泌物反过来也会影响土壤微生物的群落结构。有关研究结果表明,作物连作土壤中的微生物群落结构会发生变化,这种变化可能是发生连作障碍的一个重要因素[4]。有报道称,连续多年种植蔬菜的土地会出现土壤酸化、微生物群落结构失衡等现象[5]。
蓝莓(Blueberry)属杜鹃花科越橘属植物,喜酸性土壤,营养成分高,抗氧化能力列果品、蔬菜前列[6]。蓝莓在我国具有很大的发展空间,鲜食蓝莓市场占有率呈持续增长的趋势,国内消费需求潜力大[7-8]。由蔬菜连作改为蓝莓种植后,作物种类、耕作方式、施肥类型及养分利用等多方面的变化会对土壤质量演变产生较大的影响,除此之外蓝莓根际微生物群落结构和蔬菜的根际微生物群落结构也有较大差异。在连续多年种植蔬菜的基础上改种蓝莓可能可以达到改良土壤、减弱连作障碍的效果。许多作物在连作后都会出现很多问题,如黄瓜设施栽培后会由于其自毒作用而使黄瓜的产量和质量都下降[9];茄子在连作后会出现病虫害连年加重,抗逆性降低的情况;西瓜的连作障碍尤其严重[10]。关于引起连作障碍的原因的报道很多,主要从植物化感物质的分泌、土传病原菌的积聚、土壤微生物的变化及土壤理化性质等方面进行了研究[11-12]。雷娟利等[13]研究了不同蔬菜连作后土壤中细菌DNA分子水平的多态性,他们认为蔬菜连作会对土壤中细菌的群落结构产生影响。孟德龙等[14 ]的研究表明长期种植蔬菜土地的硝化势会增强且氨氧化细菌的组成越来越单一。吴凤芝等[15]从理化性状方面研究了连作年限对土壤理化性状的影响,得出随着连作时间的增长,土壤中的主要营养成分会增加,物理结构性能会有所改善但化学性状会变劣。此外,张国林[16]研究了水田改为蔬菜种植地后土壤特性的变化和这种变化所带来的环境效应。迄今关于连作障碍的研究大多集中于土壤理化性质方面,从土壤细菌群落结构变化方面进行研究的报道不多。关于蔬菜连作多年后改种蓝莓的土壤中细菌多样性分析则未见报道。笔者应用高通量测序技术进行土壤细菌测序,研究了蔬菜连作改为蓝莓种植后土壤微生物群落结构及丰度分布的变化,以期为土壤耕作制度的调整提供一定的科学依据。
1 材料与方法
1.1样品采集时间及地点
土壤样品采集于2014年4月10日进行,地点均位于江苏省宿迁市宿豫区。土壤样品分为:连续种植蔬菜4年,2014年改为种植蓝莓的土壤,编号为A,其土壤类型为砂浆黑土,经纬度为33°58′19"、118°24′36";连续种植蔬菜5年的土壤,编号为B,其土壤类型为砂土,经纬度为33°58′35″、118°21′39″。
1.2样品采集方法
分别对宿迁市宿豫区两个样品整块田地取样,采用5点取样法。用土壤采样器取土壤表层0~15 cm的表土,将5个采样点的土壤样品混合均匀,除去蚯蚓等土壤动物,石块、根系等杂物后过2 mm筛,装入已灭菌的封口聚乙烯袋,在-70 ℃下保存,1周内提取土壤微生物总DNA。
1.3土壤总DNA的提取
采用MoBio PowerSoil®DNA Isolation Kit试剂盒(美国MoBio公司产品),根据说明书中的步骤提取土壤样品中微生物的总DNA。
1.4测序与数据分析
委托北京诺禾致源生物信息科技有限公司对土壤样品微生物总DNA进行测序。基于Illumina Miseq平台,利用Paired-End(双末端测序)的方法,采用16S rDNA的高变区(V4区)测序技术,对检测得到的数据与已有的16S rDNA数据库进行比对分析。
2 结果与分析
2.1土壤微生物总DNA的提取结果
按照PowerSoil总DNA提取试剂盒说明书,分别对样品A(蔬菜连作改为蓝莓种植土壤)和样品B(蔬菜连作土壤)进行微生物总DNA提取。分别取每个样品微生物总DNA进行琼脂糖(浓度1%)凝胶电泳,结果如图1所示。从图1中可以看出,土壤样品微生物总DNA提取结果良好,条带清晰,无拖尾、杂带。

A:蔬菜连作改为蓝莓种植土壤; B:蔬菜连作土壤。下同。
2.2OTU维恩图分析结果
利用Uparse(Edgar, R C, 2013)软件对测序得到的序列进行聚类分析,根据97%的相似性将序列聚类成为OTU(Operational Taxonomic Unit)(图2)。应用维恩图可以直观地比较2个土壤样品之间OTU数目的组成相似程度及差异。操作分类单元OTU表示1组来源于某一个相同分类单元的序列。如图2所示,土壤样品A和样品B的细菌OTU总数目为1980个,其中共有细菌OTU数目为911个,占2个样品OTU总数的46%。土壤样品A独有细菌OTU数目为366个,土壤样品B独有OTU数目为703个。说明2个土壤样品中的细菌种类大部分是重复存在的,并且样品B的细菌多样性要高于样品A的。
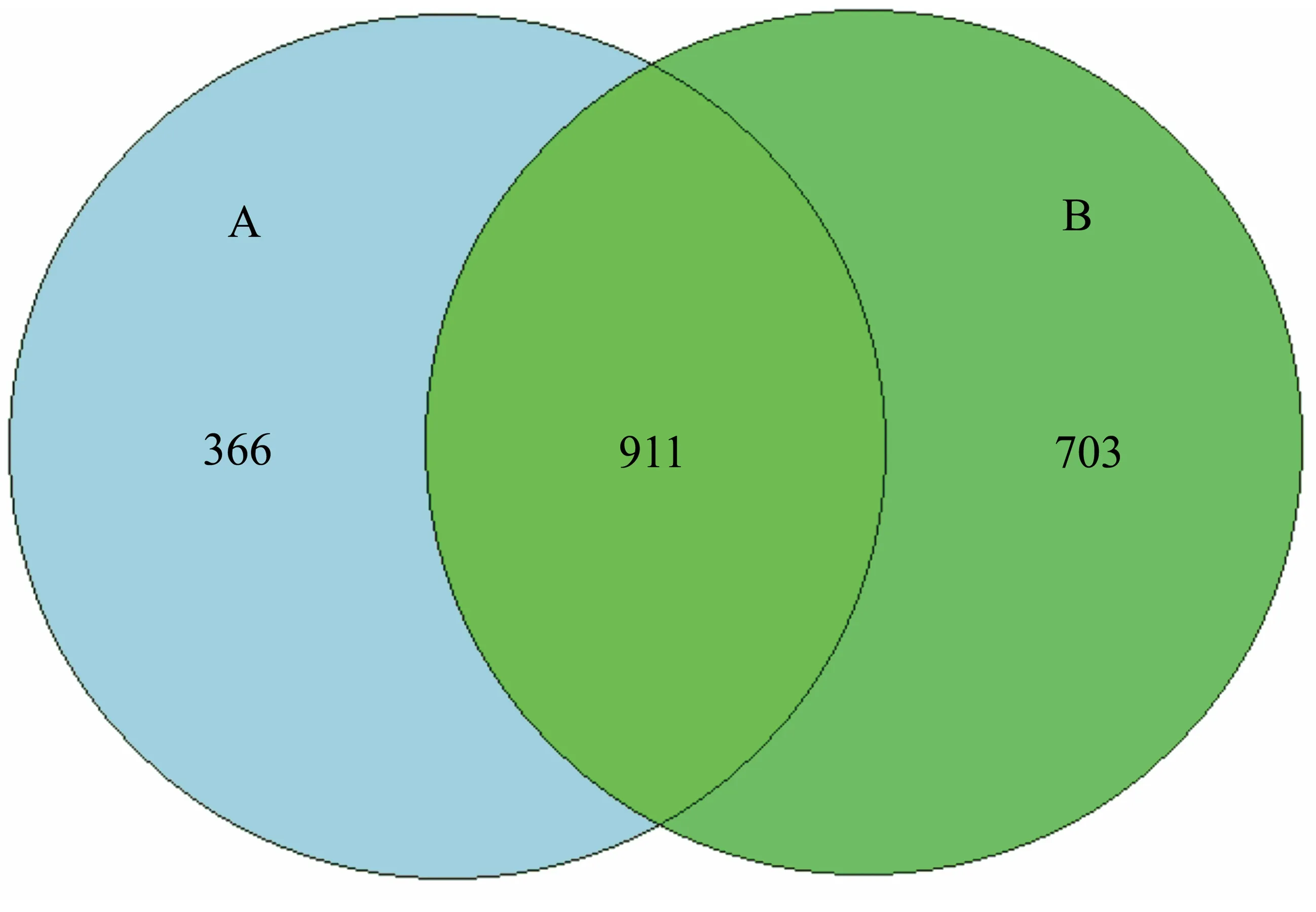
图2 操作分类单元(OTU)数目
2.3样品信息分析结果
2.3.1稀释曲线根据所得到的OTU数据的相对比例,对所取N值(一般为一组小于总序列数的等差数列)与得到的OTU数目期望值绘制土壤样品A和土壤样品B的稀释曲线(Rarefaction Curve)。通过稀释曲线可以评价所用测序量是否足以覆盖样品细菌的全部类群,也可以间接反映出样品的物种丰富程度。如图3所示,样品A和样品B的稀释曲线呈现相同的变化趋势,当测序量较少时,OTU数量随着测序量的增加而显著增加;随着测序条数的递增, 稀释曲线逐渐趋于平缓而达到平台期,表示该测序深度已经基本覆盖到样品中所有的物种。此外,在相同的测序量条件下,土壤样品B的稀释曲线纵坐标OTU数目明显高于土壤样品A的,这表明土壤样品B的物种丰富度要高于土壤样品A的。
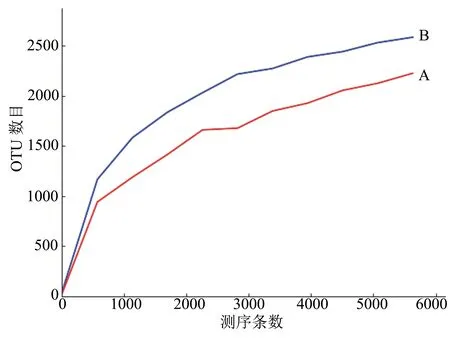
图3 土壤样品A和B的稀释曲线
2.3.2丰度曲线分析根据土壤样品A和土壤样品B所含物种丰度大小作分布曲线图,可以用来表示所测样品物种的丰富和均匀程度。在图4中,横坐标表示物种丰度的排列顺序,纵坐标表示相对丰度比例。当物种排列顺序较少时,土壤样品A和土壤样品B的丰度曲线斜率较大,物种丰富和均匀程度较差;样品A的最高相对丰度比例要高于样品B的,说明样品A所含优势细菌的比例要明显大于样品B的。随着物种排列顺序的增加,样品B的相对丰度比例总体上要高于样品A的,表明样品B的物种丰富程度和均匀程度要高于样品A的。

图4 样品A和B的物种丰度分布曲线
2.3.3群落组成分析如图5所示,样品所有序列分别属于细菌的23个门,其中细菌变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、泉古菌门(Crenarchaeota)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)和硝化螺旋菌门(Nitrospirae)所占比例较大,它们的序列总和占全部序列的90%以上,在样品细菌种类中占主导地位。在样品B中存在的广古菌门(Euryarchaeota)、BRC1门、迷踪菌门(Elusimicrobia)、GNO4门、OD1门与TM6门细菌在样品A中均不存在。
2.3.4土壤物种丰度聚类根据样品A和样品B所含物种的丰度水平,在属的水平上进行聚类分析,包括地位聚类(横向聚类)和样本聚类(纵向聚类),结果见图6。图6中不同颜色代表物种的不同相对丰度水平,可以清晰地展示出样品中优势物种;Kaistobacter、假交替单胞菌属(Pseudoalteromonas)、硫杆状菌属(Thiobacillus)、Rubritalea、浮霉菌属(Planctomyces)、Lysobacter、纤维弧菌属(Cellvibrio)、噬氢菌属(Hydrogenophaga)、鞘脂单胞菌属(Sphingomonas)和热单胞菌属(Thermomonas)在样品A中聚集最多,而Sporosarcina、Alicyclobacillus、氨氧化古细菌(Candidatusnitrososphaera)和Pontibacter为样品B中聚集较多的物种。
3 讨论
本文采用基于第二代高通量测序平台Illumina Miseq的16S rDNA测序技术,对江苏省宿迁市宿豫区的蔬菜连作转蓝莓种植与相同年份蔬菜连作的土壤的细菌群落数量分布及优势细菌类别进行了差异分析。细菌在土壤中分布广泛,行使着不同的功能。例如,硝化螺旋菌(Nitrospira)为硝化细菌,是有益细菌,与亚硝化单胞菌起主要硝化作用[18];硫杆菌(Thiobacillus)是化能自养细菌,可以对硫化物进行氧化分解[19-20];浮霉菌(Planctomyces)在海洋碳和氮循环(如厌氧氨氧化过程)中起着重要的作用[21-22];链霉菌(Streptomyces)能够对植物病原真菌起到抑制作用等。

k:界; p:门。

图6 样品A和B的物种丰度聚类结果
本研究结果表明:变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)在土壤样品A和土壤样品B中丰度水平较高,这两门细菌所占比例之和超过50%,分别为57.90%、34.00%(变形菌门)和12.30%、18.10%(酸杆菌门)。变形菌门占有主导地位,这与倪添等[23]及刘玮琦等[24]的实验研究结果一致。此外,样品A所含的变形菌门比例显著高于样品B的,但酸杆菌门比例明显低于样品B的。样品B的细菌多样性程度大于样品A的。属于样品B的优势物种在样品A中含量均较低,属于样品A的优势物种在样品B中含量也较低,物种丰度聚类差异较大。Candidatus_Solibacter、硝化螺菌属(Nitrospira)及生丝微菌属(Hyphomicrobium)是样品A中聚集较少的物种,假黄色单胞菌属(Pseudoxanthomonas)和噬氢菌属(Hydrogenophaga)是样品B中聚集较少的物种。链霉菌属(Streptomyces)、GOUTA19和互营杆菌属(Syntrophobacter)在样品A和样品B中的含量相近并且都较低。样品物种的种类及丰度分布的差异性,可能是由作物种类及耕作方法等改变造成的。
本文对不同田块土壤的细菌16S rDNA差异进行比较分析,发现种植作物种类和种植方式改变对土壤细菌的多样性产生了较大的影响。本研究结果可为土地利用方式改变引起的土壤质量演变研究提供生物学指标,同时也可为该地区合理可持续利用土地、建立科学的耕作体系提供理论依据。
4 结论
与连续多年种植蔬菜的土壤相比,连作蔬菜多年后改种蓝莓的土壤中的细菌多样性降低了,丰度也降低了,优势菌群也出现了显著的变化。改变种植作物的种类能有效改变土壤中细菌群落的组成结构。
[1] 薛超,黄启为,凌宁,等.连作土壤微生物区系分析、调控及高通量研究方法[J].土壤学报,2011,48(3):612-618.
[2] 黎宁,李华兴,朱凤娇,等.菜园土壤的理化性质和微生物生态特征与种植年限的关系[J].生态环境,2005,14(6):925-929.
[3] 黄锦法,曹志洪,李艾芬,等.稻麦轮作田改为保护地菜田土壤肥力质量的演变[J].植物营养与肥料学报,2003,9(1):19-25.
[4] 苏世鸣,任丽轩,霍振华,等.西瓜与旱作水稻间作改善西瓜连作障碍及对土壤微生物区系的影响[J].中国农业科学,2008,41(3):704-712.
[5] 冯红贤,杨暹,李欣允,等.蔬菜连作对土壤生物化学性质的影响[J].长江蔬菜,2004(11):40-43.
[6] 李丽敏,郝庆生,李亚东.中国蓝莓产业发展若干问题的思考[J].安徽农业科学,2008,36(20):8546-8548.
[7] 王辉,王鹏云,王蜀,等.我国蓝莓的发展现状及前景[J].农业现代化研究,2008,29(2):250-253.
[8] 李丽敏,赵春雷,郝庆升.中外蓝莓产业比较研究[J].中国农学通报,2010,26(23):354-359.
[9] 张俊英,许永利,刘志强.蚯蚓粪缓解大棚黄瓜连作障碍的研究[J].北方园艺,2010(4):58-60.
[10] 苏生平.蔬菜连作障碍防治技术[J].农业工程,2015,5(z1).
[11] Huang H C, Chou C H, Erickson R S. Soil sickness and its control[J]. Allelopathy Journal, 2006, 18(1): 1-21.
[12] Yu J Q, Shou S Y, Qian Y R, et al. Autotoxic potential of cucurbit crops[J]. Plant & Soil, 2000, 223(1-2): 149-153.
[13] 雷娟利,周艳虹,丁桔,等.不同蔬菜连作对土壤细菌DNA分子水平多态性影响的研究[J].中国农业科学,2005,38(10):2076-2083.
[14] 孟德龙,杨扬,伍延正,等.多年蔬菜连作对土壤氨氧化微生物群落组成的影响[J].环境科学,2012,33(4):1331-1338.
[15] 吴凤芝,刘德,王东凯,等.大棚蔬菜连作年限对土壤主要理化性状的影响[J].中国蔬菜,1998(4):5-8.
[16] 张国林.水田改为蔬菜地土壤特性的变化及其环境效应[D].广州:中国科学院广州地球化学研究所,2007.
[17] Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998.
[18] 张岩,鄢胜勇,张彦清,等.运用PCR-DGGE和克隆技术对串联附积床系统生物膜菌群的分析[J].北京工业大学学报,2013(1):122-130.
[19] 朱长见,陆建军,陆现彩,等.氧化亚铁硫杆菌作用下形成的黄钾铁矾的SEM研究[J].高校地质学报,2005,11(2):234-238.
[20] 王世梅,周立祥.提高氧化亚铁硫杆菌和氧化硫硫杆菌平板检出率的方法:双层平板法[J].环境科学学报,2005,25(10):1418-1420.
[21] 黄佩蓓,焦念志,冯洁,等.海洋浮霉状菌多样性与生态学功能研究进展[J].微生物学通报,2014,41(9):1891-1902.
[22] 薛磊,薛泉宏,卢建军,等.棉花黄萎病原真菌菌体对链霉菌4种胞外水解酶活性的影响[J].植物病理学报,2012,42(1):73-83.
[23] 倪添.稻麦轮作体系下不同施肥措施对土壤微生物区系的影响[D].南京:南京农业大学,2013.
[24] 刘玮琦,茆振川,杨宇红,等.应用16S rRNA基因文库技术分析土壤细菌群落的多样性[J].微生物学报,2008,48(10):1344-1350.
(责任编辑:黄荣华)
Changes in Soil Bacterial Community Diversity Caused by Cropping System Alteration from Vegetable Continuous Cropping to Blueberry Planting
QI Shi-gang1, TIAN Chang2, QUE Feng2, XU Zhi-sheng2, WANG Feng2, XIONG Ai-sheng2*
(1. Suqian Soil and Fertilizer Technique Guidance Station in Jiangsu Province, Suqian 223800, China; 2. State Key Laboratory of Crop Genetics and Germplasm Enhancement, College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China)
Based on the second-generation high-throughput sequencing platform Illumina Miseq, using the 16S rDNA gene sequencing technology, the author analyzed the changes in soil bacterial community diversity caused by the cropping system alteration from vegetable continuous cropping to blueberry planting in Suqian city of Jiangsu province. The results showed that:Kaistobacter,Pseudoalteromonas,Thiobacillus,Rubritalea,Planctomyces,Lysobacter,Cellvibrio,Hydrogenophaga,SphingomonasandThermomonaswere the dominant bacterial populations in the soil after cropping system alteration from vegetable continuous cropping to blueberry planting;Sporosarcina,Alicyclobacillus,CandidatusnitrososphaeraandPontibacterwere the dominant bacterial populations in the soil of continuous-cropping vegetable field; after the alteration from vegetable continuous cropping to blueberry planting, the diversity and abundance of soil bacteria were reduced, and the dominant bacterial community also changed obviously.
High-throughput sequencing; Bacterial diversity; Soil; Continuous-cropping vegetable; Blueberry
2016-05-24
教育部新世纪优秀人才支持计划项目(NCET-11-0670);江苏省杰出青年基金项目(BK20130027);江苏高校优势学科建设项目(PAPD)。
祁石刚(1973─),研究员,研究方向为土壤学。*通讯作者:熊爱生。
S154.381
A
1001-8581(2016)10-0019-05

