粒细胞集落刺激因子治疗乙型肝炎相关慢加急性肝衰竭随机对照临床研究
许 祥,刘晓燕,陈 婧,肖 珑,童晶晶,关崇丹,严立龙,苏海滨,胡瑾华
粒细胞集落刺激因子治疗乙型肝炎相关慢加急性肝衰竭随机对照临床研究
许祥,刘晓燕,陈婧,肖珑,童晶晶,关崇丹,严立龙,苏海滨,胡瑾华
目的 评价重组人粒细胞集落刺激因子(recombinant granulocyte-colony stimulating factor, rG-CSF)治疗乙型肝炎相关慢加急性肝衰竭(hepatitis B virus-associated acute-on-chronic liver failure, HBV-ACLF)的有效性和安全性。方法 将99例ACLF患者随机分为2组,试验组49例,对照组50例。对照组给予内科综合治疗,试验组在综合治疗基础上接受 rG-CSF 300 μg,1次/d,皮下注射,共计6针,然后减量至隔日1次,共6次,总计12针。结果 生存分析表明,试验组治疗1月、3月的生存率分别为91.3% 和72.9%,大于对照组的63.7%和 50.0%(P <0.05)。治疗期间无严重不良反应发生。结论rG-CSF能够显著提高HBV-ACLF患者的生存率,并且有较高的安全性。
粒细胞集落刺激因子;HBV;慢加急性肝衰竭;临床研究
近年来,粒细胞集落刺激因子治疗肝衰竭成为临床研究热点,特别是酒精性肝衰竭和乙型肝炎相关慢加急性肝衰竭(hepatitis B virus-associated acute-on-chronic liver failure, HBV-ACLF)的随机对照临床研究显示其具有治疗作用,且安全性良好[1-2]。2014年亚太肝病协会颁布的《慢加急性肝衰竭共识》明确指出重组人粒细胞集落刺激因子(recombinant granulocyte-colony stimulating factor,rG-CSF)可能是慢加急性肝衰竭潜在有效治疗药物,须要进一步扩大临床数据[3]。本课题组曾应用rG-CSF对HBV-ACLF中晚期患者进行了治疗观察,结果显示rG-CSF能显著提高部分患者的生存率[2]。本次研究将rG-CSF治疗HBV-ACLF扩大至早期和中晚期所有患者,进一步研究其有效性和安全性。
1 对象与方法
1.1对象 选择2013年6月—2015年3月解放军第三○二医院肝衰竭诊疗与研究中心住院诊治的HBV-ACLF患者,所有患者符合《肝衰竭诊治指南(2012 年版)》的慢加急性肝衰竭诊断标准[4]。入组标准:①年龄18~65岁;②临床符合慢加急性(亚急性)肝衰竭;③愿意签署知情同意书。排除标准:①既往对rG-CSF过敏;②合并其他感染:抗HAV IgM、抗HCV、抗HDV、抗HEV及抗HIV任一项阳性;③恶性肿瘤或严重的血液系统疾病;④妊娠或哺乳期妇女;⑤明确未控制现症细菌感染;⑥合并其他严重的全身性疾病和精神病患者;⑦近期或正在参加其他临床试验者。此研究方案符合赫尔辛基宣言,并通过解放军第三○二医院伦理委员会批准。
将按照上述标准筛选出的99例患者用数字表法随机分配到试验组和对照组,试验组49例,对照组50例。对照组只给予基础治疗,试验组在基础治疗的基础上给予rG-CSF治疗。2组的基线特征均衡,具有可比性(表1)。在HBV-ACLF分期方面,对照组早期22例,中期24例,晚期4例;试验组早期27例,中期20例,晚期2例。因为晚期病例数太少,本研究将中期和晚期病例合并为中晚期病例进行研究。

表1 2组基线特征Table 1 Baseline characteristics of two groups
1.2治疗方法 对照组给予内科综合治疗,包括抗病毒治疗及基础治疗(使用异甘草酸镁、还原型谷胱甘肽、前列地尔以及腺苷蛋氨酸等药物);试验组在综合治疗基础上接受 rG-CSF(北京双鹭药业,国药准字S20030048)治疗,用法:1次/d,皮下注射,共计6针,然后减量至隔日1次,共6次,总计12针。2组用药治疗期间均未进行人工肝治疗。
1.3随访及观察指标 记录各观察时间点入组患者的一般情况、症状体征、并发症和生化指标等。记录用药期间发生的不良反应。在第1个月的住院治疗期间每日进行观察并进行体格检查,出院后每1个月随访一次,共随访3个月。主要评价指标为患者1个月和3个月生存率,次要观察指标为2组肝脏功能的变化及并发症的发生情况。
1.4统计学处理 采用EpiData 3.1软件进行数据录入和管理,数据录入采用2人2次录入。采用SPSS 19.0软件进行统计学分析。计量资料经检验满足正态分布者用±s表示, 2组比较用成组t检验(方差齐),不满足正态分布者用中位数(最小值, 最大值)表示,2组比较用秩和检验。2组计数资料比较用四格表χ2检验。用Kaplan-Meier法估计生存率并绘制Kaplan-Meier生存曲线,2组生存曲线检验用log-rank检验。P<0.05表示差异有统计学意义。
2 结 果
2.1随访情况 治疗期间对照组完成49例,脱落1例;试验组完成45例,脱落3例,退出1例。治疗1个月结束时,对照组死亡18例,试验组死亡4例;3个月随访结束时,对照组死亡25例,试验组死亡13例。
2.2生存分析 用Kaplan-Meier法估计生存率并绘制Kaplan-Meier生存曲线(图1),经log-rank检验,2组生存曲线差异有统计学意义(χ2=5.912,P=0.015),试验组生存率显著高于对照组。试验组和对照组1个月生存率分别为91.3%和63.7%,3个月生存率分别为70.7%和49.3%。
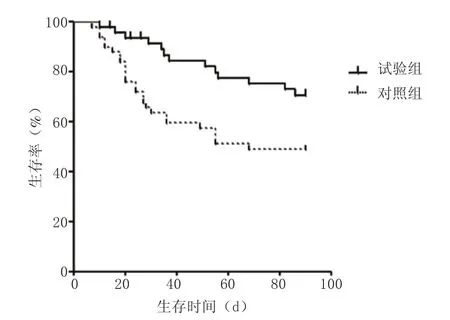
图1 2组患者生存曲线Figure 1 Survival curves of patients in two groups
按肝衰竭分期分层进行生存分析,2组早期患者生存曲线见图2,log-rank检验结果:χ2=3.585,P=0.058,P值在0.05附近,结合2组生存曲线图,下“试验组生存率有高于对照组趋势”的结论。2组中晚期患者生存曲线见图3,生存曲线差异无统计学意义(χ2=1.825,P=0.177)。

图2 2组早期患者生存曲线Figure 2 Survival curves of early phase patients in two groups
2.2肝功能和其他实验室指标的变化 治疗4周时,2组间的生化指标变化幅度如表2所示。2组肝功生化指标、白细胞、血小板以及MELD评分等变化幅度差异无统计学意义。但在治疗1周时,试验组与对照组相比,TBIL下降明显,入组时试验组TBIL值为(334.29±125.10)μmol/L,对照组为(294.06±133.03)μmol/L,治疗1周时,试验组与对照组TBIL下降的平均值分别为31.79和-7.89 μmol/L。在治疗1周时,试验组和对照组分别有7例和4例患者TBIL下降超过了其治疗前的1/3,分别占14.58%和8.50%。
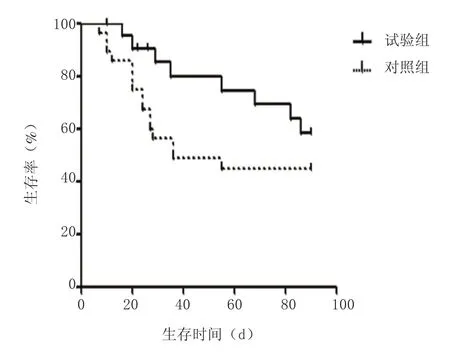
图3 2组中晚期患者生存曲线Figure 3 Survival curves of medium-and-late phase patients in two groups
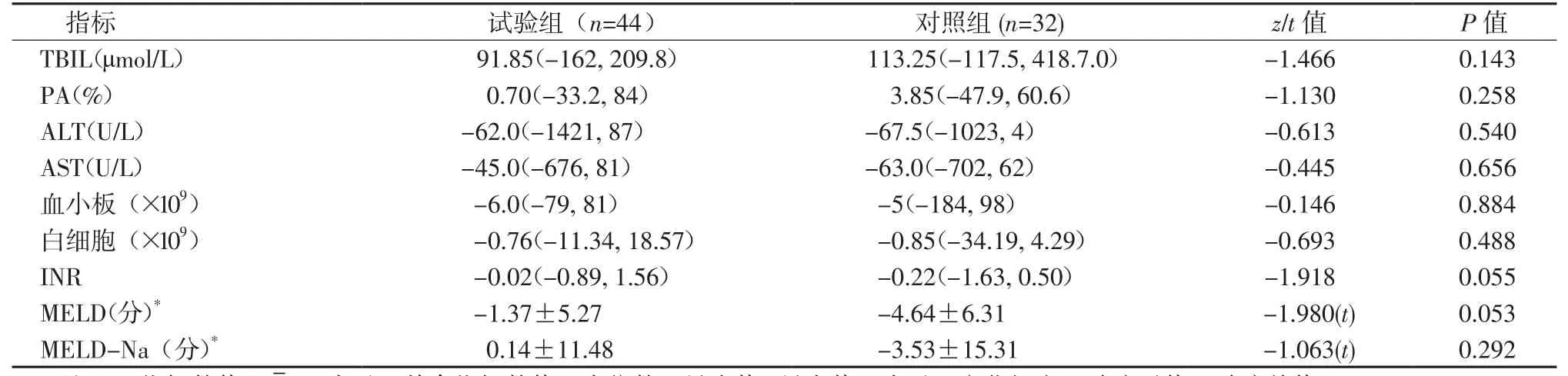
表2 2组治疗4周时各指标的变化幅度Table 2 The change range of each index of the two groups after 4-week treatment
2.3并发症 在治疗4周内试验组和对照组间的并发症发生情况如下。试验组中,共12例次发生感染,其中8例次原发性腹膜炎,3例次肺部感染,1例次口腔真菌感染;4例发生肝肾综合征;1例发生肝性脑病。对照组中,13例(16例次)发生感染,其中6例次发生原发性腹膜炎,5例次肺部感染,2例次败血症,2例次胆囊炎,1例次泌尿系感染,其中3例患者出现多部位感染,且有1例发生感染性休克;4例肝肾综合征;4例肝性脑病。试验组和对照组的感染率分别为25%和32%。在试验组中均为单一感染,而在对照组中发生了多例混合感染,抗感染疗程长。
在入组时试验组的白细胞中位数为5.88×109,在治疗过程中第3天白细胞开始明显上升,随着用药天数增加,白细胞数明显上升,均在第5~10天内达到最高值,其最大值的中位数为25.97×109,升高幅度为(4.93×109~48.56×109),在用药结束后3 d白细胞数明显回落至基线水平。
2.4不良事件 在本次研究中,1例患者用药后第3 天出现颈部、上腹部及背部皮疹,为充血性,临床不能排除药物过敏反应,停用了所有治疗用药(包括rG-CSF),皮疹消退,该患者自愿退出试验。另有7例患者在用药后1周内出现腰骶部疼痛,为钝痛,均可忍受,且自行缓解,其中5例为早期肝衰竭患者,2例为中期肝衰竭患者。此外有6例患者出现低热,体温低于38 ℃,多出现在用药过程的前3 d,持续数小时后不经处理自行缓解,其中2例为早期肝衰竭患者,3例为中期肝衰竭患者,1例为晚期肝衰竭患者。试验观察中并未明确发现不良事件的发生与肝衰竭分期的关系。rG-CSF的长期安全性多在骨髓干细胞移植动员后,并未见与rG-CSF直接相关的肾功能损伤及恶性肿瘤的发生。治疗期间未观察到与用药直接相关的其他不良事件的发生。
3 讨 论
HBV-ACLF病死率高,预后凶险,虽然肝移植可以提高肝衰竭患者的生存率,但由于受到肝源短缺、术后并发症多以及高额费用等因素的限制,使得肝移植在我国无法普遍开展,因此提高内科治疗疗效显得尤为重要[5]。rG-CSF因能促进粒系祖细胞增殖分化而广泛应用于血液系统疾病,而越来越多的证据表明其可通过多种途径减轻肝脏病理损伤:动员骨髓干细胞归巢定植于肝脏[6-7];促进肝卵圆细胞增殖,从而促进肝脏再生,减轻肝损伤[8];发挥免疫调节作用[9]。已知在严重肝硬化患者中,中性粒细胞的抗感染能力下降,使得机体易于发生感染[10],而rG-CSF作为一种强有力的中性粒细胞动员剂,能够调节中性粒细胞的增殖与分化成熟,也可驱使中性粒细胞释放到血液,使外周血中性粒细胞数量增加[11]。因此有学者认为rG-CSF还可能通过提高中性粒细胞的功能,减少和控制感染相关并发症的发生发展,提高患者生存率[12]。本研究中,试验组与对照组之间虽然感染例数接近,但是对照组的感染情况更复杂严重,其中包括原发性腹膜炎、肺炎、败血症和肺部重叠感染。rG-CSF提高机体抗感染能力有待进一步研究和证实。
慢加急性肝衰竭可引起一系列急性肝脏相关的损伤,一些病因学的治疗比如抗病毒治疗可以延缓其病情发展,但不能阻止疾病的进展。在本研究中我们仅选择了HBV-ACLF病例,使病因单一,使用rG-CSF治疗,其能够作用于粒细胞系,引起细胞因子变化,显著提高HBV-ACLF患者3个月生存率,试验组生存率显著高于对照组。试验组和对照组1个月生存率分别为91.3%和63.7%,3个月生存率分别为70.7%和49.3%。Kedarisetty等[13]使用G-CSF 治疗失代偿期肝硬化,提高了生存率。Garg 等[1]也发现G-CSF 能够提高酒精性慢加急性肝衰竭患者的生存率(29.0%~69.6%,P=0.003)。本研究中,进一步按照肝衰竭分期分析,早期患者中,2组生存曲线经log-rank检验,P值>0.05(但在0.05附近),与生存曲线不符,考虑原因与样本量较少有关,因此仍然认为试验组生存率有高于对照组的趋势;而2组中晚期生存曲线表现为有差异的趋势,但是经log-rank检验差异无统计学意义。发生生存曲线图与log-rank检验结果不一致的原因,考虑主要与样本量少有关。我们在以后的研究中将扩大样本量,进一步探讨不同分期患者的生存率。
在安全性观察中发现,试验组的不良反应仅限于腰痛和低热,且可自行恢复,不良反应小,不影响正常生活。其中1例因皮疹退出试验,该患者同时有合并其他用药,无法明确是否与粒细胞集落刺激因子直接相关,且在停用rG-CSF以及其他可能引起皮疹的药物后,皮疹消退。表明rGCSF治疗HBV-ACLF比较安全。肝衰竭患者合并细菌感染时会出现低热及中性粒细胞数增多,即在感染发生时或用药治疗期间均会发生白细胞计数升高,与rG-CSF治疗的早期反应表现类似,但若为感染则会有相关的临床症状与体征,如为原发性腹膜炎时患者会有腹痛,腹水增多等症状,临床上应积极鉴别,有必要开展进一步研究观察。因此患者在用药过程中,要严密监测白细胞升高,并与感染积极鉴别,若患者出现相应的临床症状和体征以及其他实验室指标的变化,要与单纯用药引起的白细胞升高鉴别。
本组患者治疗4周时生化指标及MELD评分2组间无明显差异,分析原因可能2组患者生存率不同,对照组存活例数少,样本量少,影响检验结果。但本试验观察到,试验组在治疗1周时,TBIL下降更显著,表现在下降幅度大,且与预后有关,但TBIL下降是否是一个影响预后的独立因素,本课题组随后将进一步进行预后影响因素的多因素统计分析。rG-CSF是否影响胆红素代谢,机制如何,值得进一步研究。
随着rG-CSF治疗HBV-ACLF临床试验增多,其减轻肝损伤的作用逐渐被认识,成为慢加急性肝衰竭内科治疗的有效治疗方法。建议进行多中心随机对照观察rG-CSF治疗HBV-ACLF的有效性和安全性,为rG-CSF治疗肝衰竭提供高等级循证医学依据。
[1] Garg V, Garg H, Khan A, et al. Granulocyte-colony stimulating factor mobilizes CD34+cells and improves survival of patients with acute-on-chronic liver failure[J]. Gastroenterology, 2012,142(3):505-512.
[2] Duan XZ, Liu FF, Tong JJ, et al. Granulocyte-colony stimulating factor therapy improves survival in patients with hepatitis B virus-associated acute-on-chronic liver failure[J]. World J Gastroenterol, 2013, 19(7):1104-1110.
[3] Sarin SK, Kedarisetty CK, Abbas Z, et al . Acute-on-chronicliver failure: consensus recommendations of the Asian Pacific Association for the Study of the Liver (APASL)[J]. Hepatol Int,2014, 8(4):453-471.
[4] 中华医学会感染病学分会肝衰竭与人工肝学组中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2012 年版)[J]. 实用肝脏病杂志,2013,16(3): 210-216.
[5] Mendizabal M, Silva MO. Liver transplantation in acute liver failure: A challenging scenario [J]. World J Gastroenterol, 2016,22(4):1523-1531.
[6] 张智峰,赵钢,赵天宇,等. 重组人粒细胞集落刺激因子动员后自体外周血干细胞在大鼠纤维化肝脏内的发育[J]. 中国组织工程研究与临床康复,2008,12(3):569-572.
[7] Gaia S, Smedile A, Omedè P, et al. Feasibility and safety of G-CSF administration to induce bone marrow-derived cells mobilization in patients with end stage liver disease[J]. J Hepatol, 2006,45(1):13-19.
[8] Spahr L, Lambert JF, Rubbia-Brandt L, et al. Granulocyte-colony stimulating factor induces proliferation of hepatic progenitors in alcoholic steatohepatitis: a randomized trial[J]. Hepatology, 2008, 48(1):221-229.
[9] 杨昊臻,郑楠楠,胡瑾华. 重组人粒细胞集落刺激因子的免疫调节作用及其在肝衰竭中的应用[J].中华肝脏病杂志,2013,21(9):718-720.
[10] Rolas L, Makhezer N, Hadjoudj S, et al. Inhibition of mammalian target of rapamycin aggravates the respiratory burst defect of neutrophils from decompensated patients with cirrhosis [J]. Hepatology, 2013, 57(3):1163-1171.
[11] Tato CM, Cua DJ . Snap Shot: Cytokines IV[J]. Cell, 2008,132(6):1062.e1-2.
[12] Moreau R, Rautou PE. G-CSF therapy for severe alcoholic hepatitis: targeting liver regeneration or neutrophil function[J]. Am J Gastroenterol, 2014, 109(9):1424-1426.
[13] Kedarisetty CK, Anand L, Bhadoria AS, et al. Combination of granulocyte colony-stimulating factor and erythropoietin improves outcomes of patients with decompensated cirrhosis[J]. Gastroenterology, 2015, 148(7):1362-1370. e7.
(2016-04-18收稿 2016-06-10修回)
(责任编委 曲 芬 本文编辑 张云辉)
The clinical trial of rG-CSF for hepatitis B virus-associated acute-on-chronic liver failure
XU Xiang, LIU Xiao-yan, CHEN Jing, XIAO Long, TONG Jing-jing, Guan Chong-dan, YAN Li-long, SU Hai-bin, HU Jin-hua*
Liver Failure Treatment and Research Center, Peking University 302 Teaching Hospital, Beijing 100039, China
, E-mail: hjh@medmail.com.cn
Objective To evaluate the safety and efficiacy of rG-CSF on patients with hepatitis B virus-associated acute-onchronic liver failure (ACLF). Methods A total of 99 cases of ACLF were randomly divided into 2 groups, 49 cases in the experimental group and 50 cases in the control group. The control group was given internal comprehensive treatment while the experimental group on the basis of the internal comprehensive treatment received rG-CSF 300 g, once per day, subcutaneous injection, six injections in total,and then reduced to once every other day, a total of 6 times, 12 injections in total. Results Survival analysis showed that the survival rates of the experimental group in January and March were 91.3% and 72.9% respectively, which were higher than those in the control group of 63.7% and 50% (P<0.05). There were no serious adverse effects during the treatment period. Conclusions rG-CSF can significantly improve the survival rate of patients with HBV-ACLF with higher security.
granulocyte-colony stimulating factor; HBV; acute-on-chronic liver failure; clinical trial
R512.62;R575.3
A
1007-8134(2016)05-0279-05
10.3969/j.issn.1007-8134.2016.05.006
北京市科技计划首都临床特色应用研究项目(Z131107002213157)
100039,北京大学解放军第三○二医院教学医院肝衰竭诊疗研究中心(许祥、刘晓燕、陈婧、肖珑、童晶晶、关崇丹、严立龙、苏海滨、胡瑾华)
胡瑾华,E-mail: hjh@medmail.com.cn

