盐度对长江刀鲚幼鱼非特异性免疫酶和消化酶活力的影响
邓平平,施永海,汪洋,徐嘉波,谢永德,刘永士,税春
(上海市水产研究所,上海200433)
盐度对长江刀鲚幼鱼非特异性免疫酶和消化酶活力的影响
邓平平,施永海,汪洋,徐嘉波,谢永德,刘永士,税春
(上海市水产研究所,上海200433)
以人工繁育的长江刀鲚Coilia nasus幼鱼(体质量为2.12 g±0.88 g)为对象,研究了盐度对其肝脏非特异性免疫酶和胃、肠、盲囊消化酶活力的影响。试验设6个盐度(3、6、9、12、15、18)处理组,每组设3个平行,每个平行放养50尾鱼,试验共进行55 d。结果表明:盐度为15时,长江刀鲚幼鱼肝脏酸性磷酸酶(ACP)和碱性磷酸酶(AKP)活力均处于最低值,分别为104.77、60.72 U/g,盐度为18时,肝脏ACP活力显著高于其他盐度组(P<0.05);超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力随盐度变化的趋势相同,与谷胱甘肽过氧化物酶(GSH-PX)活力变化趋势相反,盐度对肝脏CAT活力无显著性影响(P>0.05);相同盐度下,肠淀粉酶(AMS)、脂肪酶(LPS)、蛋白酶(胃蛋白酶PPS、胰蛋白酶TPS)活力比胃和盲囊高,胃LPS活力明显低于盲囊和肠;盐度为9时盲囊LPS活力以及盐度为15时肠TPS活力出现最大值;相同盐度下,不同消化组织AMS活力总体上为肠>盲囊>胃,盐度为12时,各消化组织AMS活力处于较低水平,盐度为15时,各消化组织AMS活力整体处于相对较高水平。根据盐度对不同组织不同酶活力的影响规律,得出适宜长江刀鲚生存的盐度为12~15。
长江刀鲚;盐度;非特异性免疫酶;消化酶
刀鲚Coilia nasus隶属于鲱形目Glupeiformes、鳀科Engraulidae、鲚属Coilia,俗称长江刀鱼,是一种生殖洄游性鱼类,主要分布于长江及通海河口流域[1-2]。繁殖季节从河口区进入淡水区产卵,初孵仔鱼经过生长肥育陆续顺流返回河口及近海区。长江刀鲚因其复杂的生活史可以作为鱼类低盐度胁迫和渗透压生理的研究对象。盐度对鱼类生理生态的直接作用是影响鱼体对渗透压的调节,间接表现为对鱼体与环境间物质交换及能量流动的影响[3]。鱼类渗透压调节是通过身体各个组织器官协同作用[4],如免疫系统、消化系统、排泄系统、鳃、皮肤等。渗透压的调节需要消耗大量的能量,使得用于生长的能量相对减小,从而导致鱼类的代谢缓慢、体质下降、免疫力降低[5]。
肝脏是鱼类重要的新陈代谢器官,参与鱼体抗氧化、糖原合成、分泌胆汁等重要生理过程[6]。在长期低盐度胁迫条件下,鱼类通过完善的非特异性免疫系统来抵御水环境的胁迫,机体会产生大量的氧自由基,从而导致相应的免疫因子发生变化以清除过多的自由基[7],机体产生了大量的相关抗氧化酶。盐度通过影响鱼类消化组织中消化酶活力来影响鱼类的消化生理活动,最终影响鱼类的生长发育[8]。
目前,研究人员已对半滑舌鳎Cynoglossus semilaevis[6]、刺参Apostichopus jappnicus[9]、大菱鲆Scophthalmus maximus[10]、真鲷Pagrosomus major[11]、黄鳍鲷Sparus latus[12]、施氏鲟Acipenser schrenckii Brandt[13]等水产动物进行了盐度对其非特异性免疫酶或消化酶影响方面的相关研究。本试验中,以人工繁育的长江刀鲚Coilia nasus幼鱼为研究对象,通过逐步增盐,长期胁迫,研究了盐度对长江刀鲚幼鱼非特异性免疫酶和消化酶活力的影响,以期为长江刀鲚生殖洄游、增殖放流及其相关生态学研究提供基础资料。
1 材料与方法
1.1 材料
试验用长江刀鲚幼鱼为上海市水产研究所苗种技术中心经人工繁殖培育的幼鱼,挑选活力强、规格相近的个体进行试验,试验鱼初始体长为(8.326±1.179)cm,体质量为(2.12±0.88)g。
1.2 方法
1.2.1 试验条件 试验用水由自然河水、杭州湾半咸水和盐卤按比例配制。试验期间,每天投喂剑水蚤和糠虾各2次,每天吸污换水各1次,并及时监测水温和盐度的变化,控制光强。
1.2.2 试验设计 试验设6个处理组,盐度分别为3、6、9、12、15和18,每组设3个平行,每个平行放养50尾鱼,试验在盛有1 t水体的水泥池中进行。各试验组起始均为淡水养殖,暂养5 d,然后盐度按每天升2的速度分别升至6、9、12、15和18,并设盐度为3的对照组。试验共进行55 d,试验水温为26.7~31.3℃。
取样前24 h停止投喂,将各组试验鱼封袋分类保存于冰箱(-80℃)中。采集各试验组长江刀鲚的肝脏、肠道、盲囊和胃样本,分别测定非特异性免疫酶和消化酶活力。
1.2.3 酶液的制备 将冷冻的试验鱼从-80℃冰箱移至冰箱(-20℃)中,再置于冰盘上逐步解冻后解剖,取出肝脏、肠道、盲囊、胃,剔除内容物和脂肪后,用0.9%预冷的生理盐水快速冲洗,并用滤纸吸干水分。将分批解剖获得的各组织保存于冰箱(-80℃)中,测定前先在冰盘内将样品剪碎,称取一定量的组织于玻璃匀浆器中,加入一定体积预冷的生理盐水后,在冰浴条件下匀浆。所得匀浆液于4℃下以2500 r/min离心20 min,取上清液作为酶液,冰浴保存,10 h内分析完毕。
1.2.4 免疫酶和消化酶活力的测定 试验过程中使用的测定试剂盒均由南京建成生物工程研究所提供,且其不同酶的活力定义如下。
BCA总蛋白定量:将56.3 mg/L蛋白标准品用双蒸水稀释成不同浓度,制作标准曲线,然后准确称取组织质量,按质量(g)∶体积(mL)=1∶9的比例加入生理盐水,在冰水条件下机械匀浆,以2500 r/min离心10 min,取上清液再用生理盐水按1∶9稀释成组织匀浆,待测。
碱性磷酸酶(AKP)活力定义为:在37℃条件下每克组织蛋白与基质作用15 min产生1 mg酚为一个活力单位(U)。
酸性磷酸酶(ACP)活力定义为:在37℃条件下每克组织蛋白与基质作用30 min产生1 mg酚为一个ACP酶活力单位(U)。
超氧化物歧化酶(SOD)活力定义为:在37℃条件下每毫克组织蛋白与1 mL反应液作用40 min,SOD抑制率达50%时所对应的SOD量为一个SOD酶活力单位(U)。
过氧化氢酶(Catalase,CAT)活力定义为:在37℃条件下每克组织蛋白中CAT每秒钟分解吸光度0.50~0.55的底物中的过氧化氢相对量为一个CAT酶活力单位(U)。
谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)活力定义为:在37℃条件下每毫克蛋白质每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1μmol/L为一个GSH-PX酶活力单位(U)。
脂肪酶(Lipase,LPS)活力定义为:在37℃条件下每克组织蛋白在本反应体系中与底物反应1分钟,每消耗1μmol底物为一个LPS酶活力单位(U)。
淀粉酶(Amylase,AMS)活力定义为:在37℃条件下每毫克组织蛋白与底物作用30 min,水解10 mg淀粉定义为一个AMS酶活力单位(U)。
胃蛋白酶(Pepsin,PPS)活力定义为:在pH为8.0、37℃条件下每毫克组织蛋白中含有的胃蛋白酶每分钟使吸光度变化0.003即为一个PPS酶活力单位(U)。
胰蛋白酶(Trypsin,TPS)活力定义为:在pH为8.0、37℃条件下每毫克组织蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为一个TPS酶活力单位(U)。
1.3 数据处理
运用Excel和SPSS 17.0软件对试验数据进行统计和处理,用单因素分析法(One-way ANOVA)进行方差分析,用Duncan法进行多重比较。试验结果均用平均值±标准差(mean±S.D.)表示,显著性水平设为0.05。
2 结果与分析
2.1 盐度对长江刀鲚幼鱼肝脏组织中免疫酶活力的影响
从图1可见:长江刀鲚幼鱼肝脏组织中ACP活力约为AKP活力的2倍;当盐度为15时,ACP和AKP活力分别处于最低值,当盐度为18时,ACP活力显著高于其他盐度组(P<0.05)。

图1 盐度对长江刀鲚幼鱼肝脏组织中水解免疫酶活力的影响Fig.1 Effect of salinity on activities of immune enzymes in the liver of esturarine tapertail anchovy Coilia nasus
从图2可见:长江刀鲚幼鱼肝脏组织中SOD和CAT活力的变化趋势相似,与GSH-PX活力的变化趋势正好相反;GSH-PX活力随盐度的变化先降后升再降,盐度为3时,GSH-PX活力最大(23.76 U/mg);SOD活力随盐度的变化先升后降再升,盐度为6时,SOD活力最大(20.71 U/g),盐度为15时,SOD活力最小(15.21 U/mg)且显著低于其他盐度组(P<0.05);CAT活力随盐度的变化先升后降再升,但盐度对肝脏组织CAT活力无显著性影响(P>0.05),盐度为6时,CAT活力最大(21.97 U/mg)。

图2 盐度对长江刀鲚幼鱼肝脏组织中非特异性抗氧化酶活力的影响Fig.2 Effect of salinity on activities of non-specific antioxidant enzymes in the liver of esturarine tapertail anchovy Coilia nasus
2.2 盐度对长江刀鲚幼鱼消化酶活力的影响
2.2.1 淀粉酶 从图3可见:相同盐度下,不同消化组织的AMS活力总体上为肠>盲囊>胃;当盐度为9~18时,盐度对不同消化组织AMS活力的影响趋势相同,即先降后升再降;盐度为12时,各消化组织AMS活力均处于较低水平,盐度为15时,各消化组织AMS活力整体处于相对较高水平。
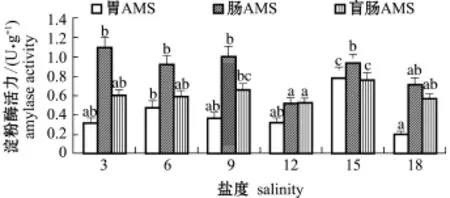
图3 盐度对长江刀鲚幼鱼消化组织中淀粉酶活力的影响Fig.3 Effect of salinity on activity of am ylase in digestive organs of esturarine tapertail anchovy Coilia nasus
2.2.2 蛋白酶 从图4可见:相同盐度下,不同组织中蛋白酶活力总体上为肠>盲囊>胃;不同盐度对肠TPS的活力影响波动幅度小于盲囊TPS、胃PPS,只有盐度为9时,肠TPS活力显著高于除对照组(盐度3)之外的其他盐度组(P<0.05)。
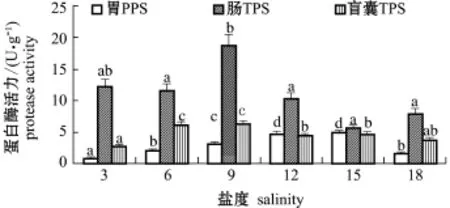
图4 盐度对长江刀鲚幼鱼消化组织中蛋白酶活力的影响Fig.4 Effect of salinity on activity of protease in digestive organs of esturarine tapertail anchovy Coilia nasus
2.2.3 脂肪酶 从图5可见:相同盐度下,胃组织中LPS活力明显低于盲囊和肠组织;当盐度为3~12时,盐度对肠和盲囊LPS的活力影响相同,即先降后升再降;不同盐度对盲囊LPS的活力影响波动幅度小于肠LPS和胃LPS,只有在盐度为9时,盲囊LPS活力显著高于其他盐度组(P<0.05)。
3 讨论
3.1 盐度对长江刀鲚幼鱼非特异性水解免疫酶的影响
ACP和AKP是免疫防御体系中比较重要的水解酶[14],也是巨噬细胞溶酶体酶的重要代谢调控酶,在体内负责磷酸集团的转移和代谢,在免疫反应中发挥作用[15-16]。本试验中低盐胁迫显示:当盐度为15时,肝脏组织ACP和AKP活力分别处于最低值;盐度为3~15时,各盐度组ACP活力无显著性差异,长江刀鲚幼鱼能够适应低盐度的胁迫;而当盐度升高为18时,ACP和AKP活力显著升高。这可能与长江刀鲚长期在自然状态下形成的生活史有关,即在洄游过程中能较好地适应低盐度的变化,且盐度为15时更接近长江刀鲚幼鱼的等渗点盐度。

图5 盐度对长江刀鲚消化组织中脂肪酶活力的影响Fig.5 Effect of salinity on activity of lipase in digestive organs of esturarine tapertail anchovy Coilia nasus
3.2 盐度对长江刀鲚幼鱼非特异性抗氧化免疫酶的影响
肝脏是鱼类重要的新陈代谢器官,参与鱼体中抗氧化、糖原合成、分泌胆汁等重要生理过程[6]。测定抗氧化酶活力一般选取肝脏或者血液[17],当盐度偏离鱼类的等渗点时,鱼体受应激反应而产生过多的活性氧自由基,而抗氧化酶(SOD、CAT和GSH-PX)活力增强有助于清除这些氧自由基[10]。SOD是一种重要的抗氧化酶,能将机体内O-2·转化成H2O2和O2,而CAT和GSH-PX与SOD具有协同作用[18-19],还可以将H2O2分解为H2O和O2[20]。SOD活力越高,表明有待消除的氧自由基越多,则越需要增强CAT和GSH-PX活力来分解H2O2。本试验中发现,随着盐度的升高,SOD和CAT活力变化趋势相似,与GSH-PX活力变化趋势相反。这可能是由于CAT与GSH-PX在参与H2O2分解过程中有拮抗作用,不同盐度下这两类酶活力优势不一致。余燕等[17]对点带石斑鱼幼鱼抗应激酶进行低盐度胁迫研究时,SOD、CAT和GSH-PX活力的变化趋势也是前两者相似而与后者者相反,这一结果与本试验结果相似。本试验中,盐度为3或15时,SOD和CAT活力与其他盐度组相比相对较低。盐度对长江刀鲚幼鱼CAT活力无显著性影响,这与王帅等[21]的相关研究结果一致。
3.3 盐度对长江刀鲚幼鱼消化酶的影响
细胞外的渗透压主要是由鳃和皮肤从外界环境主动吸收或排除Na+和Cl-而实现[22],而离子的主动吸收需要消耗能量[23]。受这两方面的影响,鱼体的消化能力会随着盐度的升高而下降。从本试验结果看,随着盐度的升高,AMS和蛋白酶的活力总体呈现下降趋势,而LPS则呈现小幅上升趋势。而对洄游性水产动物,特别是具有广盐性生理调节机制的太平洋鲑鱼类,盐度作用表现出的结果有较大的个体差异[24]。本试验中,不同组织中的AMS活力在盐度15时明显上升,各消化组织AMS活力整体处于相对较高水平。不同盐度对肠TPS活力的影响波动幅度小于盲囊TPS、胃PPS,对盲囊LPS活力影响的波动幅度小于肠LPS和胃LPS,只有在盐度为9时,肠TPS和盲囊LPS的活力较其他盐度组有显著性影响(P<0.05)。相同盐度下,长江刀鲚幼鱼不同组织消化酶活力总体从强到弱依次为肠>盲囊>胃。由此推测,长江刀鲚幼鱼酶液消化能源物质,可能主要以肠道和盲囊组织为主。
[1] 魏广莲,徐钢春,顾若波,等.刀鲚的生物学及人工养殖研究进展[J].长江大学学报:自然科学版,2012,7(9):31-35,41.
[2] 施永海,张根玉,张海明,等.刀鲚的全人工繁殖及胚胎发育[J].上海海洋大学学报,2015,24(1):36-43.
[3] De Silva S S,Perera P A B.Studies on the young grey mullet,Mugil cephalus L.:1.effects of salinity on food intake,growth and food conversion[J].Aquaculture,1976,7(4):327-338.
[4] 温海深.水产动物生理学[M].青岛:中国海洋大学出版社,2009:250-284.
[5] 马洪明,刘晓伟,麦康森,等.盐度突降对栉孔扇贝(Chlamys farreri)抗病力指标的影响[J].高技术通讯,2006,16(7):746-751.
[6] 房子恒,田相利,董双林,等.不同盐度下半滑舌鳎幼鱼非特异性免疫酶活力分析[J].中国海洋大学学报,2014,44(5):46-53.
[7] Winston GW,Di Giulio R T.Prooxidant and antioxidantmechanisms in aquatic organisms[J].Aquatic Toxicology,1991,19(2):137-161.
[8] 罗鸣钟,关瑞章,靳恒.盐度对花鳗鲡和太平洋双色鳗鲡幼鳗生长性能及消化酶活力的影响[J].水生生物学报,2015,39(4):653-660.
[9] 郑慧,李彬,荣小军,等.盐度和溶解氧对刺参非特异性免疫酶活性的影响[J].渔业科学进展,2014,35(1):118-124.
[10] 郭黎,马爱军,王新安,等.盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响[J].大连海洋大学学报,2012,27(5):422-428.
[11] 陈品健,王重刚,郑森林.盐度影响真鲷幼鱼消化酶活力的研究[J].厦门大学学报:自然科学版,1998,37(5):754-756.
[12] 李希国,李家儿,区又君.盐度对黄鳍鲷幼鱼消化酶活性的影响及消化酶活性的昼夜变化[J].海洋水产研究,2006,27(1):40-45.
[13] 庄平,章龙珍,田宏杰,等.盐度对施氏鲟幼鱼消化酶活力的影响[J].中国水产科学,2008,15(2):198-203.
[14] 孙虎山,李光友.脂多糖对栉孔扇贝血清和血细胞中7种酶活力的影响[J].海洋科学,1999(4):54-57.
[15] 郑萍萍,王春琳,宋微微,等.盐度胁迫对三疣梭子蟹血清非特异性免疫因子的影响[J].水产科学,2010,29(11):634-638.
[16] 宋林生,季延宾,蔡中华,等.温度骤升对中华绒螯蟹(Eriocheirsinensis)几种免疫化学指标的影响[J].海洋与湖沼,2004,35(1):74-77.
[17] 余燕,徐维娜,刘兆普,等.低盐度胁迫对点带石斑鱼幼鱼消化酶、抗应激酶和存活率的影响[J].渔业科学进展,2009,30(4):21-26.
[18] 李桂峰,钱沛锋,孙际佳,等.维生素C对胡子鲶血清免疫相关酶活性的影响[J].大连水产学院学报,2004,19(4):301-305.
[19] 陈迪,王连生,徐奇友.α-酮戊二酸对杂交鲟肠道形态、消化酶活力和抗氧化能力的影响[J].大连海洋大学学报,2015,30(4):363-368.
[20] FilhoDW,BoverisA.Antioxidantdefencesinmarinefish-II.elasmobranchs[J].ComparativeBiochemistryandPhysiology.Part C:Pharmacology,ToxicologyandEndocrinology,1993,106(2):415-418.
[21] 王帅,高如承,温扬敏,等.盐度突变对中国血蛤非特异性免疫酶活性的影响[J].江苏农业科学,2008(5):213-215.
[22] PillaiBR,DiwanAD.Effectsofacutesalinitystressonoxygen consumptionandammoniaexcretionratesofthemarineshrimp Metapenaeusmonoceros[J].JournalofCrustaceanBiology,2002,22(1):45-52.
[23] 王瑞芳,庄平,黄晓荣,等.渗透胁迫对中华绒螯蟹胚胎生化组成及消化酶活性的影响[J].中国水产科学,2013,20(2):299-307.
[24] 尾崎久雄.鱼类消化生理(下)[M].李爱杰,沈宗武,译.上海:上海科学技术出版社,1985:548-551.
Effectsofsalinityonactivitiesofnon-specificimmuneanddigestive enzymesinjuvenileestuarinetapertailanchovyCoilianasus
DENGPing-ping,SHIYong-hai,WANGYang,XUJia-bo,XIEYong-de,LIUYong-shi,SHUIChun
(ShanghaiFisheriesResearchInstitute,Shanghai200433,China)
Anexperimentwasconductedtoinvestigateeffectsofvarioussalinitiesonactivitiesofnon-specificimmuneanddigestiveenzymesinliver,stomach,intestineandcaecumofjuvenileestuarinetapertailanchovyCoilia nasus(bodyweight2.12g±0.88g).Juvenileestuarinetapertailanchovywithbodyweightof(2.12±0.88)gwas rearedina1ttankatarateof50fishatasalinityof3,6,9,12,15and18for55dayswithtriplication.Results showedthatthereweretheminimalactivitiesofacidphosphatase(ACP)(104.77U/g)andalkalinephosphatase(AKP)(60.72U/g)inliverofthefishatasalinityof15,significantlyhigherACPactivityinliveratasalinityof 18thanatothersalinities(P<0.05).Thesametrendwasobservedinthechangesinactivitiesofsuperoxidedismutase(SOD)andcatalase(CAT)asthesalinitywaselevated,whiletheoppositecasewasfoundinactivityof glutathioneperoxidase(GSH-PX),withoutsignificantdifferenceinCATactivity.Therewerehigheractivitiesof amylase(AMS),lipase(LPS)andtrypsin(TPS)inintestinethaninstomachandcaecum,significantlylowerLPS activityinstomachthaninintestineandcaecum,withthemaximalactivitiesofLPSincaecumandofTPSinintestineatasalinityof9(P<0.05).Atthesamesalinity,theorderofamylaseactivitywasrangedindescendingorder asintestine>caecum>stomach,andtherelativelyloweramylaseactivitiesindifferentdigestiveorganswereobserved atasalinityof12andhigheratasalinityof15,indicatingthat12-15isoftheoptimalsalinityforjuvenileestuarinetapertailanchovy.
Coilianasus;salinity;non-specificimmuneenzyme;digestiveenzyme
S917.4
A
10.16535/j.cnki.dlhyxb.2016.05.011
2095-1388(2016)05-0533-05
2016-02-15
上海市科委重点科技公关项目(11391901300);科技部与上海市共同重大任务科研专项(12dz1909302);上海市青年成长计划项目[沪农青字(2014)第3-3号]
邓平平(1986—),男,工程师。E-mail:kokou365@sohu.com
施永海(1975—),教授级高工。E-mail:yonghais@163.com

