黑麦草根际铁载体产生菌WN-H3的分离鉴定及其产铁载体培养条件的优化
陈伟 舒健虹 陈莹 曾庆飞 王小利 陆瑞霞 付薇
(贵州省草业研究所,贵阳 550009)
黑麦草根际铁载体产生菌WN-H3的分离鉴定及其产铁载体培养条件的优化
陈伟 舒健虹 陈莹 曾庆飞 王小利 陆瑞霞 付薇
(贵州省草业研究所,贵阳 550009)
从黑麦草(Lolium perenne L.)根际土壤中分离得到28份菌株,采用刃天青(chrome azural S,CAS)平板检测法定性、定量筛选出1株产铁载体能力较强的细菌WN-H3,经过菌落形态、生理生化特征、16S rDNA序列同源性和系统发育分析,初步判断为一株弗村假单胞菌(Pseudomonas vranovensis)。在摇瓶水平上采用单因子法分别研究了铁载体合成菌株WN-H3的碳、氮源利用效果及培养温度、摇床转速、培养基初始pH值等因素对菌株生长及铁载体合成能力的影响,最终优化得到铁载体产生菌的最佳发酵条件:蔗糖10 g/L,酵母浸出粉5 g/L,NaCl 5 g/L,温度28℃,转速180 r/min,pH7.5,该条件下培养48 h后菌株WN-H3产生的铁载体活性su值可达80.4%。实验表明,优化后的培养条件更利于铁载体产生菌的生长和铁载体合成。
铁载体产生菌;筛选;鉴定;条件优化
DOI:10.13560/j.cnki.biotech.bull.1985.2016.10.027
铁元素是作物生长必需的营养元索之一,是叶绿素合成所必需的,也是与呼吸作用有关的细胞色素氧化酶与过氧化酶的组成成分,参与植物体内众多氧化还原的过程[1]。随着作物品种的更换,大量氮、磷、钾无机化肥的施用,作物相继出现缺铁现象,其中缺铁对生长在碱性土壤上的植物表现较明显[2-5]。全世界具有潜在性缺铁的土壤占世界耕地面积的40%。植物缺铁是世界各地农业生产所面临的一个普遍问题,土壤中的铁在一般情况下均会氧化为溶解性极差的氧化铁或沉淀为氢氧化铁,使植物难于吸收利用[6]。
铁载体是包括细菌和真菌在内的,几乎所有好氧和兼性厌氧的微生物在铁胁迫条件下向环境分泌对Fe3+具有极高亲和力的小分子量铁螯合物,这些化合物协助微生物从环境中获取必需的铁元素[7]。在铁缺乏时,微生物在体内产生特异的铁载体,与Fe3+形成紧密的可溶复合物;同时在革兰氏阴性菌(G-)的细胞外膜上产生受体蛋白,即铁受体蛋白,特异识别Fe3+铁载体并把Fe3+运输到细胞内[8]。现在的一些研究表明,铁载体不仅对微生物的铁营养至关重要,而且它是根际促生细菌(PGPR)抑制土壤病害的重要机制[9-11],另外,铁载体还在某些动植物病原菌的致病性等诸多方面起着作用[12]。这些具有铁载体合成能力的微生物通过竞争铁元素,不仅能够改善自身的营养状况,还能够供给植物铁营养或通过与植物病原菌竞争铁营养达到生物防治的作用[13]。
目前,国内外对铁载体合成细菌的研究主要集中在玉米、水稻、小麦、棉花等大宗作物[14-16],利用产铁载体细菌提高牧草根际及周围土壤Fe3+利用率的研究鲜见报道。本研究以贵州适生牧草黑麦草为实验材料,采用CAS蓝色检测平板、定性定量法,结合菌落形态、生理生化分析,筛选鉴定出铁载体螯合能力较强的菌株,并对产铁载体培养条件进行优化,以期研究其根际铁载体分泌细菌动态变化,为进一步挖掘牧草根际铁载体细菌产铁载体潜力,并为贵州石灰性土壤缺铁问题的改善提供技术支撑。
1 材料与方法
1.1材料
1.1.1菌株采集 2014年4月,于威宁(海拔2 100m,年降雨量950 mm)、兴仁(海拔1 963 m,年降雨量1 320.5 mm)、独山(海拔970 m,年降雨量1 346.3 mm)、贵阳(海拔1 056 m,年降雨量1 124mm)4个牧草实验地中,选取长势较为旺盛的多年生黑麦草植株,去除表层土壤和杂物,采集其土层深度15 cm的根际土样,去除根系上附着的大土粒,用无菌的毛刷将根上粘着的细土扫落到无菌袋后封口,贴上标签,然后将土样用冰盒迅速带回实验室进行根际土壤细菌的分离。
1.1.2培养基及铁载体检测液 铁载体检测CAS染液:将0.079 g CAS(铬天青)溶于50 mL去离子水中,再加入10 mL 1 mmol/L FeCl3溶液(含12 mmol/L HCl),溶液A。将0.069 g十六烷基三甲基溴化铵(HDTMA)溶于40 mL的去离子水中,得溶液B。将A溶液沿烧杯壁缓缓加入B溶液中,搅拌混匀即得100 mL CAS蓝色检测液。0.1 mol/L磷酸盐缓冲液(pH6.8):每100 mL含Na2HPO4·12H2O 2.427 g,NaH2PO4·2H2O 0.590 5 g,KH2PO40.075 g,NH4Cl 0.250g,NaCl 0.125 g,使用时稀释10倍。
CAS培养基[17]:每100 mL含20%蔗糖溶液1 mL,10%酸水解酪素3 mL,1 mmol/L CaCl2100 μL,1 mmol/L MgSO42 mL,琼脂1.8 g,在约60℃时缓慢加入磷酸盐缓冲液和CAS染液各5 mL,即得CAS蓝色培养基。
MKB液体培养基:酪蛋白氨基酸5.0 g,甘油15 mL,K2HPO42.5 g,MgSO4·7H2O 0.2 g,蒸馏水1 000 mL,pH7.2。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂1.8 g,蒸馏水1 000 mL。
1.1.3产铁载体细菌 产铁载体菌株HMGY6B、GY4A分离自贵州省草业研究所贵阳实验基地,经形态学、分子学等方法鉴定,现保存于贵州省草业研究所分子生物学实验室。
1.2方法
1.2.1黑麦草根际产铁载体细菌的分离纯化与定性检测 参照文献[18]称取鲜土样10 g溶于100 mL已经灭菌的去离子水中,并置于摇床上在28℃ 145r/min的速度下摇30 min,进行稀释。吸取上清液50 μL均匀涂抹在CAS平板上,置于28℃培养箱,培养48 h。菌落表面比较光滑,菌落大而黏稠的菌落接种在CAS检测平板上进行纯化与鉴定,纯培养物保存在LB斜面上和甘油管以备菌种鉴定。将细菌纯培养物接种到CAS检测平板上,28℃培养48 h,经过培养的CAS检测平板上,分泌铁载体的细菌菌落周围会出现明显的橙黄色晕圈,记录橙黄色晕圈产生的时间、大小、颜色、形态特征。同时,通过计算晕圈比例即可溶性指数[19],对其分泌铁载体能力进行比较分析,以定性筛选铁载体能力强的菌株。
1.2.2黑麦草根际产铁载体细菌定量筛选 挑取晕圈比较明显的菌落,接种于MKB液体培养基中发酵培养,28℃,150 r/min振荡培养48 h,然后将菌悬液8 000 r/min离心15 min后得到细菌发酵上清液,分别取发酵上清液与CAS检测液各3 mL充分混匀,静置1 h后采用721型分光光度计在630 nm波长处测定吸光值(As),并取双蒸水作对照调零,另取3mL CAS检测液与3 mL未接种的MKB液体培养基上清液充分混匀,同上测定吸光值即为参比值(Ar)。按照Machuca和Miliagres[20]的方法计算铁载体活性单位(su),su=[(Ar-As)/ Ar]×100,筛选铁螯合能力强的菌株。
1.2.3黑麦草根际产铁载体细菌鉴定
1.2.3.1铁载体细菌培养性状观察 将细菌分别接种在LB平板和斜面培养基上,置于28℃恒温箱中,培养48 h后,观察描述其菌落质地、形状和大小、边缘、表面、隆起形状、透明度、菌落及培养基的颜色等培养性状。
1.2.3.2生理生化鉴定 测定方法参照常用细菌鉴定手册[21],对筛选出的铁载体细菌进行相应的生理生化检测。
1.2.3.316S rDNA序列分析 采用16S rDNA扩增通用引物27F/1495R,以菌株总DNA为模板进行扩增,测得的序列与GenBank中已有的16S rDNA序列进行同源性比对,用Mega 2法构建系统进化树。
1.2.4黑麦草根际产铁载体培养条件优化
1.2.4.1摇床发酵条件[22]用接种环从斜面菌种上取适量菌体,接种于装有50 mL培养基的250 mL三角瓶中,在145 r/min,28℃条件下,摇床振荡培养24 h,以10%(V/V)的接种量接种到装有50 mL发酵培养液的250 mL三角瓶中,使其OD630值在0.1左右,同样条件下振荡培养48 h,此培养条件是进行一下培养基优化实验的基础。
1.2.4.2碳源和氮源的筛选[22]在LB液体培养基的基础上首先对10 g/L的碳源(葡萄糖、蔗糖、乳糖、可溶性淀粉、麦芽糖)和0.5 g/L的氮源(硫酸铵、草酸铵、硝酸铵、氯化铵、柠檬酸铵)进行筛选。菌株在LB斜面上活化24 h后,制成菌悬液(浓度约为109cell/mL,OD值1.0),按菌悬液与添加碳源、氮源的LB液体培养基1∶100接种,即每100 mL培养基接菌悬液1 mL,每菌株3次重复,培养48 h,测定OD630,以不接菌空白MKB液体培养基为对照,按照1.2.4.1步骤,获得发酵上清液,用蒸馏水洗涤3次,计算铁载体活性单位。
1.2.4.3培养基组成的优化[22]确定最优碳氮源剂量后,采用逐个单因子法研究培养温度(14℃、21℃、28℃和37℃)、摇床转速(120、150、180和210 r/min)、培养基初始pH值(6.5、7.5、8.5和9.5)对菌株生长及铁载体合成能力的影响,最终筛选得到最适菌株铁载体合成的培养基条件,并以铁载体菌株HMGY6B、GY4A进行培养条件验证。
2 结果
2.1黑麦草根际铁载体细菌分离纯化与定性检测
CAS培养基培养48 h后,部分细菌周围出现明显橙黄色晕圈,依据细菌形态、颜色、大小,挑选出28株菌株,继续接种于CAS培养基,经过连续4代养后,得到4株产铁载体能力较强的菌株(图1),4份菌株第3天菌落直径大小约1.01-1.26 cm、颜色乳白或淡粉色,可溶性指数2.44-4.52(表1)。可溶性指数由大到小依次为WN-H3>DS-H5>GYH1>DS-H2。
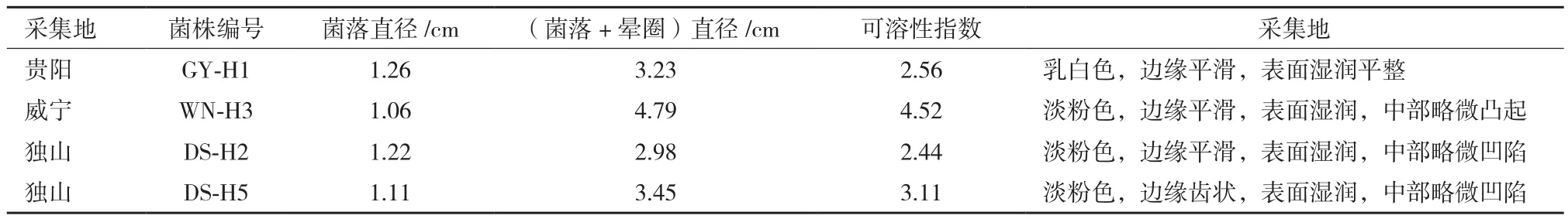
表1 产铁载体细菌菌落大小、晕圈直径
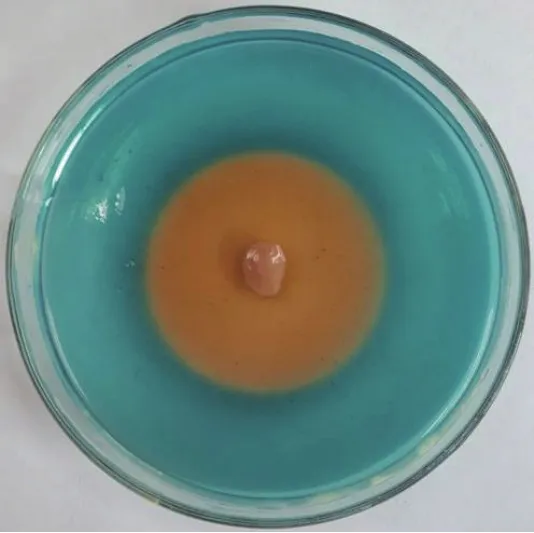
图1 菌株WN-H3纯化与CAS检测筛选
2.2黑麦草根际铁载体细菌定量筛选
在MKB液体培养基中培养48 h检测4份菌株铁载体产生能力,检测结果如表2所示。细菌培养液样品受外界环境影响pH变化较大,为了避免CAS检测液的吸收值因pH变化造成偏差,铁载体的定量检测可以通过As/Ar值的降低来衡量。如表2所示,4份菌株中WN-H3菌株的As/Ar值最低为0.26,铁载体活性单位su值为74.3%,依据Manjanatha等对细菌产铁载体能力划分,As/Ar从1.0-0之间以0.2为间隔,每减少0.2增加一个“+”,该菌株分泌铁载体的能力为“++++”,由此表明WN-H3为一株产铁载体能力较强的菌株。
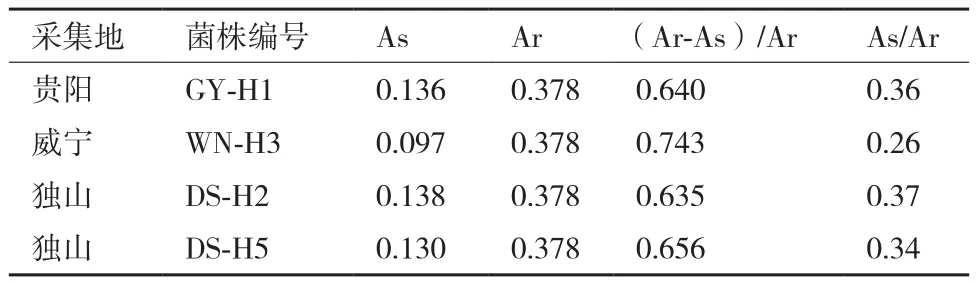
表2 4份菌株在630 nm波长处的吸光值及铁载体活性单位
2.3黑麦草根际产铁载体菌株鉴定
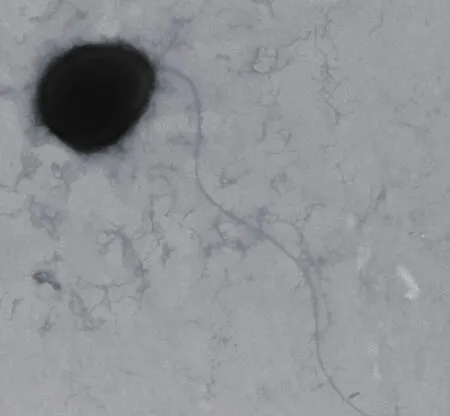
图2 WN-H3在扫描电镜下的形态特征(5 000×)
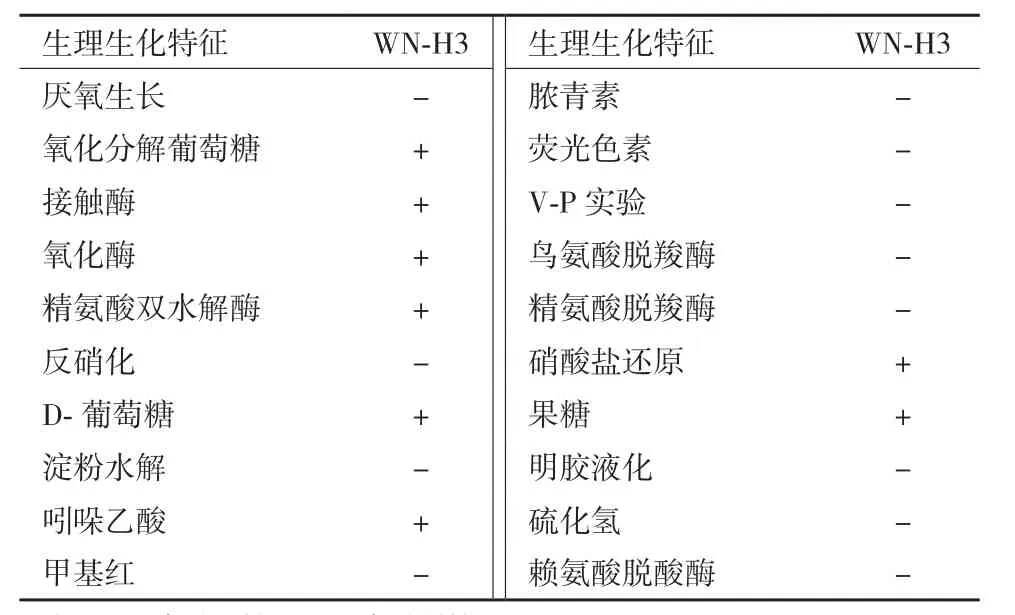
表3 菌株WN-H3生理生化特征鉴定
2.3.1菌落形态、电镜扫描及生理生化鉴定 WN-H3菌落较小、淡粉色、表面光滑半透明、有光泽、边缘整齐、中部略微凸起。WN-H3革兰氏染色阴性,近圆形的短杆状,短径0.5-1 μm,长径0.8-1.5 μm,具端鞭毛,运动,不产芽孢(图2)。最适生长温度为26℃-35℃,在4℃仍然可以生长,而41℃无法生长,最适生长pH值为6.2-7.8。生理生化特征如表3,鉴定结果与弗村假单胞菌(Pseudomonas vranovensis)较为一致。
2.3.2菌株WN-H3的16S rDNA序列分析 以WN-H3菌株总DNA为模板,对其16S rDNA全基因进行测序,得到总长为1 242 bp的16S rDNA序列。将WN-H3的16S rDNA序列在BLAST中进行对比并构建系统发育树(图3),发现WN-H3与有效发表菌株Pseudomonas vranovensis strain T-16(HQ202845)和Pseudomonas vranovensis strain T-26(HQ202851)聚在同一小枝上,与P. vranovensis strain T-16(HQ202845)同源相似性为99.3%,与P.vranovensis strain T-26(HQ202851)同源相似性为99.1%;结合菌落菌体特征、生理生化指标,初步判断WN-H3可能与Pseudomonas vranovensis strain T-16(HQ202845)和Pseudomonas vranovensis strain T-26(HQ202851)属同一物种,为一株弗村假单胞菌P. vranovensis。但因WN-H3与其他P. vranovensis菌株遗传距离较远,并未聚在同一大类,其间还聚有P. asplenii、P. putida、P. fluorescens等其它菌株,因此其明确的分类地位有待进一步研究。
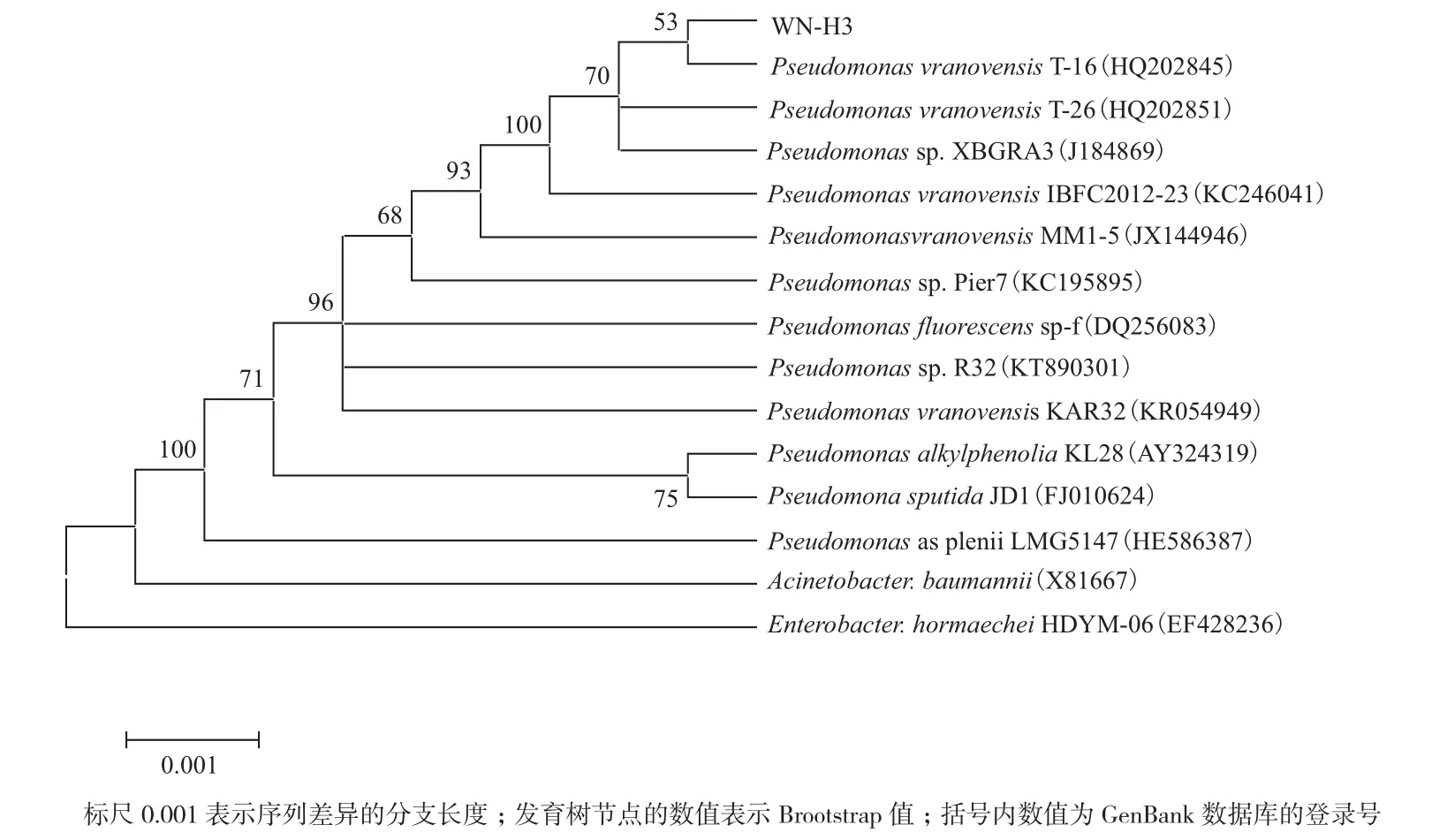
图3 菌株WN-H3的系统进化树
2.4产铁载体细菌培养条件优化
2.4.1碳源对菌株WN-H3生长及铁载体合成的影响 菌体和铁载体合成的能量来源及碳骨架主要是碳元素,本实验以10 g/L的葡萄糖、蔗糖、乳糖、可溶性淀粉、麦芽糖替代蛋白胨研究碳源对菌株WN-H3生长及产铁载体的影响。结果(表4)显示,以乳糖、麦芽糖为碳源的培养基中,菌株WN-H3不能够生长,在葡萄糖、可溶性淀粉作为碳源的培养基中生长缓慢,前者产生较少量铁载体,后者无法合成铁载体。在蔗糖为碳源的培养基中菌株生物量增加快速,培养48 h后OD630可达1.784,铁载体合成量达到最大值su=76.9%。
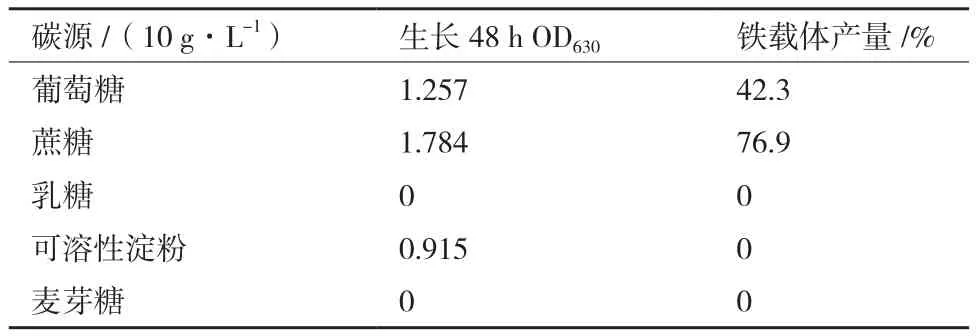
表4 不同碳源对菌株WM-H3生长及铁载体合成的影响
2.4.2氮源对菌株WN-H3生长及铁载体合成的影响 氮源是合成细菌蛋白质、核酸等含氮物质和铁载体的来源。本实验利用0.5 g/L的硫酸铵、草酸铵、硝酸铵、氯化铵、柠檬酸铵替代酵母浸出粉研究了菌株WN-H3对氮源的利用效果。WN-H3在无机氮培养基中几乎不生长,培养48 h后菌体生物产量仍然很低,铁载体无法合成,推测菌株WN-H3的生长和铁载体的合成与酵母浸出粉中的多种生长刺激因子以及蛋白胨中各种营养元素有关,因此培养基继续使用5 g/L酵母浸出粉。
2.4.3培养温度对菌株WN-H3生长及铁载体合成的影响 在不同培养温度下研究了菌株WN-H3生长及铁载体合成情况,结果如图4所示。当培养温度为28℃时,菌株WN-H3生长情况最好,且铁载体合成能力最强su值可达到78.8%。温度太低,菌体生长缓慢,在14℃时菌株WN-H3 OD630仅为0.506,su值低至37.8%,温度35℃时,OD630和su值也仅分别为0.902和52.1%。由此可见,菌株生长及铁载体合成的最佳温度为28℃。
2.4.4转速对菌株WN-H3生长及铁载体合成的影响 在250 mL三角瓶中装50 mL培养液,考察不同摇床转速对菌株生长和产铁载体能力的影响(图5)。当摇床转速达180 r/min时,菌株WN-H3生长情况最好,OD630高达1.901,铁载体合成能力最强su值可达到76.5%,在120、150和210 r/min转速下,各菌液OD630分别为1.128、1.678和1.690,铁载体活力su值分别为69.7%、72.3%和62.7%,各转速之间差异较小,由此可见转速对铁载体的生长和铁载体的合成影响不大。
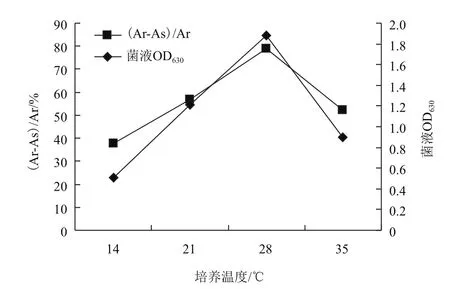
图4 培养温度对菌株WN-H3生长及铁载体合成的影响

图5 摇床转速对菌株WN-H3生长及铁载体合成的影响
2.4.5初始pH对菌株WN-H3生长及铁载体合成的影响 为了研究初始pH值对菌株生长和产铁载体能力的影响,设置了6.5、7.5、8.5和9.54的pH值。结果(图6)显示,在pH值为7.5时,菌株生长能力及铁载体合成效果最好,OD630高达2.061,铁载体合成能力最强su值可达到78.3%,其次是pH6.5时,OD630达1.64,铁载体合成su值为71.1%,尽管pH在8.5和9.5时菌体能够较好的生长,但铁载体合成能力明显减弱,分别降低为60.3%和57.6%,因此将7.5定为该菌株最佳的生长及产铁载体pH值。
2.4.6铁载体合成最佳培养条件验证 综合以上优化实验,筛选得到铁载体菌株理论最佳培养条件:10 g/L蔗糖,5 g/L酵母浸出粉,5 g/L NaCl,pH值调至7.5,28℃温度下180 r/min培养。另以产铁载体菌株WN-H3、WN-H3、GY4A为实验菌株,分别接种于未优化的LB液体培养基和优化后的LB液体培养基内进行验证,培养2、4、6、8、10、12、14、16、18、20、24、36和48 h后取样,测定两种不同培养基内菌液OD630和铁载体活力su值。实验结果(图7,图8)显示,尽管3份菌株在两种培养基内进入对数生长的时间相差较小,均在8-24 h,但在优化后的培养基中,同一取样时间内3份菌株的OD630和铁载体活力su值均高于未优化的培养基,且铁载体的分泌时间提前,其中WN-H3在培养6 h即可达19%,16 h时已经高达71%,48 h时可达80.4%。而在未优化的培养基内,菌株WN-H3培养6 h铁载体量仅为11%,20 h时铁载体分泌量才能提高到70%以上。此外,菌株WN-H3和GY4A在培养6 h时的铁载体量达16.7%和17.3%,均高于未优化的培养条件。由此证明,通过优化实验,调整后的培养条件更利于铁载体产生菌的生长和铁载体的合成。
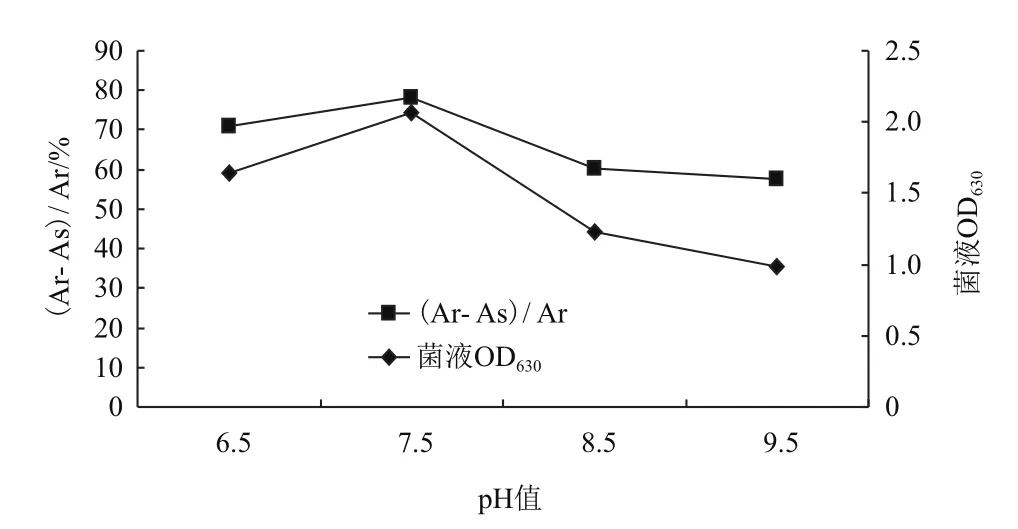
图6 初始pH值对菌株WN-H3生长及铁载体合成的影响
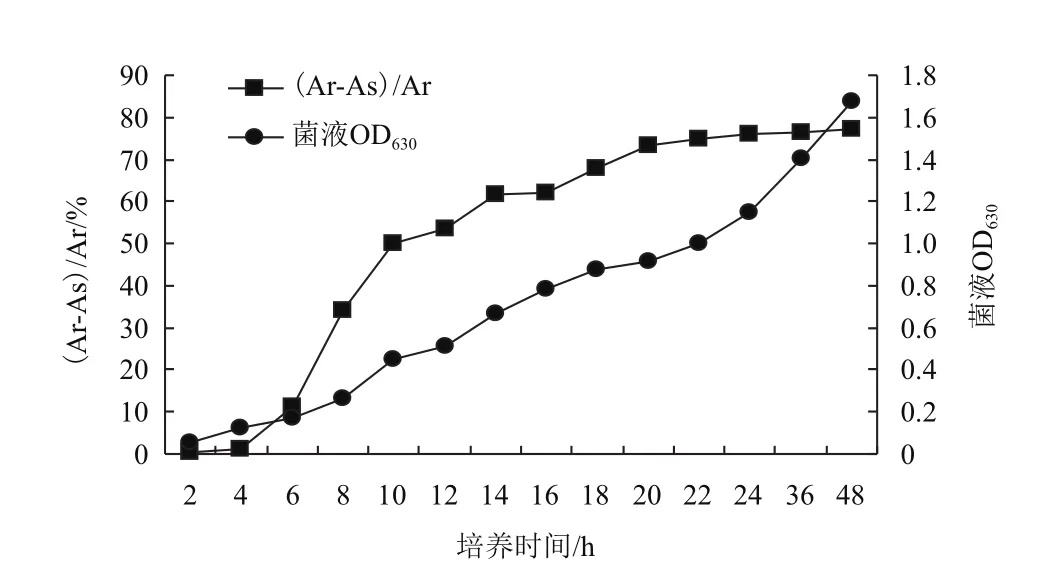
图7 菌株WN-H3在未优化培养条件下的生长曲线及铁载体分泌图
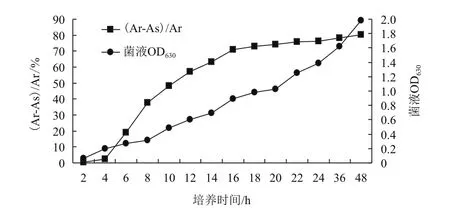
图8 菌株WN-H3在优化培养条件下的生长曲线及铁载体分泌图
3 讨论
近年来铁载体合成细菌的筛选鉴定主要为假单胞菌属荧光假单胞菌或恶臭假单胞菌,而在铁载体产生菌的筛选研究方面,Schwyn&Neilands提出的CAS法是目前应用最广泛的检测法。于素芳等[16]通过CAS法从棉花根际土壤中成功筛选出一株产铁载体能力较强的细菌菌株E19,并鉴定出该菌株为恶臭假单胞菌Pseudomonas putida。赵翔等[23]采用改进后的CAS法从东湖中筛选得到了一株产铁载体能力极高的荧光假单胞菌P. fluorescens。本研究通过CAS平板分离纯化、定性定量检测从贵州省威宁县黑麦草根际土壤里筛选得到一株铁载体产生能力较强的细菌WN-H3,形态及生理生化特征均与弗村假单胞菌P. vranovensis一致。BLAST比对结果发现,WN-H3与有效发表的弗村假单胞菌菌株P. vranovensis strainT-16(HQ202845)和P. vranovensis strain T-26(HQ202851)聚在同一小枝上,与两者同源相似性分别达99.3%和99.1%,结合菌落菌体特征、生理生化指标,初步判断WN-H3可能与Pseudomonas vranovensis strainT-16(HQ202845)和Pseudomonas vranovensis strain T-26(HQ202851)属同一物种,也为一株弗村假单胞菌P. vranovensis,但因WN-H3与其他P. vranovensis菌株遗传距离较远,并未聚在同一大类,其间还聚有P. asplenii、P. putida、P. fluorescens等其它菌株,因此其明确的分类地位有待进一步研究。
目前,国内外对弗村假单胞菌的研究利用十分少见。董立萍等[24]发现一株弗村假单胞菌,该菌具有溶磷功能,对铅污染土壤具有较好的修复功能,通过固定土壤中游离态的铅来有效抑制植物对重金属铅的吸收,同时还可以促进植物对土壤环境中营养物质的吸收,提高农作物的产量和质量。本实验研究所发现的该株弗村假单胞菌,具有较强的铁螯合能力,生长48 h后铁载体活力su值即高达78.6%,该菌株是否同时具有解磷功能将继续开展下一步研究。为了更好的发掘铁载体产生菌的产铁载体能力,本实验在摇瓶水平上采用单因子法分别研究了菌株WN-H3碳、氮源利用效果及培养温度、摇床转速、培养基初始pH值等因素对菌株生长及铁载体合成能力的影响,优化后的培养条件更利于铁载体产生菌的生长和铁载体合成。
现在的一些研究表明,铁载体不仅对微生物的铁营养至关重要,而且它是根际促生细菌(PGPR)抑制土壤病害的重要机制[7,17]。这些具有铁载体合成能力的微生物通过竞争铁营养,不仅能够改善自身的营养状况,还能够供给植物铁营养或通过与植物病原菌竞争铁营养达到生物防治的作用[9]。除生物防治作用外,铁载体能与重金属离子结合,形成金属—铁载体螯合物,提高植物根际环境中重金属的活性,增加植物对重金属的吸收和累积,提高植物修复的效率[25,26]。晋银佳[27]选取荧光假单胞菌(Pseudomonas fluorescence)作为代表微生物菌种,在培养液中添加该菌体后,采用砂基和水基方式培养的油麦菜中Cd的含量分别减少了27.23%-50.74%和10.57%-45.53%,表明微生物产生的铁载体能有效抑制油麦菜对Cd的吸收。
4 结论
结合菌株形态、生理生化特征、16S rDNA序列同源性和系统发育分析,将分离筛选得到的铁载体产生菌WN-H3鉴定为弗村假单胞菌P. vranovensis。该菌菌落较小,革兰氏染色阴性,最适生长温度为26-35℃。通过对碳、氮源利用效果及培养温度、摇床转速、培养基初始pH值等因素对菌株生长及铁载体合成能力的影响研究,最终优化得到铁载体产生菌的最佳发酵条件:蔗糖10 g/L,酵母浸出份5 g/L,NaCl 5 g/L,温度28℃,转速180 r/min,pH7.5,该条件下培养48 h后菌株WN-H3产生的铁载体活性su值可达80.4%。
[1]胡碧惠, 赵春贵, 杨素萍. 铁对产铁载体的沼泽红假单胞菌光合色素与铁载体合成的影响[J]. 微生物学报, 2014, 54(4):408-416.
[2]朱慧明, 张彦, 杨洪江. 高产铁载体假单胞菌的筛选及其对铁氧化物的利用[J]. 生物技术通报, 2015, 31(9):177-182.
[3]魏本杰, 曾晓希, 刘志成, 等. 产铁载体菌的筛选鉴定及活化镉的性能探究[J]. 环境科学与技术, 2014, 37(11):26-31.
[4]王英丽, 林庆祺, 李宇, 等. 产铁载体根际菌在植物修复重金属污染土壤中的应用潜力[J]. 应用生态学报, 2015, 24(7):2081-2088.
[5]肖艳红, 李菁, 刘祝祥, 等. 1株蛇足石杉根际铁载体细菌的分离、筛选与鉴定[J]. 微生物学杂志, 2013, 33(2):63-67.
[6]林天兴, 唐梅, 黄明远, 等. 高产铁载体棉田土壤细菌SS05的筛选与鉴定[J]. 微生物学通报, 2012, 39(5):668-676.
[7]Haas D, Défago G. Biological control of soil-borne pathogens by fluorescent Pseudomonads[J]. Nature Reviews Microbiology,2005, 3(4):307-319.
[8]Taghavi S, van der Lelie D, Hoffman A, et al. Genome sequence of the plant growth promoting endophytic bacterium Enterobacter sp. 638[J]. PLoS Genetics, 2010, 6(5):e1000943.
[9]Catara V. Pseudomonas corrugata:plant pathogen and/or biological resource?[J]. Molecular Plant Pathology, 2007, 8(3):233-244.
[10]Lodewyckx C, Vangronsveld J, Porteous F, et al. Endophytic bacteria and their potential applications[J]. Critical Reviews in Plant Sciences, 2002, 21(6):583-606.
[11]谢小军, 王敬国. 一株细菌儿茶酚型铁载体分泌的影响因素研究[J]. 微生物学通报, 2006, 33(1):105-109.
[12]Manninen M, Mattila-Sandholm T. Mmethods for the detection Pseudomonas siderophores[J]. Journal Microbiological Methods,1994, 19(3):223-234.
[13]Barzanti R, Ozino F, Bazzicalupo M, et al. Isolation and characterization of endophytic bacteria from the nickel hyperaccumulator plant Alyssum bertolonii[J]. Microbial Ecology, 2007, 53(2):306-316.
[14]朱彭玲, 杜秉海, 丁延芹, 等. 新疆棉花根际土壤铁载体产生菌的遗传多样性及系统发育研究[J]. 中国农业科学, 2009,42(5):1568-1574.
[15]何苗, 黄云, 王靖, 等. 桃树根际铁载体产生菌MX-26的分离鉴定及诱变选育[J]. 植物保护学报, 2011, 38(5):432-436.
[16]于素芳, 丁延芹, 姚良同, 等. 一株棉花根际铁载体产生菌E19的分离鉴定[J]. 生物技术, 2007, 17(6):19-21.
[17]Schwyn B, Neilands JB. Universal chemical assay for the detection and determination of siderophores[J]. Anal Biochem, 1987,160:47-56.
[18]席琳乔, 周斌, 刘婷. 铁载体合成细菌动态变化与初步鉴定研究[C]. 中国草原发展论坛文集, 2009.
[19]荣良燕, 姚拓, 赵桂琴, 等. 产铁载体PGPR菌筛选及其对病原菌的拮抗作用[J]. 植物保护, 2011, 37(1):59-64.
[20]Machuca A, Milagres AMF. Use of CAS-agar plate modified to study the effect of different variables on siderophore production by Aspergillus[J]. Lett Appl Microbiol, 2003, 36:177-181.
[21]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001.
[22]李俊峰, 李红芳, 姚淑敏, 等. J61321(Alteromonas aurantia)菌株产铁载体培养条件的研究[J]. 青岛科技大学学报:自然科学版, 2007, 28(1):20-24.
[23]赵翔, 陈绍兴, 谢志雄, 等. 高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f的筛选鉴定及其铁载体特性研究[J]. 微生物学报, 2006, 46(5):691-695.
[24]董立萍. 解磷菌修复土壤铅污染效应优化及机理探索[D].西安:西北大学, 2014:21-27.
[25]刘阿梅, 向言词, 田代科, 等. 生物炭对植物生长发育及重金属镉污染吸收的影响[J]. 水土保持学报, 2013, 27(5):193-198, 204.
[26]Shim J, Babu AG, Velmurugan P, et al. Pseudomonas fluorescens JH 70-4 promotes Pb stabilization and early seedling growth of Sudan grass in contaminated mining site soil[J]. Environmental Technology, 2014, 35(20):2589-2596.
[27]晋银佳, 刘文, 朱跃, 等. 荧光假单胞菌产铁载体对油麦菜吸收砂基和水基中镉的影响[J]. 环境工程学报, 2016, 10(1):415-420.
(责任编辑 马鑫)
Screening,Identification and Fermentation Condition Optimun of a Siderophore-producing Bacteria WN-H3 from Rhizosphere of Ryegrass
CHEN Wei SHU Jian-hong CHEN Ying ZENG Qing-fei WANG Xiao-li LU Rui-xia FU Wei
(Guizhou Institute of Prataculture,Guiyang 550009)
By mean of the chrome azural S(CAS)assay,a high-affinity siderophore- producing bacteria WN-H3 was screened out from 28 bacteria,which were isolated from the ryegrass(Lolium perenne L.)rhizosphere soil. According to morphological,biochemical and physiological characteristics,16S rDNA sequence and phylogenetic analysis,the strain was identified as Pseudomonas vranovensis. The optimal medium components(carbon and nitrogen sources)and growth conditions(temperature,rotation speed and initial pH)for siderphore production by strain WN-H3 were researched by one variable-at-a-time method. The result demonstrated that high siderophore production was yeilded at high siderophore- producing ability of 80.4% under the condition of 10 g/L sucrose,5 g/L yeast extracion,5 g/L NaCl,temperature 28℃,initial pH7.5,180 r/min.
siderophore-producing bacteria;screening;identification;condition optimun
2016-02-16
贵州省农业科学院研究生科研创新基金项目(黔农科合(创新基金)2011015号)
陈伟,男,助理研究员,研究方向:生物技术;E-mail:44075638@qq.com
付薇,女,硕士,副研究员,研究方向:牧草栽培及根际微生物;E-mail:494978600@qq.com

