马尾松人工林林窗内土壤动物作用下凋落叶C元素的动态变化
李 勋 刘 洋,2,3 张 艳 刘 华 杨万勤,2,3 张 健,2,3*
(1.四川农业大学林学院生态林业研究所,成都 611130; 2.生态林业工程重点实验室,成都 611130; 3.长江上游生态安全协同创新中心,成都 611130)
* 通信作者:E-mail:sicauzhangjian@163.com
马尾松人工林林窗内土壤动物作用下凋落叶C元素的动态变化
李 勋1刘 洋1,2,3张 艳1刘 华1杨万勤1,2,3张 健1,2,3*
(1.四川农业大学林学院生态林业研究所,成都 611130;2.生态林业工程重点实验室,成都 611130;3.长江上游生态安全协同创新中心,成都 611130)
土壤动物对凋落叶养分元素动态具有重要影响,但这种影响受控于凋落叶质量及环境条件。为了解不同大小林窗(G1:100 m2、G2:400 m2、G3:900 m2、G4:1 600 m2)内土壤动物对凋落叶中C元素季节动态的影响,采用凋落叶分解袋的方法,于凋落叶第一年分解的冬、春、夏、秋四个季节,研究了3.00和0.04 mm孔径凋落叶袋中长江上游马尾松人工林两种植物马尾松(Pinusmassoniana)、樟(Cinnamomumcamphora)凋落叶中的C元素动态特征。结果表明:土壤动物明显促进了2种凋落叶C的释放,且中型林窗(G3:900 m2)内凋落叶C损失率更高;不同季节土壤动物对凋落叶中C释放量的影响存在显著差异:土壤动物对凋落叶C释放的影响主要在春季和夏季,秋、冬两季部分林窗出现C富集现象;相对于针叶植物凋落叶,土壤动物对阔叶植物凋落叶中C元素动态的影响更为显著。这些结果说明中型林窗内土壤动物对凋落叶C释放有显著影响,在马尾松低效林改造过程中,可利用中型林窗这一显著作用,引入更容易被土壤动物分解的乡土阔叶树种樟,加速马尾松人工林的物质循环。
C元素动态;土壤动物;凋落叶分解;林窗;马尾松人工林
凋落叶分解是森林生态系统物质循环与能量流动的关键环节[1]。凋落物分解过程中释放的有机质在土壤不同元素的生物地球化学循环过程、微生物生长代谢过程、土壤固碳等方而具有重要作用[2~3]。森林生态系统碳储库包括土壤碳储库、植被碳储库和凋落物碳储库[4],我国森林生态系统总碳库为28.116Gt,凋落物层的碳储量为0.892Gt,占总量的3.2%[5]。相对于植被和土壤碳库,森林凋落物碳储量相对较小,在一些研究中常常被忽略[5]。土壤动物是凋落叶分解过程中重要的分解者,是凋落叶分解的关键生物因子,在凋落叶分解过程中具有极其重要的作用[6]。土壤动物能够加速有机物的分解和元素的转移,对凋落叶分解也有着重要的影响[7~8]。土壤动物通过对凋落叶的破碎、消化以及对微生物活性的刺激,在很大程度上控制落物的分解,而一些土壤动物种类的出现与消失或取食行为的变化又会改变分解过程中碎屑食物网结构[9~11]。研究表明,土壤生物群落对凋落叶分解具有重要贡献,但受到温度、降水等环境因子以及凋落叶质量的调控[12]。
马尾松(Pinusmassoniana)具有耐干旱瘠薄,适应能力强等特点,是我国长江上游低山丘陵区退耕还林的主要树种。由于长期采取单一树种纯林经营模式,林地出现地力衰退、森林生产力下降、物种多样性锐减、生态功能下降等现象[13]。目前,急需对长江上游现有的低效马尾松人工林林分结构进行调控,使其恢复生态系统功能,发挥生态效益。近年来,国内外关于马尾松低效人工林改造在营造混交林等方面已有较多报道[14~16]。采伐形成的林窗在人工林林分结构优化和调整上具有重要价值。与马尾松纯林相比,针阔混交林不仅能增加林地抗病防虫,针阔混交林还能显著增加有机质和土壤养分,防止地力衰退[17]。林窗的形成,导致林窗内的光环境、微地形、温湿度和土壤理化性质等发生变化,因此林窗形状、大小的不同,表现出不同的微环境特征[18]。研究发现[19~23],林窗的形成会影响土壤动物群落结构和多样性,但哪种林窗面积下土壤动物对凋落叶C动态的影响更大,目前还没有明确的结论。因此,本文以四川宜宾来复镇马尾松人工林4个不同面积林窗为研究对象,通过引种乡土阔叶树种樟(Cinnamomumcamphora),形成斑块状混交人工林,研究不同大小林窗下针叶(马尾松)和阔叶(樟)凋落叶四个季节的分解特征,为深入认识人工林生态系统物质循环过程,探索马尾松人工纯林的林窗改造效应,提高其整体服务功能提供一定的理论依据。
1 研究地点与研究方法
1.1 研究区域概况
四川省宜宾市高县来复镇林区,位于四川盆地南缘,高县北部(104°21′~104°48′E,28°11′~28°47′N),地处川云公路中段,宜高路、来沙路在此交汇,海拔高度410~560 m。研究区域属于中亚热带湿润季风气候,雨量充沛,雨热同季;最高气温40.3℃,最低气温-3.7℃,年均气温18.1℃,月均温≥10℃的有278 d,年积温5 881.3℃;年均降水量1 021.8 mm,相对湿度81%,无霜期360 d,全年日照时数1 148 h。
研究区域主要的森林类型是马尾松人工林,郁闭度0.7左右,林下植被盖度约30%,主要灌木有枹栎(QuercusserrataThunb.)、黄荆(VitexnegundoLinn.)、黄牛奶(SymplocoslaurinaWall.)、梨叶悬钩子(RubuspirifoliusSmith.)、野桐(MallotusjaponicusThunb.)、展毛野牡丹(MelastomanormaleD.Don.)等;主要草本有商陆(PhytolaccaacinosaRoxb.)、淡竹叶(LophatherumgracileBrongn.)、蕨(PteridiumaquilinumLinn.)、马唐(Digitariasanguinalis(L.)Scop.)、芒(MiscanthussinensisAnderss.)、芒萁(Dicranopterisdichotoma(Thunb.)Bernh)、皱叶狗尾草(Setariaplicata(Lam.)T.)等。
1.2 研究方法
1.2.1 样地设置
2011年8月,对试验区域内的植物多样性、土壤理化性质、林分结构等进行初步调查。根据样地调查结果,于2011年10月在试验区选择林地质量相近、林分密度相同的马尾松人工纯林进行采伐,形成4种大小不等,形状近似正方形的林窗各3个,面积分别为G1:100 m2、G2:400 m2、G3:900 m2、G4:1 600 m2,林窗边界间距大于10 m。未砍伐的纯林作为林下对照(CK),林下、林窗都设置3个重复,样地基本情况见表1。
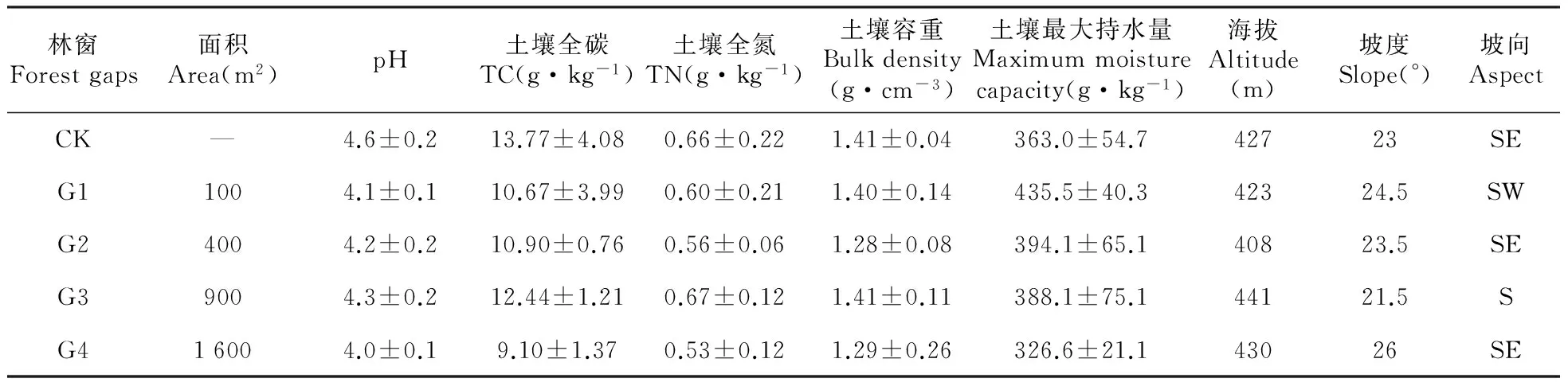
表1 马尾松人工林不同面积林窗样地基本概况
注:CK.林下对照;G1,G2,G3,G4.分别代表100、400、900、1 600 m2的林窗,下同。
Note:CK.Closed canopy as control; G1,G2,G3,G4. Represent gaps of different sizes in the order of 100, 400, 900 and 1 600 m2,the same as below.
1.2.2 实验设计与样品处理
2013年10月,在研究地的马尾松林群落内收集新鲜的马尾松和樟凋落叶,将样品带回室内自然风干。每个树种精确称取10克,装入不同孔径的分解袋(20 cm×20 cm),分解袋采用上层面0.04 mm(基本排除土壤动物进入)和3 mm(允许所有土壤动物进入),下层面均采用0.04 mm孔径尼龙网袋作为分解袋进行试验[24]。另外,分别取相同质量(10 g)风干的马尾松和樟凋落叶9袋在65℃下烘干至恒量,由其推算出网袋内样品的初始干质量(马尾松9.66 g,樟9.49 g)。
2013年11月17日,分别在人为采伐形成的马尾松(P.massoniana)人工林4种不同大小林窗(G1:100 m2、G2:400 m2、G3:900 m2、G4:1 600 m2)以及林下放置0.04、3 mm孔径的马尾松和樟凋落叶分解袋各360袋,即总袋数为2物种×3重复样品×3重复林窗×(4个林型+1林下对照)×4次取样×2孔径=720个凋落叶袋。且在对照和每个林窗下凋落叶袋中分别装设1个纽扣温度记录器(iButton DS1921G,Maxim Com.USA),每个面积林窗设置3个重复,每2 h自动记录一次温度。分别于2014年1月17日(冬季)、2014年4月17日(春季)、2014年8月17日(夏季)、2014年11月17日(秋季)收集凋落叶袋,每次从每个样点内取回马尾松和樟2种孔径分解袋各3袋。将收集的分解袋装入密封透气的土壤动物收集袋中低温保存,迅速带回室内,先将袋外泥土去除,然后将袋内分解基质全部取出放置于解剖盘中,手拣其中大型土壤动物,之后材料放置于Tullgren干式漏斗分离提取土壤动物,清除已提取了土壤动物凋落叶上的泥土,将样品中其他凋落叶和石子剔除后于65℃烘干后称重以计算残留量[25]。全碳—重铬酸钾加热法(GB7657-87),土壤含水量—铝盒烘干法测定(105℃,24 h)。其他初始含量测定方法:全氮—凯氏定氮法(LY/T1269-1999);可溶性有机碳(DOC)-TOC分析仪(multi N/C 2100,AnalytikJena)[26~27];木质素和纤维素—范氏(Van Soest)洗涤纤维法[28]。
1.2.3 数据处理和统计分析
(1)差量法计算凋落叶质量损失率[29]:
L=(M0-M1)/M0·100%
(1)
(2)凋落叶C损失率(R)[30]和土壤动物作用下C损失率[31]:
Rt=(M0·C0-Mt·Ct)/(M0·C0)·100%
(2)
Rfau=Rbt-Rst
(3)
式中,M0为凋落叶初始重(g);Mt为当次凋落叶残留量(g);Rt为当次DOC损失率(%);C0为C初始含量(初始浓度)(g·kg-1);Rbt为大孔径凋落袋内凋落叶C损失率;Rst为小孔径凋落袋内凋落叶C损失率。
数据统计与分析采用SPSS 20.0和Origin 9.0软件完成。凋落叶质量损失率、凋落叶C损失率,以及凋落叶C浓度采用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)进行,不同物种之间的养分含量差异用独立样本T检验进行。
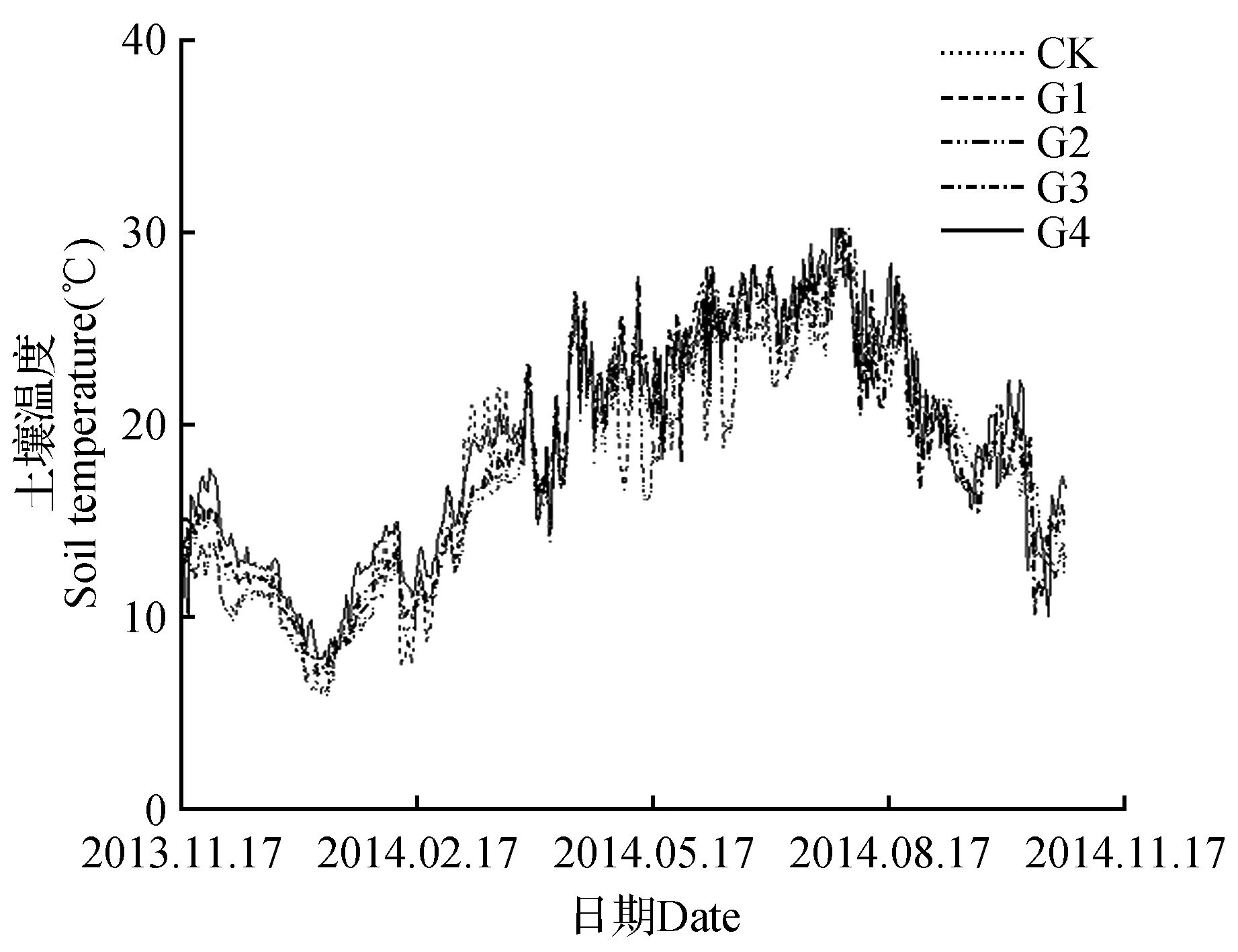
图1 马尾松人工林林窗内土壤日平均温度动态Fig.1 Daily dynamics of soil temperature in P.massoniana forest gaps
2 结果与分析
2.1 土壤温度和降雨量动态
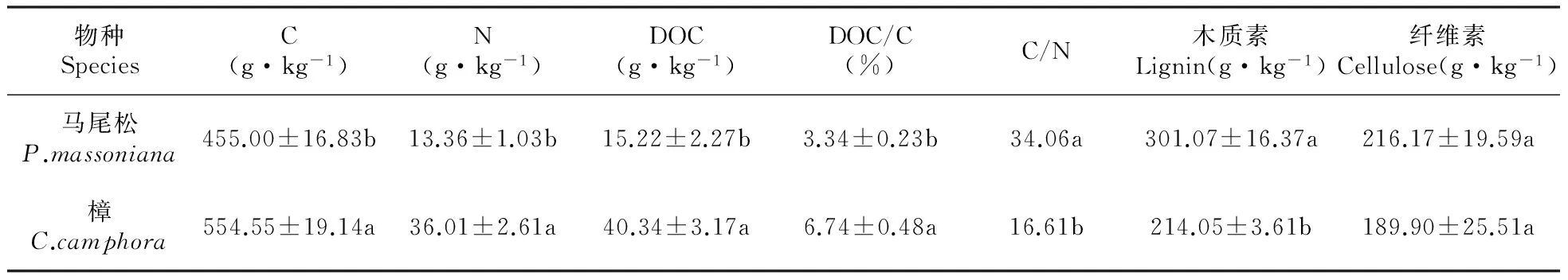
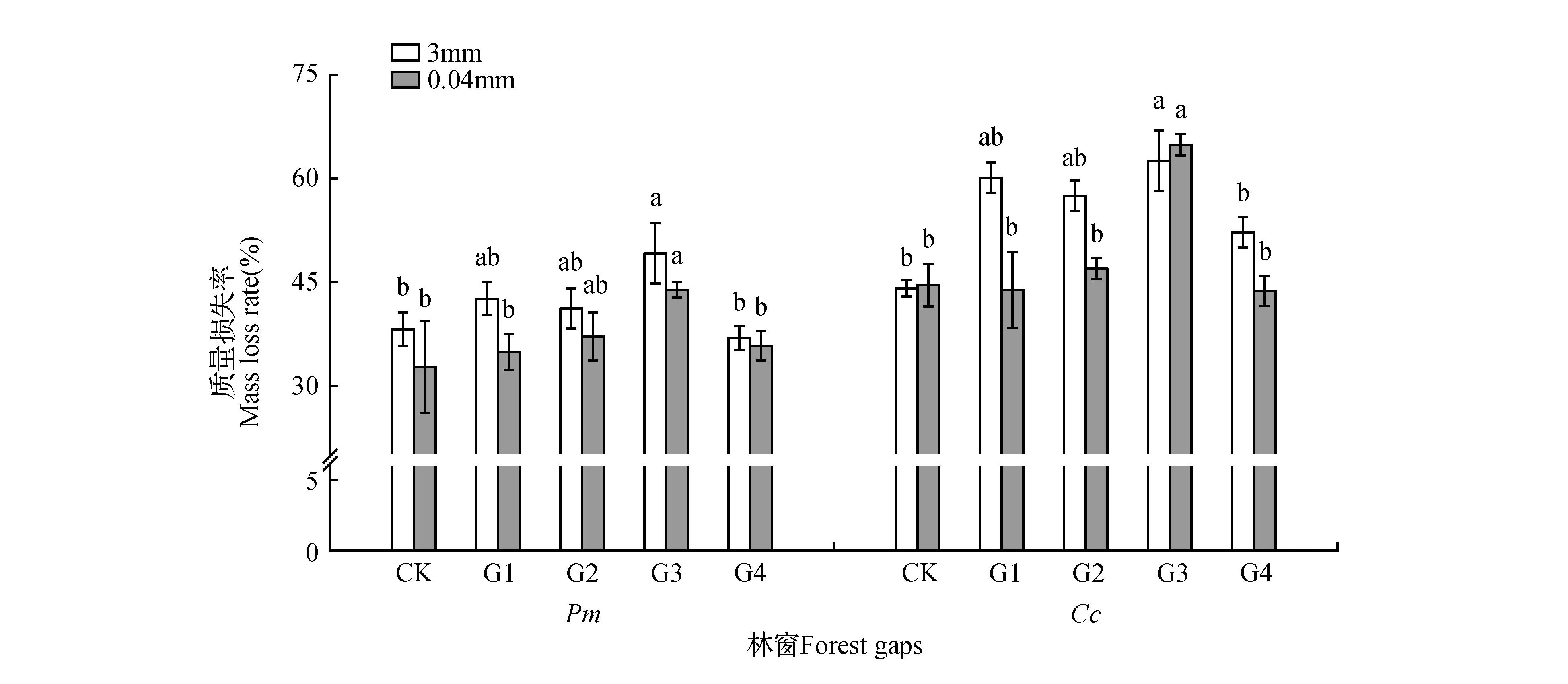
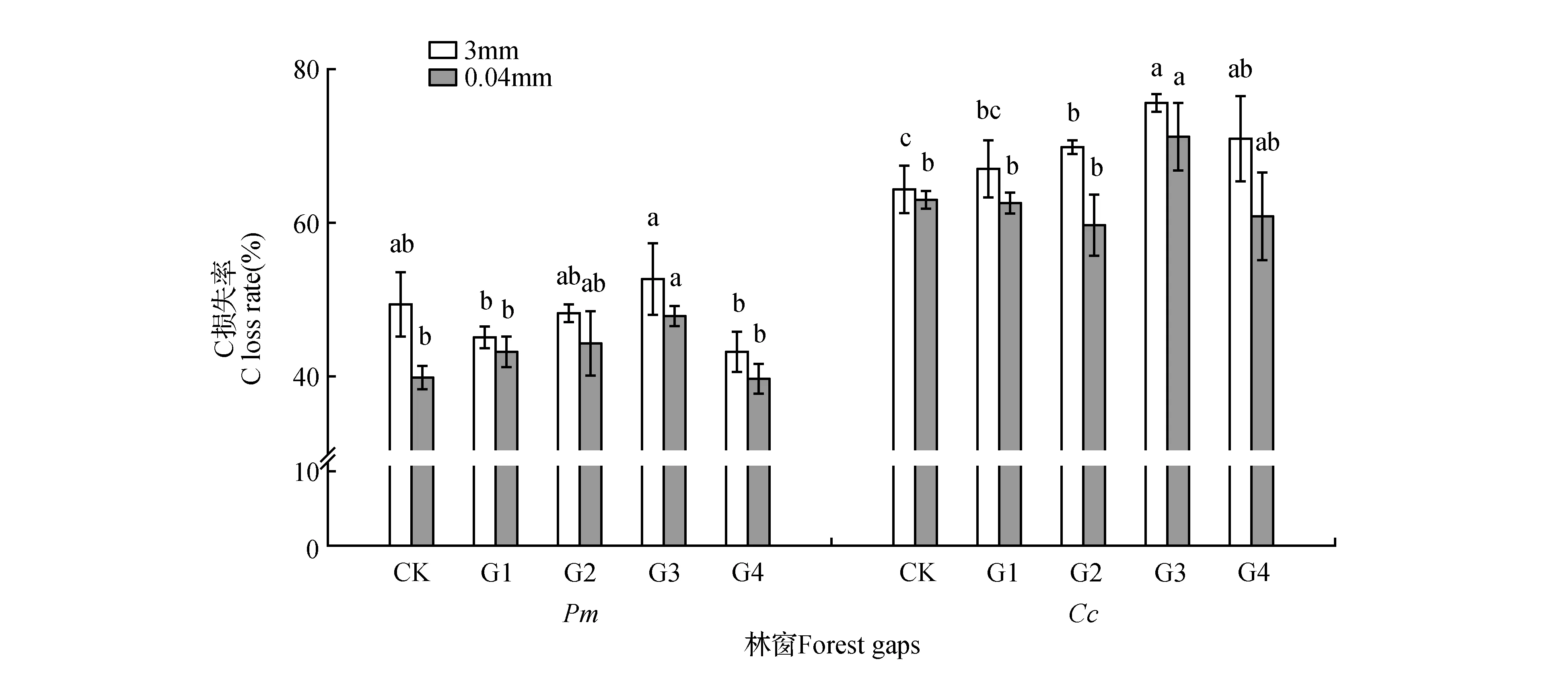
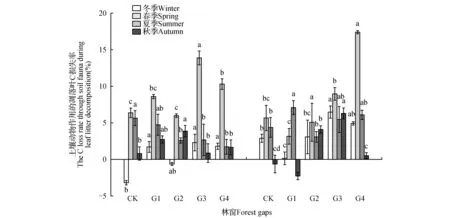
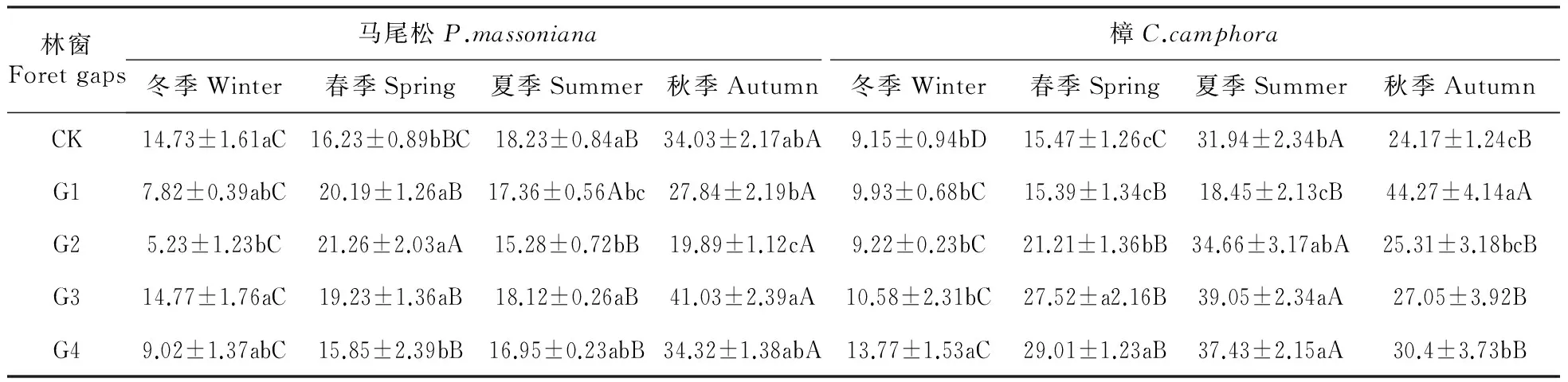
由图1可知。各林窗内凋落叶日均温变化基本一致(图1),均为8月最高,1月最低。年均温随林窗增大而升高,具体为CK(17.39℃) 2.2 凋落叶初始质量 两种凋落叶的基本养分和难降解物质的初始含量(表2),马尾松凋落叶C、N、DOC、DOC/C初始值均低于樟凋落叶,而C/N、木质素和纤维素的初始值则明显高于樟凋落叶。 图2 马尾松人工林林窗内土壤含水率季节动态Fig.2 Seasonal dynamics of soil water content in P.massoniana forest gaps 2.3 凋落叶质量损失率 经过一年的分解,3.00 mm孔径凋落叶袋中马尾松、樟凋落叶分别完成了42.44%,57.97%的分解。0.04 mm孔径凋落叶袋中马尾松、樟凋落叶分别完成了34.20%,49.78%的分解;不同大小林窗间,G3樟和马尾松凋落叶质量损失率均显著高于其它林窗和林下,分别为马尾松49.07%(3.00 mm)和43.86%(0.04 mm),樟62.38%(3.00 mm)和54.84%(0.04 mm);此外,3.00和0.04 mm孔径的凋落叶分解速率均表现为樟>马尾松(图3)。 表2 两种凋落叶的初始基质质量(平均值±标准误差) 注:不同小写字母表示不同物种之间的显著差异(P<0.05)。 Note:Different lowercase letter indicate significant difference between different plants(P<0.05). 2.4 林窗大小对凋落叶C损失率的影响 经过一年的分解,3.00 mm孔径凋落叶袋中马尾松、樟凋落叶的C损失率平均值分别为48.28%和71.89%。0.04 mm孔径凋落叶袋中马尾松、樟凋落叶的C损失率平均值分别为42.26%和61.15%;总体上,C损失率随林窗面积增大先升高后降低,G3樟和马尾松凋落叶C损失率显著高于其它林窗和林下,分别为马尾松53.76%(3.00 mm)和46.69%(0.04 mm),樟75.12%(3.00 mm)和71.22%(0.04 mm);此外,3.00和0.04 mm孔径的凋落叶C损失速率均表现为樟>马尾松(图4)。 2.5 凋落叶C元素动态 凋落叶在一年的分解后,冬季——夏季马尾松凋落叶C浓度不断上升,夏季——秋季下降;樟凋落叶C浓度春季最低,秋季次之,冬季和秋季较高。此外,除在冬季土壤动物作用下马尾松凋落叶C浓度无显著降低外,在其他季节土壤动物明显促进了凋落叶C浓度的上升(图5)。 图3 马尾松人工林林窗内马尾松和樟凋落叶质量损失率 Pm.马尾松;Cc.樟 不同小写字母表示同一面积林窗下相同孔径之间的显著差异(P<0.05),下同。Fig.3 Mass loss rate of P.massoniana and C.camphora leaf litter in P.massoniana forest gaps Pm. P.massoniana; Cc. C.camphora Different lowercase letter indicate significant difference in the same mesh size among different size of forest gaps(P<0.05),the same as below. 图4 马尾松人工林林窗内马尾松和樟凋落叶C损失率Fig.4 C loss rate of P.massoniana and C.camphora leaf litter in P.massoniana forest gaps 在第一年的分解过程中,总体上土壤动物作用的马尾松和樟凋落叶C损失率为正效应。但分解的不同季节,土壤动物对凋落叶C损失率表现出不同的效应:除了冬季土壤动物对CK,G2内马尾松凋落叶以及秋季土壤动物对CK,G1内樟凋落叶C释放为负值外,在其它林窗内4个季节均为正效应。且春、夏两季土壤动物作用的凋落叶C损失率高于冬季和秋季。此外,不同大小林窗内土壤动物作用的凋落叶C损失率为:马尾松G3(4.93%)>G1(4.44%)>G4(3.88%)>G2(2.94%)>CK(2.40%),樟G4(9.73%)>G3(6.80%)>G2(3.83%)>CK(3.01%)>G1(2.01%)。总体上看中型林窗(G3:900 m2)内土壤动物作用的凋落叶C损失率更高,且土壤动物作用的C损失率:樟>马尾松(图6)。 不同分解季节,2个物种的凋落叶中土壤动物个体密度均以夏季和秋季最大,春季次之,冬季最小。马尾松凋落叶中土壤动物个体密度以秋季最大,樟凋落叶中土壤动物个体密度以夏季最大。计算可知,不同大小林窗内凋落叶中土壤动物个体密度为马尾松G3(23.29%)>CK(19.04%)>G4(18.30%)>G1(%)>G2(15.41%);樟G4(27.65%)>G3(26.05%)>G2(22.6%)>G1(22.01%)>CK(20.18%)。总体上两个物种凋落叶中的土壤动物个体密度在G3相对更高(表3)。 图5 马尾松人工林林窗内马尾松和樟凋落叶C浓度动态 Wi.冬季;Sp.春季;Su.夏季;Au.秋季 *表示同一物种同一时期不同孔径凋落叶袋之间差异显著(P<0.05)。Fig.5 Dynamics of C concentrations in decomposing leaf litter of P.massoniana and C.camphora leaf litter in P.massoniana forest gaps Wi.Winter; Sp.Spring; Su.Summer; Au.Autumn *indicate significant difference between litterbugs of two different mesh sizes for the same species at the same stage(P<0.05). 图6 马尾松人工林林窗内土壤动物作用的凋落叶C损失率 不同小写字母表示不同面积林窗之间的显著差异(P<0.05)。Fig.6 The C loss rate through soil fauna in decomposing leaf litter of P.massoniana and C.camphora leaf litter in P.massoniana forest gaps Different lowercase letter indicate significant difference among different sized forest gaps(P<0.05). 林窗Foretgaps马尾松P.massoniana樟C.camphora冬季Winter春季Spring夏季Summer秋季Autumn冬季Winter春季Spring夏季Summer秋季AutumnCK14.73±1.61aC16.23±0.89bBC18.23±0.84aB34.03±2.17abA9.15±0.94bD15.47±1.26cC31.94±2.34bA24.17±1.24cBG17.82±0.39abC20.19±1.26aB17.36±0.56Abc27.84±2.19bA9.93±0.68bC15.39±1.34cB18.45±2.13cB44.27±4.14aAG25.23±1.23bC21.26±2.03aA15.28±0.72bB19.89±1.12cA9.22±0.23bC21.21±1.36bB34.66±3.17abA25.31±3.18bcBG314.77±1.76aC19.23±1.36aB18.12±0.26aB41.03±2.39aA10.58±2.31bC27.52±a2.16B39.05±2.34aA27.05±3.92BG49.02±1.37abC15.85±2.39bB16.95±0.23abB34.32±1.38abA13.77±1.53aC29.01±1.23aB37.43±2.15aA30.4±3.73bB 注:不同小写字母表示不同面积林窗之间的显著差异,不同大写字母表示不同季节之间的显著差异(P<0.05)。 Note:Different lowercase letter indicate significant difference among different sized forest gaps,different capital letter indicate significant difference among different sampling seasons(P<0.05). 本研究表明,不论有土壤动物(3.00 mm)参与凋落叶分解,还是排除土壤动物(0.04 mm)凋落叶分解的影响,林窗大小对马尾松和樟凋落叶中C含量均有显著影响:中型林窗(G3:900 m2)内凋落叶C损失率更高。凋落叶分解是生物因子和非生物因子共同作用的结果,其分解速率和分解时间取决于凋落叶质量、土壤、气候以及土壤生物的作用[32]。相对于其他林窗,G3凋落叶中土壤动物密度更高。这可能是因为林窗形成后,上层林冠疏开,改变了林下光照辐射条件和气流,使林窗内的温度和湿度发生变化,不同大小林窗之间的温度、湿度差异导致林窗之间的微环境差异[33],直接影响林窗内土壤动物和微生物的生存环境[34]。土壤动物对凋落叶分解过程中养分释放具有重要作用[35],土壤动物的种类、数量、分布与地上植被群落的结构有着密切的关系[36]。植物多样性调查发现:林窗形成后草灌层先锋植物(如商陆、野桐等)迅速萌发生长,且与大面积林窗相比,较小林窗更利于芒其、蕨类等植物生存。植物盖度、种类等较高的林窗,将为土壤动物提供更丰富的凋落叶以及碳、氮、磷的来源[15]。研究区域内马尾松平均株高大于16 m,阻挡了较小林窗(G1:100 m2)和林下(CK)的有效光照和降雨,对土壤湿度等条件的改善有所抑制进而限制了土壤动物和微生物的活动[15,37],而大林窗(G4:1 600 m2)内光照强度的空间异质性大,总辐射强度和有效光合辐射较高,蒸腾作用强,使大林窗内凋落叶和土壤昼夜温、湿度差异大,可能会抑制土壤动物对凋落叶分解的作用[13,38]。凋落叶C主要包括糖类、氨基酸类,淀粉类及低分子量的有机物等物质,这些物质极易被土壤动物和微生物分解和利用[38]。瓯江等[16]前期研究发现,中等面积林窗土壤有机碳含量的季节差异更小,能够更长时间维持分解者的生存。 研究表明不同季节土壤动物作用的凋落叶C损失率不同:春季和夏季较高,秋季和冬季较低。首先,尽管新鲜凋落叶具有丰富的养分资源[39],但土壤动物进人凋落叶需要一定时间,而且凋落叶尚未破碎,不利于进食,因而冬季(初次采样为1月)土壤动物对凋落叶质量损失的贡献率较小。其次,虽然冬季仍有相当数量的土壤动物存在[31],但对C释放的相对作用较小,这主要是因为低温不仅明显限制了土壤动物活动,而且可能冻结凋落叶养分资源,使得土壤动物难以取食[40]。再次,随着温度的回升,春季土壤动物的活性增强,使得土壤动物对凋落叶C释放的作用显著增加。春、夏两季气温高、湿度大,有利于土壤动物生存,土壤动物数量和类群达到最多,活动最频繁,导致土壤动物对凋落叶C释放的作用增加。此外,分解后期淋溶作用对凋落物的影响减弱,且随着分解时间的延长,木质素、纤维素等难降解物质的相对含量上升,影响土壤动物对凋落叶的分解,导致分解速率开始降低。 土壤动物作用的两种凋落叶C损失率为马尾松(6.02%)<樟(10.74%)。其原因主要是两种凋落叶的质量差异:针叶(马尾松)凋落叶多为厚革质,角质层发达,叶片表面积小且质地紧实,含有较多木质素、纤维素等物质,阻碍了降雨的淋溶作用,也不利于土壤动物的机械破坏,使得分解一定时期后还停留在表层。而阔叶凋落叶(樟)的木质素、纤维素含量相对较低,且樟凋落叶相对更大的表面积,有利于土壤动物定居其上进行分解[41~42]。N含量也是影响凋落叶分解速率的最重要的变量,高浓度N有利于凋落叶分解,因为N是土壤动物生长繁殖必不可少的营养元素,N浓度越高,土壤动物的代谢活性越强,繁殖越快,凋落叶的分解速率随之加快[43],其次凋落叶C:N高,耐分解成分高也会抑制土壤动物的活性[44],因而分解较慢,C释放也慢[45]。本研究中马尾松凋落叶相对较高的C/N和较低的N含量是其分解较慢的原因之一。此外,由于土壤动物食性的差异,对不同树种的取食的喜好不同,这也可能影响土壤动物对不同凋落叶碳释放的贡献[46]。 当前研究表明林窗内土壤动物促进凋落叶C释放,且中等面积林窗(900 m2)内凋落叶全碳损失率更高。研究结果也表明林窗内不同物种凋落叶的全碳损失率表现出显著的季节差异。本研究在设置林窗梯度并引入乡土阔叶树种(樟)的基础上,研究了土壤动物对凋落叶C释放的季节动态。为研究林分干扰调节森林生态系统凋落物养分释放提供参考,需进一步深入研究林窗内凋落物和土壤养分的转化过程和机制。 1.Liu C J,Ilvesniemi H,Berg B,et al.Aboveground litterfall in Eurasian forests[J].Journal of Forestry Research,2003,14(1):27-34. 2.Qualls R G,Haines B L.Geochemistry of dissolved organic water percolating through a forest ecosystem[J].Soil Science Society of America Journal,1991,55:1112-1123. 3.Park J H,Matzner E.Controls on the release of dissolved organic carbon and nitrogen from a deciduous forest floor investigated by manipulations of aboveground litter inputs and water flux[J].Biogeochemistry,2003,66:265-86. 4.Huang C D,Zhang J,Yang W Q,et al.Characteristics of carbon stock in artificial forest ecosystem in Sichuan Province of China[J].Chinese Geographical Science,2008,19(8):1644-1650. 5.周玉荣,于振良,赵士洞.我国主要森林生态系统碳贮量和碳平衡[J].植物生态学报,2000,24(5):518-522. 6.Ulrich I.Changes in the fauna and its contribution to mass loss and N release during leaf litter decomposition in two deciduous forests[J].Pedobiologia,2000,44:105-118. 7.Smith V C,Bradford M A.Litter quality impacts on grassland litter decomposition are differently dependent on soil fauna across time[J].Applied Soil Ecology,2003,24:197-203. 8.Yin X Q,Song B,Dong W H,et al.A review on the eco-geography of soil fauna in China[J].Journal of Geographical Sciences,2010,20(3):333-346. 9.Barajas G G,Alvarez S J.The relationships between litter fauna and rates of litter decomposition in a tropical rain forest[J].Applied Soil Ecology,2003,24:91-100. 10.Seung J J,Myeong H Y,Kaneyuki N.Contribution of microarthropods to the decomposition of needle litter in a Japanese cedar(CryptomeriajaponicaD.Don) plantation[J].Forest Ecology and Management,2006,234:192-198. 11.Yang X D,Chen J.Plant litter quality influences the contribution of soil fauna to litter decomposition in humid tropical forest,southwestern China[J].Soil Biology & Biochemistry,2009,41:910-918. 12.葛晓改,曾立雄,黄志霖,等.土壤温度和水分含量对三峡库区马尾松林凋落物叶分解的影响[J].林业科学,2013,49(9):153-157. 13.莫江明,彭少麟,方运霆,等.鼎湖山马尾松针阔叶混交林土壤有效氮动态的初步研究[J].生态学报,2001,21(3):492-497. 14.崔宁洁,张丹桔,刘洋,等.马尾松人工林不同大小林窗植物多样性及其季节动态[J].植物生态学报,2014,38(5):477-490. 15.崔宁洁,刘洋,张健,等.林窗对马尾松人工林植物多样性的影响[J].应用与环境生物学报,2014,20(1):8-14. 16.欧江,张捷,崔宁洁,等.采伐林窗对马尾松人工林土壤微生物生物量的初期影响[J].自然资源学报,2014,29(12):2036-2047. 17.林英华,杨德付,张夫道,等.栎林凋落层土壤动物群落结构及其在凋落物分解中的变化[J].林业科学研究,2006,19(3):331-336. 18.刘文杰,李庆军,张光明,等.西双版纳望天树林林窗小气候特征研究[J].植物生态学报,2000,24(3):356-361. 19.陈梅,朱教君,闫巧玲,等.辽东山区次生林不同大小林窗光照特征比较[J].应用生态学报,2008,19:2555-2560. 20.刘庆,吴彦.滇西北亚高山针叶林林窗大小与更新的初步分析[J].应用与环境生物学报,2002,8:453-459. 21.包维楷,刘照光,袁亚夫,等.瓦屋山中亚热带湿性常绿阔叶林的林窗形成特征[J].应用生态学报,2001,12:485-490. 22.郭晋平,丁颖秀,张芸香.关帝山华北落叶松林凋落物分解过程及其养分动态[J].生态学报,2009,29(10):5684-5695. 23.Landsberg J J.A theory of forest dynamics,the ecological implications of forest succession models[J].Forest Ecology & Management,1987,18:161-163. 24.Crutsinger G M,Sanders N J,Classen A T.Comparing infra- and inter-specific effects on litter decomposition in an old-field ecosystem[J].Basic and Applied Ecology,2009,10:535-543. 25.夏磊,吴福忠,杨万勤,等.川西亚高山森林凋落叶分解初期土壤动物对红桦凋落叶质量损失的贡献[J].应用生态学报,2012,23(2):301-306. 26.Boyer J N,Groffman P M.Bioavailability of water extractable organic carbon fractions in forest and agricultural soil profiles[J].Soil Biology & Biochemistry,1996,28(6):783-790. 27.王春阳,周建斌,王祥,等.黄土高原区不同植物凋落叶可溶性有机碳的含量及生物降解特性[J].环境科学,2011,32(4):1139-1145. 28.Graca M A S,Bärlocher F,Gessner M O.Methods to study litter decomposition:A practical guide[J].Springer Ebooks,2005. 29.邓长春,陈亚梅,和润莲,等.雪被期川西高山林线交错带凋落物可溶性有机碳的淋失特征[J].生态学杂志,2014,33(11):2921-2929. 30.李正才,徐德应,杨校生,等.北亚热带6种森林类型凋落物分解过程中有机碳动态变化[J].林业科学研究,2008,21(5):675-680. 31.刘瑞龙,李维民,杨万勤,等.土壤动物对川西高山/亚高山森林凋落叶分解的贡献[J].应用生态学报,2013,24(12):3354-3360. 32.窦荣鹏,江洪,余树全,等.柳杉凋落物在中国亚热带和热带的分解[J].生态学报,2010,30(7):1758-1763. 33.Arunachalam A,Arunachalam K.Influence of gap size and soil properties on microbial biomass in a subtropical humid forest of north-east India[J].Plant and Soil,2000,223(1-2):187-195. 34.宋新章,肖文发.林隙微生境及更新研究进展[J].林业科学,2006,42(5):114-119. 35.Aerts R.The freezer defrosting:global warming and litter decomposition rates in cold biomes[J].Journal of Ecology,2006,94(4):713-724. 36.孟好军,刘贤德,金铭,等.祁连山不同森林植被类型对土壤微生物影响的研究[J].土壤通报,2007,38(6):1127-1130. 37.Arunachalam A,Maithani K,Pandey H N,et al.The impacts of disturbance on detrital dynamics and soil microbial biomass of aPinuskesiyaforest in north-east India[J].Forerst Ecology & Management,1996,88(3):273-282. 38.Mema D W,Singh T B,Joymati D L.Monthly changes of collembolan population under the gradients of moisture,organic carbon and nitrogen contents in a sub-tropical forest soil,Manipur[J].Journal of Experimental Sciences,2012,2(12):10-12. 39.Hunter M D,Adl S,Pringle C M,et al.Relative effects of macroinvertebrates and habitat on the chemistry of litter during decomposition[J].Pedobiologia,2003,47(2):101-115. 40.Heemsbergen D A,Berg M P,Loreau M,et al.Biodiversity effects on soil processes explained by interspecific functional dissimilarity[J].Science,2004,306(5698):1019-1020. 41.田兴军,立石贵浩.亚高山针叶林土壤动物和土壤微生物对针叶分解的作用[J].植物生态学报,2002,26(3):257-263. 42.郭培培,江洪,余树全,等.亚热带6种针叶和阔叶树种凋落叶分解比较[J].应用与环境生物学报,2009,15:655-659. 43.Polyakova O,Billor N.Impact of deciduous tree species on litterfall quality,decomposition rates and nutrient circulation in pine stands[J].Forest Ecology &Management,2007,253:11-18. 44.Cardenas R E,Dangles O.Do canopy herbivores mechanically facilitate subsequent litter decomposition in soil?A pilot study from a Neotropical cloud forest[J].Ecological Research,2012,27(5):975-981. 45.Schlesinger W H,Hasey M M.Decomposition of chaparral shrub foliage:Losses of organic and inorganic constituents from deciduous and evergreen leaves[J].Ecology,1981,62:762-774. 46.Gartner T B,Cardon Z G.Decomposition dynamics in mixed species leaf litter[J].Oikos,2004,104:230-246. EffectsofSoilFaunaonCDynamicsinDifferentSizedForestGapsinPinusmassonianaPlantation LI Xun1LIU Yang1,2,3ZHANG Yan1LIU Hua1YANG Wan-Qin1,2,3ZHANG Jian1,2,3* (1.Institute of Ecology & Forestry,College of Forestry,Chengdu 611130;2.Key Laboratory of Forestry Ecological Engineering in Sichuan,Chengdu 611130;3.Collaborative Innovation center of Ecological security in the Upper Reaches of Yangtze River,Chengdu 611130) Soil fauna has an important effect on litter nutrient release, and the effect could vary with litter types and be controlled by environmental factors such as temperature and precipitation. We to characterized the effect of soil fauna on C dynamics in different sized forest gaps (G1: 100 m2, G2: 400 m2, G3: 900 m2, G4: 1 600 m2) during litter decomposition of aPinusmassonianaplantation in a hilly area of the upper reaches of Yangtze River. A field litterbag experiment was conducted inP.massonianaplantation of Sichuan, China, from January 2014 to November 2014. Samples of air-dried leaf litter forP.massoniana(Pm) andCinnamomumcamphora(Cc) were placed in nylon litterbags (20 cm×20 cm, 10 g per bag) of two different mesh sizes (3.00 and 0.04 mm). The amount of C released were investigated in different sized forest gaps during the first year of decomposition, i.e., Spring, Summer, Autumn and Winter. There was a significant difference in the amount of litter C released through soil fauna among different sized gaps: medium sized gap (G3: 900 m2) promoted the C release ofCcandPm. The content of C displayed a declining trend in Spring and Summer, but with an obvious enrichment process in Winter and Autumn. Soil fauna imposed a positive effect on C release, the contribution of soil fauna to the C loss rate displayed asCc>Pm. Based on the above results, soil fauna imposed a positive effect on C release inP.massonianaplantation. When we reconstruct the low-function forest, we can take advantage of medium sized gap and introduce native broad-leaf tree speciesCcwhich is easier to be decomposed by soil fauna to accelerate nutrient cycling and maintains the soil fertility ofP.massonianaplantation. C dynamics;soil fauna;litter decomposition;forest gap;Pinusmassonianaplantation 国家自然科学基金项目(31370628);国家科技支撑计划项目(2011BAC09B05);四川省科技支撑计划项目(2013SZ0067、2011SZ0239);四川省科技厅应用基础项目(2012JY0047);四川省教育厅科技创新团队计划项目(11TD006)资助 李勋(1990—),男,硕士研究生,主要从事长江中上游马尾松低效林改造。 2015-10-08 S71.55 A 10.7525/j.issn.1673-5102.2016.02.007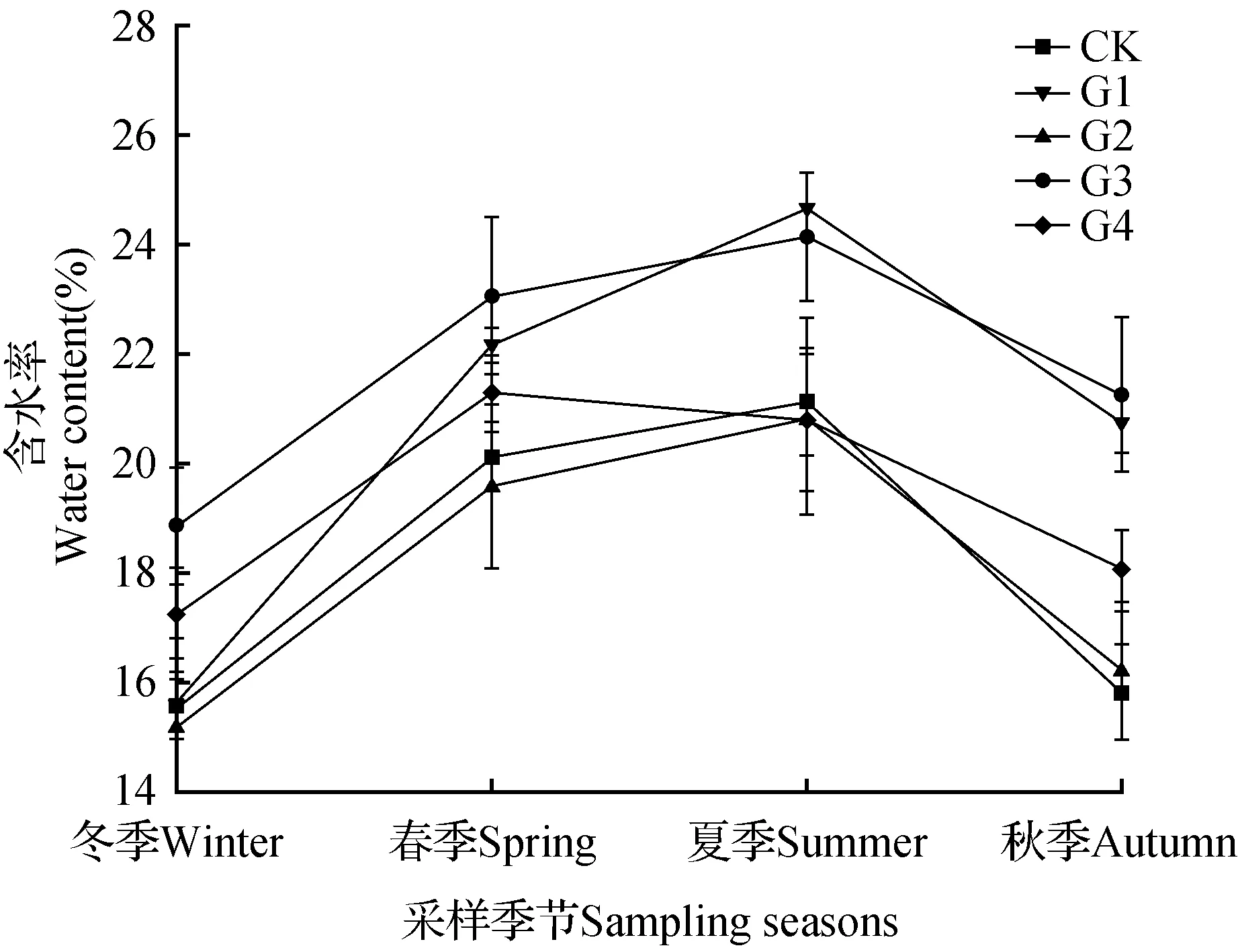

3 讨论
4 结论

