柑橘黄龙病寄主长春花愈伤组织的诱导与增殖
宋晓兵, 彭埃天, 陈 霞, 凌金锋, 张炼辉
(1. 广东省农业科学院 植物保护研究所 广东省植物保护新技术重点实验室,广州 510640;2. 广东省微生物信号与作物病害防控重点实验室,广州 510640)
柑橘黄龙病寄主长春花愈伤组织的诱导与增殖
宋晓兵1,2, 彭埃天1, 陈 霞1, 凌金锋1, 张炼辉2
(1. 广东省农业科学院 植物保护研究所 广东省植物保护新技术重点实验室,广州 510640;2. 广东省微生物信号与作物病害防控重点实验室,广州 510640)
以柑橘黄龙病寄主长春花为试材,研究建立长春花的组织培养体系。取长春花幼嫩叶片为外植体,进行外植体的消毒处理及不同激素的配方筛选,建立长春花愈伤组织诱导及增殖培养体系。试验表明外植体消毒处理组合为75%乙醇处理30~45 s,0.1%氯化汞处理3 min;培养基为MS基本培养基,愈伤组织诱导的激素组合:2,4-D 1.0 mg·L-1+NAA 1.0 mg·L-1+6-BA 2.0 mg·L-1,愈伤组织增殖的激素组合:NAA 1.0 mg·L-1+6-BA 2.0 mg·L-1,长春花愈伤组织诱导率达到90%以上。建立了长春花愈伤组织诱导及增殖培养体系,对利用转基因工程技术抗病育种从而控制柑橘黄龙病具有重要意义。
长春花;愈伤组织;诱导;增殖
柑橘黄龙病(huanglongbing)由韧皮部杆菌属细菌(CandidatusLiberobacter sp.)[1-2]侵染引起,是柑橘生产上的毁灭性病害,已成为制约柑橘产业健康发展的关键因素之一[3]。长春花是柑橘黄龙病的寄主之一,长春花被柑橘黄龙病菌侵染过后,叶片表现为黄化、斑驳等症状,与感染黄龙病的柑橘植株症状极其相似,病原可在长春花筛管细胞内大量繁殖[4]。研究建立长春花的组织培养体系,有助于柑橘黄龙病病原的分离培养[5],对利用转基因工程技术抗病育种从而控制柑橘黄龙病具有重要意义[6]。
1 材料与方法
1.1材料
供试材料为长春花[Catharathusroseus(L.) G. Don],采自广东省农业科学院绿化带花圃,移至实验室盆栽。
1.2方法
1.2.1培养基及激素的选择
基本培养基为MS培养基。1)愈伤组织诱导培养基:MS+2,4-D 1.0 mg·L-1+NAA 1.0 mg·L-1+6-BA 2.0 mg·L-1;2)愈伤组织增殖培养基:MS+NAA 1.0 mg·L-1+6-BA 2.0 mg·L-1。两种培养基均加入蔗糖30 g/L,琼脂粉7 g/L,pH值调至5.8,121℃高温灭菌20 min。
1.2.2外植体处理
选取长春花的新生幼嫩叶片,清水冲洗30 min,然后用无菌水冲洗1次,置于无菌培养皿中,加入适量75%酒精浸泡30~45 s,无菌水漂洗1次后,再转入0.1%氯化汞溶液中浸泡3 min,无菌水漂洗3次,然后用无菌剪刀将叶片切成5 mm×5 mm左右的小块。
1.2.3愈伤组织的诱导
将消毒处理后的长春花叶片小块用无菌镊子平放在诱导培养基上,随后进行组织培养,培养温度27℃,暗培养。培养10 d后统计外植体生成愈伤组织的数量,并计算诱导率。诱导率(%)=(形成愈伤组织的外植体块数/总接种外植体的块数)×100%。
1.2.4愈伤组织的增殖
外植体脱分化形成一定大小的愈伤组织后,将愈伤组织切成小块重新接入增殖培养基中进行培养,培养条件同上。
2 结果与分析
2.1外植体的选择及处理
长春花的外植体一般可选择幼嫩叶片、种子、叶柄、无菌苗下胚轴等[7],唐忠海等以根、茎、叶为外植体,叶片对愈伤组织的诱导率高达88%,为最高,根次之,茎的诱导率最低[8];严春艳等以幼嫩叶片为外植体,诱导率达90%[9]。本试验发现长春花幼嫩叶片的愈伤组织诱导率明显高于老叶,但是长春花叶片的内生真菌丰富,若外植体消毒不彻底,极易污染内生真菌,显微镜检多为镰刀菌。
4)对于共塔架设线路,为了尽量降低双极闭锁概率,建议接地极线进行配置绝缘时,除了考虑操作过电压水平,还应进行雷电过电压校核。通过技术经济比较,对于±800 kV滇西北至广东特高压直流输电工程共塔架设段线路,推荐采用提高接地极线绝缘配置的反事故措施,建议将由操作过电压水平确定的9片170 mm结构高度绝缘子提高到由雷电过电压水平确定的15片170 mm结构高度绝缘子。
2.2愈伤组织形成
将外植体接种到诱导培养基上,2~3 d后叶片增厚变肥大,5~7 d后叶片开始弯曲,切口处萌发出浅白色愈伤组织(图1),10 d左右逐渐长满白色至浅黄色的瘤状愈伤组织(图2),再经2周愈伤组织团直径可达1 cm以上(图3)。本试验培养基组合长春花愈伤组织的诱导率达到90%以上。
2.3愈伤组织的增殖
将诱导培养基上的愈伤组织团粒接种到增殖培养基上,2周后愈伤组织团直径可达3 cm以上,愈伤组织结构致密,颜色白色,生长速率较快(图4)。基本可以满足转基因试验的需求。

图1 长春花叶片愈伤诱导5~7 d
Fig 1 Leaf callus induction ofCatharathusroseusafter 5 to 7 days
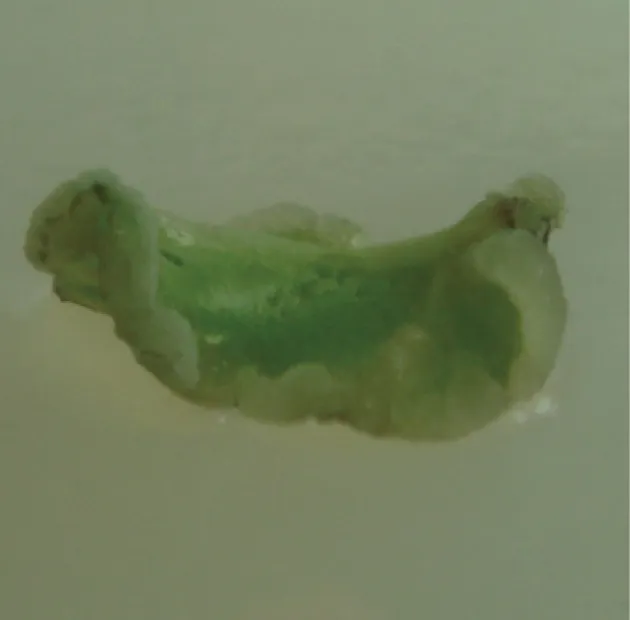
图2 长春花叶片愈伤诱导10 d
Fig 2 Leaf callus induction ofCatharathusroseusafter 10 days

图3 长春花叶片愈伤诱导30 d
Fig 3 Leaf callus induction ofCatharathusroseusafter 30 days

图4 长春花叶片愈伤组织的增殖
Fig 4 Proliferation ofCatharathusroseusleaf callus
3 讨论
3.1外植体的消毒处理
3.2激素的选择
研究表明植物激素NAA和2,4-D组合使用对长春花愈伤组织的诱导效果均较明显,但单独使用NAA诱导的愈伤组织颜色偏黄,生长缓慢[11];KT对长春花愈伤组织的诱导效应不明显[9],或者单独使用KT无愈伤组织产生[12]。本研究发现,激素2,4-D在长春花愈伤组织诱导中有着至关重要的作用,在不添加2,4-D的诱导培养基中,愈伤组织的诱导率低于30%。
3.3激素的用量
孙敏等研究表明2,4-D浓度较高时外植体容易褐化死亡[11],本试验中2,4-D浓度在1.0 mg·L-1时外植体褐化率较低,愈伤组织呈乳白色颗粒状。郭胜娟等研究发现,当6-BA浓度高于3.0 mg·L-1时反而抑制愈伤组织的产生[12],本试验中6-BA浓度在2.0 mg·L-1时愈伤组织结构疏松,生长速度较快。植物激素的种类、浓度及激素之间的配比都会影响愈伤组织的生长状态,增加2, 4-D浓度可提高愈伤组织的生长速度,降低6-BA的浓度可降低褐化率[13],MS培养基添加2,4-D 1.0 mg·L-1+NAA 1.0 mg·L-1+6-BA 2.0 mg·L-1时愈伤组织诱导效果较好,为本试验筛选出的最佳愈伤组织诱导培养基。
3.4研究意义
柑橘黄龙病由局限于韧皮部的革兰氏阴性细菌侵染所引起,国内外陆续有黄龙病病菌成功培养的报道,但至今尚未获得广泛认可的纯培养[14]。赵鸿燕等将感染黄龙病的柑橘叶片消毒、匀浆,用细菌过滤器无菌抽滤后,接种于改良的液体培养基中,随后涂布固体培养基,培养出的病原菌对四环素有高度敏感性以及对长春花具有侵染性[15];张景宁等以感染黄龙病的柑橘叶脉浸出液培养病菌,获得的病原菌以虫传、针注、剥皮接种、浸根等方法接种健康的柑橘幼苗,均表现出典型的黄龙病症状[16];Davis等利用放线菌(Propionibacteriumacnes)与黄龙病病菌共培养,培养物经PCR检测黄龙病菌为阳性[17];Sechler等报道培养出黄龙病原菌,病菌接种至柑橘幼苗叶片,表现典型的黄龙病症状,再次分离培养该病原菌并利用PCR检测,16s rDNA测序验证为柑橘黄龙病菌[18]。
长春花是适宜柑橘黄龙病菌大量增殖的草本寄主[19],柯穗等研究证实利用菟丝子可将柑橘黄龙病病原从感病柑橘上接种到长春花[20],柯冲等用电镜观察感染柑橘黄龙病菌的长春花叶脉,发现在其筛管细胞中存在柑橘黄龙病病原,且数量远比柑橘病苗上的多[21],田亚南等利用qPCR分别检测柑橘黄龙病菌在不同寄主中的浓度,结果表明柑橘木虱中病原菌含量最高、长春花次之、柑橘中带菌量最少[22]。可见黄龙病菌能在长春花体内大量增殖,研究长春花的组织培养体系对于黄龙病原菌的分离培养具有重要意义。本研究采用长春花幼嫩叶片诱导出愈伤组织,愈伤组织再增殖培养出大量的愈伤组织,建立了愈伤组织诱导及增殖培养体系,为今后研究柑橘黄龙病病原的分离培养奠定了基础,对利用转基因工程技术抗病育种防治柑橘黄龙病具有重要意义。
[1]JAGOUEIX S, BOVÉJ M, GARNIER M. The phloem-limited bacterium of greening disease of citrus is a member of the a subdivision of the proteobacteria[J]. International Journal of Systematic Bacteriology, 1994, 44(3):379-386.
[2]TEIXEIRA DDO C, SAILLARD C, EVEILLARD S, et al. ‘CandidatusLiberibacter americanus’, associated with citrus huanglongbing (greening disease) in São Paulo State, Brazil [J]. Int J Syst Evol Microbiol, 2005, 55(Pt5):1857-1862.
[3]宋晓兵,彭埃天,陈 霞,等. 柑橘黄龙病病原培养及分子检测技术研究进展[J]. 广东农业科学,2013, 40(23):65-69.
[4]GARNIER M. Transmission of the organism associated with citrus greening disease from sweet orange to periwinkle by dodder[J]. Phytopathology, 1983, 73(10):1358-1363.
[5]胡勤学,周咏芝,丁达明. 长春花组织培养柑桔黄龙病病原类细菌的初步研究[J]. 浙江柑橘,1991(3):37-38.
[6]袁 芳,王 荃,潘琪芳,等. 根癌农杆菌介导的g10 h基因遗传转化长春花初步研究[J]. 上海交通大学学报(农业科学版),2009,28(6):606-610.
[7]曾智发,柳润辉. 长春花组织培养研究进展[J]. 药学实践杂志,2012,30(4):258-261.
[8]唐忠海,饶力群,李兰岚. 长春花愈伤组织的诱导及限速酶活性的研究[J]. 天然产物研究与开发,2006,18(4):596-598.
[9]严春艳,马伟丽,于荣敏. 长春花愈伤组织诱导及培养条件优化[J]. 中药材,2008,31(7):955-956.
[10]石岳香,周 敏,唐忠海,等. 长春花内生真菌的分离及鉴定[J]. 安徽农业科学,2008,36(29):12712-12713.
[11]孙 敏,伍春莲,汪 洪,等. 多因子正交试验对长春花离体培养条件的筛选[J]. 西南师范大学学报(自然科学版),2002,27(2):202-205.
[12]郭胜娟,杨春燕,冯玲玲. 长春花愈伤组织的诱导和增殖[J]. 华中师范大学学报(自然科学版),2004,38(2):228-230.
[13]李祥会,伍春莲,房守敏,等. 正交试验法优化长春花愈伤组织继代培养条件[J]. 西华师范大学学报(自然科学版),2010,31(4):347-351.
[14]胡文召,周长勇. 柑橘黄龙病病原研究进展[J]. 植物保护,2010,36(3):30-33.
[15]赵鸿燕,周咏芝,葛宗民,等. 柑橘黄龙病病原类细菌(Bacterium-like organism, BLO)的培养与性质[J].湖南大学学报(自然科学版),1990,12(1):6-9.
[16]张景宁,刘仲健,程伟文,等. 柑橘黄龙病病原类细菌分离培养及其感病性研究[J].中国农业科学,1994,27(2):7-12.
[17]DAVIS M J,MONDAL S,CHEN H,et al.Co-cultivation of‘Candidatusliberibacter asiatieus’with actinobacteria from citrus with huanglongbing[J]. Plant Disease, 2008, 92(11):1547-1550.
[18]SECHLER A,SCHUENZEL E L,COOKE P,et al. Cultivation of‘CandidatusLiberibacter asiaticus’,Ca.L.africanus,andCa.L.americanus associated with huanglongbing[J].Phytopathology, 2009, 99(5):480-486.
[19]李 佳,殷幼平,郑莉萍,等. 柑橘黄龙病寄主长春花内生细菌的分离及功能鉴定[J]. 微生物学通报,2014,41(5):862-870.
[20]柯 穗,李开本,柯 冲,等. 通过菟丝子成功地将黄龙病病原从柑桔传到长春花[J]. 福建省农科院学报,1986(1):11-16.
[21]柯 冲,柯 穗,李开本. 柑桔黄龙病病原形态与性质的研究[J]. 福建省农科院学报,1991,6(1):1-10.
[22]田亚南,柯 穗,柯 冲. 应用多聚酶链式反应(PCR)技术检测和定量分析柑桔黄龙病病原[J].植物病理学报,1996,26(3):243-250.
Callus induction and proliferation of citrus huanglongbing host plant Catharathus roseus (L.) G. Don
SONG Xiao-bing1,2, PENG Ai-tian1, CHEN Xia1, LING Jin-feng1, ZHANG Lian-hui2
(1.Research Institute of Plant Protection, Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Guangdong Academy of Agricultural Sciences, Guangzhou 510640; 2.Guangdong Province Key Laboratory of Microbial Signals and Disease Control, Guangzhou 510640, China)
In this study, the tissue culture system ofCatharathusroseus(L.) G. was presented. Using the young leaves ofC.roseus(L.) G. as explants, the callus induction and proliferation system ofC.roseus(L.) G. was explored through screening disinfection treatment of explants and different hormone formulation. The results showed the explants sterilization treatment combination was 75% ethanol for 30-45 s and 0.1% mercuric chloride for 3 min. The medium was MS, the hormones combination were 2,4-D 1.0 mg/L-1+NAA 1.0 mg/L-1+6-BA 2.0 mg L-1for the callus induction, and the hormones combination were NAA 1.0 mg L-1+6-BA 2.0 mg L-1for callus proliferation. The results showed that the callus induced ratio ofC.roseus(L.) G was higher than 90%. The culture system of callus induction and proliferation was established, which will be important for the resistance breeding using transgenic engineering technology to control citrus huanglongbing disease.
Catharathusroseus(L.) G. Don; callus tissue; induction; proliferation
2015-12-16;
2016-01-25
广东省微生物信号与作物病害防控重点实验室开放基金(MSDC-01);广东省科技计划项目(广东省农作物病虫害绿色防控技术研究开发中心建设);广东省农业领域引导项目(2013B020309004);广东省公益研究与能力建设项目(2014B020203003)
宋晓兵,博士研究生,研究方向为病原细菌学,E-mail:xbsong@126.com
彭埃天,研究员,主要从事果树病害防控等工作,E-mail:pengait@163.com
Q943.1; S436.66
A
2095-1736(2016)05-0031-03
doi∶10.3969/j.issn.2095-1736.2016.05.031

