TLR家族基因在产蛋高峰期和停产期鸭肠道中的表达研究
郭佳佳,戴子淳,陆 晨,张 甜,施振旦,赵 伟,马卫明,应诗家*
(1.山东农业大学动物科技学院,泰安 271018; 2.江苏省农业科学院畜牧研究所,南京 210014)
TLR家族基因在产蛋高峰期和停产期鸭肠道中的表达研究
郭佳佳1,2,戴子淳2,陆晨2,张甜2,施振旦2,赵伟2,马卫明1*,应诗家2*
(1.山东农业大学动物科技学院,泰安 271018; 2.江苏省农业科学院畜牧研究所,南京 210014)
旨在研究TLR家族基因在产蛋高峰期和停产期鸭肠道中的表达。选择同日龄产蛋高峰期鸭20只,随机均分为两组,一组在限食7 d停产后自由采食10 d,另一组自由采食17 d。采用RT-PCR和qRT-PCR的方法,检测TLR1-1、TLR1-2、TLR2-1、TLR2-2、TLR3、TLR4、TLR5、TLR7、TLR15和TLR21基因在鸭十二指肠、空肠、回肠和盲肠中的表达。结果显示,10种禽类TLR家族基因均在鸭十二指肠、空肠、回肠和盲肠中表达;除TLR1-2、TLR2-2、TLR4和TLR21基因外,其他6种TLR家族基因在不同肠道中差异表达(P<0.05),其中,TLR3、TLR5和TLR7基因在十二指肠中高表达,TLR1-1、TLR2-1和TLR15基因在盲肠中高表达;除TLR4和TLR7基因外,其他8种TLR家族基因在产蛋高峰期鸭肠道中的表达水平高于停产期(P<0.05)。结果表明,蛋鸭肠道存在TLR介导的固有免疫反应机制,且产蛋高峰期蛋鸭肠道病原相关分子模式的识别能力强于停产期蛋鸭。
蛋鸭;Toll样受体;肠道;产蛋高峰期;停产期
中国的蛋鸭养殖主要采用传统的水面养殖模式[1-2]。这种粗放的养殖模式容易使养殖水体中肠道病原微生物及其释放的代谢物进入鸭消化道,诱导肠道炎性反应,影响饲料消化吸收利用,进而影响产蛋性能[3]。研究表明,降低载禽水体微生物浓度能降低肠道TLR4表达水平和炎性反应[3],提高鸭[3]或鹅[4]的产蛋性能。此外,饲料中含有的病原微生物及其代谢产物,如细菌内毒素、真菌毒素和霉菌毒素[5]等,也诱导肠道炎性反应。因此,蛋鸭肠道的病原分子识别能力对维持肠道功能稳态和产蛋性能具有重要的作用。
Toll样受体(TLRs)是一类病原模式识别受体基因,是非特异性免疫反应关键的组成部分[6-7]。目前,在鸡的研究中,共发现10种TLRs家族基因[8-10],包括TLR1-1、TLR1-2、TLR2-1、TLR2-2、TLR3、TLR4、TLR5、TLR7、TLR15和TLR21。这些TLR家族基因识别多种病原分子[11-12],启动胞内信号级联效应,诱导非特异性免疫反应[13-14],抵御病原微生物的侵害[15],维持组织细胞功能稳态。禽类抗病力与TLR家族基因表达密切相关[16-18],而肠道是机体接触病原分子的重要器官之一。肠道存在多样化微生物区系,维持肠道功能稳态,而TLRs参与调节这一过程[19],并且肠道TLRs识别微生物和饲料抗原,修复损伤的肠道上皮细胞和清除进入肠黏膜的病原分子[20]。然而,目前国内外研究了性成熟前鸭TLR家族部分基因,如:TLR2-1[21]、TLR3[22-23]、TLR4[24-27]、TLR5[28-29]和TLR7[30]基因的克隆和组织表达谱及其对病原分子的反应性,而对其他TLR家族基因的研究较少,对TLR家族基因在产蛋期鸭肠道不同功能部位的差异表达研究更少。由于产蛋高峰期蛋鸭采食量增加、嬉水习性增强,肠道接触病原微生物的机率增加,因而,产蛋高峰期鸭肠道病原相关分子的识别能力对肠道免疫保护、功能稳态、饲料消化吸收以及高产蛋性能维持至关重要。
本试验研究10种TLR家族基因在产蛋高峰期和停产期鸭十二指肠、空肠、回肠和盲肠中的表达,为蛋鸭肠道启动非特异性免疫反应、抵御病原微生物侵染的分子调控机理研究奠定基础,对维持蛋鸭肠道功能稳态和产蛋性能具有重要的意义。
1 材料与方法
1.1试验动物
动物试验在南京市畜牧家禽科学研究所江宁基地进行。试验蛋鸭为连城白鸭和樱桃谷鸭杂交F1代鸭。在产蛋高峰期时(产蛋率>80%),选择20只蛋鸭,随机分为两组,每组10只,每组独立一栏。一组高峰期蛋鸭自由采食;另一组高峰期蛋鸭当日自由采食后,停止供料7 d,使其停止产蛋,再自由采食10 d,恢复体况。采用“地面平养+水池”养殖模式,每栏有独立运动场(长3.80 m,宽1.30 m)和水池(长1.10 m,宽1.30 m,深0.32 m)。试验期间,鸭自由饮水,自然光照。试验结束后,取脾、十二指肠、空肠、回肠和盲肠等组织,液氮保存。
1.2主要试剂
RNA抽提试剂盒购自天根生化科技(北京)有限公司;Taq PCR Master Mix购自上海翊圣生物科技有限公司;50 bp Marker和PrimeScriptRTMaster Mix购自宝生物工程(大连)有限公司;FastStart Universal SYBR Green Master购自罗氏诊断产品(上海)有限公司;其他常规试剂购自南京寿德化玻公司。
1.3总RNA提取和反转录
分别取蛋鸭脾、十二指肠、空肠、回肠和盲肠组织,按天根试剂盒说明书提取总RNA。RNA质量检测合格后,参照TaKaRa反转录试剂盒说明,合成cDNA第一链,-20 ℃保存备用。反应体系为10 μL:2 μL 5 × Prime Script Buffer,8 μL RNA (<500 ng )。反转录程序:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 保存。
1.4RT-PCR反应和测序
根据GenBank登录号,利用Primer Premier 5.0软件设计兼并引物,引物信息见表1,由上海英骏生物技术有限公司合成。由于目前禽类10种TLR家族基因是否都在蛋鸭肠道不同功能部位表达不清楚,因此,采用普通PCR的方法对停产期蛋鸭的脾、十二指肠、空肠、回肠和盲肠组织10种禽类TLR家族基因进行扩增,其中以脾组织为阳性对照[11],以不加cDNA模板为阴性对照。
PCR反应体系为20 μL:2 × Taq PCR Master Mix 10 μL,ddH2O 8 μL,上游和下游引物各0.5 μL,RT产物1 μL。反应程序:95 ℃预变性5 min;95 ℃变性30 s,57/60 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸7 min,4 ℃保存。PCR产物用2.5%琼脂糖凝胶电泳初步鉴定,由上海生工生物工程股份有限公司测序。
1.5qRT-PCR 分析
根据RT-PCR的表达谱结果,对在不同肠道组织中表达的TLR家族基因进行Real-time PCR。Real-time PCR反应体系为20 μL:1 μL RT产物,上游和下游引物各0.6 μL,7.8 μL ddH2O,10 μL FastStart Universal SYBR Green Master (ROX)。反应程序:50 ℃ 2 min,95 ℃预变性10 min;PCR循环:95 ℃变性15 s,57/60 ℃退火30 s,72 ℃ 延伸30 s,读板,共35个循环。以管家基因β-actin为内参,每个样品重复3次,取平均Ct值进行计算,所得试验数据按2-△△Ct结果统计分析。
1.6数据分析
采用SPSS 13.0软件进行统计分析,数据结果以“平均值 ± 标准误(Mean ± SE)”表示。对于每个基因的表达数据,以不同产蛋期和肠道不同功能部位为固定效应,采用两因子线性模型进行统计分析,Bonferroni修正法多重比较;对于同一产蛋期,肠道不同功能部位的基因表达数据,采用单因子方差分析,Duncan法多重比较;对于肠道同一功能部位,不同产蛋期的基因表达数据,采用t检验分析。
表1定量PCR引物
Table 1Primer pairs used for Real-time PCR

目的基因Targetgene登录号AccessionNo.引物序列(5'→3')Primersequence退火温度/℃Annealingtemperature产物大小/bpProductsizeβ-actinM26111CCCTGTATGCCTCTGGTCCTCGGCTGTGGTGGTGAA60194TLR1-1NM_001310424CAAGCGTCAAAGTCTAACAGCCGTGCTCATCCCATCATACAAGAGG60102TLR1-2JN572686CATTGAAGCCTTGACAGTAGCTCCTCGCCTCCATCGGTA57270TLR2-1HQ166194AGGAAACTTTGAGGGCATTACGGAAGTGTAGAGTTCTGAACCAGT60243TLR2-2JQ687404ATAAGCATAAGAAGGGTAGACAATCCCAGGCACAGTAGC60196TLR3KC292270TAATCTGGCTATTTCTCCTCCAAAGTCGTGCTAAATTA57160TLR4HQ436371GGTGCCACATCCATACAATTAGGTCAGTCAGAGAGGATA60173TLR5KC845942GGGGAAGAACATATCAACAGATCACTAAAGTACCTGCT60139TLR7JQ910168CAACCTTTCCCAGAGCATTTCCTCAGCCTAACATACCG60191TLR15JQ014619ATATGAGGCTCAGACGAAGGGTAGTCCACAGCGGTTAG60100TLR21JN573269TGTGCTTCTACCTCTTCACCGTGGTACTTCAGCCGCCAGT6096
2 结 果
2.1肠道TLR家族基因的表达谱
分别对脾、十二指肠、空肠、回肠和盲肠组织进行RT-PCR扩增,PCR产物电泳检测结果见图1,所扩增的TLRs片段与预期的片段大小一致。通过测序,并与GenBank已登录(表1)的序列比对,同源性为97%以上,表明PCR扩增片段为目的基因片段。并且,结果显示,已公开的10种禽类TLR家族基因均在鸭十二指肠、空肠、回肠和盲肠组织中表达(图1)。

1、2、3、4、5、6、7、8、9、10.分别表示TLR1-1、TLR1-2、TLR2-1、TLR2-2、TLR3、TLR4、TLR5、TLR7、TLR15、TLR21基因扩增片段;、S、K、H、N、P.分别表示十二指肠、空肠、回肠、盲肠和脾组织的扩增片段;B和M.分别表示空白对照和DNA相对分子质量标准1,2,3,4,5,6,7,8,9,10.Indicate fragments amplified of TLR1-1,TLR1-2,TLR2-1,TLR2-2,TLR3,TLR4,TLR5,TLR7,TLR15 and TLR21 genes,respectively.S,K,H,N,P.Indicate fragments amplified of β-actin gene in duodenum,jejunum,ileum,cecum and spleen,respectively.B,M.Indicate the negative control and DNA marker,respectively图1 TLR家族基因在肠道不同功能部位的RT-PCR电泳图Fig.1 RT-PCR of TLRs in duck intestinal tracts
2.2肠道TLR家族基因的差异表达
不同肠段TLR家族基因表达的结果见表2和图2。线性模型的统计结果显示,除TLR1-2、TLR2-2、TLR4和TLR21基因,TLR1-1、TLR2-1、TLR3、TLR5、TLR7和TLR15基因在十二指肠、空肠、回肠和盲肠中的表达水平差异显著(P<0.05,表2),其中,盲肠TLR1-1、TLR2-1和TLR15基因表达水平高于十二指肠、空肠和回肠,而十二指肠TLR3、TLR5和TLR7基因表达水平高于空肠、回肠和盲肠。在产蛋高峰期,TLR1-1、TLR2-1、TLR2-2、TLR3、TLR5、TLR7和TLR15基因在肠道不同功能组织中的表达水平差异显著(P<0.05),而在停产期,仅TLR3基因在肠道不同功能组织中的表达水平差异显著(P<0.05,图2)。
2.3产蛋高峰期和停产期对肠道TLR家族基因表达的影响
产蛋高峰期和停产期对肠道TLR家族基因表达的影响见表2和图2。线性模型的统计结果显示,除TLR4和TLR7基因外,其他8种TLR家族基因在产蛋高峰期的表达水平显著高于停产期(P<0.05;表2)。高峰期蛋鸭十二指肠的TLR1-1、TLR1-2、TLR2-1、TLR2-2、TLR3、TLR5和TLR15基因、空肠的TLR1-1、TLR1-2、TLR2-1、TLR2-2和TLR5基因、回肠的TLR1-2、TLR2-1、TLR2-2、TLR3、TLR5和TLR21以及盲肠的TLR1-1、TLR1-2、TLR2-1、TLR2-2、TLR3、TLR5和TLR21基因表达水平显著高于停产期(P<0.05),而高峰期蛋鸭回肠的TLR7和TLR15以及空肠的TLR21基因表达水平显著低于停产期(P<0.05,图2)。
表2蛋鸭肠道TLR家族基因的表达
Table 2mRNA levels ofTLRgenes in duck intestinal tracts

基因Gene肠道组织Intestinaltissue产蛋状态Egglayingstate十二指肠Duodenum空肠Jejunum回肠Ileum盲肠Caecum产蛋高峰期Peakoflay停产期EndoflayTLR1-11.28±0.53b0.92±0.30b1.24±0.31b6.64±2.30a4.30±1.22**0.76±0.19TLR1-20.75±0.180.73±0.131.00±0.271.07±0.311.53±0.18**0.26±0.04TLR2-10.76±0.22b0.39±0.10b0.37±0.11b1.89±0.65a1.56±0.33**0.16±0.04TLR2-21.64±0.471.31±0.362.43±0.601.76±0.573.14±0.35**0.70±0.24TLR34.03±1.35a1.03±0.16b2.47±0.75ab3.05±0.65ab4.56±0.72**0.72±0.21TLR43.65±1.503.37±1.071.37±0.222.73±0.653.05±0.422.52±0.90TLR530.62±15.09a1.50±0.45b2.16±0.67b2.66±0.67b19.85±8.59*0.61±0.25TLR7606.68±171.03a202.84±63.37b95.13±24.91b474.03±116.54ab350.48±70.83338.86±93.25TLR1573.74±22.83ab38.47±14.59ab20.45±6.53b96.33±24.43a81.09±15.64*33.41±10.28TLR21477.63±180.2977.37±21.66299.64±135.08419.41±142.87480.49±126.60*162.64±51.22
同行不同字母表示差异显著(P<0.05)。同列中,*.P<0.05;**.P<0.01
Values with different small letters differ significantly in the same row (P<0.05).*.Indicates significant difference (P<0.05);**.Indicates extremely significant difference (P<0.01) in the same column
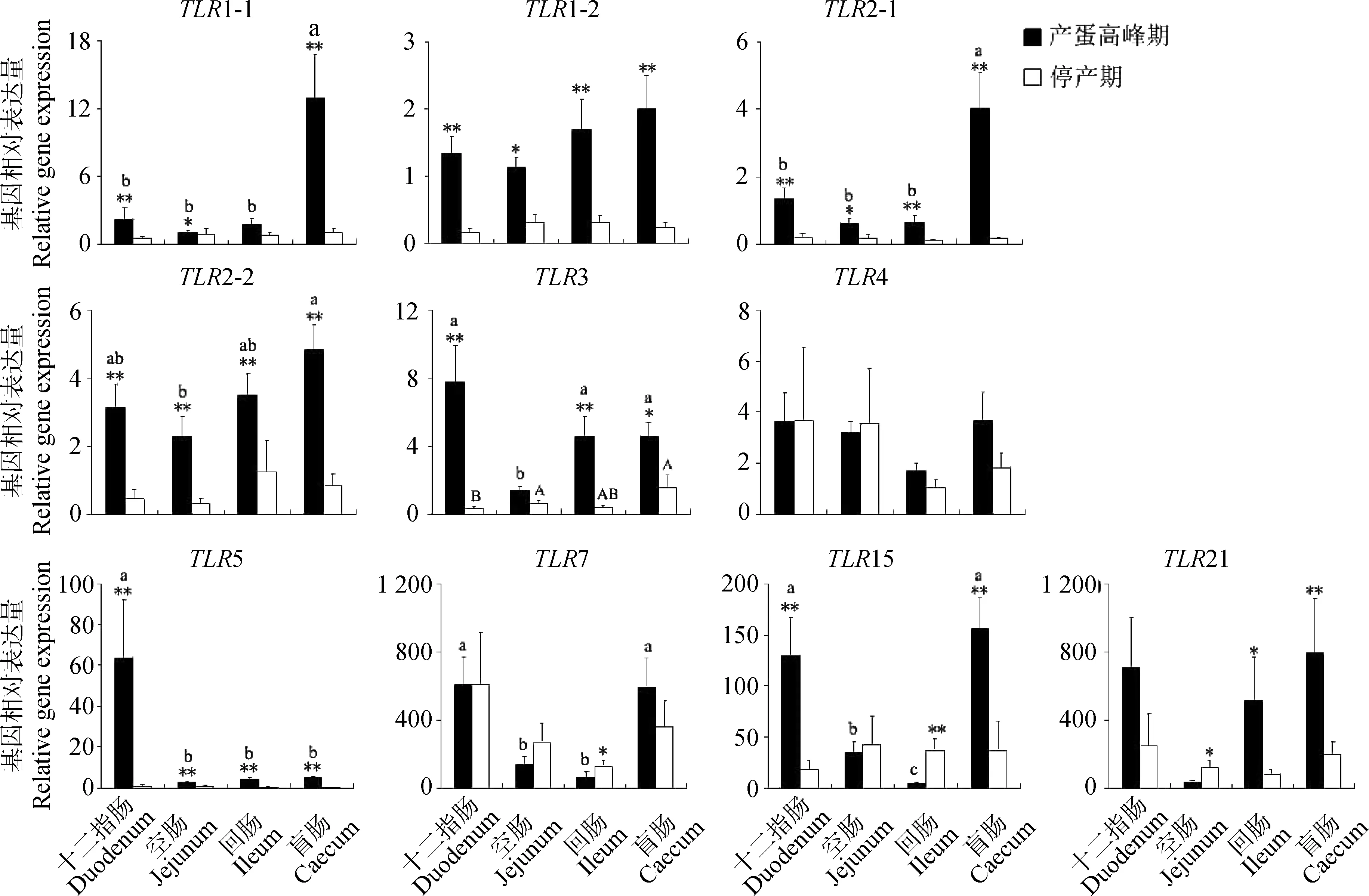
在同一组织中,*.P<0.05,**.P<0.01;在同一产蛋期中,不同小写字母或不同大写字母表示差异显著(P<0.05)*.Indicates significant difference (P<0.05),**.Indicates extremely significant difference (P<0.01) in the same tissue.Values with different small letters or different capital letters differ significantly (P<0.05) in the same laying period图2 不同产蛋期鸭肠道TLRs家族基因差异表达Fig.2 Differential gene expression of TLRs in duck intestinal tracts between peak and end of lay
3 讨 论
非特异性免疫反应是机体抵抗感染性疾病的第一道屏障,而TLR家族基因是非特异性免疫反应的关键调节基因[6-7],也是连接非特异性免疫和特异性免疫的桥梁[31]。目前,在鸡的研究中,共发现10种TLRs家族基因识别广泛的病原微生物及其代谢产物。TLR1可识别肽聚糖、脂磷壁酸、阿拉伯糖甘露糖脂及酵母和真菌的酵母多糖[32];TLR2除具有TLR1识别功能外还可识别革兰氏阴性菌释放的LPS[32];TLR3识别双链RNA[33];TLR4识别革兰氏阴性菌释放的LPS[34-36];TLR5识别细菌鞭毛蛋白[32];TLR7识别单链RNA[32];TLR15识别革兰氏阴性菌,而TLR21识别细菌基因组产生的未甲基化CpG DNA序列[12]。本试验中,10种TLRs家族基因均在蛋鸭肠道的十二指肠、空肠、回肠和盲肠组织中表达,表明除免疫器官和免疫细胞外,蛋鸭肠道组织本身也存在TLR-介导的非特异性免疫应答机制,维持肠道功能稳态。
水禽肠道不同功能部位差异性表达TLRs基因,对病原分子的识别能力具有差异性特点。雏鹅空肠和回肠TLR2-1表达水平高于十二指肠和盲肠[37],而雏鸭空肠TLR5表达水平高于十二指肠、回肠和盲肠[28]。TLR3在70日龄的马岗鹅胰腺组织中表达量最高,其次是脾、十二指肠和肺,而在肌肉和皮肤中表达量最低[33]。本试验中,性成熟期蛋鸭十二指肠组织TLR3、TLR5和TLR7基因以及盲肠组织TLR1-1、TLR2-1和TLR15基因表达水平高于其他肠段组织,说明蛋鸭十二指肠对单链RNA、双链RNA和细菌鞭毛蛋白的识别能力更强,而盲肠对肽聚糖、脂磷壁酸、阿拉伯糖甘露糖脂、酵母和真菌的酵母多糖、LPS以及革兰氏阴性菌的识别能力更强。TLR家族基因在十二指肠和盲肠中高表达,可能由于伴有病原分子的食糜最先抵达十二指肠,其作为诱发因子启动病原识别模式受体基因表达,而盲肠本身富含微生物,其对病原的识别能力有助于盲肠微生物区系稳态。
不同日龄家禽组织识别病原微生物的能力存在差异。研究表明,不同日龄鸡阴道组织TLR2-1、TLR2-2和TLR4基因[38]、睾丸组织TLR2-1、TLR2-2、TLR3、TLR4、TLR5和TLR15基因[39]、卵巢组织TLR2-1、3、4、5、7、15和21基因[40]表达差异显著,而性成熟期鸭小肠TLR7基因表达高于非性成熟期[30]。由于不能在同一日龄和同一养殖水环境下选择产蛋高峰期和停产期鸭,本试验参照蛋鸡[41]限饲停产的研究方法,避免了不同日龄和养殖环境对TLR家族基因表达的影响。试验发现,产蛋高峰期鸭肠道TLR1-1、TLR1-2、TLR2-1、TLR2-2、TLR3、TLR5、TLR15和TLR21基因表达水平高于停产期鸭,其中空肠和回肠分别有5和6种基因表达水平高于停产期,而十二指肠和盲肠有7种基因高于停产期,说明高峰期蛋鸭肠道识别病原微生物的能力显著高于停产期蛋鸭,而且在高峰期蛋鸭十二指肠和空肠的病原识别能力更强。产蛋高峰期水禽增加的采食量和增多的水面嬉戏行为导致肠道接触病原微生物机率增大,因而,可能诱导高峰期蛋鸭肠道病原模式识别受体的表达。在蛋禽研究中,限饲停产后自由采食的处理方式,保证了试验动物年龄的一致性,且最大限度减少限饲应激对基因表达的影响,但对于TLR家族基因,停产后的自由采食能否恢复肠道TLR家族基因表达需要进一步验证。
4 结 论
4.110种禽类TLR家族基因在蛋鸭肠道十二指肠、空肠、回肠和盲肠中表达,肠道存在TLR-介导的非特异性免疫应答机制,维持肠道功能稳态。
4.26种TLR家族基因在蛋鸭肠道十二指肠、空肠、回肠和盲肠中差异表达,其中十二指肠和盲肠各有3种TLR基因高表达。
4.38种TLR家族基因在产蛋高峰期鸭肠道中的表达高于停产期,其中空肠和回肠分别有5和6种TLR基因表达高于停产期,而十二指肠和盲肠有7种TLR基因表达高于停产期。
[1]施振旦,刘丽,孙爱东.“禽-鱼”高密度养殖对水禽生产性能危害的研究[J].中国家禽,2011,33(13):1-3.
SHI Z D,LIU L,SUN A D.Detrimental effect of stocking density on geese production performance in “Goose-Fish” production system[J].ChinaPoultry,2011,33(13):1-3.(in Chinese)
[2]CHEN Y S.Integrated livestock-fish production in China.In:BRANCKAERT R D,MUKHERJEE T K,eds.,Integrated Livestock-Fish Production Systems[M].FAO Animal Production and Health Paper.FAO,Rome,Italy,1992:58-60.
[3]应诗家,许爱红,戴子淳,等.益生菌对载鸭水体和产蛋性能的影响及其分子机制[J].中国农业科学,2015,48(11):2262-2269.
YING S J,XU A H,DAI Z C,et al.Effects of pro-biotic microbes on living water and laying performance in layer ducks and molecular mechanisms[J].ScientiaAgriculturaSinica,2015,48(11):2262-2269.(in Chinese)
[4]YANG X W,LIU L,JANG D L,et al.Improving geese production performance in “Goose-Fish” production system by competitive reduction of pathogenic bacteria in pond water[J].JIntegrAgr,2012,11(6):993-1001.
[5]冯鹏,孙启忠.不同比例玉米与沙打旺混贮营养成分及有毒有害物质分析[J].畜牧兽医学报,2011,42(9):1264-1270.
FENG P,SUN Q Z.Nutrient composition and content of poisonous substances in corn and astragalus adsurgens mixed silage[J].ActaVeterinariaetZootechnicaSinica,2011,42(9):1264-1270.(in Chinese)
[6]SONODA Y,ABDEL MAGEED A M,ISOBE N,et al.Induction of avian beta-defensins by CpG oligodeoxynucleotides and proinflammatory cytokines in hen vaginal cellsinvitro[J].Reproduction,2013,145(6):621-631.
[7]ADEREM A,ULEVITCH R J.Toll-like receptors in the induction of the innate immune response[J].Nature,2000,406(6797):782-787.
[8]YOSHIMURA Y.Avian beta-defensins expression for the innate immune system in hen reproductive organs[J].PoultSci,2015,94(4):804-809.
[9]MICHAILIDIS G,ANASTASIADOU M,GUIBERT E,et al.Activation of innate immune system in response to lipopolysaccharide in chicken Sertoli cells[J].Reproduction,2014,148(3):259-270.
[10]CHEN C,ZIBIAO H,MING Z,et al.Expression pattern of Toll-like receptors (TLRs) in different organs and effects of lipopolysaccharide on the expression of TLR 2 and 4 in reproductive organs of female rabbit[J].DevCompImmunol,2014,46(2):341-348.
[11]SUBEDI K,ISOBE N,NISHIBORI M,et al.Changes in the expression of toll-like receptor mRNAs during follicular growth and in response to lipopolysaccharide in the ovarian follicles of laying hens[J].JReprodDev,2007,53(6):1227-1235.
[12]BROWNLIE R,ALLAN B.Avian toll-like receptors[J].CellTissueRes,2011,343(1):121-130.
[13]DAS S C,ISOBE N,YOSHIMURA Y.Changes in the expression of interleukin-1 beta and lipopolysaccharide-induced TNF factor in the oviduct of laying hens in response to artificial insemination[J].Reproduction,2009,137(3):527-536.
[14]SUBEDI K,ISOBE N,NISHIBORI M,et al.Changes in the expression of gallinacins,antimicrobial peptides,in ovarian follicles during follicular growth and in response to lipopolysaccharide in laying hens (Gallus domesticus)[J].Reproduction,2007,133(1):127-133.
[15]KAISHO T,AKIRA S.Toll-like receptor function and signaling[J].JAllergyClinImmunol,2006,117(5):979-987.
[16]WANG Q,WU Y,CAI Y,et al.Spleen transcriptome profile of muscovy ducklings in response to infection with muscovy duck reovirus[J].AvianDis,2015,59(2):282-290.
[17]SONG C,YU S,DUAN Y,et al.Effect of age on the pathogenesis of DHV-1 in Pekin ducks and on the innate immune responses of ducks to infection[J].ArchVirol,2014,159(5):905-914.
[18]李秀,毕瑜林,徐琪,等.ALB、TLR7、PSPH和WSB1基因在雏鸭肝炎病毒易感与抗性群体间的差异表达分析[J].中国兽医学报,2013,33(2):161-165.
LI X,BI Y L,XU Q,et al.Comparison ofALB,TLR7,PSPHandWSB1 genes mRNA expression between susceptible and resistant populations to duck hepatitis virus[J].ChineseJournalofVeterinaryScience,2013,33(2):161-165.(in Chinese)
[19]HAAG L M,SIEGMUND B.Intestinal microbiota and the innate immune system-A crosstalk in Crohn's disease pathogenesis[J].FrontImmunol,2015,6:489.
[20]ABREU M T,FUKATA M,ARDITI M.TLR signaling in the gut in health and disease[J].JImmunol,2005,174(8):4453-4460.
[21]李国勤,马永升,贾红敏,等.鸭TLR2基因的克隆、序列分析及其结构预测[J].中国畜牧杂志,2011,47(19):17-21.
LI G Q,MA Y S,JIA H M,et al.Molecular cloning,sequential analysis and structure prediction of duckTLR2[J].ChineseJournalofAnimalScience,2011,47(19):17-21.(in Chinese)
[22]JIAO P R,WEI L M,CHENG Y Q,et al.Molecular cloning,characterization,and expression analysis of the Muscovy duck Toll-like receptor 3 (MdTLR3) gene[J].PoultSci,2012,91(10):2475-2481.
[23]ZHANG M,SONG K,LI C,et al.Molecular cloning of Peking duck Toll-like receptor 3 (duTLR3) gene and its responses to reovirus infection[J].VirolJ,2015,12:207.
[24]ZHAO W,HUANG Z,CHEN Y,et al.Molecular cloning and functional analysis of the duck TLR4 gene[J].IntJMolSci,2013,14(9):18615-18628.
[25]JIA H,LI G,LI J,et al.Cloning,expression and bioinformatics analysis of the duck TLR 4 gene[J].BrPoultSci,2012,53(2):190-197.
[26]ELFEIL W K,ABOUELMAATTI R R,SUN C,et al.Identification,cloning,expression of a novel functional anas platyrhynchos mRNA TLR4[J].JAnimVetAdv,2012,11(10):1727-1733.
[27]黄正洋,陈阳,李欣钰,等.鸭TLR4基因可变剪接体的克隆、鉴定及组织表达分析[J].畜牧兽医学报,2013,44(5):697-702.
HUANG Z Y,CHEN Y,LI X Y,et al.Identification and expression analysis of alternative splicing ofTLR4 in duck[J].ActaVeterinariaetZootechnicaSinica,2013,44(5):697-702.(in Chinese)
[28]CHENG Y,SUN Y,WANG H,et al.Cloning,expression and functional analysis of the duck Toll-like receptor 5 (TLR5) gene[J].JVetSci,2015,16(1):37-46.
[29]XIONG D,PAN Z,KANG X,et al.Molecular cloning and functional analysis of duck Toll-like receptor 5[J].ResVetSci,2014,97(1):43-45.
[30]KOLLURI G,RAMAMURTHY N,CHURCHIL R R,et al.Influence of age,sex and rearing systems on Toll-like receptor 7 (TLR7) expression pattern in gut,lung and lymphoid tissues of indigenous ducks[J].BrPoultSci,2014,55(1):59-67.
[31]AKIRA S,TAKEDA K,KAISHO T.Toll-like receptors:critical proteins linking innate and acquired immunity[J].NatImmunol,2001,2(8):675-680.
[32]KOGUT M H,IQBAL M,HE H,et al.Expression and function of Toll-like receptors in chicken heterophils[J].DevCompImmunol,2005,29(9):791-807.
[33]刘少丰.鹅TLR3和TLR5基因的克隆及其功能研究[D].湛江:广东海洋大学,2013.
LIU S F.Molecular cloning and fuction studies on gooseTLR3 and 5 genes[D].Zhanjiang:Guangdong Ocean University,2013.(in Chinese)
[34]OZOE A,ISOBE N,YOSHIMURA Y.Expression of Toll-like receptors (TLRs) and TLR4 response to lipopolysaccharide in hen oviduct[J].VetImmunolImmunopathol,2009,127(3-4):259-268.
[35]HEUMANN D,ROGER T.Initial responses to endotoxins and Gram-negative bacteria[J].ClinChimActa,2002,323(1-2):59-72.
[36]李欣,李中改,张小艺,等.金英黄归汤对LPS介导乳腺上皮细胞TLR4信号通路中相关因子的影响[J].畜牧兽医学报,2016,47(3):609-614.
LI X,LI Z G,ZHANG X Y,et al.Effects of Jin-Ying-Tang on correlated molecules of Toll-like receptor 4 signaling of LPS-induced mouse mammary epithelial cellsinvitro[J].ActaVeterinariaetZootechnicaSinica,2016,47(3):609-614.(in Chinese)
[37]YONG Y,LIU S,HUA G,et al.Identification and functional characterization of Toll-like receptor 2-1 in geese[J].BMCVetRes,2015,11:108.
[38]MICHAILIDIS G,THEODORIDIS A,AVDI M.Effects of sexual maturation and Salmonella infection on the expression of Toll-like receptors in the chicken vagina[J].AnimReprodSci,2011,123(3-4):234-241.
[39]ANASTASIADOU M,THEODORIDIS A,AVDI M,et al.Changes in the expression of Toll-like receptors in the chicken testis during sexual maturation andSalmonellainfection[J].AnimReprodSci,2011,128(1-4):93-99.
[40]MICHAILIDIS G,THEODORIDIS A,AVDI M.Transcriptional profiling of Toll-like receptors in chicken embryos and in the ovary during sexual maturation and in response toSalmonellaenteritidisinfection[J].AnimReprodSci,2010,122(3-4):294-302.
[41]NII T,SONODA Y,ISOBE N,et al.Effects of lipopolysaccharide on the expression of proinflammatory cytokines and chemokines and the subsequent recruitment of immunocompetent cells in the oviduct of laying and molting hens[J].PoultSci,2011,90(10):2332-2341.
(编辑郭云雁)
Expression of Toll-like Receptors in Duck Intestinal Tract at the Peak and End of Lay
GUO Jia-jia1,2,DAI Zi-chun2,LU Chen2,ZHANG Tian2,SHI Zhen-dan2,ZHAO Wei2,MA Wei-ming1*,YING Shi-jia2*
(1.CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Taian271018,China;2.InstituteofAnimalScience,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
This study aimed to investigate expression of toll-like receptors in different segments of intestinal tract in duck at the peak and end of lay.Twenty laying ducks at the peak of lay were randomly assigned to 2 groups.One group ducks were given a restricted feed for 7 days,and then provided with feedadlibitumfor 10 days.Another group ducks were provided with feedadlibitumfor 17 days.Expression ofTLR1-1,TLR1-2,TLR2-1,TLR2-2,TLR3,TLR4,TLR5,TLR7,TLR15 andTLR21 were analyzed in duck duodenum,jejunum,ileum and caecum by RT-PCR and qRT-PCR methods.The results showed that 10TLRs genes were all expressed in duodenum,jejunum,ileum and caecum.Except forTLR1-2,TLR2-2,TLR4 andTLR21,the otherTLRs genes mRNA expression was significantly different among different segments of duck intestinal tract (P<0.05).Of these,TLR3,TLR5 andTLR7 mRNA expression were higher in duodenum than in the other tissues,whileTLR1-1,TLR2-1 andTLR15 mRNA expression were higher in caecum than in the other tissues.Except forTLR4 andTLR7,the otherTLRs genes mRNA expression was higher in ducks at the peak of lay than that in ducks at the end of lay (P<0.05).In conclusion,a TLR-mediated innate immune response mechanism exists in the laying duck intestinal tract,and there was stronger ability to recognize pathogens in duck intestinal tract at the peak of lay than that at the end of lay.
laying duck;toll-like receptors (TLRs);intestinal tract;peak of lay;end of lay
10.11843/j.issn.0366-6964.2016.10.009
2016-02-18
江苏省农业科技自主创新资金(CX(12)3070);国家水禽产业技术体系(CARS-43-16)
郭佳佳(1992-),女,福建宁德人,硕士生,主要从事家禽非特异性免疫反应研究,Tel:025-84390956,E-mail: 767171432@qq.com
马卫明,教授,Tel: 0538-8242593-8205,E-mail:mawm@sdau.edu.cn;应诗家,副研究员,Tel: 025-84390772,E-mail:ysj@jaas.ac.cn
S834;S813.3
A
0366-6964(2016)10-2012-08

